2. 北京联合大学 生物化学工程学院, 北京 100023
2. College of Biochemical Engineering, Beijing Union University, Beijing 100023, China
3-羟基丙酸(3-HP)是一种重要的平台化合物,可用于个人护理、水处理、胶黏剂和涂料等领域,此外,3-HP作为单体可合成新型生物可降解材料聚3-羟基丙酸。近年来随着市场需求量的增大和使用价值的提升,3-HP成为人们的研究热点[1]。化学合成3-HP能耗大,环境污染严重,而微生物发酵生产3-HP条件温和,无污染,因此开发潜力极大[2-3]。3-HP发酵液中除3-HP外,还含有乳酸、乙酸、2, 3-丁二醇、1, 3-丁二醇和琥珀酸等,其中3-HP和乳酸为同分异构体,结构相似且较难分离,严重阻碍了3-HP的工业化生产[4]。
目前工业生产上多采用离心和膜过滤法处理发酵液,但离心设备能耗大且分离效果差,而膜过滤工艺繁琐、膜元件成本高、易污染且难于清洗,因此探求一种经济快捷、综合效果较好的工艺迫在眉睫[5]。絮凝剂具有来源广、用量少、价格低廉、环境友好等优点,絮凝工艺操作简捷,可有效提高固液分离速率,因此倍受研究者青睐[6]。脱色是化工生产中一个重要的工艺单元,脱色效果直接影响产品的成色和纯度。活性炭物化性质良好、容量大、易再生,是工业生产中最常用的脱色剂[7]。目前,絮凝和脱色工艺已分别应用于衣康酸、1, 3-丙二醇、乳酸和透明质酸等发酵液的处理。黄俊等[8]用壳聚糖处理γ-氨基丁酸发酵液,菌体去除率达97.30%,而γ-氨基丁酸损失率仅为1.20%。Hubmann等[9]探究活性炭对1,3-丙乙醇发酵液的脱色工艺,活性炭用量为6.00 g/L时, 脱色率达59.50%,效果显著。这些研究虽为3-HP发酵液预处理提供了理论参考,但对絮凝前后菌体和絮凝剂的形态变化考察甚少,此外,将絮凝和脱色工艺联用处理3-HP发酵液也鲜有报道。
本文基于壳聚糖和活性炭在发酵液预处理中的优势,以絮凝率、脱色率为指标,选取不同类型絮凝剂和活性炭,探究其对3-HP发酵液处理的效果。通过机理探究、单因素分析和正交试验,确定关键因素并优化工艺参数,为3-HP发酵液分离及工业化提供依据。
1 实验部分 1.1 试剂及原料肺炎克雷伯氏菌(Klebsiella pneumoniae)为本实验室保存;3-HP发酵液,A600=11.20,pH=7,质量浓度78.00 g/L。
蛋白胨、酵母粉、海藻酸钠、Ca(OH)2、FeCl3、NaCl、HCl、ZnCl2、K2HPO4、KH2PO4和H3BO3,西陇化工股份有限公司;聚丙烯酰胺(PAM),爱森中国絮凝剂有限公司;壳聚糖(脱乙酰度为85.0%,分子量6.00 kDa~140.00 kDa)和甲壳素,济南海得贝海洋生物工程有限公司;活性炭颗粒(粉)、硅藻土、聚合硫酸铁(SPFS)、聚合氯化铝(PAC)、(NH4) 2SO4、CuCl2·2H2O、MnCl2·4H2O、NiCl2·6H2O、Na2MO4·2H2O、CoCl2·2H2O和MgSO4·7H2O,天津市天大化工实验厂。
LB培养基(g/L):蛋白胨,10.00;NaCl,10.00;酵母粉,5.00。甘油培养基(g/L):K2HPO4,3.40;KH2PO4,1.30;(NH4) 2SO4,4.00;MgSO4·7H2O,0.50;CaCO3,0.10;酵母粉,3.00;甘油,40.00;微量元素,1.25 mL/L。微量元素溶液(g/L):FeSO4·7H2O,1;ZnCl2,0.07;CuCl2·2H2O,0.02;MnCl2·4H2O,0.1;NiCl2·6H2O,0.025;H3BO3,0.06;Na2MO4·2H2O,0.03;CoCl2·2H2O,0.20;HCl (37%),4 mL。
1.2 实验仪器723N型可见光分光光度计,上海天普分析仪器有限公司;PHS-3 C型雷磁pH计,上海仪电科学仪器股份有限公司;5 L自控BIOTECH-5 BG型发酵罐,上海保兴生物设备工程有限公司;GC-14 B型高效液相色谱仪(HPLC),日本岛津公司;BCPCA S4800型扫描电子显微镜,日本JEOL公司。
1.3 实验方法 1.3.1 发酵液制备菌种复苏 配制100 mL LB培养基于250 mL三角瓶,120 ℃灭菌20 min,接菌量1.00%,37 ℃,200 r/min恒温震荡箱培养12 h。
上罐发酵 配制3 L发酵培养基于5 L发酵罐,120 ℃灭菌20 min,接复苏后菌株,采用连续流加方式发酵,6 h后开始补料,48 h停止发酵。发酵罐参数:温度37 ℃,转速400 r/min,通气量4.50 L/min,pH 7。
1.3.2 发酵液絮凝絮凝剂 (1) 壳聚糖絮凝剂:以醋酸(质量分数1%)为溶剂,配制8 g/L溶液,搅拌并溶胀24 h。(2) 海藻酸钠助凝剂:以蒸馏水为溶剂,配制质量浓度为8 g/L溶液,搅拌至溶解,溶胀24 h。(3) PAC、SPFS、FeCl3、甲壳素、硅藻土、PAM和Ca(OH)2絮凝剂:以蒸馏水为溶剂(或分散剂),配制质量浓度为8 g/L溶液(或悬浊液)。
絮凝 量取30 mL 3-HP发酵液8份于不同烧杯中,依次加入0.5 mL、1.0 mL、1.5 mL、2.0 mL、2.5 mL、3.0 mL、3.5 mL、4.0 mL絮凝剂(空白加蒸馏水),再加入等量助凝剂,机械搅拌10~20 min,静置30 min,过滤,取上清液,紫外分光度计测定600 nm下吸光度值,确定最佳用量。调节发酵液pH分别至1、2、3、4、5、6、7、8、9、10、11、12、13、14,于最佳用量下,在上述条件测定吸光度值,确定最佳pH。
1.3.3 活性炭吸附脱色将3-HP发酵絮凝液恒温水浴预热至37 ℃,取50 mL于100 mL小烧杯中,分别加入0.10 g、0.20 g、0.30 g、0.40 g、0.50 g、0.60 g活性炭颗粒(粉),恒温静置5~15 min,过滤,取上层清液,紫外分光度计测定最佳吸收波长[10]下的吸光度值。
1.4 分析与表征 1.4.1 菌体絮凝率和脱色率测定采用紫外分光光度计测定3-HP发酵液吸光度。其中菌体絮凝率F用600 nm下吸光度A600表示,即F=(A600, 絮凝前-A600, 絮凝后)/A600, 絮凝前×100%;脱色率T用最佳吸收波长下吸光度A300表示,即T=(A300, 脱色前-A300, 脱色后)/A300, 脱色前×100%。
1.4.2 3-HP含量测定采用HPLC检测发酵液3-HP含量。色谱柱为C18柱,柱温30 ℃,紫外吸收波长210 nm,流动相中水、磷酸和甲醇体积比为950.00:0.50:50.00,流速0.80 mL/min,进样20.00 μL,采用外标法定量[11]。
1.4.3 SEM分析絮凝菌体采用BCPCA S4800型扫描电子显微镜观察单一菌体和絮凝后菌体表面结构。样品用缓冲液清洗,戊二醛固定,保存,冷冻干燥,喷金提高扫描电镜图像质量。
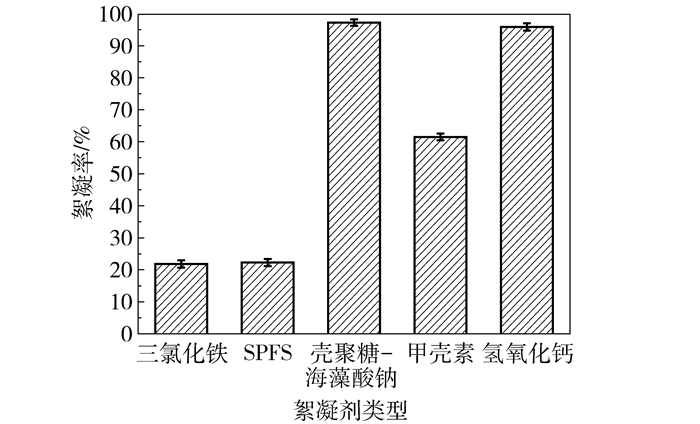
2 结果与讨论 2.1 絮凝剂的筛选采用Ca(OH)2、FeCl3、SPFS、聚丙烯酰胺、聚合氯化铝、硅藻土、壳聚糖-海藻酸钠和甲壳素8种絮凝剂对3-羟基丙酸发酵液进行絮凝预实验。由表 1可知,絮凝剂PAC、PAM和硅藻土不能使3-HP发酵液分层,对菌体无絮凝效果。由图 1可知,FeCl3、SPFS和甲壳素絮凝率分别为21.83%、22.25%、61.50%;以Ca(OH)2为絮凝剂,菌体去除率达95.83%;以壳聚糖-海藻酸钠复合絮凝剂处理发酵液,菌体去除率达97.21%。
| 下载CSV 表 1 8种絮凝剂对3-HP发酵液的絮凝效果 Table 1 Effects of eight flocculants on flocculation of the broth |
|
图 1 絮凝剂对3-HP发酵液的絮凝效果 Fig.1 Effect of different flocculants on flocculation of the broth |
本文所用发酵液的无机盐浓度较高,致使PAC、PAM和硅藻土絮凝效果较差。Ca(OH)2作为絮凝剂,一方面Ca2+可促进带负电菌体电中和,降低电位,聚集形成沉淀;另一方面,Ca(OH)2会致菌体变性乃至死亡[12](具体机理还有待深入研究),大量引入的Ca2+在3-HP发酵液中不易沉淀,浓缩呈糊状,为后续分离增加难度[13]。壳聚糖-海藻酸钠作为复合絮凝剂,菌体去除较彻底且产物损失量少。综合考虑絮凝效果和经济效益等因素,最终选择壳聚糖-海藻酸钠作为絮凝剂。鲁诗峰等[14]研究了12种絮凝剂对1, 3-丙二醇发酵液的影响,对比发现壳聚糖的絮凝效果较好,菌体去除率达99.10%,与本实验结论相吻合,为后续奠定良好理论基础。
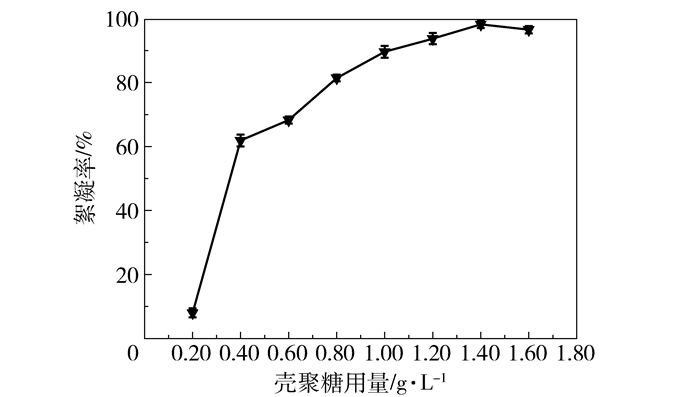
2.2 壳聚糖-海藻酸钠絮凝3-HP发酵液工艺优化 2.2.1 壳聚糖用量对3-HP发酵液絮凝影响如图 2所示,对于同批3-HP发酵液而言,絮凝率随壳聚糖用量的增加而显著升高,当絮凝剂用量为1.40 g/L时,絮凝率达97.70%以上;絮凝剂大于1.40 g/L时,絮凝效果维持在97.00%左右无明显变化。
|
图 2 壳聚糖用量对3-HP发酵液絮凝的影响 Fig.2 Effect of quantity of chitosan on 3-HP flocculation |
此现象与吸附架桥絮凝机理[15]一致,即当高分子絮凝剂覆盖微粒表面近一半时,絮凝剂一端吸附微粒,另一端碰撞吸附剩余微粒,形成胶团,絮凝效果较佳;当絮凝剂过量时,微粒表面全部被覆盖,无空余表面吸附其他絮凝剂,因此絮凝效果不明显。故壳聚糖的最佳用量为1.40 g/L。Qin等[16]用壳聚糖絮凝1, 3-丙二醇发酵的菌体,确定壳聚糖最佳用量为0.80 g/L,较本实验用量低,推测是由于本文所用3-HP发酵液菌体浓度高所致。
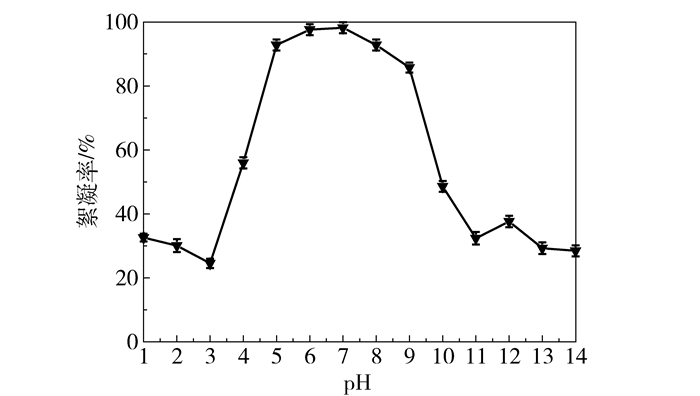
2.2.2 pH值对3-HP发酵液絮凝的影响通常,pH通过影响絮凝剂分子电离程度、分子链延伸程度和菌体、蛋白质等大分子表面电荷的Z电位来改变絮凝效果。按照Derjguin-Landau-Verwey-Overbeek(DLVO)胶体稳定性理论,絮凝发生时胶体表面Z电位为零,此时pH即溶液等电点[17]。如图 3所示,3-HP发酵液的pH为6~7时,絮凝率达99.00%以上,可见其等电点位于6~7之间。其中,壳聚糖是阳离子型聚合物,其带电性在pH>9时变化,絮凝作用不明显;pH<5致使胶体微粒所带电荷由负转正,表面电动电位ζ变化,微粒间互相排斥重新建立,分散体系稳定,絮凝效果变差。由于3-HP、乳酸和乙酸等有机弱酸具有缓冲作用,故调节3-HP发酵液至低pH需加入大量酸,操作不便且对分离设备要求甚高,综合考虑pH=7为最佳。
|
图 3 pH对3-HP发酵液絮凝的影响 Fig.3 Effect of pH on 3-HP flocculation |
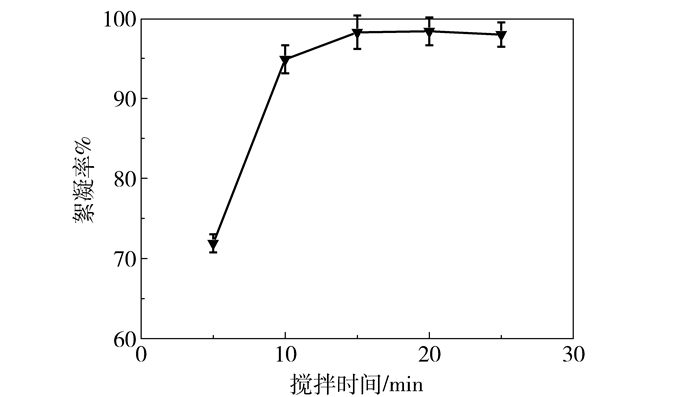
由图 4可知,对于3-HP发酵液体系,加入壳聚糖絮凝剂之后随搅拌时间增加絮凝效果变化明显。机械搅拌时间在15 min以内,菌体絮凝率迅速增大;15 min时,菌体絮凝率为98.2%;15 min以后,菌体絮凝率增加趋于平稳,基本维持在98.0%左右。综上,絮凝过程搅拌时间过短,絮凝剂分散不均匀, 菌体之间无法通过有效架桥作用形成胶团,絮凝效果不明显;而低pH环境下长时间搅拌会降低菌体活性,不利于絮凝菌体再发酵。故机械搅拌15 min,静置30 min为宜。张江红等[18]用壳聚糖和海藻酸钠絮凝2, 3-丁二醇发酵液,最终确定搅拌时间为30 min,静置1 h。本文所需搅拌和静置时间稍短,既保证絮凝效果,又降低能耗。
|
图 4 搅拌时间对3-HP发酵液絮凝的影响 Fig.4 Effect of time on 3-HP flocculation |
为进一步优化絮凝工艺,本文以絮凝剂用量、搅拌时间、pH值为考察因素,设计三因素三水平的正交试验[19]。因素水平排列及结果见表 2、3,SPSS软件分析正交结果见表 4。
| 下载CSV 表 2 正交实验因素水平表 Table 2 Factors and levels of orthogonal tests |
| 下载CSV 表 3 正交试验结果 Table 3 Results of orthogonal tests |
| 下载CSV 表 4 SPSS正交结果 Table 4 Tests of inter-subjects effects of SPSS |
由表 4可知,A、B、C 3因素的sig值均大于0.05,说明各因素之间无显著影响。影响3-HP发酵液絮凝效果的因素顺序为:絮凝剂用量>pH值>搅拌时间。由表 3极差分析结果可知,最佳工艺参数组合为A2B3C2,即壳聚糖用量1.60 g/L,海藻酸钠用量1.60 g/L,发酵液pH=6,搅拌时间20 min。在此条件下,菌体絮凝率在99.00%以上且3-羟基丙酸损失率不足2.00%。
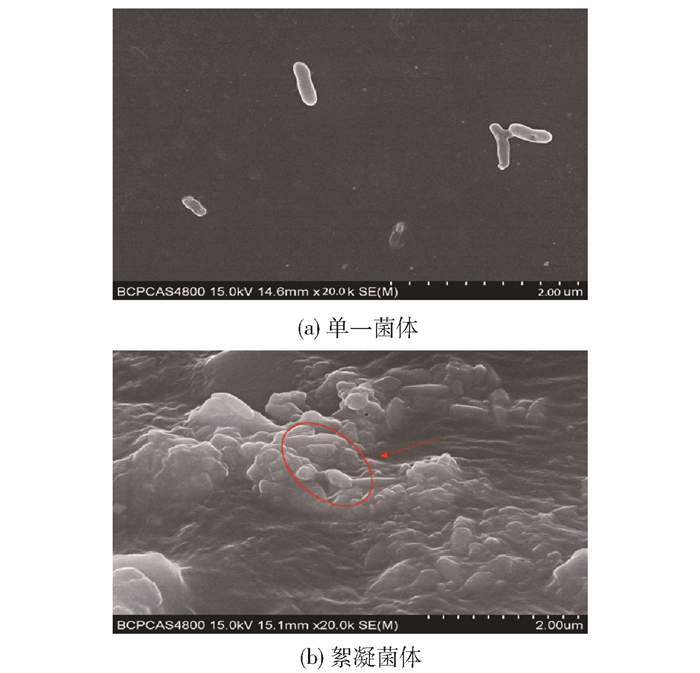
2.3 壳聚糖絮凝机制由图 5可明显观察到3-HP发酵液絮凝前后菌体形态的变化。菌体絮凝后形成絮体,在絮凝剂作用下,菌体通过架桥吸附和离子键等作用聚集成结构紧实的絮凝物沉淀[20]。
|
图 5 菌体结构扫描电镜图 Fig.5 Scanning electron microscope images of bacteria |
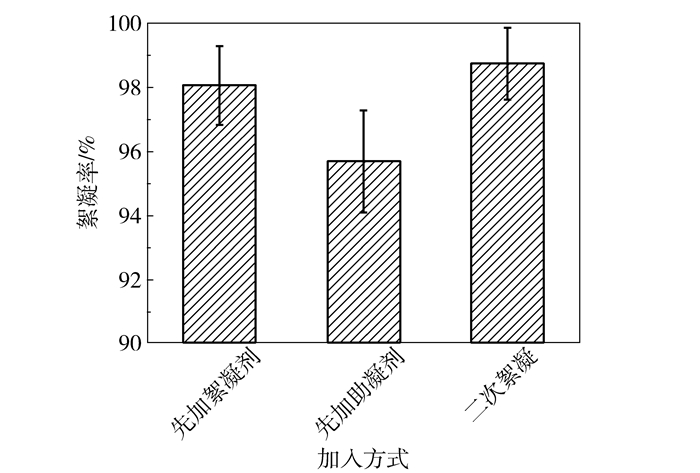
图 6反映了絮凝剂、助凝剂加入先后顺序对絮凝效果的影响。首先加入壳聚糖絮凝剂,菌体絮凝率达98.00%;而先加海藻酸钠助凝剂,絮凝率仅为72.00%,絮凝效果明显降低。由此推断,絮凝过程壳聚糖使固体小颗粒形成小胶团,海藻酸钠增稠作用促使小胶团结合成大胶团,加速沉淀,故首先加入壳聚糖并充分搅拌接触,可有效提高其絮凝率[21]。可采用二次絮凝的方法:首先加入80%絮凝剂和助凝剂,过滤之后再加入剩余20%絮凝剂和助凝剂,以提高絮凝效果。
|
图 6 复合絮凝剂添加顺序对3-HP发酵液絮凝影响 Fig.6 Effect of different addition methods on 3-HP flocculation |
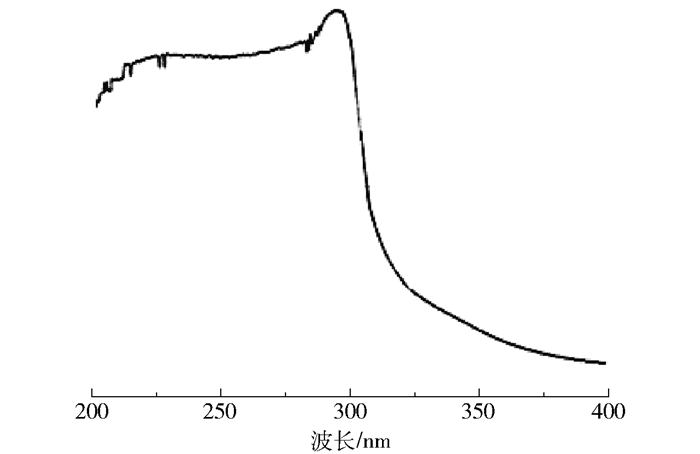
通常,活性炭吸附脱色效果与其粒度、用量、溶液pH、脱色时间和温度等因素有关[22]。低pH值下,带电量少或不带电的物质较易被吸附;活性炭对不带电物质吸附力较强,对带电物质阴离子吸附较弱。由图 7可知,絮凝液的最大吸收波长在300 nm左右。
|
图 7 絮凝液的紫外-可见光扫描图谱 Fig.7 UV-visible spectrum of the flocculant |
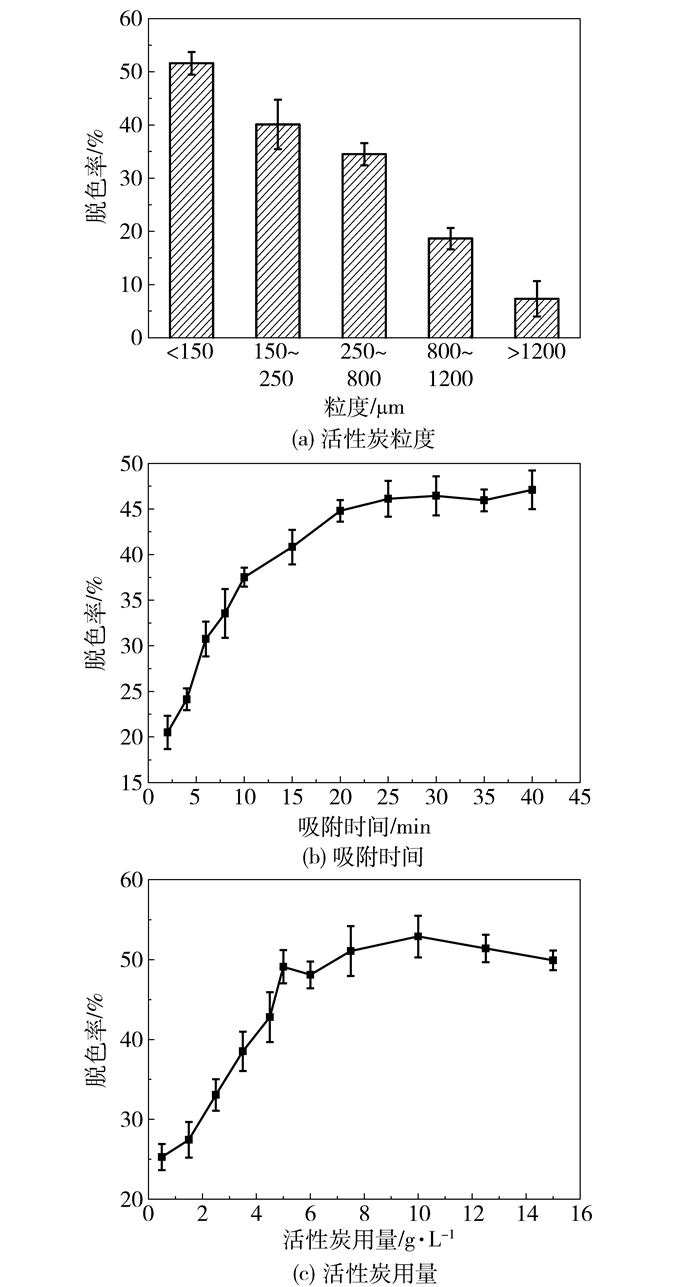
由图 8(a)可知,不同颗粒活性炭对3-HP发酵絮凝液中色素脱除效果有明显差异。脱色所用活性炭粒度大于1200 μm时,3-HP发酵絮凝液脱色率仅为7.32%;而活性炭粒度小于150 μm,3-HP发酵絮凝液脱色率可达51.70%。由此可见,活性炭粒度越小脱色效果越好。因为粉状活性炭比粒状活性炭具有更大比表面积,对色素吸附量也更大,故脱色效果更明显。
|
图 8 3-HP发酵液脱色工艺影响因素 Fig.8 Factors affecting the decoloration of 3-HP broth |
图 8(b)、(c)为吸附时间、活性炭用量对发酵液脱色影响。随着活性炭用量的增大,溶液透光率升高,说明脱色效果变好。根据差异显著性分析,活性炭用量在4.00 g/L、5.00 g/L时,透光率差异显著;而活性炭用量在5.00 g/L和6.00 g/L时,脱色透光率变化不大,因此采用5.00 g/L活性炭进行脱色处理,且该用量远低于工业应用中活性炭用量不超过30 g/L的要求[23]。活性炭脱色过程随吸附时间的增加,发酵絮凝液透光率增大,脱色效果越来越好。脱色时间小于30 min,发酵液脱色率随时间延长而迅速升高;脱色时间超过30 min,色素吸附接近饱和,脱色效果变化不明显。因此活性炭脱色时间以30 min为宜,发酵液脱色率可达46.45%。
3 结论(1) 在Ca(OH)2、FeCl3、Fe2(SO4)3、聚丙烯酰胺、聚合氯化铝、硅藻土、壳聚糖-海藻酸钠和甲壳素等8种絮凝剂中,壳聚糖-海藻酸钠复合絮凝剂效果最佳,其最佳絮凝工艺为:首先加入壳聚糖,充分搅拌,再加入海藻酸钠,其用量均为1.60 g/L,pH=7,搅拌时间20 min,静止30 min,菌体去除率为99.10%。
(2) 根据实验现象推测絮凝机制为:壳聚糖使固体小颗粒形成小胶团,海藻酸钠增稠作用促使小胶团结合成大胶团,进而絮体沉淀。
(3) 3-HP絮凝液最佳脱色条件为:活性炭粒度150 μm,粉末活性炭用量5.00 g/L,振荡时间30 min,脱色效果最佳,脱色率可达46.45%。
| [1] |
Kumar V, Ashok S, Park S. Recent advances in biological production of 3-hydroxypropionic acid[J]. Biotechnology Advances, 2013, 31(6): 945-961. DOI:10.1016/j.biotechadv.2013.02.008 |
| [2] |
Ko Y, Ashok S, Zhou S F, et al. Aldehyde dehydrogenase activity is important to the production of 3-hydroxypropionic acid from glycerol by recombinant Klebsiella pneumoniae[J]. Process Biochemistry, 2012, 47(7): 1135-1143. DOI:10.1016/j.procbio.2012.04.007 |
| [3] |
Dishisha T, Pyo S H, Hatti-Kaul R. Biobased 3-hydroxypropionic-and acrylic acid production from biodiesel glycerol via integrated microbial and chemical catalysis[J]. Microbial Cell Factories, 2015, 14(200): 1501-1506. |
| [4] |
张育新, 康勇. 絮凝剂的研究现状及发展趋势[J]. 化工进展, 2002, 21(11): 799-804. Zhang Y X, Kang Y. Review of the present status and development of flocculation agents[J]. Chemical Industy and Engineering Progress, 2002, 21(11): 799-804. (in Chinese) DOI:10.3321/j.issn:1000-6613.2002.11.002 |
| [5] |
Bayati B, Belbasi Z, Ejtemaei M, et al. Separation of pentane isomers using MFI zeolite membrane[J]. Separation and Purification Technology, 2013, 106(6): 56-62. |
| [6] |
Prochaska K, Staszak K, Woźniak-Budych M J, et al. Nanofiltration, bipolar electrodialysis and reactive extraction hybrid system for separation of fumaric acid from fermentation broth[J]. Bioresource Technology, 2014, 167(3): 219-225. |
| [7] |
Wang Z Y, Wang C, Wang P F, et al. The performance of chitosan/montmorillonite nanocomposite during the flocculation and floc storage processes of Microcystis aeruginosa cells[J]. Environmental Science & Pollution Research International, 2015, 22(14): 11148-11161. |
| [8] |
黄俊, 梅乐和, 胡升, 等. γ-氨基丁酸发酵液的絮凝和脱色工艺研究[J]. 食品工业科技, 2009, 30(7): 257-259. Huang J, Mei L H, Hu S, et al. Study on flocculalion and decolorization of γ-aminobutyric acid fermentation broth[J]. Science and Technology of Food Industry, 2009, 30(7): 257-259. (in Chinese) |
| [9] |
Hubmann G, Guillouet S, Nevoigt E. Gpd1 and Gpd2 fine-tuning for sustainable reduction of glycerol formation in Saccharomyces cerevisiae[J]. Applied and Environmental Microbiology, 2011, 77(17): 5857-5867. DOI:10.1128/AEM.05338-11 |
| [10] |
Menéndez J A, Menéndez E M, Iglesias M J, et al. Modification of the surface chemistry of active carbons by means of microwave-induced treatments[J]. Carbon, 1999, 37(7): 1115-1121. DOI:10.1016/S0008-6223(98)00302-9 |
| [11] |
董慧茹. 仪器分析[M]. 2版. 北京: 化学工业出版社, 2009: 44-101. Dong H R. Instrumental analysis[M]. 2nd ed. Beijing: Chemical Industry Press, 2009: 44-101. (in Chinese) |
| [12] |
Fu F L, Wang Q. Removal of heavy metal ions from wastewaters:a review[J]. Journal of Environmental Management, 2011, 92(3): 407-418. DOI:10.1016/j.jenvman.2010.11.011 |
| [13] |
Chen L, Chen D H, Wu C L. A new approach for the flocculation mechanism of chitosan[J]. Journal of Polymers and the Environment, 2003, 11(3): 87-92. DOI:10.1023/A:1024656813244 |
| [14] |
鲁诗峰, 张代佳, 修志龙. 1, 3-丙二醇发酵液的絮凝处理及絮凝细胞的再利用[J]. 食品与发酵工业, 2006, 32(9): 10-13. Lu S F, Zhang D J, Xiu Z L. Flocculation of 1, 3-PD fermentation broth and reuse of cell in flocs[J]. Food and Fermentation Industries, 2006, 32(9): 10-13. (in Chinese) |
| [15] |
Schmitt A, Fernández-Barbero A, Cabrerizo-Vilchez M, et al. Experimental evidence regarding the influence of surface charge on the bridging flocculation mechanism[J]. Progress in Colloid & Polymer Science, 2007, 104(1): 144-147. |
| [16] |
Qin J Y, Xiao Z J, Ma C Q, et al. Production of 2, 3-butanediol by Klebsiella Pneumoniae using glucose and ammonium phosphate[J]. Chinese Journal of Chemical Engineering, 2006, 14(1): 132-136. DOI:10.1016/S1004-9541(06)60050-5 |
| [17] |
Mohan Raj S, Rathnasingh C, Jung W C, et al. Effect of process parameters on 3-hydroxypropionic acid production from glycerol using a recombinant Escherichia coli[J]. Applied Microbiology & Biotechnology, 2009, 84(4): 649-657. |
| [18] |
张江红, 孙丽慧, 修志龙. 2, 3-丁二醇发酵液的絮凝除菌与絮凝细胞的循环利用[J]. 过程工程学报, 2008, 8(4): 779-783. Zhang J H, Sun L H, Xiu Z L. Removal of Klebsiella pneumoniae cells from 2, 3-butanediol fermentation broth by flocculation and reuse of cells in flocs[J]. The Chinese Journal of Process Engineering, 2008, 8(4): 779-783. (in Chinese) |
| [19] |
陈魁. 试验设计与分析[M]. 北京: 清华大学出版社, 1996: 94-180. Chen K. Design of experiments and analysis[M]. Beijing: Tsinghua University Press, 1996: 94-180. (in Chinese) |
| [20] |
Divakaran R, Sivasankara Pillai V N. Flocculation of algae using chitosan[J]. Journal of Applied Phycology, 2002, 14(5): 419-422. DOI:10.1023/A:1022137023257 |
| [21] |
Mendoza Y, Rahn-Chique K, García-Valera N, et al. On the physical significance of the adjusting parameters in the evaluation of the flocculation rate of an oil-in-water nanoemulsion[J]. Interciencia, 2015, 40(8): 519-524. |
| [22] |
Radwanski E R, Last R L. Tryptophan biosynthesis and metabolism:biochemical and molecular genetics[J]. The Plant Cell, 1995, 7(7): 921-934. DOI:10.1105/tpc.7.7.921 |
| [23] |
Menéndez J A, Menéndez E M, Iglesias M J, et al. Modification of the surface chemistry of active carbons by means of microwave-induced treatments[J]. Carbon, 1999, 37(7): 1115-1121. DOI:10.1016/S0008-6223(98)00302-9 |








