2. 北京化工大学 材料科学与工程学院, 北京 100029
2. College of Materials Science and Engineering, Beijing University of Chemical Technology, Beijing 100029, China
Fe3O4的晶体结构为反尖晶石型的面心立方结构[1],晶体结构决定了Fe3O4的成核惯态为立方体。若其生长环境有利于立方晶核6个晶面的面心同性、快速生长,则各晶面最终会消失,从而形成球形或准球形纳米晶[2]。纳米Fe3O4除了具有纳米粒子的量子尺寸效应、表面与界面效应、体积效应、介电效应等正常特性外[3],还具有强顺磁效应、优良的催化活性等特性,因此被广泛应用于磁记录、磁屏蔽、光催化、光电子材料等领域。近年来磁性纳米材料由于具有超强的顺磁性、室温下矫顽力大、居里温度低、磁化强度小等优点,已被应用于疾病的诊断及治疗、药物载体和生物分离等生物医学领域[4-5]。
随着化工、染料、纺织等工业的发展,有机染料的排放量日益剧增,然而有机染料在排放前往往不能得到较好的处理,导致对土壤、水体等造成严重污染,因此人们也开始逐渐关注如何更好地处理有机染料。传统处理有机染料的方法主要包括物理吸附法、反渗透法等物理化学方法,然而这些方法都不能高效率地处理有机染料。化学降解法因对染料的降解具有不可逆性、降解率高、降解程度彻底、催化剂回收率高等优点,受到越来越多科研人员的青睐。其中Fenton降解法运用传统的Fenton反应原理[6],通过Fe3O4纳米结构等催化H2O2分解产生氧化性极强的·OH自由基,将有机污染物氧化分解为水和二氧化碳[7]。
合成Fe3O4磁性纳米材料的方法有很多,包括溶胶-凝胶法、水热法、模板法、化学共沉淀法[8]、溶剂热法[9]、微乳液法[10]、电化学法[11]、超声辐射溶液法[12]、微波法[13]等液相合成方法,可合成各种不同微观形貌的单分散性Fe3O4磁性纳米材料。其中溶剂热法由于具有工艺简单、设备便宜、易于批量生产、可直接得到结晶良好的产品以及容易控制合适的化学计量比和晶粒形貌等特点,在控制合成Fe3O4纳米结构的研究中最为常用[9]。而在溶剂热合成体系中利用多元醇作为还原剂,使用合适的添加剂以及控制水的含量通常可以获得水体系中难以获得的目标产物,从而更加丰富了Fe3O4纳米结构控制合成的路径。
本文以FeCl3·6H2O为铁源,乙二醇为还原剂,乙二胺为模板剂,通过溶剂热法于200 ℃制备出形貌均一、分散性较好的磁性Fe3O4微球,并对其形貌、晶体结构等进行表征。采用磁分离的方法对目标产物进行了简洁高效的分离,其回收率可达到90%。利用回收后的催化剂进行降解二甲酚橙实验,发现催化剂的催化效率几乎与初始催化剂的催化效率完全相同。
1 实验部分 1.1 实验原料及仪器 1.1.1 试剂六水合三氯化铁,分析纯,天津市光复科技发展有限公司;无水乙酸钠,二甲酚橙,30%过氧化氢,分析纯,天津市科密欧化学试剂有限公司;乙二胺,乙二醇,无水乙醇,分析纯,天津市富宇精细化工有限公司;实验用水为实验室自制蒸馏水。
1.1.2 仪器SB-25-12DT型超声波清洗仪,宁波新芝生物科技有限公司;JB-12型磁力加热搅拌器,上海梅香仪器有限公司;SHA-Ca型水浴恒温振荡器,金坛市宏平仪器厂;H-7650型透射电子显微镜,日本Hitachi公司;D/MAX2200型X-射线衍射仪,日本理学株式会社;TU-1901型双光束紫外-可见光分光光度计,北京普析通用仪器有限公司;Spectrum400型傅里叶变换红外光谱仪,美国Perkin-Elmer公司;NANNUO-Ⅳ型光化学反应仪,上海汗诺仪器有限公司。
1.2 磁性Fe3O4微球的合成按质量比1:3称取FeCl3·6H2O和无水醋酸钠于100 mL烧杯中,然后倒入48 mL乙二醇,超声30 min,得到橙红色悬浊液。再将烧杯放入水浴恒温振荡器中振荡加热至50 ℃,加入预热好的10 mL乙二胺液体,之后将烧杯置于磁力加热搅拌器搅拌至悬浊液转变为澄清的橙红色溶液。将该溶液转入100 mL带有聚四氟乙烯内衬的反应釜中200 ℃反应6 h。反应完成后,将反应釜中的液体倒入烧杯中并用磁铁分离产物。将产物用去离子水和乙醇各洗涤3遍后70 ℃真空干燥。
1.3 磁性Fe3O4微球Fenton降解二甲酚橙取20 mg磁性Fe3O4微球加入到200 mL的20 mg/L二甲酚橙溶液中,机械搅拌15 min。加入30%过氧化氢溶液10 mL并混合均匀后,置于光化学反应仪(U=30 V,I=4 A)中进行Fenton降解反应。每隔10 min取10 mL反应溶液直到150 min,用紫外-可见分光光度计对反应液进行分析,并计算其降解率D。
| $ D = \frac{{({A_1} - {A_0})}}{{{A_0}}} \times 100{\text{% }} $ | (1) |
式(1) 中A1为样品的吸光度,A0为原溶液的吸光度。
1.4 测试与表征利用日本理学株式会社的D/MAX2200型X射线衍射仪(Cu-Kα射线,λ=1.5418 nm)对样品进行X射线衍射分析(XRD),测试范围10°~80°,速度4(°)/min;利用日本Hitachi公司的H-7650型透射电子显微镜(TEM),在100 kV加速电压下拍摄磁性Fe3O4微球的TEM照片;通过美国Perkin-Elmer公司的Spectrum400型傅里叶变换红外光谱仪(FT-IR)对样品进行红外光谱扫描,扫描范围400~4000 cm-1;利用北京普析通用仪器有限公司TU-1901型双光束紫外-可见光分光光度计测试二甲酚橙降解前后的紫外-可见光谱,光谱扫描范围350~550 nm,波长定位436 nm,扫描速度0.2 nm/s。
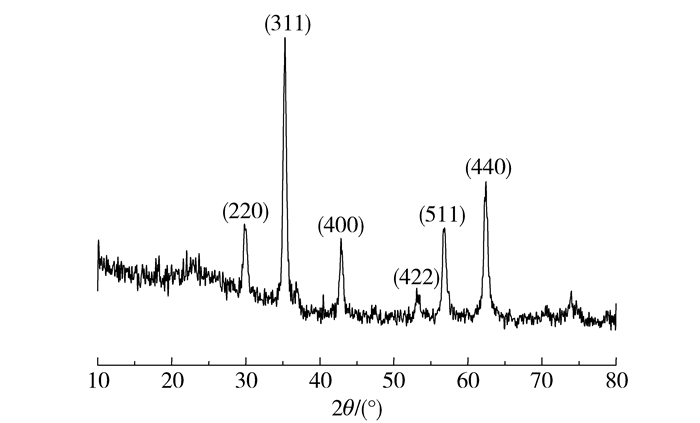
2 结果与讨论 2.1 磁性Fe3O4微球分析结果 2.1.1 晶体结构如图 1所示,溶剂热反应合成的样品的衍射峰与Fe3O4标准卡(JCPDS No. 75-0033) 相符,其空间群为Fd-3m[227],晶格类型为面心立方,晶格常数为a=0.9000 nm,不存在其他杂质衍射峰,即所制备样品的纯度较高。以最强衍射峰2θ=35.319°晶面为基准,根据Debye-Scherrer公式d=kλ/(βcosθ)(d为纳米粒子的直径,k为Scherrer常数,值为0.89,β为衍射峰半高宽度,θ为衍射角度),计算得到构成Fe3O4微球的结构基元直径约为7.6995 nm[14]。
|
图 1 磁性Fe3O4微球的XRD图谱 Fig.1 XRD pattern of magnetic Fe3O4 nanospheres |
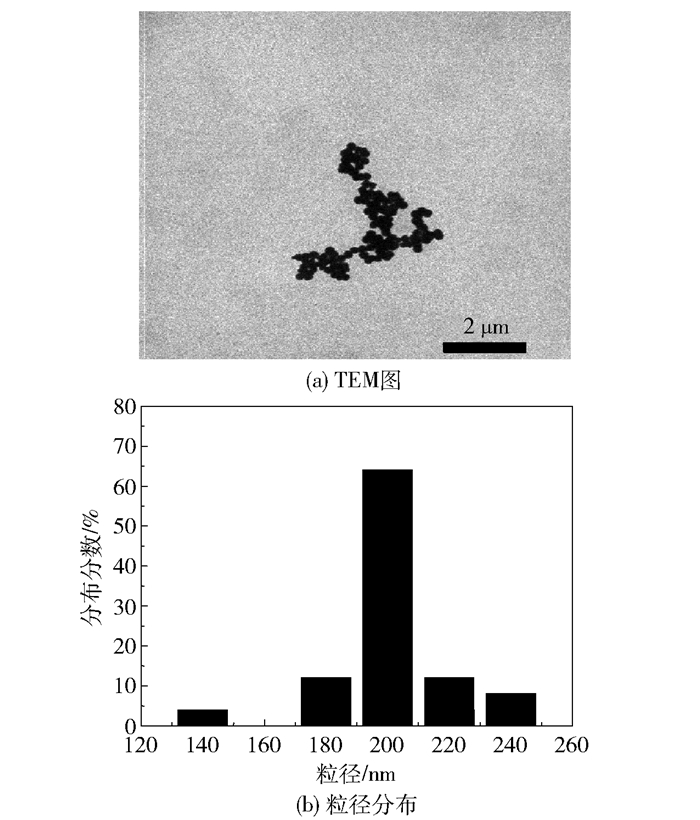
磁性Fe3O4微球的TEM及粒径分布如图 2所示。图 2的结果表明,所合成的产品形貌均一,分散性较好,每个微球为球形或近球形,平均粒径约为200 nm左右。
|
图 2 磁性Fe3O4微球的TEM及粒径分布图 Fig.2 TEM images and size distribution of the magnetic Fe3O4 nanospheres |
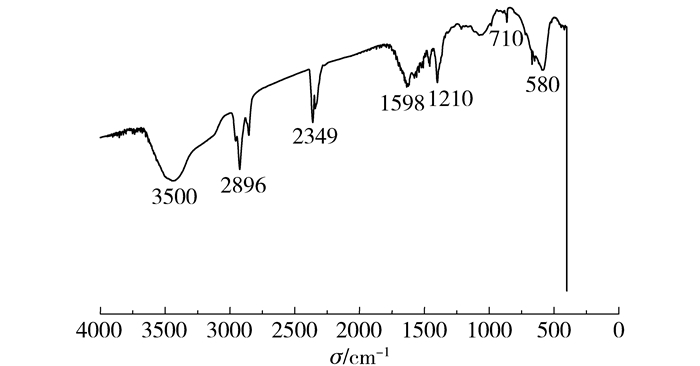
磁性Fe3O4微球的红外光谱如图 3所示,580 cm-1为Fe3O4特征吸收峰,710 cm-1为伯胺N—H的扭曲振动峰,1210 cm-1为C—N的脂肪族伯胺的伸缩振动峰,1598 cm-1为伯胺N—H的变角振动峰,2349 cm-1为CO2的伸缩振动峰,2896 cm-1为—CH2的伸缩振动峰,3500 cm-1为—OH的伸缩振动峰。由于反应物中含有乙二醇,故谱图中含有—OH的特征峰,但是不难看出磁性Fe3O4微球表面修饰有乙二胺。表面氨基的存在一定程度上能够增加微球的单分散性、亲水性和抗氧化性。
|
图 3 磁性Fe3O4微球的红外光谱图 Fig.3 FT-IR spectrum of the magnetic Fe3O4 nanospheres |
图 4为固定反应温度等其他条件不变,仅改变模板剂乙二胺剂量的情况下所得到的磁性Fe3O4微球TEM照片。由图可以看出,反应体系中乙二胺浓度对磁性Fe3O4微球的分散性、粒径及形貌有较大影响。随着乙二胺剂量的增加,磁性Fe3O4微球粒径逐渐趋于平均,形貌变得均一,单分散性提高。当体系中无乙二胺(图 4(a))时,合成的产品分散性较差,并有明显的团聚现象,粒径、形貌不均一。当体系中乙二胺添加量为5 mL时(图 4(b)),所生成的磁性Fe3O4虽呈球状,但分散性较差,并有轻微团聚现象发生,且粒径、形貌不够均一。当向反应体系中加入10 mL乙二胺时(图 4(c)),所制备的磁性Fe3O4微球仍具有球状或类球状形貌,粒子的单分散性明显高于前两者,并且粒径、形貌十分均一。当增大乙二胺用量至15 mL时(图 4(d)),所得产品形貌并未改变,单分散性也较图 4(c)有所降低,粒径形貌不够均一,有轻微团聚现象。综上,当加入10 mL乙二胺时,合成产品的单分散性达到最优。

|
图 4 不同剂量乙二胺所合成磁性Fe3O4微球TEM的图像 Fig.4 TEM images of magnetic Fe3O4 nanospheres obtained with different amounts of added 1, 2-ethanediamine |
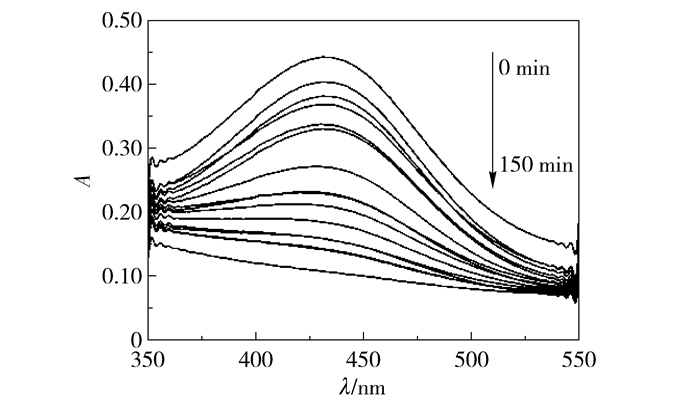
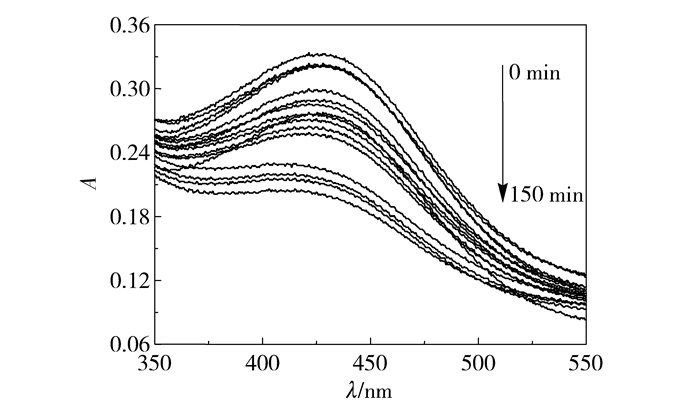
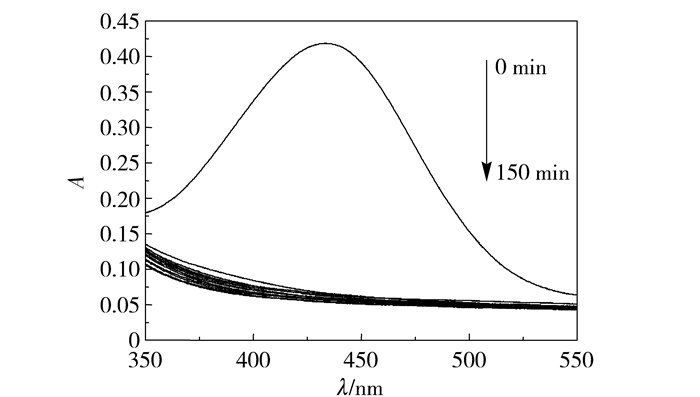
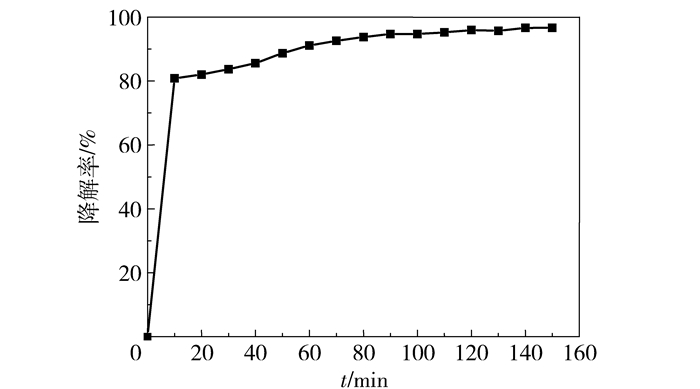
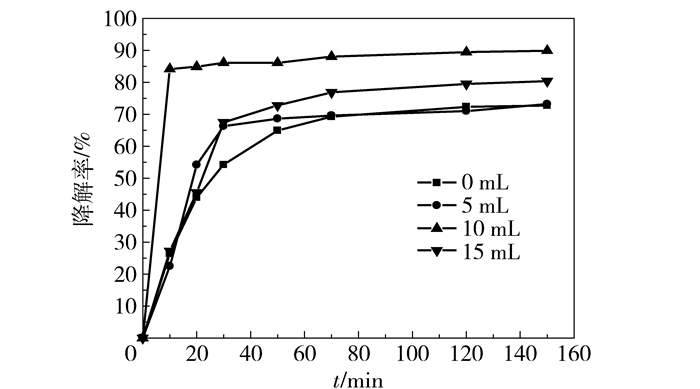
如图 5和图 6所示,当不加入H2O2或无紫外光照射下催化剂的催化降解效率较低。从图 7可以看出,在pH=1,过氧化氢加入量为15 mL时,由紫外-可见光谱吸收峰得出,在反应进行至30 min之前,二甲酚橙特征吸收峰吸光度减弱明显,反应至50 min特征吸收峰几乎消失。为了研究方便,对不同降解时间下二甲酚橙特征吸收峰的强度进行分析,得到了二甲酚橙降解率与时间关系曲线如图 8所示。在前30 min二甲酚橙降解率增加较快,至60 min时降解速率减缓,由此可知当反应进行至60 min时反应接近平衡状态。反应至150 min时降解率为96.68%。
|
图 5 无H2O2催化剂降解二甲酚橙紫外-可见光谱图 Fig.5 UV-vis spectra of xylenol orange during degradation by magnetic Fe3O4 nanospheres without H2O2 |
|
图 6 无紫外光光照下催化剂催化降解二甲酚橙紫外-可见光谱图 Fig.6 UV-vis spectra of xylenol orange during degradation by magnetic Fe3O4 nanospheres without ultraviolet light |
|
图 7 磁性Fe3O4催化降解二甲酚橙紫外-可见光谱图 Fig.7 UV-vis spectra of xylenol orange during degradation by magnetic Fe3O4 nanospheres |
|
图 8 二甲酚橙降解率与时间关系曲线 Fig.8 Degradation ratio of xylenol orange as a function of time during degradation by magnetic Fe3O4 nanospheres |
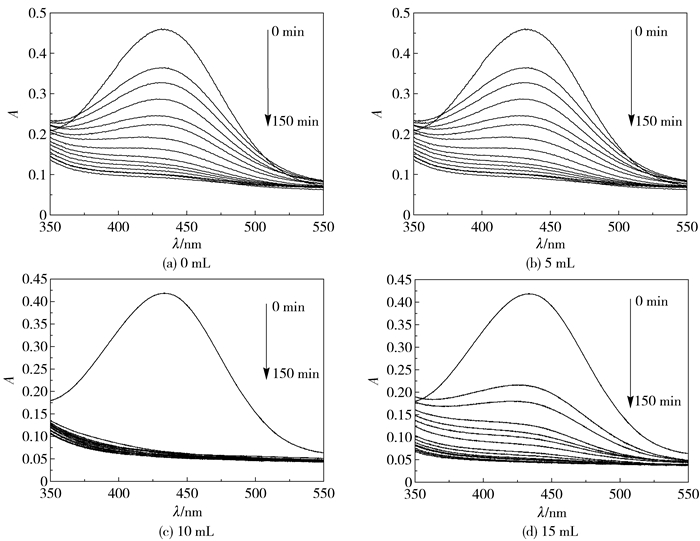
如图 9和图 10所示,在反应体系中加入不同剂量的乙二胺,对所合成的样品的催化降解效率具有明显的影响。当反应体系中未加入乙二胺时(图 9(a)),前30 min降解速率最小,且反应结束时降解率仅为72%;当反应体系中乙二胺剂量为5 mL时(图 9(b)),其降解速率较未加入乙二胺有所提高。当乙二胺加入量为10 mL时,降解速率达到最大值(图 9(c)),反应进行至10 min时降解率已达85%以上,且反应结束时降解率为90%以上。当反应体系加入15 mL乙二胺时(图 9(d)),降解速率与加入5 mL乙二胺时的降解速率相近,但反应结束时的降解率较加入5 mL乙二胺高。综上,反应体系中加入10 mL乙二胺对降解速率和反应最终的降解率具有显著的影响。究其原因,由于乙二胺对样品形貌、粒径的影响与对样品催化降解效率的影响相吻合,可以发现当样品的分散性较好、形貌较为平均时催化降解效率最高。除此之外,乙二胺对样品的表面修饰使样品亲水性提高,也能够提高样品的催化降解效率。但随着乙二胺增多,氨基数量增多,影响催化剂与溶液接触,因此当乙二胺加入量为15 mL时催化降解效率有所下降。
|
图 9 不同剂量乙二胺所合成磁性Fe3O4微球降解二甲酚橙紫外-可见光谱 Fig.9 UV-vis spectra of xylenol orange during degradation by Fe3O4 with different amounts of added 1, 2-ethanediamine |
|
图 10 加入不同剂量乙二胺时二甲酚橙降解率与时间关系曲线 Fig.10 Degradation ratio of xylenol orange as a function of time during degradation by magnetic Fe3O4 nanospheres with different amounts of added 1, 2-ethanediamine |
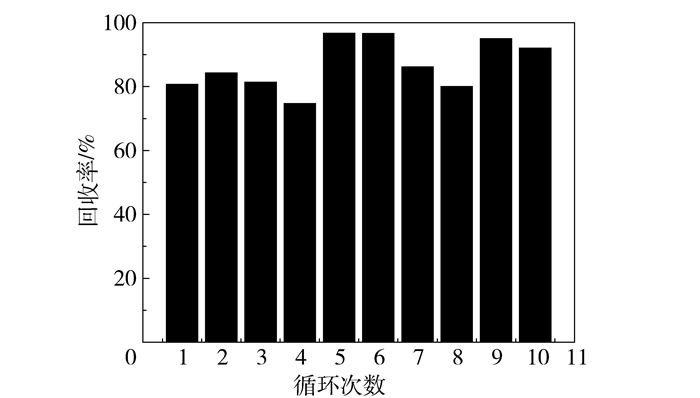
催化剂重复利用效率及回收率如表 1和图 11所示。由图 11可知,除了催化剂第4次催化后回收率为74.70%外,其余回收率都在80%~95%之间。表明催化剂回收分离过程中能够利用磁分离使催化剂的分离简单方便,并可将分离过程中的损失降到最低。
| 下载CSV 表 1 催化剂回收率及循环利用效率 Table 1 Recovery ratios and recovery efficiency of the catalyst |
|
图 11 催化剂的回收率 Fig.11 Recovery ratios of the catalyst |
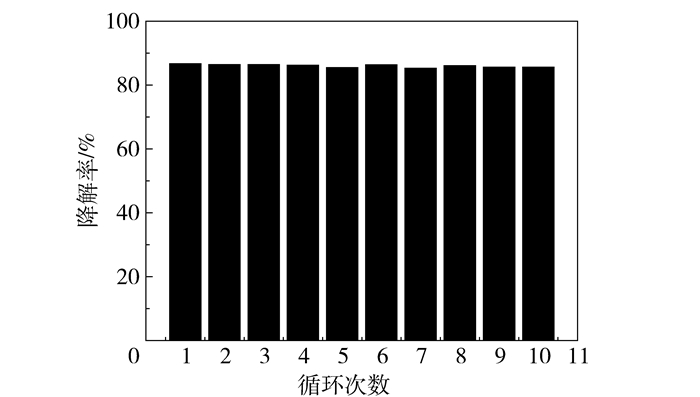
如图 12所示,在催化剂重复利用过程中可以发现回收后催化剂的降解率能够始终维持在85%左右,这也说明催化剂的稳定性较好,复原能力较强。
|
图 12 催化剂循环利用效率 Fig.12 Recovery efficiencies of the catalyst |
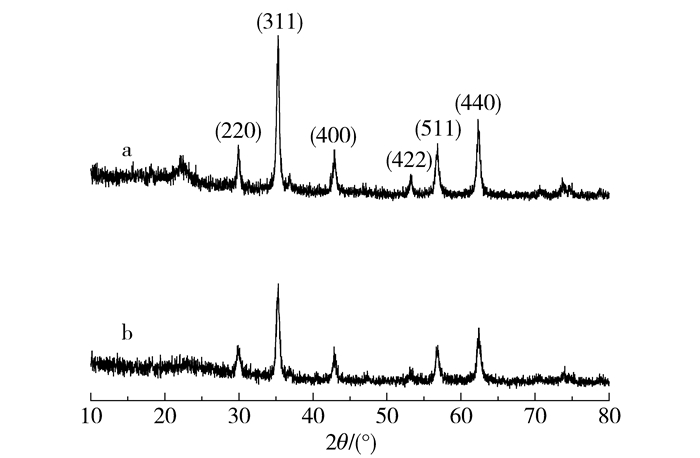
如图 13所示,催化降解10次后样品的XRD谱图与新合成的样品无明显差别,说明磁性Fe3O4微球在反应过程中是作为催化剂存在的,并没有随着反应的进行而发生变化。这也从结构的角度解释了在重复利用的过程中,催化剂的回收率以及催化降解效率始终维持在很高水平的原因。
|
a—初始样品;b—催化降解10次后样品。 图 13 催化降解前后Fe3O4微球的XRD图谱 Fig.13 XRD patterns of magnetic Fe3O4 nanospheres before and after reaction |
(1) 以FeCl3·6H2O为铁源,乙二醇为还原剂,乙二胺为模板剂制备磁性Fe3O4微球,可有效地控制所生成产物的形貌、尺寸及分散性。所得到的磁性Fe3O4微球呈球状或似球状,粒子粒径分布于140~240 nm,具有良好的单分散性,所得样品与未加入乙二胺相比粒径更加平均且形貌更加均一。此外,乙二胺的加入量对催化降解效率具有显著影响。
(2) 制备的Fe3O4微球在Fenton降解二甲酚橙方面效果显著,降解率达90%以上。反应后催化剂可直接通过磁铁吸引的方式回收,回收率可达90%以上。回收后的催化剂只需简单超声清洗便可再生并循环利用,且催化剂再生后的降解效果与其一次催化的效果相近。
| [1] |
Laurent S, Forge D, Port M, et al. Magnetic iron oxide nanoparticles:synthesis, stabilization, vectorization, physicochemical characterizations, and biological applications[J]. Chemical Reviews, 2008, 108(6): 2064-2110. DOI:10.1021/cr068445e |
| [2] |
王旭珍. Fe3O4微/纳米磁性材料的合成、自组装及其性能研究[D]. 辽宁大连: 大连理工大学, 2012. Wang X Z. Fe3O4 nano/micrometer materails:fabrication, self-assembly and magnetic property[D]. Dalian, Liaoning:Dalian University of Technology, 2012. (in Chinese) |
| [3] |
徐莺莺, 林晓影, 陈春英. 影响纳米材料毒性的关键因素[J]. 科学通报, 2013, 58(24): 2466-2478. Xu Y Y, Lin X Y, Chen C Y. Key factors influencing the toxicity of nanomaterials[J]. Chinese Science Bulletin, 2013, 58(24): 2466-2478. (in Chinese) |
| [4] |
Emadi H, Kharat A N. Single source preparation of superparamagnetic Fe3O4 nanoparticles by simple cyclic microwave approach[J]. Materials Research Bulletin, 2013, 48(10): 3994-4001. DOI:10.1016/j.materresbull.2013.06.008 |
| [5] |
Yang C, Wu J J, Hou Y L. Fe3O4 nanostructures:synthesis, growth mechanism, properties and applications[J]. Chemical Communications, 2011, 47(18): 5130-5141. DOI:10.1039/c0cc05862a |
| [6] |
梁大鑫. 金属硫族化合物半导体材料的制备与性质研究[D]. 长春: 吉林大学, 2012. Liang D X. The synthesis and properties of metal chalcogenide semiconductors[D]. Changchun:Jilin University, 2012. (in Chinese) |
| [7] |
Wang N, Zhu L H, Wang D L, et al. Sono-assisted preparation of highly-efficient peroxidase-like Fe3O4 magnetic nanoparticles for catalytic removal of organic pollutants with H2O2[J]. Ultrasonics Sonochem, 2010, 17: 526-533. DOI:10.1016/j.ultsonch.2009.11.001 |
| [8] |
张伟, 张邦文, 袁泽明, 等. 化学共沉淀法制备Fe3O4纳米颗粒的研究进展[J]. 内蒙古科技大学学报, 2012, 31(4): 348-350. Zhang W, Zhang B W, Yuan Z M, et al. Advances in the preparation of nanomagnetite by chemical co-precipitation[J]. Journal of Inner Mongolia University of Science and Technology, 2012, 31(4): 348-350. (in Chinese) |
| [9] |
牛文军, 沈亚乐, 许静, 等. Fe3O4纳米微球的溶剂热法合成及其对二甲酚橙的催化降解研究[J]. 无机化学学报, 2013, 29(10): 2110-2118. Niu W J, Shen Y L, Xu J, et al. Solvothermal synthesis of Fe3O4 nanospheres and study on the catalytic degradation of xylenol orange[J]. Chinese Journal of Inorganic Chemistry, 2013, 29(10): 2110-2118. (in Chinese) |
| [10] |
崔静, 王騊, 王晟. 微乳液法合成MgCO3·3H2O纳米棒及其应用拓展[J]. 浙江理工大学学报:自然科学版, 2015, 33(2): 183-187. Cui J, Wang T, Wang S. Synthesis of MgCO3·3H2O nanorod via micro-emulsion method and research on its applications[J]. Journal of Zhejiang Sci-Tech University:Natural Science, 2015, 33(2): 183-187. (in Chinese) |
| [11] |
林松竹, 陈欢欢, 李艺花, 等. 磁性Fe3O4纳米晶的电化学制备及在线混凝过程研究[J]. 高等学校化学学报, 2014, 35(12): 2529-2533. Lin S Z, Chen H H, Li Y H, et al. Electrochemical preparation of magnetic Fe3O4 nanocrystalline and its online coagulation properties[J]. Chemical Journal of Chinese Universities, 2014, 35(12): 2529-2533. (in Chinese) |
| [12] |
Kumar R V, Koltypin Y, Xu X N, et al. Fabrication of magnetite nanorods by ultrasound irradiation[J]. Journal of Applied Physics, 2001, 89(11): 6324-6328. DOI:10.1063/1.1369408 |
| [13] |
Muraliganth T, Murugan A V, Manthiram A. Facile synthesis of carbon-decorated single-crystalline Fe3O4 nanowires and their application as high performance anode in lithium ion batteries[J]. Chemical Communications, 2009, 41(47): 7360-7362. |
| [14] |
Zhu L P, Xiao H M, Zhang W D, et al. One-pot template-free synthesis of monodisperse and single-crystal magnetite hollow spheres by a simple solvothermal route[J]. Crystal Growth & Design, 2008, 8(3): 957-963. |








