石油资源是不可再生资源,随着石油用量的增加,资源的逐渐稀缺,石油价格不断上涨。另一方面,石油的燃烧会产生大量的有害物质, 严重危害人体健康, 产生的CO2引发温室效应, 对生态平衡造成严重破坏[1]。面对这种现状, 研究开发新的可替代能源意义重大[2]。生物柴油便于储存和运输,硫含量低,可降解和再生,并具有良好的润滑性[3],是一种可再生的新型绿色能源[4-5]。我国对生物柴油的开发和研究起步较晚[6-7], 但发展势头迅猛, 有很多大中型企业已经开始进行生物柴油的生产制备。制备生物柴油的方法有直接混合法、微乳化法、高温裂解法、酯交换法等, 其中最常用的为酯交换法[8]。浓硫酸是目前使用最为广泛的催化剂, 但存在难分离、难回收、设备腐蚀和环境污染严重等问题[9]。固体催化剂反应条件较为温和, 可控性强,循环利用率高,易与产物分离。然而固体碱催化剂易发生皂化反应, 对反应条件要求苛刻, 固体酸催化剂则能够有效的避免这些问题。
由芳香族化合物或碳水化合物经炭化、磺化可制得活性较高的炭基固体酸催化剂,已有很多研究人员对此进行了研究[10-12]。本文以简单易得的葡萄糖为原料,对其进行炭化、磺化,得到葡萄糖炭基固体酸催化剂,将其用于催化油酸与甲醇的酯化反应,并对工艺条件进行了优化。
1 实验部分 1.1 实验原料及设备葡萄糖(GB), 油酸,甲醇,乙醇,0.1 mol/L氢氧化钾,酚酞指示剂,分析纯,国药集团化学试剂有限公司;浓硫酸, 分析纯,天津化工有限公司;去离子水,实验室自制。
LTKC-4-12A可编程节能型管式加热炉,杭州蓝天化工仪器厂;FA1004B型电子天平,上海越平科学仪器有限公司;DUG-90366型干燥箱,上海精宏实验设备有限公司;SHZ-D(Ⅲ)循环水式真空泵,巩义市予华仪器有限责任公司。
1.2 催化剂的制备炭化 以葡萄糖为炭质材料,在氮气(60 mL/min)保护下于管式炉中200 ℃下炭化2 h,并收集炭化物。
磺化 炭化物与硫酸的质量体积比(g/mL)为1:20,用量筒取20 mL的98%浓硫酸于锥形瓶内,置于油浴锅内加热到130 ℃,再称取1 g炭化物加入到锥形瓶中,在转子的搅拌下反应2 h。
洗涤 磺化反应达到设定的反应时间后, 自然冷却至室温, 将混合物加入到装有蒸馏水的烧杯内, 经搅拌、静置、过滤后, 用蒸馏水洗涤至滤液pH值为7, 置于干燥箱内干燥即可得到葡萄糖炭基固体酸催化剂。
1.3 生物柴油的制备称取3 g左右的油酸,置于三口烧瓶内,按一定的剂油质量比(剂油比)加入催化剂,插入温度计,安装回流装置,保持反应装置的气密性。待反应体系达到一定温度,按一定的醇油物质的量比加入甲醇,反应一定时间。结束后过滤,蒸馏,滴定。
1.4 测试与表征 1.4.1 X射线衍射分析(XRD)利用XRD分析葡萄糖炭基固体酸催化剂的微晶大小及其排布形式。将样品用研钵磨细, 利用德国布鲁克公司D8 Advance型X射线衍射仪对样品进行XRD表征。扫描方式为连续扫描,起始角度4.80°,扫描速度0.2(°)/s,采样时间0.5 s,探测器为正比探测器。
1.4.2 扫描电子显微镜分析(SEM)采用日本日立公司su8010型电子显微镜观察和分析葡萄糖炭基固体酸催化剂的整体形貌及结构。
1.4.3 生物柴油产率的计算通过酯化反应来检测催化剂的催化效果,转化率X的计算公式为
| $ X=\frac{{{A}_{0}}-{{A}_{t}}}{{{A}_{0}}} $ |
其中,A0为初始酸值,At为瞬时酸值。
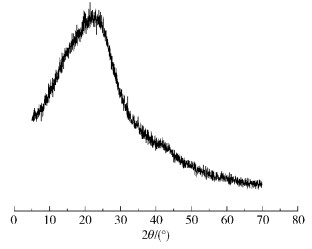
2 结果与讨论 2.1 葡萄糖炭基固体酸催化剂的晶体结构及形貌由图 1的XRD谱图可见,在2θ=12°~30°之间有一个较强且宽的特征峰,这表明该固体酸催化剂为类似于石墨的无定形炭结构,且石墨化程度较低。
|
图 1 葡萄糖炭基固体酸催化剂的XRD表征 Fig.1 XRD characterization of the glucose carbon-based solid acid catalyst |
图 2为催化剂的扫描电镜图。由图可见,该催化剂表面多孔,呈块状分布,有明显的断面且其形态不规则。

|
图 2 葡萄糖炭基固体酸催化剂的电镜照片 Fig.2 Scanning electron microscopy image of the glucose carbon-based solid acid catalyst |
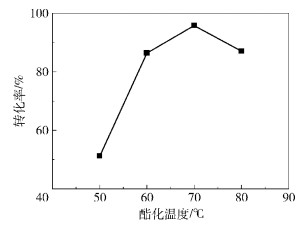
在不同酯化反应温度下,采用磺酸化炭质催化剂,以剂油比0.07,醇油物质的量比10:1,反应7 h,对油酸及其产物进行酸值滴定,计算得到油酸转化率如图 3所示。
|
图 3 酯化反应温度对油酸转化率的影响 Fig.3 Effect of temperature on the conversion of oleic acid esterification |
由图 3可见,随酯化温度的升高,油酸的转化率明显升高。当酯化温度达到70 ℃时,转化率达到95.79%,酯化温度继续升高,油酸转化率迅速降低。
分析这种现象的原因为:酯化反应为吸热反应,反应体系温度的增高有利于反应正向进行,所以转化率有所提高;当反应温度过高时,有副反应产生, 如醇脱水、酯水解等,导致酯化反应转化率明显降低。
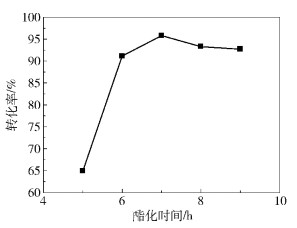
2.2.2 酯化反应时间利用磺酸化炭质为催化剂,在剂油比0.07,醇油物质的量比10:1,酯化温度70 ℃条件下,反应不同时间,并对油酸及其产物进行酸值滴定,计算油酸转化率,结果如图 4所示。
|
图 4 酯化反应时间对油酸转化率的影响 Fig.4 Effect of oleic acid esterification reaction time on the conversion |
由图 4可见,随反应时间的延长,油酸转化率迅速升高,直至7 h,转化率达到95.79%。随着反应时间的进一步延长,转化率有下降趋势。
造成这种现象的原因可能是随着反应时间的增加,反应逐渐达到平衡,反应7 h后基本达到平衡。进一步延长酯化反应时间,油酸转化率明显下降,这是因为酯化反应为可逆反应,反应时间过长,有副反应发生,导致油酸甲酯部分分解,油酸转化率下降。
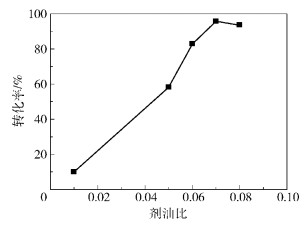
2.2.3 剂油比调整不同的剂油比,利用磺酸化炭质为催化剂,在醇油物质的量比10:1,酯化温度70 ℃的条件下反应7 h,对油酸及产物进行酸值滴定,计算油酸转化率,结果如图 5所示。
|
图 5 剂油比对油酸转化率的影响 Fig.5 Effect of oleic acid to oil ratio on the oleic acid conversion |
由图 5可以看出,随剂油比的增大,油酸的转化率明显升高,在剂油比达到0.07时,油酸转化率最高。随剂油比的继续增大,转化率有所下降。
出现这种现象的原因是炭基固体酸催化剂催化油酸与甲醇的酯化反应属于多相催化反应,由于催化剂的比表面积不变,用量不断增多,则反应界面不断加大,反应速度逐渐加快,油酸的转化率提高明显。但是随着催化剂用量的继续增加,催化剂用量基本达到饱和状态,继续加入催化剂会导致催化剂的聚集,使接触面积减小,导致转化率的下降。
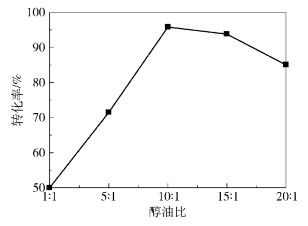
2.2.4 醇油物质的量比当醇油物质的量比不同时,利用磺酸化炭质为催化剂,在剂油比0.07,酯化温度70 ℃的条件下反应7 h,对油酸及产物进行酸值滴定,计算油酸转化率,结果见图 6。
|
图 6 醇油比对油酸转化率的影响 Fig.6 Effect of methanol to oil ratio on the oleic acid conversion |
由图 6可见,随醇油物质的量比的增加,油酸转化率明显增加。当醇油物质的量比达到10:1时,油酸的转化率达到最大,随醇油物质的量比的继续增加,转化率有所下降。
出现这种趋势的原因可能是甲醇作为反应物, 其含量的增加无疑会促进反应向正向移动, 加快反应的进行;然而,过多甲醇的加入会稀释油酸甲酯的浓度,且反应体系极性增加,导致亲核取代反应速率减慢,因此进一步增加甲醇用量反而使反应速率下降, 油酸转化率降低。
3 结论(1) 以葡萄糖为原料,可制得葡萄糖炭基固体酸催化剂,得到的催化剂表面呈多孔不规则分布,为石墨化程度较低的无定形炭。
(2) 利用所制得的催化剂催化油酸与甲醇的酯化反应,最佳的反应条件为:酯化温度70 ℃,醇油物质的量比10:l,剂油比0.07,反应7 h。此时油酸的转化率最高,可达到95.79%。
| [1] |
Shay E G. Diesel fuel from vegetable oils:status and opportunities[J]. Biomass & Bioenerg, 1993, 4(4): 227-242. |
| [2] |
王常文, 崔方方, 宋宇. 生物柴油的研究现状及发展前景[J]. 中国油脂, 2014, 39(5): 44-47/48. Wang C W, Cui F F, Song Y. Research situation and development prospect of biodiesel[J]. China Oils and Fats, 2014, 39(5): 44-47/48. (in Chinese) |
| [3] |
闵恩泽, 姚志龙. 我国发展生物柴油产业的挑战与对策[J]. 天然气工业, 2008, 28(7): 1-4. Min E Z, Yao Z L. Challenges and policies for the development of biodiesel industry in China[J]. Natural Gas Industry, 2008, 28(7): 1-4. (in Chinese) |
| [4] |
李昊. 碳基固体酸催化剂的制备及其应用研究[D]. 昆明: 昆明理工大学, 2011: 4-6. Li H. The preparation of carbon-based solid acid catalyst and its application research[D]. Kunming:Kunming University of Science and Technology, 2011:4-6. (in Chinese) |
| [5] |
Intarapong P, Iangthanarat S, Phanthong P, et al. Activity and basic properties of KOH/mordenite for transesterification of palm oil[J]. Journal of Energy Chemistry, 2013, 22(5): 690-700. DOI:10.1016/S2095-4956(13)60092-3 |
| [6] |
Wu G Y, Lin X P, Wu M X, et al. Kinetics of cottonseed oil transesterification in batch reactor[J]. Journal of Chemical Engineering of Chinese Universities, 2003, 17(3): 314-318. |
| [7] |
Sheng M, Guo D F, Zhang D H. Study on preparation of bio-diesel with soybean oil[J]. China Oils & Fats, 2002, 21(7): 1782-1790. |
| [8] |
魏红明, 赵华. 生物柴油制备方法及应用现状[J]. 当代化工, 2006, 35(4): 246-249/269. Wei H M, Zhao H. Preparation methods of application situation of biodiesel fuels[J]. Contemporary Chemical Industry, 2006, 35(4): 246-249/269. (in Chinese) |
| [9] |
Liu Y J, Lotero E, Jr Goodwin J G. A comparision of the esterification of acetic acid with methanol using heterogeneous versus homogeneous acid catalysis[J]. Journal of Catalysis, 2006, 242(2): 278-286. DOI:10.1016/j.jcat.2006.05.026 |
| [10] |
Hara M, Yoshida T, Takagaki A, et al. A carbon material as a strong protonic acid[J]. Angewandte Chemie International Edition, 2004, 43: 2955-2958. DOI:10.1002/(ISSN)1521-3773 |
| [11] |
Toda M, Takagaki A, Okamura M, et al. Green chemistry:biodiesel made with sugar catalyst[J]. Nature, 2005, 438(438): 178. |
| [12] |
Zong M H, Duan Z Q, Lou W Y, et al. Preparation of a sugar catalyst and its use for highly efficient production of biodiesel[J]. Green Chemistry, 2007, 9(5): 434-437. DOI:10.1039/b615447f |








