文章信息
- 游以勒, 王胜锋.
- You Yile, Wang Shengfeng
- 磷酸二酯酶5抑制剂与肿瘤发病关联研究的新进展
- Progress in research of association between phosphodiesterase 5 inhibitors and cancer incidence
- 中华流行病学杂志, 2023, 44(9): 1486-1490
- Chinese Journal of Epidemiology, 2023, 44(9): 1486-1490
- http://dx.doi.org/10.3760/cma.j.cn112338-20230213-00072
-
文章历史
收稿日期: 2023-02-13
磷酸二酯酶5抑制剂(PDE5Is)通过抑制磷酸二酯酶5(PDE5)分解环磷酸鸟苷(cGMP)为无生物活性的衍生物,促使cGMP依赖性蛋白激酶(PKG)激活、蛋白质磷酸化和细胞内Ca2+浓度升高,最终导致平滑肌松弛[1]。PDE5Is包括西地那非、他达拉非和伐地那非等,因良好的疗效和安全性而被欧洲药物管理局和美国食品药品监督管理局批准作为治疗勃起功能障碍(ED)的一线药物。目前,临床上批准的PDE5Is适应证还包括下尿路症状和肺动脉高压;此外,许多临床前研究表明PDE5Is在癌症、糖尿病、心功能不全、阿尔茨海默病等疾病中具有潜在的治疗作用[1]。
伴随用药数量的逐年增加,人群研究提示西地那非可能会增加黑色素瘤和基底细胞癌的发病风险[2],细胞实验研究也提示西地那非可能通过cGMP-PKG1通路促进黑色素瘤细胞的生长和迁移[3],但缺乏剂量反应关系的证据。同时,也有研究提示PDE5Is可能会降低结直肠癌发病风险[4],动物实验研究也提示提高肠道cGMP水平可以通过靶向早期癌变阶段来减少肠道肿瘤的发生[5],但一项研究认为ED患者中并无关联[6]。近些年,陆续在JAMA[7]、Gastroenterology[4]、Eur Urol等[8]杂志发表了源自美国、英国、瑞典、丹麦等地万级至百万级样本量的皮肤瘤、结直肠癌相关的大规模人群研究。本文通过系统梳理PDE5Is与肿瘤发病风险的关联研究,总结现有研究的经验及不足,为未来开展研究提供思路和参考。
1. PDE5Is与肿瘤发病关联研究现状:
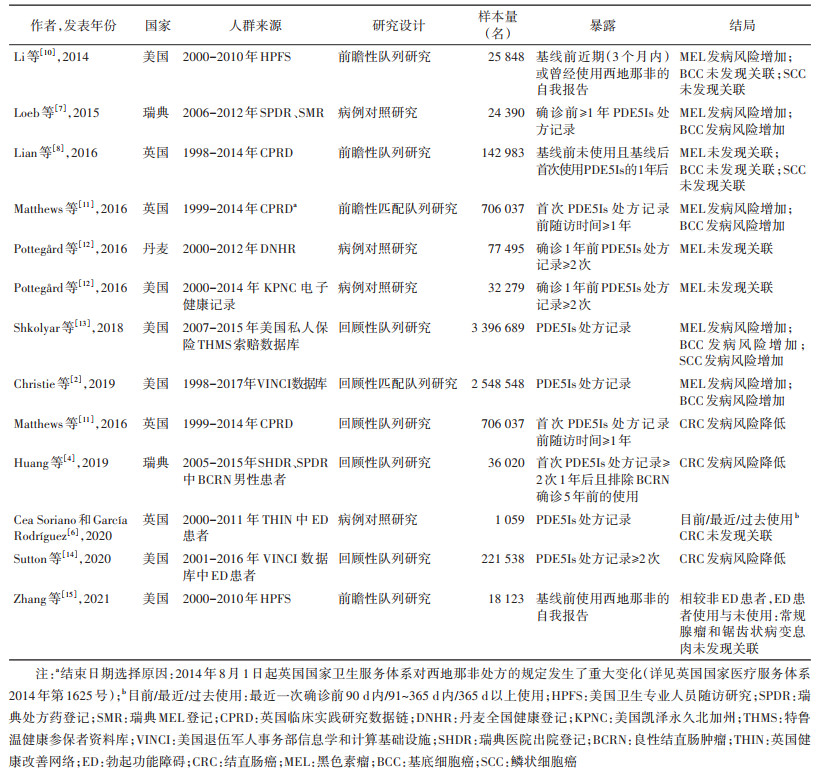
(1)皮肤癌:共有9项(其中1项为基于药品不良反应自发呈报系统的数据挖掘[9],表 1未列入)人群研究关注PDE5Is与黑色素瘤、基底细胞癌、鳞状细胞癌的发病风险关联(表 1)。研究数据源主要依赖欧美等地区的大型电子医疗数据、保险索赔数据和临床研究数据;设计类型以队列研究(尤其前瞻性队列研究)和病例对照研究为主。
2017年,汇集2项队列研究[10-11]和2项病例对照研究[7, 12]的Meta分析显示,使用PDE5Is与黑色素瘤(RR=1.11,95%CI:1.02~1.22)、基底细胞癌(RR=1.16,95%CI:1.13~1.20)发病风险增加相关[16];随后在上述5项研究基础上补充纳入同一项队列研究[8]的4项Meta分析皆支持这一结论[17-20],同时显示与鳞状细胞癌(OR=1.04,95%CI:0.78~1.37)无统计学关联[17],但是一项补充纳入2项大规模队列研究[2, 13]的Meta分析显示,鳞状细胞癌(OR=1.07,95%CI:1.01~1.13)发病风险亦增加[21]。
(2)结直肠癌:目前共有5项人群研究关注PDE5Is与结直肠癌的发病风险关联(表 1)。研究数据源、设计类型均与皮肤癌类似,其中1项侧重关注PDE5Is与结直肠癌癌前病变(常规腺瘤和锯齿状病变息肉)的发病风险关联[15]。
2021年,汇集3项队列研究[4, 11, 14]和1项病例对照研究[6]的Meta分析显示,使用PDE5Is人群结直肠癌发病风险显著降低(RR=0.85,95%CI:0.76~0.95),且与药物类型无统计学关联(RR=1.00,95%CI:0.98~1.02)[22]。现有研究基本提示PDE5Is具有预防结直肠癌的作用,且存在剂量反应关系证据。如随着PDE5Is累计使用剂量[4]或处方数量[14]的增加,结直肠癌发病风险持续降低,存在明显线性关系;用药时长超过5年的发病风险显著降低(RR=0.63,95%CI:0.59~0.68)[22]。
(3)前列腺癌:现有3项人群研究关注PDE5Is与前列腺癌的发病风险关联。研究数据源主要来自美国,设计类型与皮肤癌类似,其中Machen等[23]在Chavez等[24]的基础上进行了完善。2019年,汇集1项队列研究[24]和2项病例对照研究[23, 25]的Meta分析显示,使用PDE5Is与前列腺癌发病风险增加无统计学关联(OR=0.71,95%CI:0.40~1.29)[26]。尽管先前研究提示了PDE5Is的预防作用(OR=0.4,95%CI:0.3~0.5)[24],但后续研究均认为并无关联[23, 25]。
(4)其他肿瘤:对肾上腺偶发瘤,2010年一次会议摘要提到的一项小型回顾性研究发现,32例每月4次、至少持续30个月使用PDE5Is的ED患者中出现5例肾上腺偶发瘤(无功能肾上腺腺瘤),其中4例使用西地那非、1例使用他达拉非;鉴于肾上腺偶发瘤的发病率约为6%,认为使用PDE5Is可能与肾上腺新发肿瘤病变相关(P=0.03),有待更大规模的人群研究确证[27]。除上述肿瘤外,目前尚未发现与其他肿瘤的人群关联研究。
2. 方法学层面存在的问题:尽管现有关联较为清晰,但因果推断仍存诸多争议。以原始研究最多的皮肤癌为例,方法学层面存在3点局限。
(1)缺乏剂量反应关系的证据:就PDE5Is片剂数量而言,对基底细胞癌,发病风险随片剂数量俱增[2];但对黑色素瘤,仅一项研究提示使用≥25片者发病风险显著增加(HR=1.34,95%CI:1.04~1.72)[8],Meta分析显示高低剂量发病风险并无差异[16],甚至一项研究发现随着使用量级的增加,发病风险先升后降,最大剂量反而具有保护作用(OR=0.81,95%CI:0.77~0.86)[2]。就PDE5Is处方数量而言,对黑色素瘤,一项研究提示使用≥7次处方者发病风险显著增加(HR=1.30,95%CI:1.01~1.69)[8],但同一数据库更大规模研究却未能验证这一发现[11],其他研究亦未见关联[7, 19]。就肿瘤分期而言,Meta分析显示使用PDE5Is人群原位黑色素瘤发病风险增加且高于局部黑色素瘤[16, 21],非局限性黑色素瘤发病风险反而降低[12, 20-21];此前研究也发现,黑色素瘤0、Ⅰ期发病风险增加,Ⅱ~Ⅳ期发病风险反而降低[7]。
(2)存在尚未调整的残余混杂:现有研究多调整了年龄、BMI、吸烟状况、查尔森合并症指数、其他疾病诊断和地理位置,但不少研究未能考虑最高文化程度、社会经济地位、年就诊次数等,日晒[10]和性别[13]也极少涉及。以日晒因素为例,黑色素瘤、基底细胞癌、日光性角化病的共同危险因素是日晒,黑色素瘤、非黑色素瘤皮肤癌分别与间歇日晒、慢性日晒密切相关[17],而使用PDE5Is与日光性角化病(HR=1.21,95%CI:1.17~1.25)发病风险同样相关[11]。此外,较高的文化程度、社会经济地位与PDE5Is、恶性黑色素瘤发病风险均相关[7];使用PDE5Is人群年就诊次数更多[2],且较低分期的黑色素瘤发病率更高[12]。
(3)暴露的初始定义与后续变化欠考虑:对暴露的初始定义,病例对照研究中,Pottegård等[12]考虑到近期药物使用与癌症发展因果关系甚微[28],忽略了确诊前1年内开具的处方,Loeb等[7]发现仅在确诊前1年内首次使用PDE5Is的男性黑色素瘤发病风险显著增高(OR=1.27,95%CI:1.09~1.48);Lian等[8]考虑了暴露作用的潜伏期(即首次PDE5Is处方1年后才认为暴露)以最小化检出症候偏倚。对用药信息的后续变化,Li等[10]最早研究仅于2000年有一次自我报告用药信息,后续研究通过电子医疗数据获取PDE5Is处方数量、片剂数量,然而仅有少数研究更新处方数量、用药时长累积的结局[11],探索剂量和时间反应关系[11, 13]。
其余肿瘤研究也存在类似的问题,如吸烟、饮食等结直肠癌混杂因素无法获取[4];样本量相对较小[6, 23],把握度不足;随访时间较短[25](4年),而前列腺癌潜伏期较长甚至终生未被发现[29]。
3. 人群层面受限于PDE5Is的特殊情况也存在3点不足。
(1)不同亚型PDE5Is的使用差异:就PDE5Is上市时间而言,西地那非于1998年上市,他达拉非和伐地那非则于2003年上市;不少研究起始时间早于2003年,造成一段长达5年的西地那非独占市场的研究时期,而不同亚型PDE5Is之间可能存在风险差异。以皮肤癌为例,对黑色素瘤,使用200~499片他达拉非者发病风险(OR=2.05,95%CI:1.10~3.84)明显高于使用200~499片西地那非(OR=1.44,95%CI:0.99~2.11)和≥500片西地那非(OR=1.39,95%CI:0.58~3.32)[12];不同亚型PDE5Is中,使用他达拉非者发病风险最高,且较西地那非发病更早而病死率更低[9];然而,一项Meta分析却显示,仅有西地那非与黑色素瘤发病风险增加相关(OR=1.16,95%CI:1.03~1.30)[21]。
(2)不同地区或种族的情况复杂:就PDE5Is使用地区而言,西地那非、他达拉非和伐地那非皆率先于美国上市,其他国家和地区使用滞后且处方管制各有不同。以前列腺癌为例,北美地区使用者更多且前列腺癌发病风险更低[25],可能归因于北美地区管制较为宽松,而其他地区只有在适应症(如ED)更严重的情况下方可使用,面临更多与前列腺癌相关的危险因素(如ED患者的吸烟、肥胖和冠状动脉疾病等)抵消PDE5Is潜在的预防作用。不同地区人群之间也可能存在发病风险差异,如PDE5Is相关黑色素瘤发病风险仅在欧洲地区人群中显著增加,美国人群则未发现统计学关联[17, 21];然而,现有研究数据源皆基于西方发达国家人群数据,而发展中国家也存在大量使用人群,现有研究结论可能不适用于其他种族或地区[20]。
(3)不同性别、适应症的代表性不足:就PDE5Is使用对象而言,PDE5Is最早批准用于治疗ED,使用对象绝大多数为男性且伴有ED,造成女性使用研究极少(仅一项研究提示性别差异[13])、适应症偏倚(即所治疾病本身可能影响研究结论)和一般人群外推性不明。如此前研究发现,仅在良性结直肠肿瘤确诊前使用PDE5Is发病风险更低[4],提示潜在的适应症偏倚尚未厘清;仅对ED患者,大规模(221 538名研究对象)回顾性队列研究支持PDE5Is的预防作用[14],而后续研究又认为并无关联[6, 15]。此外,不少研究纳入人群皆伴有一定基础病变(如良性结直肠肿瘤[4]、ED[6, 14-15, 24]);以Chavez等[24]最早的前列腺癌研究为例,纳入者皆为ED患者,且并非所有对象都接受了前列腺活检而存在漏诊风险,后续研究尽管得以多次强制性活检,但研究人群PDE5Is使用率较低,代表性仍受限[25]。
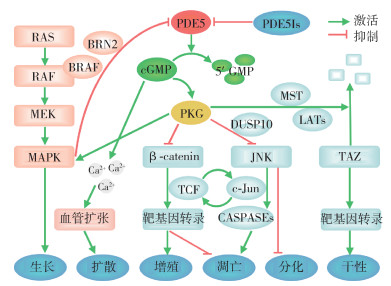
4. PDE5Is与肿瘤发病关联的可能机制:尽管现有研究存在争议,但机制研究为上述风险关联皆提供了微观证据。PDE5Is通过抑制PDE5的降解作用,导致cGMP水平升高,激活PKG、提高Ca2+水平。现有实验室证据主要揭示5条肿瘤关联通路,其中第1条为双重机制,第2条为致癌机制,后3条为抗癌机制,且存在正反馈环路:①cGMP-Ca2+通路:胞质Ca2+增多导致细胞收缩性增强、血管扩张,一方面促进黑色素瘤的侵袭和转移[30],另一方面促进循环灌注、降低缺血缺氧所致肿瘤发病风险。②cGMP-PKG-MAPK通路:cGMP通过PKG1增强MAPK活性,从而促进黑色素瘤生长和迁移[3]。与此同时,MAPK通路BRAF突变通过转录因子BRN2抑制PDE5的表达,激活cGMP-Ca2+通路[30];MAPK活性与cGMP水平的交互促进受限于PDE5的降解作用[3],而PDE5Is打破这一制约,显著增强黑色素瘤发展的正反馈。③cGMP-PKG-β连环蛋白通路:PKG通过降低β连环蛋白水平,导致与TCF结合减少,靶基因转录活性降低,抑制细胞增殖、诱导细胞凋亡,从而抑制结直肠癌的生长[31]。④cGMP-PKG-JNK通路:PKG2通过双重特异性蛋白磷酸酶10抑制JNK活性、促进杯状细胞标志物MUC2表达,抑制细胞凋亡和增殖,促进杯状细胞分化[32],从而减少瘤变和息肉数量,维持肠上皮细胞稳态[5]。与此同时,c-Jun转录与TCF表达相互调控,建立起连接β连环蛋白通路与JNK通路的正反馈环路[33]。⑤cGMP-PKG-TAZ通路:PKG2通过MST和LATs降解TAZ,导致靶基因转录活性降低,肿瘤细胞干性降低,促进细胞分化,从而抑制前列腺癌的生长和转移[34]。此外,PDE5Is通过PKG和转录因子CREB,增强酪氨酸酶表达,导致黑色素合成增多[35],从而显著促进黑色素瘤的发展[36];通过提高射精频率,可能减少前列腺腺泡中致癌分泌物的残留,从而降低前列腺癌发病风险[37]。见图 1。
|
| 注:①环磷酸鸟苷(cGMP)-Ca2+通路:PDE5:磷酸二酯酶-5;②cGMP-cGMP依赖性蛋白激酶(PKG)-丝裂原活化蛋白激酶(MAPK)通路:ERK:细胞外信号调节激酶;MEK:MAPK和ERK激酶;③cGMP-PKG-β-catenin通路:β-catenin:β连环蛋白;TCF:T细胞因子;④cGMP-PKG-c-Jun氨基末端激酶(JNK)通路:JDUSP10:双重特异性蛋白磷酸酶10;CASPASEs:含半胱氨酸的天冬氨酸蛋白水解酶;⑤cGMP-PKG-TAZ通路及说明:MST:哺乳动物不育系20样激酶;LATs:大肿瘤抑制激酶;TAZ:转录调节蛋白1;干性:干细胞活性 图 1 磷酸二酯酶-5抑制剂(PDE5Is)与肿瘤发病风险关联的机制 |
5. 总结与展望:现有观察性研究提示,使用PDE5Is与黑色素瘤、基底细胞癌发病风险增加相关,鳞状细胞癌结果尚不一致,而与前列腺癌无统计学关联,可能具有结直肠癌化学预防作用。但需注意,因果推断时,仍存在混杂因素调整不充分[4, 12]、用药信息未考虑时序变化[6, 10, 17]、研究人群代表性不足[6, 14-15, 24]等局限,仍待大规模前瞻性研究或随机对照试验的确证。未来研究开展面临至少3项机遇:①随着“万艾可”专利到期,用药成本骤降、市场规模扩张,可能弱化社会经济地位等因素的混淆。②随着PDE5Is适应症(如下尿路症状、肺动脉高压[1])的拓展,女性和非ED男性PDE5Is使用者日益增多,同时跨国数据库合作日益紧密,有助于在更多人群中的验证。③随着健康医疗大数据的开发,基于观察性健康医疗数据科学与信息学计划等数据库,针对不同国家和地区人群开展相关研究已具备基础。在此基础上,现提出后续研究的3个潜在方向:①继续关注皮肤癌的残余混杂、结直肠癌的适应症偏倚、前列腺癌的研究不足等局限,进一步探索剂量[4, 8, 14]和时间[22]反应关系、肿瘤分期[4, 7, 12, 16, 20]的因果佐证;其中,剂量反应关系可能不是简单的线性关系[2]。②基于跨国数据库和健康医疗大数据,针对不同亚型PDE5Is、地区或种族、性别和适应症的人群开展外推性验证。③现有不少针对不同肿瘤开展的研究数据源相同[2, 10, 14-15],验证了基于同一数据库挖掘不同肿瘤的可行性,因此,未来基于大数据挖掘PDE5Is与肿瘤整体发病风险关联也值得尝试。
利益冲突 所有作者声明无利益冲突
| [1] |
Samidurai A, Xi L, Das A, et al. Beyond erectile dysfunction: cGMP-specific phosphodiesterase 5 inhibitors for other clinical disorders[J]. Annu Rev Pharmacol Toxicol, 2023, 63: 585-615. DOI:10.1146/annurev-pharmtox-040122-034745 |
| [2] |
Christie A, Vera PL, Higgins M, et al. Erectile dysfunction medications and skin cancer: an analysis in US veterans[J]. Urology, 2019, 126: 116-120. DOI:10.1016/j.urology.2019.01.025 |
| [3] |
Dhayade S, Kaesler S, Sinnberg T, et al. Sildenafil potentiates a cGMP-dependent pathway to promote melanoma growth[J]. Cell Rep, 2016, 14(11): 2599-2610. DOI:10.1016/j.celrep.2016.02.028 |
| [4] |
Huang WQ, Sundquist J, Sundquist K, et al. Use of phosphodiesterase 5 inhibitors is associated with lower risk of colorectal cancer in men with benign colorectal neoplasms[J]. Gastroenterology, 2019, 157(3): 672-681.e4. DOI:10.1053/j.gastro.2019.05.012 |
| [5] |
Sharman SK, Islam BN, Hou YL, et al. Cyclic-GMP-elevating agents suppress polyposis in APCmin mice by targeting the preneoplastic epithelium[J]. Cancer Prev Res (Phila), 2018, 11(2): 81-92. DOI:10.1158/1940-6207.CAPR-17-0267 |
| [6] |
Cea Soriano L, García Rodríguez LA. No association between use of phosphodiesterase 5 inhibitors and colorectal cancer in men with erectile dysfunction[J]. Pharmacoepidemiol Drug Saf, 2020, 29(5): 605-608. DOI:10.1002/pds.5000 |
| [7] |
Loeb S, Folkvaljon Y, Lambe M, et al. Use of phosphodiesterase type 5 inhibitors for erectile dysfunction and risk of malignant melanoma[J]. JAMA, 2015, 313(24): 2449-2455. DOI:10.1001/jama.2015.6604 |
| [8] |
Lian Y, Yin H, Pollak MN, et al. Phosphodiesterase type 5 inhibitors and the risk of melanoma skin cancer[J]. Eur Urol, 2016, 70(5): 808-815. DOI:10.1016/j.eururo.2016.04.035 |
| [9] |
王燕霞, 李正红, 陈爱华, 等. 磷酸二酯酶-5抑制剂相关黑色素瘤不良反应2 161例[J]. 药品评价, 2022, 19(5): 312-316. DOI:10.19939/j.cnki.1672-2809.2022.05.15 Wang YX, Li ZH, Chen AH, et al. 2 161 cases of adverse reactions of melanoma associated with phosphodiesterase-5 inhibitors[J]. Drug Eval, 2022, 19(5): 312-316. DOI:10.19939/j.cnki.1672-2809.2022.05.15 |
| [10] |
Li WQ, Qureshi AA, Robinson KC, et al. Sildenafil use and increased risk of incident melanoma in US men: a prospective cohort study[J]. JAMA Intern Med, 2014, 174(6): 964-970. DOI:10.1001/jamainternmed.2014.594 |
| [11] |
Matthews A, Langan SM, Douglas IJ, et al. Phosphodiesterase type 5 inhibitors and risk of malignant melanoma: matched cohort study using primary care data from the UK clinical practice research datalink[J]. PLoS Med, 2016, 13(6): e1002037. DOI:10.1371/journal.pmed.1002037 |
| [12] |
Pottegård A, Schmidt SAJ, Olesen AB, et al. Use of sildenafil or other phosphodiesterase inhibitors and risk of melanoma[J]. Br J Cancer, 2016, 115(7): 895-900. DOI:10.1038/bjc.2016.248 |
| [13] |
Shkolyar E, Li SF, Tang J, et al. Risk of melanoma with phosphodiesterase type 5 inhibitor use among patients with erectile dysfunction, pulmonary hypertension, and lower urinary tract symptoms[J]. J Sex Med, 2018, 15(7): 982-989. DOI:10.1016/j.jsxm.2018.05.002 |
| [14] |
Sutton SS, Magagnoli J, Cummings TH, et al. The association between phosphodiesterase-5 inhibitors and colorectal cancer in a national cohort of patients[J]. Clin Transl Gastroenterol, 2020, 11(6): e00173. DOI:10.14309/ctg.0000000000000173 |
| [15] |
Zhang YW, Lo CH, Giovannucci EL. Phosphodiesterase 5 inhibitor use and risk of conventional and serrated precursors of colorectal cancer[J]. Cancer Epidemiol Biomarkers Prev, 2021, 30(2): 419-421. DOI:10.1158/1055-9965.EPI-20-1126 |
| [16] |
Loeb S, Ventimiglia E, Salonia A, et al. Meta-analysis of the association between phosphodiesterase inhibitors (PDE5Is) and risk of melanoma[J]. J Natl Cancer Inst, 2017, 109(8): djx086. DOI:10.1093/jnci/djx086 |
| [17] |
Tang HL, Wu WT, Fu SS, et al. Phosphodiesterase type 5 inhibitors and risk of melanoma: a meta-analysis[J]. J Am Acad Dermatol, 2017, 77(3): 480-488.e9. DOI:10.1016/j.jaad.2017.04.1129 |
| [18] |
Wang J, Shen YG, Wang JN, et al. Relation of phosphodiesterase type 5 inhibitors and malignant melanoma: a meta-analysis and systematic review[J]. Oncotarget, 2017, 8(28): 46461-46467. DOI:10.18632/oncotarget.17518 |
| [19] |
Deng T, Duan X, Liu B, et al. Association between phosphodiesterase type 5 inhibitors use and risk of melanoma: a meta-analysis[J]. Neoplasma, 2018, 65(2): 216-221. DOI:10.4149/neo_2018_170111N23 |
| [20] |
Feng SJ, Zhou L, Liu QY, et al. Are phosphodiesterase type 5 inhibitors associated with increased risk of melanoma?: a systematic review and meta-analysis[J]. Medicine (Baltimore), 2018, 97(3): e9601. DOI:10.1097/MD.0000000000009601 |
| [21] |
Lu YP, Fan SJ, Liang Z, et al. Phosphodiesterase type 5 inhibitors and risk of skin cancers in men: a meta-analysis and trial sequential analysis involving 7, 479, 852 subjects[J]. World J Mens Health, 2021, 39(4): 683-696. DOI:10.5534/wjmh.200082 |
| [22] |
Bhagavathula AS, Tesfaye W, Vidyasagar K. Phosphodiesterase type 5 inhibitors use and risk of colorectal cancer: a systematic review and meta-analysis[J]. Int J Colorectal Dis, 2021, 36(12): 2577-2584. DOI:10.1007/s00384-021-04022-5 |
| [23] |
Machen GL, Rajab MH, Pruszynski J, et al. Phosphodiesterase type 5 inhibitors usage and prostate cancer: a match-paired analysis[J]. Transl Androl Urol, 2017, 6(5): 879-882. DOI:10.21037/tau.2017.06.02 |
| [24] |
Chavez AH, Scott Coffield K, Hasan Rajab M, et al. Incidence rate of prostate cancer in men treated for erectile dysfunction with phosphodiesterase type 5 inhibitors: retrospective analysis[J]. Asian J Androl, 2013, 15(2): 246-248. DOI:10.1038/aja.2012.162 |
| [25] |
Jamnagerwalla J, Howard LE, Vidal AC, et al. The association between phosphodiesterase type 5 inhibitors and prostate cancer: results from the REDUCE study[J]. J Urol, 2016, 196(3): 715-720. DOI:10.1016/j.juro.2016.03.172 |
| [26] |
Wu YG, Qu XF, Wang Y, et al. Effect of phosphodiesterase type 5 inhibitors on prostate cancer risk and biochemical recurrence after prostate cancer treatment: a systematic review and meta-analysis[J]. Andrologia, 2019, 51(2): e13198. DOI:10.1111/and.13198 |
| [27] |
Drenidis DG, Loannis II, Deliveliotis C, et al. 203 the effect of phosphodiesterase type 5-a inhibitors chronic use on the adrenal glands[J]. Eur Urol Suppl, 2010, 9(2): 95. DOI:10.1016/S1569-9056(10)60206-0 |
| [28] |
Burstein HJ, Schwartz RS. Molecular origins of cancer[J]. N Engl J Med, 2008, 358(5): 527. DOI:10.1056/NEJMe0800065 |
| [29] |
陈雨良, 严维刚. 前列腺潜伏癌的尸检研究[J]. 中华泌尿外科杂志, 2022, 43(3): 229-233. DOI:10.3760/cma.j.cn112330-20210326-00153 Chen YL, Yan WG. Autopsy studies of latent prostate cancer[J]. Chin J Urol, 2022, 43(3): 229-233. DOI:10.3760/cma.j.cn112330-20210326-00153 |
| [30] |
Arozarena I, Sanchez-Laorden B, Packer L, et al. Oncogenic BRAF induces melanoma cell invasion by downregulating the cGMP-specific phosphodiesterase PDE5A[J]. Cancer Cell, 2011, 19(1): 45-57. DOI:10.1016/j.ccr.2010.10.029 |
| [31] |
Piazza GA, Ward A, Chen X, et al. PDE5 and PDE10 inhibition activates cGMP/PKG signaling to block Wnt/β-catenin transcription, cancer cell growth, and tumor immunity[J]. Drug Discov Today, 2020, 25(8): 1521-1527. DOI:10.1016/j.drudis.2020.06.008 |
| [32] |
Wang R, Kwon IK, Singh N, et al. Type 2 cGMP-dependent protein kinase regulates homeostasis by blocking c-Jun N-terminal kinase in the colon epithelium[J]. Cell Death Differ, 2014, 21(3): 427-437. DOI:10.1038/cdd.2013.163 |
| [33] |
Sancho R, Nateri AS, de Vinuesa AG, et al. JNK signalling modulates intestinal homeostasis and tumourigenesis in mice[J]. EMBO J, 2009, 28(13): 1843-1854. DOI:10.1038/emboj.2009.153 |
| [34] |
Liu NH, Mei L, Fan XY, et al. Phosphodiesterase 5/protein kinase G signal governs stemness of prostate cancer stem cells through Hippo pathway[J]. Cancer Lett, 2016, 378(1): 38-50. DOI:10.1016/j.canlet.2016.05.010 |
| [35] |
Zhang XD, Yan GR, Ji J, et al. PDE5 inhibitor promotes melanin synthesis through the PKG pathway in B16 melanoma cells[J]. J Cell Biochem, 2012, 113(8): 2738-2743. DOI:10.1002/jcb.24147 |
| [36] |
Noonan FP, Zaidi MR, Wolnicka-Glubisz A, et al. Melanoma induction by ultraviolet A but not ultraviolet B radiation requires melanin pigment[J]. Nat Commun, 2012, 3: 884. DOI:10.1038/ncomms1893 |
| [37] |
Rider JR, Wilson KM, Sinnott JA, et al. Ejaculation frequency and risk of prostate cancer: updated results with an additional decade of follow-up[J]. Eur Urol, 2016, 70(6): 974-982. DOI:10.1016/j.eururo.2016.03.027 |
 2023, Vol. 44
2023, Vol. 44