文章信息
- 姚添, 扆琳珠, 王科科, 李雁笛, 渠轶群, 丰淑英, 王素萍, 冯永亮.
- Yao Tian, Yi Linzhu, Wang Keke, Li Yandi, Qu Yiqun, Feng Shuying, Wang Suping, Feng Yongliang
- HBsAg阳性母亲新生儿干扰素基因刺激因子天然免疫信号通路对婴儿乙型肝炎疫苗无/弱应答的影响
- Effects of neonatal stimulator of interferon genes innate immune signaling pathway of HBsAg-positive mothers on non/hypo-response to hepatitis B vaccine in infants
- 中华流行病学杂志, 2023, 44(9): 1447-1453
- Chinese Journal of Epidemiology, 2023, 44(9): 1447-1453
- http://dx.doi.org/10.3760/cma.j.cn112338-20230715-00005
-
文章历史
收稿日期: 2023-07-15
2. 山西医科大学临床流行病学与循证医学中心, 太原 030001;
3. 山西医科大学公共卫生学院流行病学教研室, 太原 030001;
4. 山西医科大学第一医院, 太原 030001;
5. 太原市第三人民医院妇产科, 太原 030001
2. Center of Clinical Epidemiology and Evidence Based Medicine, Shanxi Medical University, Taiyuan 030001, China;
3. Department of Epidemiology, School of Public Health, Shanxi Medical University, Taiyuan 030001, China;
4. The First Hospital of Shanxi Medical University, Taiyuan 030001, China;
5. Department of Obstetrics and Gynaecology, The Third People's Hospital of Taiyuan, Taiyuan 030001, China
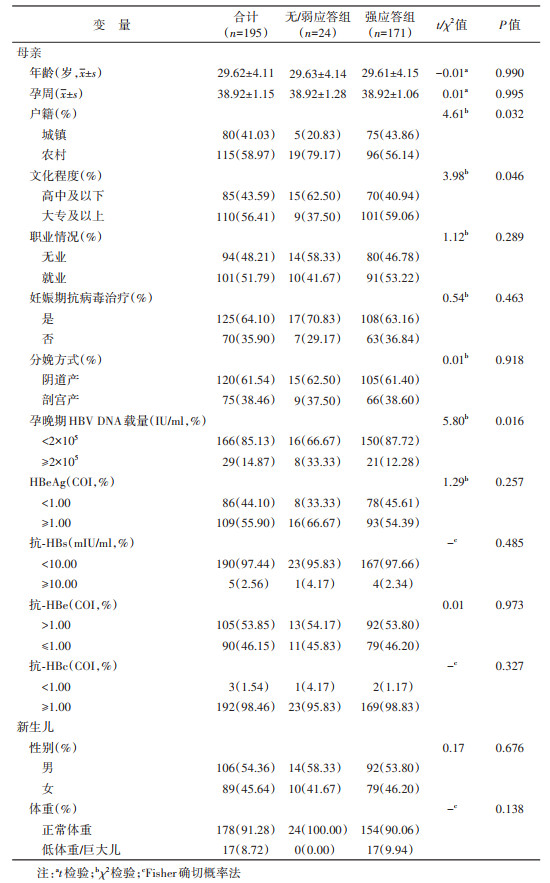
HBsAg阳性母亲的婴儿乙型肝炎(乙肝)疫苗无/弱应答(抗-HBs < 100 mIU/ml)率高(11.98%~35.16%)[1-2],HBV易感性高,是我国HBV慢性感染者积累的主要原因,探讨该人群乙肝疫苗无/弱应答影响因素是实现乙肝精准防控并降低HBV新发感染的重中之重。既往研究主要聚焦在母亲乙肝感染状况(如HBV DNA载量等)对婴儿乙肝疫苗无/弱应答的影响[3-6],而乙肝疫苗免疫应答是天然免疫和特异性免疫共同作用的结果,胎儿自身免疫状况如何和其是否影响乙肝疫苗无/弱应答尚未阐明。天然免疫的激活是乙肝疫苗免疫应答的“首要环节”,亦是机体防御HBV的第一道防线[7]。研究显示,干扰素基因刺激因子(STING)天然免疫信号通路既在疫苗应答中发挥至关重要作用[8-11],同时可识别HBV DNA并与其发生相互抑制作用[12-13]。HBsAg阳性母亲的胎儿从孕育到出生处在母体HBV高危生物环境下,宫内可接触到来自母体的HBV DNA[14-16],新生儿STING天然免疫信号通路长期与HBV相互作用是否受到不同程度抑制继而导致婴儿期乙肝疫苗无/弱应答未见相关报道。
本研究在HBV感染母婴队列研究的基础上,通过巢式病例对照研究方法,探讨HBsAg阳性母亲新生儿STING天然免疫信号通路对婴儿乙肝疫苗无/弱应答的影响,为降低该人群乙肝疫苗无/弱应答率,建立精准预防模式,继而降低HBV新发感染率提供新思路,为实现WHO提出的2030年消除病毒性肝炎目标提供依据。
对象与方法1. 研究对象:将2019年11月到2022年6月在太原市第三人民医院分娩的HBsAg阳性母亲及其新生儿/婴儿作为研究对象,建立HBV感染母婴队列。纳入标准:①母亲HBsAg阳性;②新生儿为单胎活产且无严重出生缺陷。排除标准:母亲合并感染HCV、人类免疫缺陷病毒(如HIV)或梅毒等。本研究获得山西医科大学伦理委员会审查(批准文号:2018LL323),研究对象均签署知情同意书,自愿参加。
2. 问卷调查和生物标本采集:由培训合格的调查员通过面对面问卷调查和电子病历查阅的方式收集母亲及其新生儿的流行病学资料和临床资料。内容包括:母亲年龄、文化程度、乙肝感染史、孕产史、分娩方式、孕晚期乙肝五项和HBV DNA等;新生儿出生身长和体重。采集新生儿脐静脉血3 ml用于检测STING天然免疫信号通路关键分子蛋白水平和免疫细胞比例。新生儿按照《慢性乙型肝炎防治指南(2022年版)》在出生12 h内注射100 IU乙肝高效价免疫球蛋白并接种重组乙肝疫苗[17],按0-1-6月10 μg方案接种,对全程接种后1~2个月(7~8月龄)的婴儿随访,采集其股静脉血3 ml用于检测抗-HBs。
3. 检测方法:采用流式细胞术检测新生儿脐血中STING天然免疫信号通路关键分子蛋白(STING、pIRF3)水平以及疫苗应答相关免疫细胞(DC、T、B和浆细胞)比例,通过CytExpert 2.3软件进行流式细胞术结果整理。采用化学发光微粒子免疫分析法检测随访婴儿的血清抗-HBs。
4. 相关定义:将HBsAg≥0.05 COI、抗-HBs≥10 mIU/ml、HBeAg≥1.00 COI、抗-HBe≤1.00 COI、抗-HBc≥1.00 COI判定为阳性。将乙肝疫苗全程接种后血清抗-HBs < 100 mIU/ml定义为乙肝疫苗无/弱应答,抗-HBs≥100 mIU/ml定义为乙肝疫苗强应答[5]。STING、pIRF3蛋白和疫苗应答相关免疫细胞的表达高低均以中位数分组。母亲HBV DNA载量高低以孕妇妊娠期HBV抗病毒治疗标准(2×105 IU/ml)进行分组。
5. 统计学分析:使用EpiData 3.1软件进行数据双录入,使用SAS 9.4和R 4.1.3软件进行数据清理和统计。满足正态分布的定量资料采用x±s描述;定性资料以率或构成比(%)描述。单因素分析采用t检验、χ2检验或Fisher确切概率法;多因素分析采用非条件logistic回归逐步法分析(入选标准α=0.05,剔除标准α=0.10),在多因素分析基础上进一步构建列线图将该模型可视化。绘制受试者工作曲线(ROC)和校准曲线评估该列线图预测HBsAg阳性母亲婴儿乙肝疫苗无/弱应答的效能。采用R 4.1.3软件中的bnlearn软件包进行HBsAg阳性母亲婴儿乙肝疫苗无/弱应答影响因素及因素间关系的分析,通过Netica 5.18软件绘制贝叶斯网络及条件概率分布表。双侧检验,检验水准α=0.05。
结果1. 一般情况:共调查并随访195对母婴,婴儿乙肝疫苗无/弱应答率和强应答率分别为12.31%(24/195)和87.69%(171/195)。两组母亲分娩年龄分别为(29.63±4.14)岁和(29.61±4.15)岁,孕周为(38.92±1.28)周和(38.92±1.06)周,母亲妊娠期HBV抗病毒药物治疗率分别为70.83%(17/24)和63.16%(108/171),阴道产的HBsAg阳性母亲居多,分别占62.50%(15/24)和61.40%(105/171),孕晚期HBV DNA < 2×105 IU/ml的母亲占66.67%(16/24)和87.72%(150/171)。乙肝疫苗无/弱应答组和强应答组新生儿男女性别比分别为1.40∶1和1.16∶1,分别有100.00%(24/24)和90.06%(154/171)的新生儿出生体重正常。见表 1。
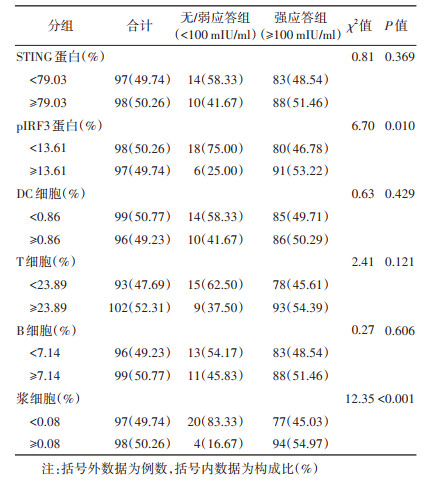
2. 新生儿STING天然免疫信号通路及相关免疫细胞分析:HBsAg阳性母亲婴儿乙肝疫苗强应答组中新生儿的STING天然免疫信号通路关键分子以及疫苗应答相关免疫细胞表达水平均高于无/弱应答组。其中强应答组pIRF3蛋白和浆细胞高水平表达占比明显高于无/弱应答组(53.22% vs. 25.00%,54.97% vs. 16.67%,均P < 0.05)。见表 2。
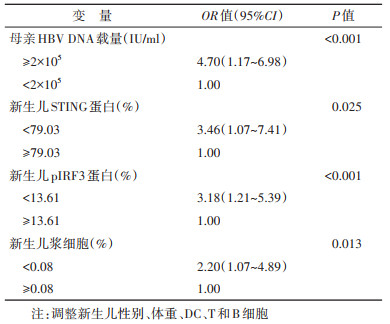
3. 多因素logistic回归分析:将HBsAg阳性母亲婴儿乙肝疫苗全程接种后免疫应答情况作为因变量,母亲HBV DNA、新生儿性别、体重、STING、pIRF3蛋白、DC、T、B和浆细胞纳入非条件logistic回归模型,结果显示,母亲HBV DNA高载量(≥2×105 IU/ml)的婴儿发生乙肝疫苗无/弱应答风险是HBV DNA低载量(< 2×105 IU/ml)的4.70倍(OR=4.70,95%CI:1.17~6.98);与STING蛋白高表达(≥79.03%)的新生儿相比,STING蛋白低表达(< 79.03%)的新生儿在婴儿期更容易发生乙肝疫苗无/弱应答(OR=3.46,95%CI:1.07~7.41);新生儿pIRF3蛋白低表达(< 13.61%)和浆细胞百分比低(< 0.08%)亦为婴儿乙肝疫苗无/弱应答的危险因素(OR=3.18,95%CI:1.21~5.39;OR=2.20,95%CI:1.07~4.89)。见表 3。
4. 列线图:在多因素logistic回归分析的基础上,构建HBsAg阳性母亲婴儿乙肝疫苗无/弱应答预测的列线图,校准曲线结果显示,预测发生率与实际发生率具有较良好的一致性,预测模型具有良好识别力和预测能力。ROC分析结果显示,该列线图预测HBsAg阳性母亲婴儿乙肝疫苗无/弱应答的曲线下面积为0.81(95%CI:0.63~0.83,P < 0.001),该模型具有较好的预测能力。见图 1。

|
| 刺激因子(STING)天然免疫信号通路对婴儿乙型肝炎疫苗无/弱应答影响 图 1 HBsAg阳性母亲新生儿干扰素基因 |
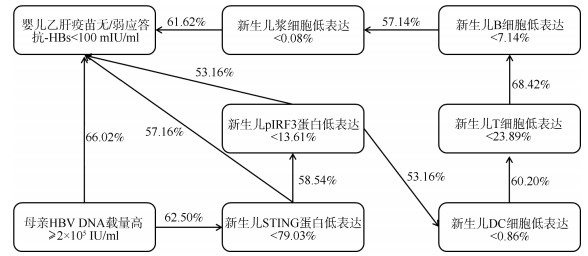
5. 贝叶斯网络模型:进一步构建含8个节点和10条有向边的乙肝疫苗应答与其相关因素的贝叶斯网络模型。结果显示,母亲HBV DNA、新生儿STING、pIRF3蛋白和浆细胞占比与HBsAg阳性母亲婴儿乙肝疫苗无/弱应答直接相关,而新生儿DC、T和B细胞占比则间接与HBsAg阳性母亲婴儿乙肝疫苗无/弱应答相关。条件概率分布结果显示,母亲HBV DNA高载量时,新生儿STING蛋白低表达的条件概率较高(62.50%),其pIRF3蛋白低表达的条件概率较高(58.54%),同样,其DC、T、B和浆细胞低表达的条件概率均较高(53.16%、60.20%、68.42%和57.14%);当母亲HBV DNA高载量、新生儿STING蛋白低表达、pIRF3蛋白低表达、浆细胞低表达时,乙肝疫苗无/弱应答的条件概率均较高(66.02%、57.16%、53.16%、61.62%)。见图 2。
|
| 注:有向边表示父节点导致子节点(箭头指向的节点)的发生;有向边的百分比表示父节点存在的条件下,子节点发生的条件概率乙型肝炎(乙肝)疫苗无/弱应答影响贝叶斯网络模型 图 2 HBsAg阳性母亲新生儿干扰素基因刺激因子(STING)天然免疫信号通路对婴儿 |
HBsAg阳性母亲婴儿乙肝疫苗无/弱应答率高,且影响因素复杂,是我国乙肝防控的瓶颈,揭示该人群乙肝疫苗无/弱应答影响因素是实现乙肝精准防控和全面保护的重中之重,对实现WHO提出的2030年消除病毒性肝炎目标具有重大意义。
本研究共随访了195对HBsAg阳性母亲及其婴儿,其中婴儿有24例发生了无/弱应答,无/弱应答率为12.31%。王雪飞等[2]对2011- 2012年收集的91对HBsAg阳性母亲及其婴儿进行调查,发现婴儿乙肝疫苗无/弱应答率为35.16%;2017年Lu等[1]报道了广西壮族自治区和江苏省共884对HBsAg阳性/HBeAg阴性母亲的婴儿乙肝疫苗无/弱应答率为11.98%。可见HBsAg阳性母亲婴儿乙肝疫苗无/弱应答率有下降趋势,但仍高于一般婴儿(1%~8%),亟待进行该人群乙肝疫苗无/弱应答影响因素研究。本研究结果提示,母亲HBV DNA、新生儿STING天然免疫信号通路和浆细胞水平是HBsAg阳性母亲婴儿乙肝疫苗无/弱应答的影响因素。
国内外研究提示,母亲HBV DNA高载量与婴儿乙肝疫苗无/弱应答密切相关[3-6, 18]。王斌等[6]研究发现HBsAg阳性母亲HBV DNA≥1×107拷贝数/ml,其婴儿更容易发生乙肝疫苗无应答(OR=2.59,95%CI:1.12~5.10);李本科等[4]研究发现HBV DNA高载量的母亲其婴儿发生乙肝疫苗免疫无应答的风险是HBV DNA低载量母亲的2.65(95%CI:1.11~6.35)倍。与国内外研究一致,本研究HBV DNA≥2×105 IU/ml的母亲其婴儿发生无/弱应答的风险是母亲HBV DNA < 2×105 IU/ml婴儿的4.70(95%CI:1.17~6.98)倍。其原因可能是妊娠期母-胎之间存在细胞转运,母亲HBV DNA可通过胎盘或外周血单核细胞进入胎儿体内[14-16],使胎儿免疫受到损伤,进而影响其乙肝疫苗免疫应答。
HBV侵入人体后,人体需首先通过DNA识别受体识别HBV DNA,而多数DNA识别受体均要通过STING蛋白将信号传递到下游TBK1-IRF3通路[19],启动天然免疫。研究显示,STING天然免疫信号通路与HBV具有相互抑制作用,一方面可以激活STING天然免疫信号通路以清除和抑制HBV的复制;另一方面,HBV也可阻抑STING天然免疫信号通路的活化[12-13]。更值得关注的是,近年来,Science等期刊报道了STING天然免疫信号通路活化可激活特异性免疫应答,诱导出广谱、强效的体液和细胞免疫应答,成为疫苗领域研究的热点[8-11]。Ito等[11]将STING通路配体的环鸟苷酸-腺苷酸(cGAMP)作为HBV疫苗佐剂,将HBsAg和cGAMP联合接种显著增强了野生型小鼠和HBV转基因小鼠的体液和细胞免疫反应,表明cGAMP作为乙肝疫苗佐剂具有良好的功效。提示STING天然免疫信号通路既受HBV影响,又在乙肝疫苗应答中发挥重要作用。本研究结果显示,HBsAg阳性母亲新生儿STING天然免疫信号通路相关分子(STING、pIRF3蛋白)低表达是婴儿乙肝疫苗无/弱应答的危险因素(OR=3.46,95%CI:1.07~7.41;OR=3.18,95%CI:1.21~5.39),进一步通过贝叶斯网络模型分析结果显示,母亲HBV DNA高载量时,新生儿STING和pIRF3蛋白高表达的条件概率低于母亲HBV DNA低载量,提示母亲HBV DNA高载量可能会抑制新生儿STING天然免疫信号通路导致婴儿乙肝疫苗无/弱应答。
接种乙肝疫苗产生保护性抗体是天然免疫和特异性免疫共同作用的结果。天然免疫是疫苗免疫应答的“首要环节”,天然免疫激活后进一步促进DC细胞的活化,进而刺激T、B细胞所介导的特异性免疫应答[20]。天然免疫受到抑制亦会导致特异性免疫被阻抑。本研究贝叶斯网络模型结果显示,母亲HBV DNA高载量会抑制新生儿STING天然免疫信号通路,同样,DC、T、B和浆细胞低表达的条件概率均较高(53.16%、60.20%、68.42%和57.14%)。提示,母亲HBV DNA可能通过抑制新生儿STING天然免疫信号通路,进而抑制疫苗应答相关细胞(DC、T、B和浆细胞)影响婴儿乙肝疫苗应答。
本研究基于logistic回归分析进一步构建HBsAg阳性母亲婴儿乙肝疫苗无/弱应答的风险预测列线图,结果显示母亲HBV DNA载量高且新生儿STING、pIRF3蛋白和浆细胞同时低表达时婴儿发生乙肝疫苗无/弱应答的风险最高,提示母亲HBV DNA载量高、新生儿STING、pIRF3蛋白和浆细胞低表达同时存在会增加婴儿乙肝疫苗无/弱应答风险。
综上所述,母亲HBV DNA可能通过抑制其新生儿STING天然免疫信号通路关键分子及疫苗应答相关免疫细胞导致婴儿乙肝疫苗无/弱应答。提示HBsAg阳性孕妇妊娠期应进行规范化抗病毒治疗以降低HBV DNA载量,同时,需重点关注新生儿STING天然免疫信号通路和浆细胞表达水平。本研究亦可为该人群乙肝疫苗无/弱应答机制研究及疫苗佐剂的研发提供新思路。本研究为单中心研究,结果的外推存在一定的局限性,下一步会通过多中心研究进一步深入探索。
利益冲突 所有作者声明无利益冲突
作者贡献声明 姚添:方案制定、数据整理分析、论文撰写;扆琳珠、王科科、李雁笛:问卷调查、样本收集、数据核对;渠轶群、丰淑英:样本收集;王素萍、冯永亮:课题总体设计
| [1] |
Lu Y, Liang XF, Wang FZ, et al. Hepatitis B vaccine alone may be enough for preventing hepatitis B virus transmission in neonates of HBsAg (+)/HBeAg (-) mothers[J]. Vaccine, 2017, 35(1): 40-45. DOI:10.1016/j.vaccine.2016.11.061 |
| [2] |
王雪飞, 史晓红, 许喜喜, 等. 白介素-6和白介素-12在HBsAg阳性母亲婴儿乙肝疫苗免疫应答中的作用[J]. 中华流行病学杂志, 2017, 38(7): 950-953. DOI:10.3760/cma.j.issn.0254-6450.2017.07.020 Wang XF, Shi XH, Xu XX, et al. Effect of interleukin-6 and interleukin-12 on immune response to hepatitis B vaccination in infants of HBsAg-positive mothers[J]. Chin J Epidemiol, 2017, 38(7): 950-953. DOI:10.3760/cma.j.issn.0254-6450.2017.07.020 |
| [3] |
朱宝申, 李素文, 田红霞, 等. HBsAg阳性母亲血清HBV DNA含量对婴儿联合免疫接种效果的影响[J]. 中国妇幼保健, 2013, 28(24): 3903-3905. DOI:10.7620/zgfybj.j.issn.1001-4411.2013.28.08 Zhu BS, Li SW, Tian HX, et al. Influence of serum HBV DNA level in pregnant women with HBV infection on the effect of blocking mother-to-infant transmission by passive-active immunoprophylaxis[J]. Mater Child Health Care China, 2013, 28(24): 3903-3905. DOI:10.7620/zgfybj.j.issn.1001-4411.2013.28.08 |
| [4] |
李本科, 纪民, 赵旭. 母亲乙肝病毒感染状况对其子代疫苗接种效果影响的分析[J]. 公共卫生与预防医学, 2020, 31(2): 138-140. DOI:10.3969/j.issn.1006-2483.2020.02.034 Li BK, Ji M, Zhao X. Analysis of the impact of maternal hepatitis B virus infection on vaccination effect of the offspring[J]. J Public Health Prev Med, 2020, 31(2): 138-140. DOI:10.3969/j.issn.1006-2483.2020.02.034 |
| [5] |
陈雅琴, 杨锋, 林秋兰. HBsAg阳性母亲新生儿免疫无或弱应答影响因素[J]. 中国热带医学, 2019, 19(6): 578-580. DOI:10.13604/j.cnki.46-1064/r.2019.06.19 Chen YQ, Yang F, Lin QL. Influencing factors of immune deficiency and weak response in neonates with HBsAg positive mothers[J]. China Trop Med, 2019, 19(6): 578-580. DOI:10.13604/j.cnki.46-1064/r.2019.06.19 |
| [6] |
王斌, 许喜喜, 温海秀, 等. HBsAg阳性母亲所生婴儿乙型肝炎疫苗无/弱应答的影响因素研究[J]. 中华流行病学杂志, 2017, 38(7): 911-915. DOI:10.3760/cma.j.issn.0254-6450.2017.07.013 Wang B, Xu XX, Wen HX, et al. Influencing factors for non/low-response to hepatitis-B vaccine in infants of HBsAg positive mothers[J]. Chin J Epidemiol, 2017, 38(7): 911-915. DOI:10.3760/cma.j.issn.0254-6450.2017.07.013 |
| [7] |
Černý J, Stříž I. Adaptive innate immunity or innate adaptive immunity?[J]. Clin Sci (Lond), 2019, 133(14): 1549-1565. DOI:10.1042/CS20180548 |
| [8] |
Wang J, Li PY, Yu Y, et al. Pulmonary surfactant- biomimetic nanoparticles potentiate heterosubtypic influenza immunity[J]. Science, 2020, 367(6480): eaau 0810. DOI:10.1126/science.aau0810 |
| [9] |
Liu ZZ, Zhou J, Xu W, et al. A novel STING agonist-adjuvanted pan-sarbecovirus vaccine elicits potent and durable neutralizing antibody and T cell responses in mice, rabbits and NHPs[J]. Cell Res, 2022, 32(3): 269-287. DOI:10.1038/s41422-022-00612-2 |
| [10] |
van Herck S, Feng B, Tang L. Delivery of STING agonists for adjuvanting subunit vaccines[J]. Adv Drug Deliv Rev, 2021, 179: 114020. DOI:10.1016/j.addr.2021.114020 |
| [11] |
Ito H, Kanbe A, Hara A, et al. Induction of humoral and cellular immune response to HBV vaccine can be up-regulated by STING ligand[J]. Virology, 2019, 531: 233-239. DOI:10.1016/j.virol.2019.03.013 |
| [12] |
Li YQ, He MJ, Wang ZY, et al. STING signaling activation inhibits HBV replication and attenuates the severity of liver injury and HBV-induced fibrosis[J]. Cell Mol Immunol, 2022, 19(1): 92-107. DOI:10.1038/s41423-021-00801-w |
| [13] |
Zheng BQ, Yu YT, Pan ZY, et al. HBsAg dampened STING associated activation of NK cells in HBeAg-negative CHB patients[J]. Int J Mol Sci, 2021, 22(14): 7643. DOI:10.3390/ijms22147643 |
| [14] |
Lo YMD, Lo ESF, Watson N, et al. Two-way cell traffic between mother and fetus: biologic and clinical implications[J]. Blood, 1996, 88(11): 4390-4395. DOI:10.1182/blood.V88.11.4390.4390 |
| [15] |
魏俊妮, 王素萍, 双杰玉. 母胎细胞转运与乙型肝炎病毒宫内感染关系的研究[J]. 中华流行病学杂志, 2005, 26(4): 240-244. DOI:10.3760/j.issn:0254-6450.2005.04.004 Wei JN, Wang SP, Shuang JY. Study on the relationship between fetomaternal cellular traffic and hepatitis B virus intrauterine infection[J]. Chin J Epidemiol, 2005, 26(4): 240-244. DOI:10.3760/j.issn:0254-6450.2005.04.004 |
| [16] |
Xu DZ, Yan YP, Zou SM, et al. Role of placental tissues in the intrauterine transmission of hepatitis B virus[J]. Am J Obstet Gynecol, 2001, 185(4): 981-987. DOI:10.1067/mob.2001.117968 |
| [17] |
中华医学会肝病学分会, 中华医学会感染病学分会. 慢性乙型肝炎防治指南(2022年版)[J]. 中华临床感染病杂志, 2022, 15(6): 401-427. DOI:10.3760/cma.j.issn.1674-2397.2022.06.001 Chinese Society of Hepatology, Chinese Medical Association, Chinese Society of Infectious Diseases, Chinese Medical Association. Guidelines for the prevention and treatment of chronic hepatitis B (version 2022)[J]. Chin J Clin Infect Dis, 2022, 15(6): 401-427. DOI:10.3760/cma.j.issn.1674-2397.2022.06.001 |
| [18] |
Xu WM, Cui YT, Wang L, et al. Lamivudine in late pregnancy to prevent perinatal transmission of hepatitis B virus infection: a multicentre, randomized, double-blind, placebo-controlled study[J]. J Viral Hepat, 2009, 16(2): 94-103. DOI:10.1111/j.1365-2893.2008.01056.x |
| [19] |
Zhang ZL, Zhou HF, Ouyang XH, et al. Multifaceted functions of STING in human health and disease: from molecular mechanism to targeted strategy[J]. Signal Transduct Target Ther, 2022, 7(1): 394. DOI:10.1038/s41392-022-01252-z |
| [20] |
胡一飞. 基于STING激动剂的淋巴结靶向纳米疫苗抗慢性HBV感染的作用及机制研究[D]. 济南: 山东大学, 2022. Hu YF. STING agonist-based lymph node-targeted nanovaccine against CHB[D]. Ji'nan: Shandong University, 2022. |
 2023, Vol. 44
2023, Vol. 44