文章信息
- 李学松, 黄久仪, 郭吉平, 顾桢茂, 刘广西, 张懿, 蔡珍璋, 王艳.
- Li Xuesong, Huang Jiuyi, Guo Jiping, Gu Zhenmao, Liu Guangxi, Zhang Yi, Cai Zhenzhang, Wang Yan
- 队列人群出血性卒中和缺血性卒中危险因素的对比研究
- Comparison of risk factors for hemorrhagic stroke and ischemic stroke, a prospective long-term follow-up cohort study
- 中华流行病学杂志, 2023, 44(9): 1383-1389
- Chinese Journal of Epidemiology, 2023, 44(9): 1383-1389
- http://dx.doi.org/10.3760/cma.j.cn112338-20230210-00069
-
文章历史
收稿日期: 2023-02-10
卒中的死亡率居我国死亡原因的前列,也是造成中老年人残疾的主要原因[1]。深入研究卒中的危险因素,对于更有针对性地采取预防措施,降低卒中发病率有重要意义。出血性卒中与缺血性卒中的多数危险因素一致,如高血压病史、糖尿病、血脂异常、心血管病史、肥胖等[2],但2种亚型卒中的发病机制、病理基础及遗传因素并不完全一致[3],某些危险因素的暴露方式和暴露水平也存在明显的差异,如高血压病史对出血性卒中发病的相对风险更高[4],房颤患者缺血性卒中发病的相对风险更高[5],适量饮酒是缺血性卒中的保护因素[6]。目前有关出血性卒中和缺血性卒中危险因素的研究多为回顾性和横断面的对比,基于队列人群比较2种亚型卒中危险因素的研究少见。因此,本研究将前瞻性队列研究人群出血性卒中和缺血性卒中的危险因素进行分析和比较,为卒中危险因素研究及预防提供必要的证据。
对象与方法1. 研究对象:基于2003年在上海市奉贤区某农村社区建立卒中危险因素的前瞻性研究队列。纳入标准:①有当地常住户籍;②年龄≥40岁;③无卒中病史。排除标准:①有明确诊断肝肾疾病史;②恶性肿瘤晚期;③离开本地6个月以上的户籍人口(由村或居委会提供名单)。最终纳入有应答且最终完成调查、检测且资料完整者10 565例,应答率89.6%。所有研究对象签署知情同意书。
2. 研究方法:应用统一设计的表格面对面进行基线调查,包括:①年龄、性别、身高、体重、文化程度、婚姻状况等一般情况;②高血压、心脏病、糖尿病病史、既往卒中史、卒中家族史、吸烟、饮酒、体育锻炼等卒中的常见危险因素;③血压测量、心电图和脑血管血流动力学指标(CVHI)检测。基线调查于2003年4-6月和2004年12月至2005年1月进行,调查和检测项目完全一致,由经过统一培训的脑血管疾病预防专业研究人员完成。血压测量和心电图检测(定义左心室肥厚和房颤)方法及各危险因素的定义见文献[7]。
基线调查后连续监测队列人群的卒中发病情况,以首发卒中作为观察终点,监测方法:①由乡村医生及时上报新发卒中病例;②神经内科医生接报后一周内对新发病例进行复核,并填写卒中病例个案调查表;③每6个月委派神经内科医生对新发卒中病例的诊断进行集中审核;④年终根据乡镇医院死亡登记、急诊、住院登记及村民面询等方式核查卒中病例漏报情况。随访截止时间为2015年12月31日,卒中按照中华医学会第四届全国脑血管病学术会议修订的《各类脑血管疾病诊断要点》进行判断[8]。
CVHI检测采用上海麦登电子设备有限公司生产的脑血管血流动力学分析仪(CBA CV-300型),探头频率5 MHz。检测操作由经过统一培训的2名技师完成;检测部位为双侧颈总动脉甲状软骨上缘水平;检测指标包括左右两侧颈动脉平均血流量、最大流速、最小流速、平均流速、外周阻力、特性阻抗、脉搏波速、动态阻力、可扩张度、临界压水平及DBP与临界压的差值,共11对指标。脑血管功能积分计算方法:将100分的分值按照对卒中发病作用的权重分配给上述检测指标,根据个体检测指标的异常程度扣除不同比例的分值,100分减去扣除分值后的得分即受检者的脑血管功能积分。脑血管功能积分范围为0~100分,75分为最佳截断点,将 < 75分定义为卒中高危个体,分值越低脑血管功能损害越严重,卒中风险越高。2名技师临床检测积分值判定的符合率为97.62%,Kappa值为0.94[9]。
3. 统计学分析:使用SPSS 14.0软件进行统计学分析。将基线和随访资料建立Fox visual数据库,以双输入法输入数据,核对后备用。将出血性卒中和缺血性卒中分别进行危险因素的单因素和多因素分析。卒中危险因素单因素分析采用χ2检验,剂量反应关系分析采用趋势χ2检验。关联强度用RR值及其95%CI描述。多因素分析采用Cox比例风险回归模型,分别以出血性卒中和缺血性卒中发病为因变量,各危险因素和脑血管功能积分为自变量,随访时间(年)作为时间变量导入回归方程,选择Wald后退法和默认门槛值进行回归分析,关联强度用风险比(HR)及其95%CI描述。死亡及失访人群将具体日期作为随访终点。计入发病统计的卒中病例均为首发病例。双侧检验,检验水准α=0.05。
结果1. 基本情况:共纳入研究对象10 565例,其中男性4 444例(42.1%),年龄(55.8±10.9)岁,年龄范围为40~91岁;女性6 121例(57.9%),年龄(56.6±11.9)岁,年龄范围为40~96岁。截至2015年12月31日,随访(11.15±2.26)年。随访第1年无失访者,1年后累计失访512例,失访原因全部为搬迁,失访率为4.8%。随访期间死亡666例。随访期间发生首发卒中病例371例,其中出血性卒中103例(27.8%),缺血性卒中268例(72.2%)。累积卒中总发病率为3.51%,其中出血性卒中为0.98%,缺血性卒中为2.54%。年均卒中总发病率为319.2/10万,其中出血性卒中为88.6/10万,缺血性卒中为230.6/10万。在卒中患者中,356例(96.0%)有电子计算机断层扫描或磁共振成像诊断结果,15例(4.0%)为住院前死亡的卒中患者。在10 565例研究对象中,有心电图检测者7 489例(70.9%)。
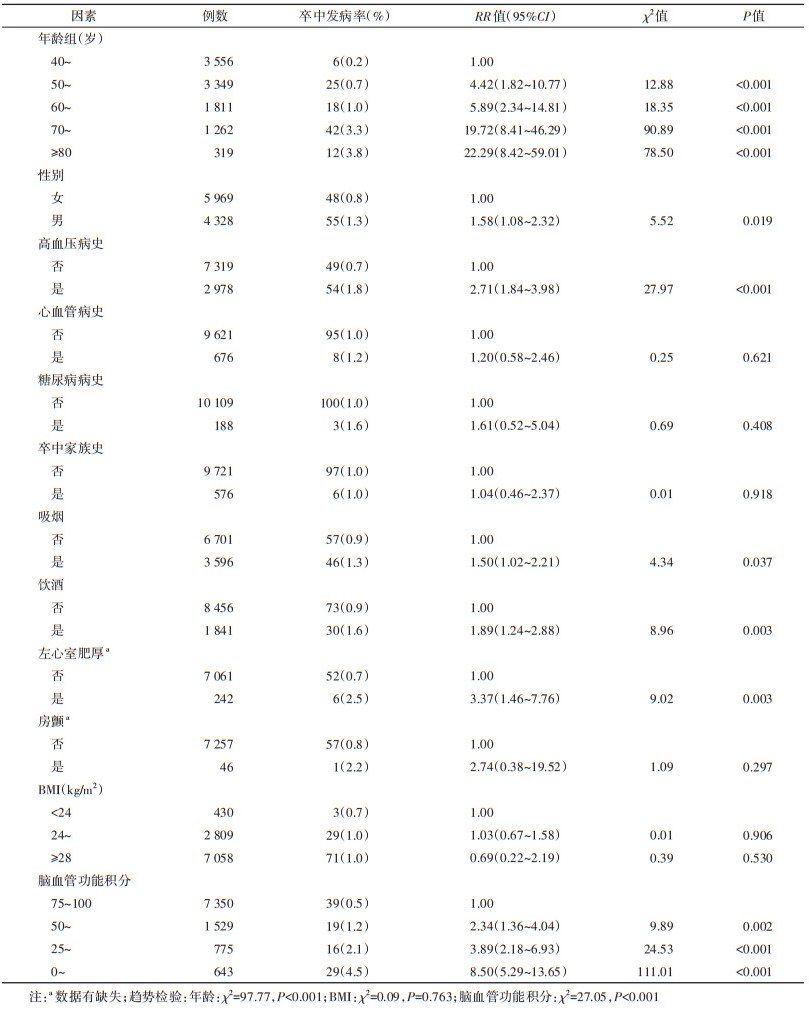
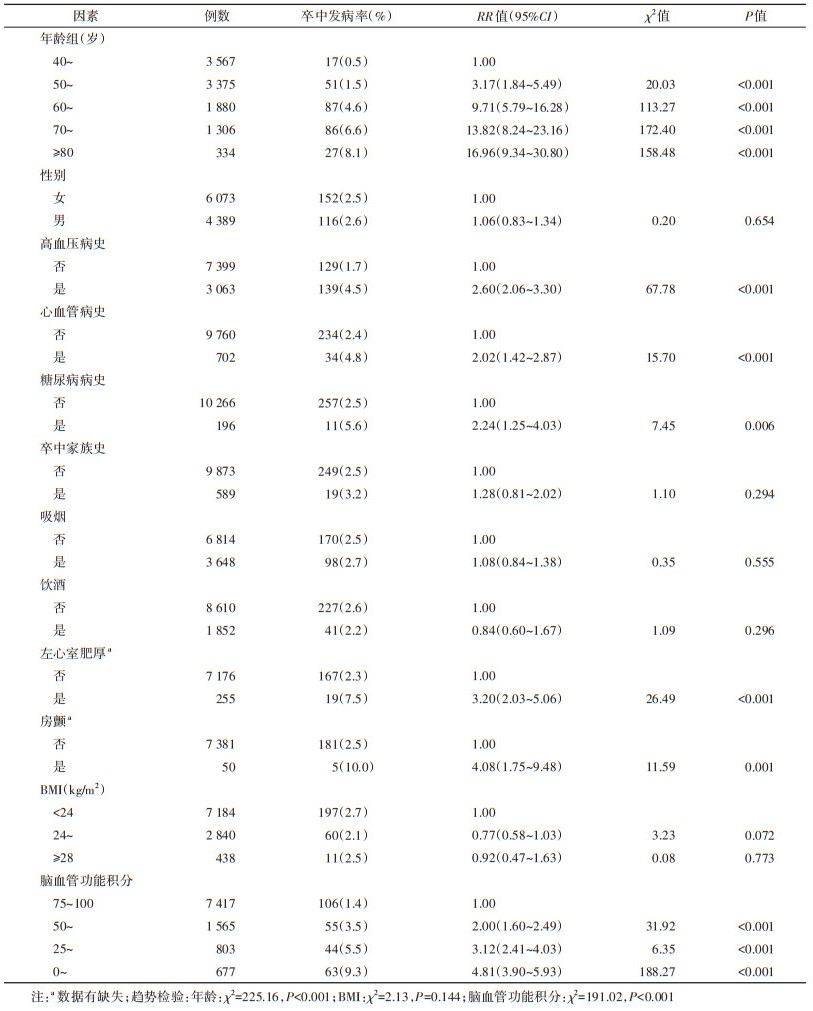
2. 出血性卒中与缺血性卒中危险因素单因素分析:分别在出血性卒中和缺血性卒中的单因素分析时剔除缺血性卒中和出血性卒中病例,结果显示,年龄升高、男性、高血压病史、吸烟、饮酒、左心室肥厚、脑血管功能积分降低与出血性卒中有统计学关联(P < 0.05);年龄升高、高血压病史、心血管病史、糖尿病病史、左心室肥厚、房颤和脑血管功能积分降低与缺血性卒中有统计学关联(P < 0.05)。其中年龄、脑血管功能积分与缺血性卒中和出血性卒中风险的剂量反应关系有统计学意义(P < 0.05)。见表 1,2。
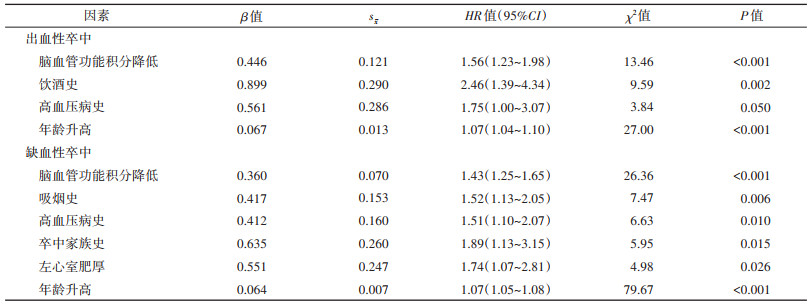
3. 出血性卒中与缺血性卒中危险因素多因素分析:Cox比例风险回归分析结果显示,被筛选进入出血性卒中回归方程的危险因素分别是脑血管功能积分降低(HR=1.56,95%CI:1.23~1.98)、饮酒史(HR=2.46,95%CI:1.39~4.34)、高血压病史(HR=1.75,95%CI:1.00~3.07)和年龄升高(HR=1.07,95%CI:1.04~1.10)。被筛选进入缺血性卒中回归方程的危险因素分别为脑血管功能积分降低(HR=1.43,95%CI:1.25~1.65)、吸烟史(HR=1.52,95%CI:1.13~2.05)、高血压病史(HR=1.51,95%CI:1.10~2.07)、卒中家族史(HR=1.89,95%CI:1.13~3.15)、左心室肥厚(HR=1.74,95%CI:1.07~2.81)和年龄升高(HR=1.07,95%CI:1.05~1.08)。见表 3。
本研究结果提示,脑血管功能积分降低、高血压病史、年龄升高是出血性卒中和缺血性卒中共同的独立危险因素。高血压病史是卒中重要的可控危险因素,本研究发现高血压病史是缺血性卒中和出血性卒中共同的独立危险因素,其中出血性卒中和缺血性卒中的HR值分别为1.75(95%CI:1.00~3.07)和1.51(95%CI:1.10~2.07),前者略高于后者,与文献报道结果基本一致[10]。年龄升高是卒中另一个重要的危险因素[11],但年龄对2种亚型卒中发病风险的影响鲜见文献报道。本研究结果显示,在出血性卒中和缺血性卒中危险因素的回归模型中,年龄升高均为其独立的危险因素,且作用强度一致。糖尿病在卒中的危险因素中居重要地位[12],但在本研究中均未被筛选进入2种亚型卒中的回归方程,可能与糖尿病和脑血管功能积分产生交互作用有关,尚有待进一步研究。
脑血管功能积分是基于CVHI检测的卒中风险综合评估指标,全国多中心扩展性试验课题组研究结果显示,脑血管功能积分降低(< 75分)能显著增加卒中发病风险,呈显著的剂量反应关系[8]。本课题组的另一项队列研究也显示,脑血管功能积分降低与未来10年卒中发病风险上升密切相关,可评估未来10年的卒中发病风险[13]。脑血管功能积分还是目前脑血管疾病一级预防指南和临床管理指南共同推荐的首发卒中风险评估工具[14-15]。本研究结果显示,脑血管功能积分降低为出血性卒中和缺血性卒中共同的独立危险因素,且积分值与发病风险间均存在显著的剂量反应关系,提示脑血管功能损害不仅增加缺血性卒中的风险,也同样增加出血性卒中的风险。
本研究还提示,饮酒史是出血性卒中的独立危险因素,吸烟史、卒中家族史和左心室肥厚是缺血性卒中的独立危险因素,2种亚型卒中危险因素存在明显差异。饮酒与心脑血管病的病因学联系与饮酒量及产生效应的时间有关,荟萃分析表明,适量饮酒(2~4杯)增加即时心血管事件风险,但在24 h后心肌梗死和出血性卒中的相对风险降低30%。每日饮酒约6杯可使1周内缺血性卒中的风险降低19%,但大量饮酒增加心血管事件的相对风险[16]。本研究饮酒致出血性卒中的HR值为2.46(95%CI:1.39~4.34),饮酒增加出血性卒中的风险是否与我国人群的饮酒习惯有关,尚有待进一步研究。已有研究显示,吸烟使卒中风险增加的OR值为1.61(95%CI:1.34~1.93),现在吸烟和既往吸烟的OR值分别为1.92(95%CI:1.49~2.48)和1.30(95%CI:0.93~1.81),但未见吸烟与出血性卒中和缺血性卒中关系的亚组分析结果[17]。吸烟与2种亚型卒中病因学联系的差异尚待更多研究证实。
左心室肥厚是Framingham卒中风险积分规则中的7个预测因子之一[18]。本研究也提示其为缺血性卒中的独立危险因素,HR值为1.74(95%CI:1.07~2.81),但未被筛选进入出血性卒中的回归模型。家族史不仅通过增加诸多危险因素的易感性增加卒中的风险,也是卒中的独立危险因素[19]。本研究卒中家族史是缺血性卒中的独立危险因素,HR值为1.89(95%CI:1.13~3.15),但未被筛选进入出血性卒中回归模型,提示卒中家族史对不同亚型卒中发病风险的影响可能存在差异。
本研究存在局限性。本研究存在部分人群心电图资料缺失的情况,可能对多因素分析的有效数据造成影响。但剔除房颤和左心室肥厚2项指标后进行Cox比例风险回归分析后,被筛选进入出血性卒中和缺血性卒中Cox比例风险回归分析的其他危险因素并无变化,提示部分人群心电图资料缺失对最终的研究结果并未造成大的影响。
本前瞻性队列研究发现出血性卒中和缺血性卒中的危险因素不尽相同。脑血管功能积分降低、高血压病史、年龄升高是出血性卒中和缺血性卒中共同的独立危险因素,饮酒史是出血性卒中的独立危险因素,吸烟史、卒中家族史和左心室肥厚是缺血性卒中的独立危险因素。
利益冲突 所有作者声明无利益冲突
作者贡献声明 李学松:论文撰写;黄久仪:统计分析;郭吉平:现场研究实施;顾桢茂:检测工作;刘广西、张懿、蔡珍璋:现场调查和随访;王艳:总体设计
| [1] |
Wang WZ, Jiang B, Sun H, et al. Prevalence, incidence, and mortality of stroke in China: results from a nationwide population-based survey of 480 687 adults[J]. Circulation, 2017, 135(8): 759-771. DOI:10.1161/CIRCULATIONAHA.116.025250 |
| [2] |
Meschia JF, Bushnell C, Boden-Albala B, et al. Guidelines for the primary prevention of stroke: a statement for healthcare professionals from the American Heart Association/American Stroke Association[J]. Stroke, 2014, 45(12): 3754-3832. DOI:10.1161/STR.0000000000000046 |
| [3] |
Chauhan G, Debette S. Genetic risk factors for ischemic and hemorrhagic stroke[J]. Curr Cardiol Rep, 2016, 18(12): 124. DOI:10.1007/s11886-016-0804-z |
| [4] |
Qi WW, Ma J, Guan TJ, et al. Risk factors for incident stroke and its subtypes in China: a prospective study[J]. J Am Heart Assoc, 2020, 9(21): e016352. DOI:10.1161/JAHA.120.01635 |
| [5] |
Migdady I, Russman A, Buletko AB. Atrial fibrillation and ischemic stroke: a clinical review[J]. Semin Neurol, 2021, 41(4): 348-364. DOI:10.1055/s-0041-1726332 |
| [6] |
Lu HY, Ni JX, Yang QX, et al. Alcohol consumption and stroke risk in men: a population-based cohort study in rural Tianjin, China[J]. Neuroepidemiology, 2021, 55(4): 266-274. DOI:10.1159/000515036 |
| [7] |
郭吉平, 黄久仪, 管阳太, 等. 脑血流动力学改变与脑卒中发病关系的队列研究[J]. 中华预防医学杂志, 2013, 47(4): 323-327. DOI:10.3760/cma.j.issn.0253-9624.2013.04.008 Guo JP, Huang JY, Guan YT, et al. A cohort study on the relationship between cerebrovascular hemodynamic changing and risk of stroke[J]. Chin J Prev Med, 2013, 47(4): 323-327. DOI:10.3760/cma.j.issn.0253-9624.2013.04.008 |
| [8] |
中华医学会神经科学会, 中华医学会神经外科学会. 各类脑血管疾病诊断要点[J]. 中华神经科杂志, 1996, 29(6): 379-380. Chinese Society of Neurology, Chinese Society of Neurosurgery. Key points for diagnosis of various cerebrovascular disease[J]. Chin J Neurol, 1996, 29(6): 379-380. |
| [9] |
脑卒中高危人群筛检手段全国多中心扩展性试验课题组. 脑卒中高危人群筛检手段的多中心前瞻性研究与评价[J]. 中华流行病学杂志, 2008, 29(2): 105-109. DOI:10.3321/j.issn:0254-6450.2008.02.001 HONG Zhen and The Collaborative Research Group of the National 10th Five Year Plan Project. Multiple center collaborative research on high risk population screening measure[J]. Chin J Epidemiol, 2008, 29(2): 105-109. DOI:10.3321/j.issn:0254-6450.2008.02.001 |
| [10] |
Chen CY, Lin PT, Wang YH, et al. Etiology and risk factors of intracranial hemorrhage and ischemic stroke in young adults[J]. J Chin Med Assoc, 2021, 84(10): 930-936. DOI:10.1097/JCMA.0000000000000598 |
| [11] |
Lucke-Wold BP, Turner RC, Lucke-Wold AN, et al. Age and the metabolic syndrome as risk factors for ischemic stroke: improving preclinical models of ischemic stroke[J]. Yale J Biol Med, 2012, 85(4): 523-539. |
| [12] |
Chen R, Ovbiagele B, Feng WW, et al. Diabetes and stroke: epidemiology, pathophysiology, pharmaceuticals and outcomes[J]. Am J Med Sci, 2016, 351(4): 380-386. DOI:10.1016/j.amjms.2016.01.011 |
| [13] |
黄久仪, 郭吉平, 曹奕丰, 等. 脑血管功能积分预测10年首发脑卒中风险方法的建立[J]. 中华神经科杂志, 2021, 54(5): 434-440. DOI:10.3760/cma.j.cn113694-20200722-00559 Huang JY, Guo JP, Cao YF, et al. Establishment and evaluation of a method for predicting 10‑year risk of first stroke with cerebrovascular function score[J]. Chin J Neurol, 2021, 54(5): 434-440. DOI:10.3760/cma.j.cn113694-20200722-00559 |
| [14] |
中华医学会神经病学分会, 中华医学会神经病学分会脑血管病学组. 中国脑血管病一级预防指南2019[J]. 中华神经科杂志, 2019, 52(9): 684-709. DOI:10.3760/cma.j.issn.1006-787.2019.09.002 Chinese Society of Neurology, Chinese Stroke Society. Guidelines for the primary prevention of cerebrovascular diseases in China 2019[J]. Chin J Neurol, 2019, 52(9): 684-709. DOI:10.3760/cma.j.issn.1006-787.2019.09.002 |
| [15] |
中国卒中学会. 中国脑血管病临床管理指南[M]. 北京: 人民卫生出版社, 2019. Chinese Stroke Association. Guidelines for clinical management of cerebrovascular diseases in China[M]. Beijing: People's Medical Publishing House, 2019. |
| [16] |
Mostofsky E, Chahal HS, Mukamal KJ, et al. Alcohol and immediate risk of cardiovascular events: a systematic review and dose-response meta-analysis[J]. Circulation, 2016, 133(10): 979-987. DOI:10.1161/CIRCULATIONAHA.115.019743 |
| [17] |
Pan BQ, Jin X, Jun L, et al. The relationship between smoking and stroke: a meta-analysis[J]. Medicine (Baltimore), 2019, 98(12): e14872. DOI:10.1097/MD.0000000000014872 |
| [18] |
Wolf PA, D'Agostino RB, Belanger AJ, et al. Probability of stroke: a risk profile from the Framingham Study[J]. Stroke, 1991, 22(3): 312-318. DOI:10.1161/01.STR.22.3.312 |
| [19] |
Mierzecki A, Bukowska H, Kłoda K, et al. Homocysteine and metabolic risk factors in individuals with family history of premature ischemic stroke[J]. Pol Arch Med Wewn, 2013, 123(6): 282-288. DOI:10.20452/pamw.1770 |
 2023, Vol. 44
2023, Vol. 44