文章信息
- 贾小芳, 苏畅, 杜文雯, 姜红如, 黄绯绯, 张兵, 王志宏, 王惠君.
- Jia Xiaofang, Su Chang, Du Wenwen, Jiang Hongru, Huang Feifei, Zhang Bing, Wang Zhihong, Wang Huijun
- 中国4省份55岁及以上中老年人认知功能与帕金森病前驱期患病概率的关联研究
- Association between cognitive function and probability of prodromal Parkinson's disease in middle aged and elderly people aged 55 years and above in 4 provinces in China
- 中华流行病学杂志, 2023, 44(9): 1376-1382
- Chinese Journal of Epidemiology, 2023, 44(9): 1376-1382
- http://dx.doi.org/10.3760/cma.j.cn112338-20230109-00017
-
文章历史
收稿日期: 2023-01-09
帕金森病(PD)是老年人常见的一种神经退行性疾病,重要特征为出现运动迟缓、静止性震颤和肌强直等运动症状,而出现非运动症状或轻微帕金森迹象但无典型的运动症状的阶段称为帕金森病前驱期(pPD)[1]。PD患者在诊断前已存在客观的认知功能减退[2]。pPD的认知功能引起了国内外学者的关注,如我国有研究关注pPD患者轻度认知功能障碍的特点及影响因素[3-4]。但有学者提出早期认知功能缺陷可能对PD发病过程中的其他非运动症状有较好的预测作用[2]。本研究拟利用神经系统疾病专病社区队列研究2020年调查数据,分析我国≥55岁中老年人总体认知功能及不同认知域功能与pPD患病概率的关联性,为确定pPD高危人群和有效干预提供一定的参考依据,也为进一步开展相关队列研究提供线索。
对象与方法1. 研究对象:基于神经系统疾病专病社区队列研究。该项目采用多阶段分层整群随机抽样的方法在河北省、浙江省、陕西省和湖南省(4省份)抽取调查对象,旨在≥55岁中老年人群建立阿尔茨海默病(AD)和PD社区队列。具体研究设计见文献[5-6]。项目通过中国CDC营养与健康所伦理委员会审查(批准文号:2017020),调查对象均签署知情同意书。本研究选择2020年调查中未患AD、PD且具有完整人口统计学、疾病史、认知功能评估和PD风险因素调查数据的调查对象作为研究对象,最终纳入分析4 634人。
2. 研究方法:
(1)认知功能评估:经培训合格的调查员采用蒙特利尔认知测验(MoCA)中文版量表[7],严格按照指导语、通过面对面方式在规定的10~15 min内完成调查对象的认知功能评估。MoCA量表有30个条目,所有条目得分之和即为总分,范围0~30分。当受教育年限≤12年且MoCA总分 < 30分时,总分加1分[8]。分数越高表示认知功能越好。为探讨不同认知功能水平与pPD患病概率的关联性,将MoCA总分四等分为 < 20、20~、25~和30分。基于MoCA量表的评估条目,进一步计算6种不同认知域指数评分,包括记忆、执行、视空间、语言、注意力和定向,具体计算方法见文献[9]。
(2)PD风险因素调查及pPD患病概率计算:利用专门设计的PD风险因素筛查问卷,由调查员通过面对面询问方式收集有关运动因素、非运动因素和其他危险因素的信息。按照国际帕金森病及运动障碍协会(MDS)制定的pPD诊断标准[10],本研究利用可获得的风险因素计算pPD患病概率:①危险标志物:包括男性、无吸烟史、无咖啡因摄入史(包括咖啡和茶叶)、经常杀虫剂暴露、职业溶剂暴露、2型糖尿病、低身体活动水平和低血尿酸水平;②前驱标志物:包括嗅觉丧失、便秘、过度日间嗜睡、症状性低血压、勃起功能障碍、小便功能障碍和抑郁。计算pPD患病概率的具体步骤和方法参考MDS[10]:①根据研究对象的年龄确定pPD先验概率;②计算每个危险标志物和前驱标志物的似然比(LR),缺失值赋值为1.0[10];③将相关标志物的LR值相乘分别计算出全部危险标志物和全部前驱标志物的LR值,将二者相乘得到总LR值;④计算验前比和验后比;⑤计算后验概率,即pPD患病概率,后验概率≥30%,则判定为可能或极可能为pPD。
(3)其他协变量及分组:调查员通过面对面询问采集人口统计学、疾病史等信息。采用老年抑郁量表筛查抑郁症状,量表得分 > 11分则判定为抑郁[6]。将具有医生诊断的高血压、心肌梗死和中风任意一种疾病者判定为有心血管疾病史,否则为无。将文化程度分为小学以下、小学和初中及以上。按照家庭人均月收入水平(元)分为低(< 1 000)、中(1 000~)和高(≥4 000)组。
3. 统计学分析:采用SAS 9.4软件进行数据整理与统计学分析。计量和计数资料分别用M(Q1,Q3)、构成比或比例(%)描述。由于计量资料不符合正态分布,不同认知功能评分组间差异采用Kruskal-Wallis检验,若组间存在显著性差异,进一步采用Student-Newman-Keuls法进行两两比较。采用χ2检验或Cochran-Armitage趋势检验比较不同认知功能评分组间不同特征的人群比例差异。由于本研究中可能或极可能pPD患者比例较低,认知功能与pPD关联性分析采用多因素线性回归模型,将pPD患病概率作为因变量,MoCA总分或四等分组作为自变量,模型1未校正混杂因素,模型2校正文化程度、家庭人均月收入水平和心血管疾病史。考虑到计算pPD患病概率时纳入了年龄和性别,故模型未校正。由于pPD患病概率为非正态分布,经对数转换后纳入模型。模型结果表示为回归系数β值(95%CI)的反对数(eβ),即认知功能评分每增加1个单位,pPD患病概率变化(eβ-1)×100%,或与Q1组相比,总体认知功能评分Q2、Q3或Q4组pPD患病概率变化(eβ-1)×100%。类似地,本研究进一步分析不同认知域功能评分与pPD患病概率的关联性。双侧检验,检验水准α=0.05。
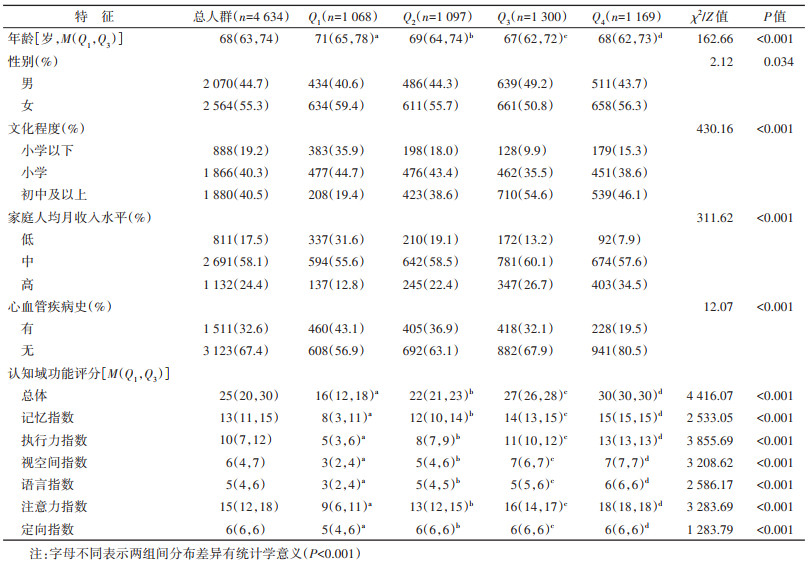
结果1. 一般特征:共纳入≥55岁的中老年人4 634人。其中,≥68岁者占50.0%,男性占44.7%,小学以下文化程度占19.2%,家庭人均月收入水平中等者占比最高(58.1%),有心血管疾病史者占32.6%。研究人群总体认知功能评分、记忆、执行力、视空间、语言、注意力和定向指数评分的M(Q1,Q3)分别为25(20,30)、13(11,15)、10(7,12)、6(4,7)、5(4,6)、15(12,18)和6(6,6)分。不同认知功能评分组间年龄、总体认知功能评分及不同认知域功能评分指数的分布差异有统计学意义(均P < 0.001),不同性别、文化程度、家庭人均月收入水平和心血管疾病史的人群比例差异有统计学意义(均P < 0.05)。见表 1。
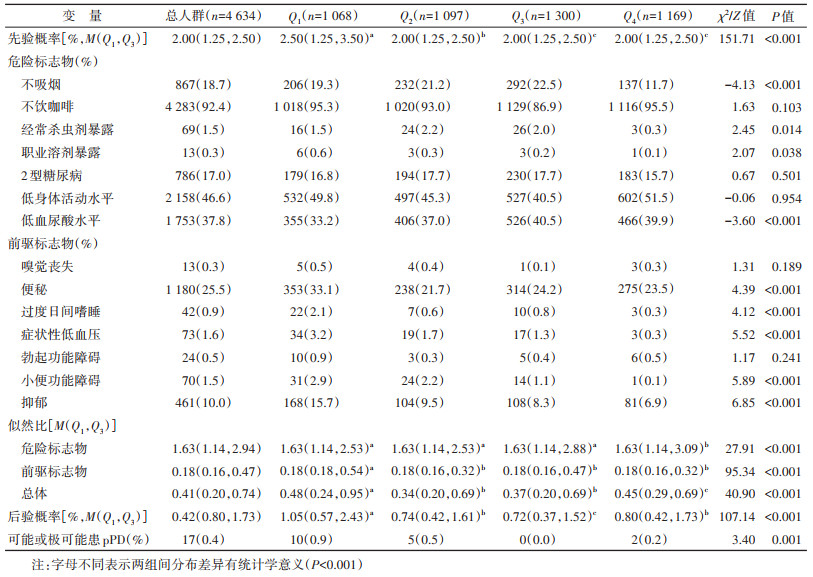
2. 不同认知功能评分组的pPD相关特征:研究人群先验概率M(Q1,Q3)为2.00%(1.25%,2.50%)。危险标志物中不饮咖啡(92.4%)、低身体活动水平(46.6%)和低血尿酸水平(37.8%)的人群比例较高,而职业溶剂暴露的人群比例最低(0.3%)。前驱标志物中便秘的人群比例最高(25.5%),其次是抑郁(10.0%)。危险标志物的LR、前驱标志物的LR和总LR的M(Q1,Q3)分别为1.63(1.14,2.94)、0.18(0.16,0.47)和0.41(0.20,0.74)。后验概率M(Q1,Q3)为0.42%(0.80%,1.73%),可能或极可能患pPD者共17人(0.4%)。不同认知功能评分组间先验概率、危险标志物的LR、前驱标志物的LR、总LR和后验概率的分布差异有统计学意义(均P < 0.001),不吸烟、经常杀虫剂和职业溶剂暴露、低血尿酸水平、便秘、过度日间嗜睡、症状性低血压、小便功能障碍、抑郁的人群比例差异有统计学意义(均P < 0.05),可能或极可能患pPD者比例差异有统计学意义且呈下降趋势(P < 0.05)。见表 2。
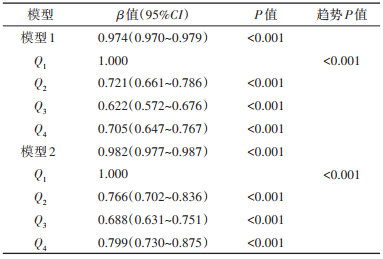
3. 总体认知功能与pPD患病概率的关联性:模型1结果显示总体认知功能评分及不同认知功能评分分组与pPD患病概率的关联有统计学意义(均P < 0.001)。模型2校正混杂因素后,总体认知功能评分每增加1个单位,pPD患病概率降低1.8%,β值(95%CI)为0.982(0.977~0.987);与Q1组相比,总体认知功能评分Q2、Q3和Q4组pPD患病概率分别降低23.4%、31.2%和20.1%,相应的β值(95%CI)分别为0.766(0.702~0.836)、0.688(0.631~0.751)和0.799(0.730~0.875),且趋势有统计学意义(P < 0.001)。见表 3。
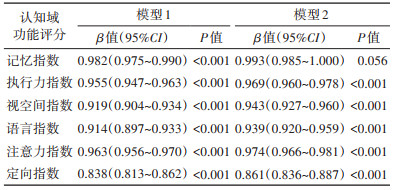
4. 不同认知域功能与pPD患病概率的关联性:模型1结果显示,6种不同认知域功能评分与pPD患病概率的关联有统计学意义(均P < 0.001)。模型2结果显示,除记忆指数评分外,较高的执行力、视空间、语言、注意力和定向指数评分与较低的pPD患病概率有关,且差异有统计学意义(均P < 0.001)。见表 4。
识别pPD及其特征是PD研究领域的重要方向之一。以非运动症状为主要特征的PD前驱阶段可持续20年,这一阶段对识别PD高危人群和早期干预具有重要意义[11]。本研究利用神经系统疾病专病社区队列研究2020年调查数据,按照MDS诊断标准,发现我国4省份≥55岁中老年人可能或极可能患pPD(后验概率≥30%)者比例为0.4%。类似地,我国一项社区横断面研究报道了≥50岁人群pPD患病率为2.4%[1],而希腊社区横断面研究发现≥65岁人群pPD患病率为2.3%或3.0%[12-13],这可能与种族差异、研究人群特征和纳入pPD后验概率评估的可利用标志物不同有关。神经心理失调是PD患者确诊前已有的一系列早期特征之一,包括记忆障碍、焦虑或抑郁、认知功能减退和淡漠,认知功能改变是pPD症状之一[14]。因此,中老年期认知功能对pPD和PD发生的潜在影响值得关注。本研究利用横断面数据探讨了认知功能与pPD患病概率的关联性,发现较高的总体认知功能及5种不同认知域功能均与较低的pPD患病概率有关,提示针对中老年人及早开展认知功能训练可能延缓或阻断PD发生。
PD患者中约20%~40%会出现轻度认知功能障碍,约3%~30%在发病≤5年或80%在发病20~25年后进展为痴呆[15]。基于队列研究进行的Meta分析报道了总体认知功能及执行功能减退均会显著增加PD发病风险,提示总体认知功能及执行功能下降是PD的前驱症状[16]。有关认知功能和PD的纵向研究较少,但已有的队列研究证据表明PD高危人群可能存在认知功能下降,尤其是执行功能,其次是记忆力[17]。pPD是PD病程发展的早期阶段,据报道约20%~30%早期患者发生认知功能减退[18]。我国已有研究关注pPD患者轻度认知功能障碍的特点及危险因素,发现pPD患者合并轻度认知功能障碍,记忆、执行功能、注意/工作记忆是常见受损认知域[3-4, 19],提示患者发生pPD前可能存在认知功能的变化。本研究采用社区横断面调查数据分析总体认知功能及不同认知域功能与pPD患病概率的关联性,校正混杂因素后,较高的总体认知功能评分与较低的pPD患病概率相关;与Q1组相比,总体认知功能评分Q2、Q3和Q4组pPD患病概率分别降低23.4%、31.2%和20.1%。类似地,希腊一项≥65岁老年人群横断面研究发现轻度认知功能障碍患者较正常认知功能者有较高的pPD患病概率[12]。本研究进一步关注了不同认知域功能指数评分与pPD患病概率的相关性,发现除记忆力之外,较高的执行力、视空间、语言、注意力和定向功能与较低的pPD患病概率相关。Speelberg等[16]报道了执行功能减退与PD发生相关,而记忆和注意力不相关。Bougea等[12]报道了记忆、执行力、视空间、语言和注意力评分与pPD患病概率存在显著负相关。本研究与上述既往研究结果存在一定的一致性,不同研究之间的差异可能与种族差异、不同的认知评估方法有关。既往研究采用了一系列具体的认知功能成套测验[12, 16],而本研究采用了常用的MoCA量表评估认知功能,可能低估了不同认知域功能。但目前的研究结果提示我国≥55岁中老年人总体认知功能及不同认知域功能减退可能增加pPD患病概率,有待进一步纵向研究的证实。
pPD主要表现为一系列非运动症状,在PD典型运动症状出现的许多年前即可发生。队列研究结果表明快速眼动睡眠行为障碍、抑郁或焦虑、便秘和嗅觉是前四位可预测PD的前驱标志物[20]。本研究人群便秘的人群比例最高(25.5%),其次是抑郁(10.0%)。荷兰一项55~64岁人群pPD症状患病率的横断面研究显示,便秘和抑郁的人群比例分别为9.7%和12.0%,分别位于该研究人群pPD症状的第三和第二位[11]。以上研究提示医务工作人员应针对中老年人群加强有关PD及pPD症状的宣教,出现pPD症状的中老年人可能具有较高的PD患病风险。我国中老年居民尤其应关注便秘和抑郁。
本研究存在局限性。首先,横断面研究不能确定总体认知功能及不同认知域功能与pPD患病概率的因果关系。此外,本研究采用调查中可获得的危险标志物和前驱标志物估计pPD后验概率,不包含MDS诊断标准涉及的有关遗传因素、经颅超声、快速眼动睡眠行为障碍、临床运动标志物、神经成像及全面的认知功能评估与诊断等相关指标,一定程度上可能会低估研究人群pPD患病概率及pPD患病率。因此,在与既往研究尤其是临床研究进行比较时需注意。
综上所述,我国4省份≥55岁中老年居民总体认知功能及执行力、视空间、语言、注意力和定向功能减退与pPD患病概率增加具有相关性,提示中老年人应重视pPD早期识别和干预,针对认知功能这一可调节危险因素开展早期认知功能干预可能有助于预防pPD及PD发生。
利益冲突 所有作者声明无利益冲突
作者贡献声明 贾小芳:研究设计、论文撰写;苏畅、杜文雯、姜红如、黄绯绯:数据收集、整理与统计分析;张兵、王志宏、王惠君:论文修改、经费支持
志谢 感谢参加神经系统疾病专病社区队列研究2020年调查的所有工作人员和调查对象
| [1] |
Pan CX, Li YQ, Ren JR, et al. Characterizing mild cognitive impairment in prodromal Parkinson's disease: a community-based study in China[J]. CNS Neurosci Ther, 2022, 28(2): 259-268. DOI:10.1111/cns.13766 |
| [2] |
Kempster P. Prodromal and advanced non-motor features of Parkinson's disease[J]. BMJ Neurol Open, 2021, 3(1): e000168. DOI:10.1136/bmjno-2021-000168 |
| [3] |
徐剑霞, 刘卫国, 华平, 等. 帕金森病前驱期轻度认知功能障碍的临床特点及相关影响因素分析[J]. 中华神经医学杂志, 2020, 19(10): 1001-1007. DOI:10.3760/cma.j.cn115354-20200515-00369 Xu JX, Liu WG, Hua P, et al. Clinical characteristics of mild cognitive impairment and its related risk factors in prodromal Parkinson's disease[J]. Chin J Neuromed, 2020, 19(10): 1001-1007. DOI:10.3760/cma.j.cn115354-20200515-00369 |
| [4] |
曹幸毅, 龚爱平, 李志宁. 帕金森病前驱期轻度认知功能障碍的危险因素分析[J]. 癫痫与神经电生理学杂志, 2021, 30(6): 333-337. Cao XY, Gong AP, Li ZN. Analysis of risk factors of mild cognitive dysfunction in the prodromal stage of Parkinson's disease[J]. J Epileptol Electroneurophysiol (China), 2021, 30(6): 333-337. |
| [5] |
Jia XF, Wang ZH, Huang FF, et al. A comparison of the Mini-Mental State Examination (MMSE) with the Montreal Cognitive Assessment (MoCA) for mild cognitive impairment screening in Chinese middle-aged and older population: a cross-sectional study[J]. BMC Psychiatry, 2021, 21(1): 485. DOI:10.1186/s12888-021-03495-6 |
| [6] |
贾小芳, 王志宏, 黄绯绯, 等. 中国4省份55岁及以上中老年人空腹血糖与轻度认知功能障碍的关联研究[J]. 中华流行病学杂志, 2022, 43(10): 1590-1595. DOI:10.3760/cma.j.cn112338-20211223-01012 Jia XF, Wang ZH, Huang FF, et al. Association between fasting plasma glucose and mild cognitive impairment in Chinese 55 and older population from four provinces[J]. Chin J Epidemiol, 2022, 43(10): 1590-1595. DOI:10.3760/cma.j.cn112338-20211223-01012 |
| [7] |
Lu JH, Li D, Li F, et al. Montreal cognitive assessment in detecting cognitive impairment in Chinese elderly individuals: a population-based study[J]. J Geriatr Psychiatry Neurol, 2011, 24(4): 184-190. DOI:10.1177/0891988711422528 |
| [8] |
Nasreddine ZS, Phillips NA, Bédirian V, et al. The montreal cognitive assessment, MoCA: a brief screening tool for mild cognitive impairment[J]. J Am Geriatr Soc, 2005, 53(4): 695-699. DOI:10.1111/j.1532-5415.2005.53221.x |
| [9] |
Julayanont P, Brousseau M, Chertkow H, et al. Montreal cognitive assessment memory index score (MoCA-MIS) as a predictor of conversion from mild cognitive impairment to Alzheimer's disease[J]. J Am Geriatr Soc, 2014, 62(4): 679-684. DOI:10.1111/jgs.12742 |
| [10] |
Heinzel S, Berg D, Gasser T, et al. Update of the MDS research criteria for prodromal Parkinson's disease[J]. Mov Disord, 2019, 34(10): 1464-1470. DOI:10.1002/mds.27802 |
| [11] |
Roos DS, Klein M, Deeg DJH, et al. Prevalence of prodromal symptoms of Parkinson's disease in the late middle-aged population[J]. J Parkinsons Dis, 2022, 12(3): 967-974. DOI:10.3233/JPD-213007 |
| [12] |
Bougea A, Maraki MI, Yannakoulia M, et al. Higher probability of prodromal Parkinson disease is related to lower cognitive performance[J]. Neurology, 2019, 92(19): e2261-2272. DOI:10.1212/WNL.0000000000007453 |
| [13] |
Maraki MI, Stefanis L, Yannakoulia M, et al. Motor function and the probability of prodromal Parkinson's disease in older adults[J]. Mov Disord, 2019, 34(9): 1345-1353. DOI:10.1002/mds.27792 |
| [14] |
Schrag A, Horsfall L, Walters K, et al. Prediagnostic presentations of Parkinson's disease in primary care: a case-control study[J]. Lancet Neurol, 2015, 14(1): 57-64. DOI:10.1016/S1474-4422(14)70287-X |
| [15] |
Bock MA, Tanner CM. The epidemiology of cognitive function in Parkinson's disease[J]. Prog Brain Res, 2022, 269(1): 3-37. DOI:10.1016/bs.pbr.2022.01.004 |
| [16] |
Speelberg DHB, Janssen DJM, Bloem BR, et al. Prodromal cognitive deficits and the risk of subsequent Parkinson's disease[J]. Brain Sci, 2022, 12(2): 199. DOI:10.3390/brainsci12020199 |
| [17] |
Fengler S, Liepelt-Scarfone I, Brockmann K, et al. Cognitive changes in prodromal Parkinson's disease: a review[J]. Mov Disord, 2017, 32(12): 1655-1666. DOI:10.1002/mds.27135 |
| [18] |
Weintraub D, Chahine LM, Hawkins KA, et al. Cognition and the course of prodromal Parkinson's disease[J]. Mov Disord, 2017, 32(11): 1640-1645. DOI:10.1002/mds.27189 |
| [19] |
潘晨曦, 刘卫国, 李蓝婷, 等. 帕金森病前驱期轻度认知损害特点及其相关因素分析[J]. 中国临床神经科学, 2021, 29(2): 154-160. Pan CX, Liu WG, Li LT, et al. Characteristics of mild cognitive impairment and its correlative factors in prodromal Parkinson's disease[J]. Chin J Clin Neurosci, 2021, 29(2): 154-160. |
| [20] |
Postuma RB, Berg D. Prodromal Parkinson's disease: the decade past, the decade to come[J]. Mov Disord, 2019, 34(5): 665-675. DOI:10.1002/mds.27670 |
 2023, Vol. 44
2023, Vol. 44