文章信息
- 刘春语, 程思, 庞元捷, 余灿清, 孙点剑一, 裴培, 陈君石, 陈铮鸣, 吕筠, 李立明, 代表中国慢性病前瞻性研究项目协作组.
- Liu Chunyu, Cheng Si, Pang Yuanjie, Yu Canqing, Sun Dianjianyi, Pei Pei, Chen Junshi, Chen Zhengming, Lyu Jun, Li Liming, for the China Kadoorie Biobank Collaborative Group
- 饮茶与恶性肿瘤发病风险关联的孟德尔随机化研究
- Tea consumption and cancer: a Mendelian randomization study
- 中华流行病学杂志, 2023, 44(7): 1027-1036
- Chinese Journal of Epidemiology, 2023, 44(7): 1027-1036
- http://dx.doi.org/10.3760/cma.j.cn112338-20230217-00086
-
文章历史
收稿日期: 2023-02-17
2. 北京大学公众健康与重大疫情防控战略研究中心, 北京 100191;
3. 国家食品安全风险评估中心, 北京 100022;
4. 英国牛津大学临床与流行病学研究中心纳菲尔德人群健康系, 牛津 OX3 7LF
2. Peking University Center for Public Health and Epidemic Preparedness & Response, Beijing 100191, China;
3. China National Center for Food Safety Risk Assessment, Beijing 100022, China;
4. Clinical Trial Service Unit and Epidemiological Studies Unit, Nuffield Department of Population Health, University of Oxford, Oxford OX3 7LF, United Kingdom
已有研究显示,我国国民饮茶率为38.6%,饮茶者数量达到4.28亿[1]。在中国,对“饮茶可以防癌”的认识广为流传,部分参考了一些实验室研究的证据或基于人群的病例对照研究。然而,基于队列研究得到的饮茶与恶性肿瘤的关联结果并不一致。一些研究表明,饮茶对恶性肿瘤的发病风险有保护作用[2-6]。少量队列研究表明饮茶可能增加乳腺癌[7-8]和胃癌[9]的发病风险。2020年发表的一项纳入11项实验性研究、46项队列研究和85项病例对照研究的系统综述和Meta分析结果显示,尚无充分证据证明饮绿茶可以预防恶性肿瘤[10]。另外一项研究对已发表的饮茶和恶性肿瘤的观察性研究进行了伞形综述和Meta分析,结果显示,饮茶与口腔癌发病风险降低的关联证据明确,而现有证据只能提示饮茶与胆道癌、乳腺癌、子宫内膜癌、肝癌风险降低可能存在关联[11]。
近年来,以遗传变异作为工具变量的孟德尔随机化(MR)分析被广泛用于检验疾病病因与辅助因果推断。MR分析假设遗传变异在人群中随机分配,可类比随机对照试验,一定程度地避免观察性流行病学研究中常见的反向因果和混杂偏倚,更真实地呈现暴露因素与研究结局的关系[12]。来自中国的双生子研究结果显示,饮茶行为一定程度受到遗传因素的影响,遗传度为13.45%[13]。这使得我们有可能利用相关的遗传变异构建工具变量,开展饮茶与恶性肿瘤的MR研究,辅助确定两者之间的真实关联。
本课题组前期基于中国慢性病前瞻性研究(CKB),充分考虑到中国男性饮茶人群中吸烟率和饮酒率较不饮茶人群更高,为了更为有效地控制吸烟和饮酒可能导致的混杂作用,Li等[9]在不吸烟且不过量饮酒者中评价饮茶与恶性肿瘤发病风险之间的关联,发现每日饮茶与全部恶性肿瘤、结肠直肠癌、肝和肝内胆管癌、气管/支气管和肺癌、女性乳腺癌和宫颈癌的发病风险无显著的统计学关联;无论是否有饮茶习惯,恶性肿瘤发生风险均随吸烟量或饮酒量增加而增加。本研究拟基于CKB项目中有基因数据的约10万名研究对象进一步开展饮茶与恶性肿瘤发病风险关联的MR研究。
对象与方法1. 研究对象: CKB项目于2004-2008年在全国5个城市和5个农村地区募集研究对象,共有512 725名年龄在30~79岁的研究对象签署知情同意书并完成了基线调查,包括问卷调查、体格测量和血标本采集,项目具体信息见文献[14-15]。
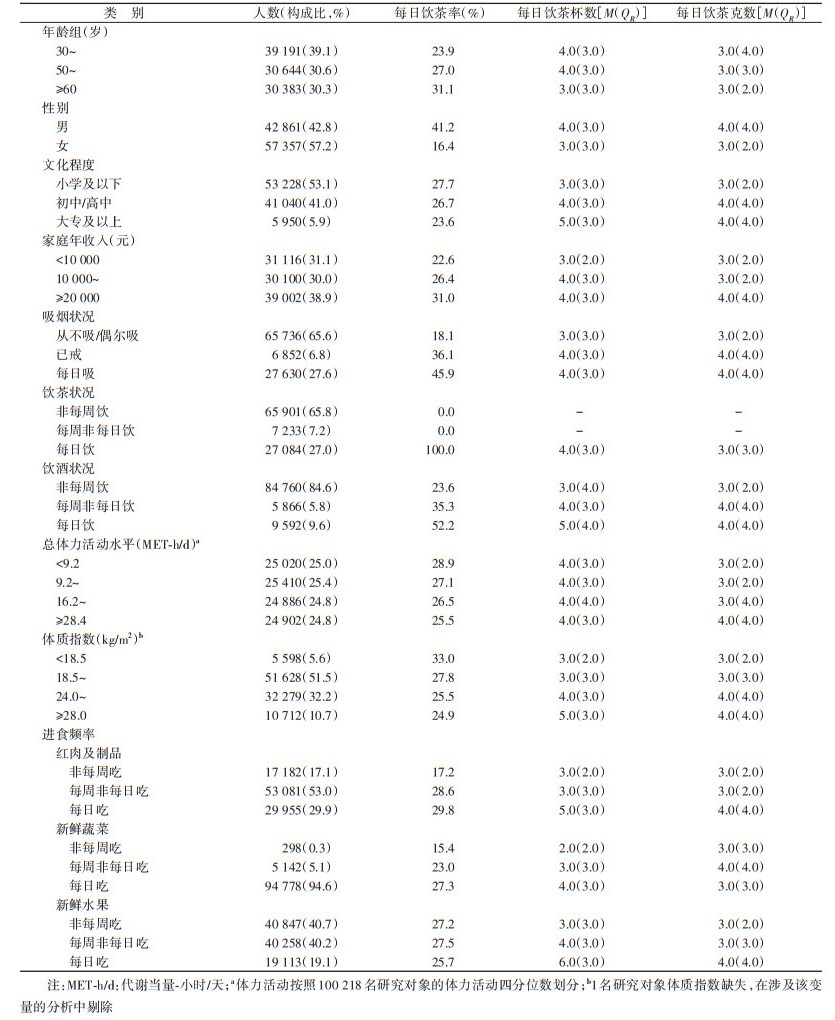
2. 饮茶及其他协变量的评价: 基线调查时由统一培训的调查员根据问卷询问研究对象的饮茶习惯。过去一年里的饮茶频率:①从不或几乎从不饮茶;②特殊场合偶尔饮茶;③只在特定几个月饮茶;④不分季节每个月都饮茶,但频率不到每周一次;⑤每周饮茶。对于选择①~④的个体,询问以前是否有过每周都饮茶且至少持续一年的经历。对于选择⑤的个体,询问过去一年里的饮茶频率:1~、3~、6~7 d/周。进一步询问饮茶日每日喝茶杯数(按标准杯300 ml换算)、添换新茶叶次数(当天不更换或不添加则为0)、每次投放的茶叶量(g,调查时展示2、4和6 g茶叶量,估计时精准到0.5 g)。根据上述问题,构建“过去一年里是否每日饮茶”变量:是(自报6~7 d/周饮茶)、否(其他)。“每日饮茶杯数”变量为对应问题的自报。构建“每日饮茶克数”变量:(饮茶日每日添换新茶叶次数+1)×每次投放的茶叶量。
研究中涉及的其他基本社会人口学特征、生活方式特征等也通过问卷询问获得。包括年龄、性别、文化程度(小学及以下、初中/高中、大专及以上)、家庭年收入(< 10 000、10 000~、≥20 000元)、吸烟状况(从不吸/偶尔吸、已戒、每日吸)、每日吸烟支数、饮酒状况(非每周饮、每周非每日饮、每日饮)、每周纯酒精摄入量(g)、总体力活动水平、每周红肉及制品、新鲜蔬菜、新鲜水果进食频率(非每周吃、每周非每日吃、每日吃)。生活方式特征变量的评价和转换方法详见文献[16-21]。体重、身高等信息由调查员现场测量获得,进一步计算BMI。
3. 结局评价: 对所有研究对象的结局随访自基线调查完成后开始。本研究使用的随访数据是研究对象出现观察结局、失访、死亡或截至2018年12月31日,失访人数不足1%。死亡原因和死亡时间通过链接死因登记系统确定;主要慢性病的发病通过常规疾病监测系统获取;住院事件通过全民医疗保险数据库获取;长期随访还辅以主动的定向监测。疾病编码采用《国际疾病分类》第十版。本研究的主要终点为随访期间新发生的恶性肿瘤:全部恶性肿瘤(C00~C97)、胃癌(C16)、肝和肝内胆管癌(C22)、结肠直肠癌(C18~C20)、气管/支气管和肺癌(C33~C34)以及女性乳腺癌(C50)。
4. 基因分型数据: CKB项目使用针对中国汉族人群定制设计的芯片(Affymetrix Axiom® CKB array)进行基因分型。经过位点质控(剔除不符合哈-温遗传平衡的位点、基因频率与千人基因计划东亚人群相差 > 0.2的位点)和样本质控[剔除单核苷酸多态性(SNP)主成分异常值个体]后,参照千人基因计划东亚人群数据进行基因填补。最后可用研究对象100 639名,可用SNP位点2 400万个[22]。
5. 工具变量的构建: 饮茶工具变量从基于以下3个数据开展的饮茶全基因组关联研究(GWAS)获得:日本生物银行(BBJ)[23]、日本雅虎数据库[24]、英国生物银行(UKB)[25]。首先提取全基因组显著相关的位点(P=5×10-8),如果提取有效位点较少,进一步提取与饮茶提示性相关的位点(P=1×10-5)。3个数据库提取的位点数分别为525、12、3 119个。
考虑饮茶行为的稳定性,从CKB具有基因分型数据的100 639名研究对象中,排除基线自报过去有超过一年每周饮茶习惯但现在不饮者(n=2 247)或有超过一年每周饮酒习惯但现在不饮者(n=4 636),排除基线自报冠心病(n=3 084)、脑卒中(n=1 400)、恶性肿瘤(n=421)3种疾病任意一种者,剩余90 145名用于工具变量构建。
按照以下策略筛选位点:①去除重复的位点,保留二等位多态性的SNP位点;②对位点进行二次质控,排除填补质量差及最小等位基因频率小的位点;③在CKB的90 145名研究对象中检验位点与3个饮茶变量(是否每日饮茶、每日饮茶杯数、每日饮茶克数)的关联,分别保留与3个饮茶变量存在关联的位点(P < 0.01);④仅保留独立位点(r2 < 0.10)。最终筛选出与上述3个变量相关的独立SNP位点数依次为54、42、28个,分别使用这些位点构建遗传风险评分(GRS)作为3个饮茶变量的工具变量。因位点来自不同人群研究,按照非加权的方式构建GRS[26]: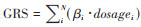
6. 统计学分析: 首先描述不同基线特征人群中的饮茶行为。MR分析使用二阶段最小二乘回归模型(2SLS)。第一阶段,在90 145名研究对象中建立GRS工具(自变量)与自报饮茶行为(因变量)的线性回归或logistic回归模型。模型中调整年龄、年龄2(年龄与饮茶的非线性关系)、性别、芯片类型、10个地区、12个遗传主成分。12个遗传主成分用于解决样本的群体分层问题,是在100 639名有基因型数据的CKB个体中利用协方差矩阵主成分分析法获得。第二阶段,从具有基因分型数据的100 639名研究对象中,剔除基线自报患有恶性肿瘤者(n=421),剩余100 218名研究对象纳入分析。人年计算从基线调查日期到死亡、失访或2018年12月31日为止。利用第一阶段模型得到的系数预测100 218名研究对象的饮茶行为。构建预测的饮茶行为(自变量)与随访新发结局(因变量)的Cox比例风险回归模型。模型中调整与第一阶段相同的协变量,报告风险比(HR)及其95%CI。
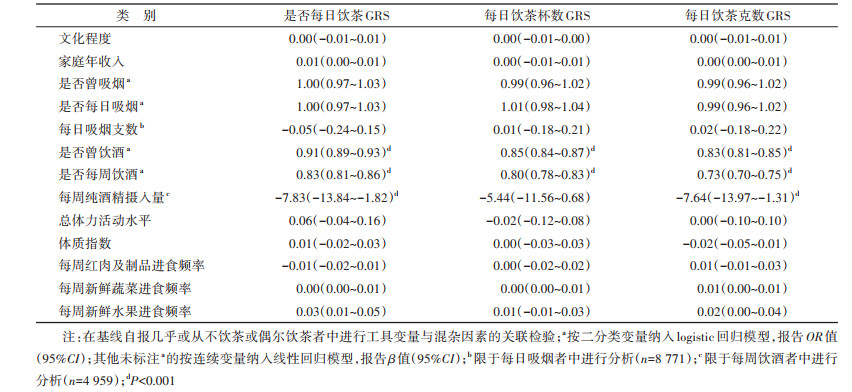
对MR研究的3个基本假设进行检验[12]:①GRS与自报饮茶行为强相关:绘制GRS频数直方图,以及GRS五分位数对应的调整年龄、性别、地区后的自报饮茶率或饮茶量及其95%CI。并使用2SLS第一阶段的回归模型进行检验。F统计量反映工具变量与饮茶行为之间的关联强度,根据假设,F > 10表明遗传工具变量有效[27]。同时报告R2,即工具变量所解释的饮茶行为的方差。②GRS与观察性研究中可能的混杂因素无关:在基线自报几乎或从不饮茶或偶尔饮茶者中(n=53 392),首先对GRS进行标准化处理,然后使用线性回归检验每个标准差变化的GRS与文化程度、家庭年收入、总体力活动水平、BMI、吸烟状况、饮酒状况、每周红肉及制品、新鲜蔬菜、新鲜水果进食频率的关联。③GRS对疾病结局不存在水平多效性作用:使用MR-Egger方法计算饮茶与恶性肿瘤MR分析的截距及P值。如果截距不偏离0,则提示不存在水平多效性。
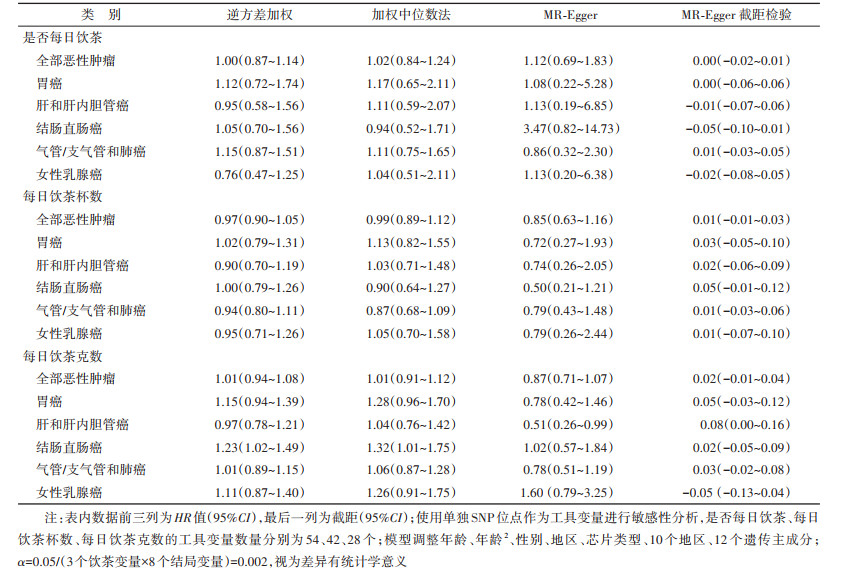
为检验结果的稳健性,进行敏感性分析。①由于GRS与饮酒行为存在关联,采用以下两种策略减少饮酒的影响。第一,采用多变量MR方法:将东亚人中与酒精代谢相关的遗传位点rs671和rs1229984并入筛选出的与3个饮茶变量相关的独立位点,重新保留独立位点。rs671因与饮茶位点存在连锁不平衡而删除,最终在原有饮茶相关位点基础上增加rs1229984,即独立位点数依次为55、43、29个。用这些位点对饮茶和饮酒行为分别构建GRS,然后分别预测饮茶和饮酒的行为,并将预测的饮茶和饮酒行为同时放入2SLS第二阶段的回归模型中,检验控制饮酒后饮茶与恶性肿瘤发病的关联。第二,在从不或几乎从不饮酒者(n=46 602)中进行分析。②利用筛选出的与3个饮茶行为相关的独立SNP位点作为工具变量,使用逆方差加权法、加权中位数法、MR-Egger法分别检验饮茶行为与随访新发结局的关联。
本研究所有分析利用R 4.1.2软件进行,MR分析使用的应用包为TwoSampleMR。涉及多重检验时,使用Bonferroni校正后的α值作为统计显著性阈值。双侧检验,检验水准α=0.05。
结果1.基本特征: MR分析纳入CKB中的100 218名研究对象,年龄(53.7±11.0)岁,女性占57.2%。男性每日饮茶率为41.2%,男性每日饮茶者中每日饮茶杯数和茶叶克数的M(QR)分别为4.0(3.0)杯和4.0(4.0)g;女性每日饮茶率为16.4%(表 1)。每日吸烟者和每日饮酒者的每日饮茶率和饮茶量高于每周非每日吸烟或每周非每日饮酒者。研究对象随访(11.4±3.0)年,累计随访1 139 127人年。随访期间,共确定新诊断的恶性肿瘤6 886名。
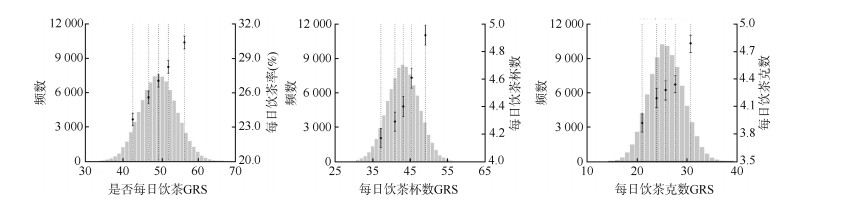
2. GRS与饮茶及潜在混杂因素的关联检验: 构建的GRS与自报饮茶行为的相关性见图 1。随GRS升高,研究对象调整性别、年龄、地区后自报的每日饮茶率、每日饮茶杯数、每日饮茶克数也呈现增高趋势(均P < 0.001),提示构建的GRS与个体的饮茶行为存在较好的相关性。GRS与是否每日饮茶、每日饮茶杯数、每日饮茶克数有强关联,F值分别为421.5、325.5和129.7,R2分别为0.37%、0.98%和0.72%。检验GRS与多种基线社会学特征和生活方式因素之间的关联,未发现GRS与除饮酒行为以外的其他变量之间存在明显的统计学关联(表 2)。
|
| 注:图中虚线为GRS五分位数,点和95%CI为五分位数所对应的调整年龄、性别、地区后的自报每日饮茶率、每日饮茶杯数、每日饮茶克数及其95%CI 图 1 饮茶遗传风险评分(GRS)与自报饮茶行为的相关性 |
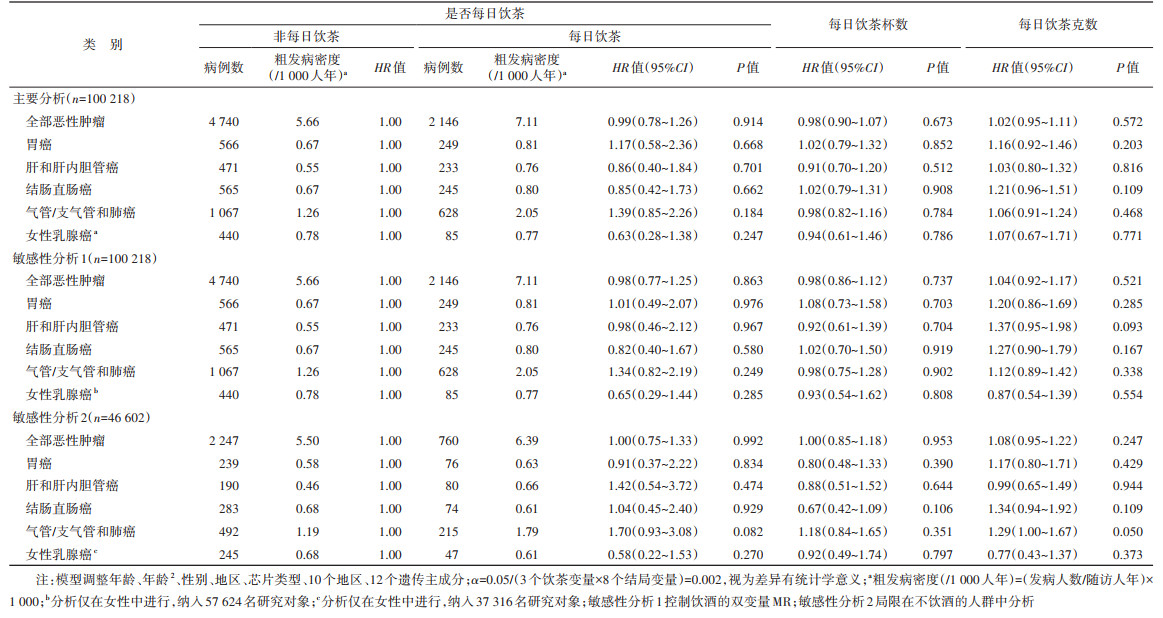
3. 饮茶与恶性肿瘤发病风险的MR分析: 分析结果显示,是否每日饮茶、每日饮茶杯数、每日饮茶克数与全部恶性肿瘤以及多种类型的恶性肿瘤,包括胃癌、肝和肝内胆管癌、结肠直肠癌、气管/支气管和肺癌以及女性乳腺癌的发病无统计学关联(表 3)。相比于非每日饮茶者,每日饮茶者的全部恶性肿瘤及部分亚型(胃癌、肝和肝内胆管癌、结肠直肠癌、气管/支气管和肺癌以及女性乳腺癌)的发病HR值(95%CI)分别为0.99(0.78~1.26)、1.17(0.58~2.36)、0.86(0.40~1.84)、0.85(0.42~1.73)、1.39(0.85~2.26)以及0.63(0.28~1.38)。控制饮酒行为的影响后,包括多变量MR,以及在不饮酒的人群中的分析结果表明,饮茶与全部恶性肿瘤以及各类恶性肿瘤发病无统计学关联(表 3)。多种敏感性分析,包括逆方差加权法、加权中位数法、MR-Egger法的分析得到类似的结果(表 4)。MR-Egger截距检验提示,本研究不存在水平多效性。
本研究基于CKB队列中有基因数据的10万人进行MR分析,结果提示,是否每日饮茶、每日饮茶杯数和每日饮茶克数与全部恶性肿瘤及部分亚型(胃癌、肝和肝内胆管癌、结肠直肠癌、气管/支气管和肺癌、女性乳腺癌)的发病风险无因果关联。
既往基于观察性研究设计分析饮茶与恶性肿瘤发病风险的关联可能受到一些偏倚的影响。除了自报饮茶行为引入的信息偏倚,以及在常见病例对照研究中病例组多为生存者所引入的选择偏倚和因果倒置问题,混杂偏倚也是不容忽视的问题。饮茶者的社会经济状况和更多的生活方式可能不同于非饮茶者。本课题组前期在CKB人群中的观察性研究显示,饮茶者中吸烟率和饮酒率都高于非饮茶者,且吸烟量和饮酒量也随着消耗茶叶量的增加而增加[9]。在饮茶与恶性肿瘤的关联分析中,模型中调整吸烟、饮酒以及其他可能的混杂因素后,相比于不饮茶者,每日饮茶者的恶性肿瘤发病风险随茶叶消耗量增加而增加。当分析进一步限制在从不吸烟且不过量饮酒者中时,上述关联消失。这组分析提示,对于吸烟、饮酒引入的混杂偏倚,即使作为协变量纳入模型中调整,仍然可能存在残余混杂。本研究采用MR分析,相比于观察性研究,在一定程度上可能更好地避免因果倒置和混杂偏倚,研究结果提示,尚无证据支持饮茶与恶性肿瘤发生风险之间存在因果关联。
饮茶与恶性肿瘤结局的MR研究较少。一项使用UKB 349 376名研究对象饮茶数据以及乳腺癌协会联盟122 977名乳腺癌病例和105 974名对照数据的两样本MR研究结果表明,饮茶与乳腺癌患病无关[28]。一项使用BBJ的152 653名研究对象饮茶数据、1 866名肝细胞癌病例和195 745名非病例数据的两样本MR研究显示,饮茶与肝细胞癌的风险降低有关[29];但该项研究中忽略了工具变量与饮酒存在相关性的问题,未控制饮酒行为的影响,且暴露和结局的人群相同,可能产生偏离无效假说的结果。
多项GWAS显示,在东亚人群中与饮茶相关的位点也与饮酒行为存在相关性[23-24]。一项在BBJ中进行的GWAS发现,12q24与饮茶、鱼肉摄入及甜味偏好均存在关联,而该位点同时也与饮酒呈现强关联。然而在调整了饮酒之后,12q24与饮茶的关联仅略微减弱,P值由1.2×10-7变为3.8×10-5;而12q24与鱼肉摄入和甜味偏好的关联消失,这提示12q24与饮茶存在独立关联。遗传变异的多效性很常见。例如,基于UKB的研究发现,饮酒与教育年限、HDL-C、吸烟、超重等存在遗传相关性[30]。本研究中构建的饮茶GRS与饮酒行为存在相关性。删除多效性位点会损失工具变量的预测效能。因此,本研究参照既往研究的做法[31-32],采取控制饮酒的多变量MR作为敏感性分析,也有助于理解饮茶与结局的独立关联[33]。
实验室研究显示,茶叶中的营养物如茶多酚是抗氧化剂,可以通过减少细胞中氧化应激和DNA的损伤来降低发生恶性肿瘤的风险[34-35]。儿茶素没食子酸酯可以与靶蛋白结合,抑制酶活性或信号传导途径,从而抑制癌细胞增殖[35]。而另一方面,茶叶在种植、加工和储存过程中受到重金属或黄曲霉毒素污染时,饮茶可能会增加恶性肿瘤的风险[36-37]。尽管存在这些可能性,目前的人群研究证据仍不支持饮茶与恶性肿瘤发生风险间存在因果关联,可能与生物活性成分在机体内的生物利用度等因素有关[38-39]。
本研究在中国人群中利用MR分析探讨了饮茶与恶性肿瘤发病的关联。研究基于前瞻性队列,样本量相对较大,基线调查时对饮茶行为的评价较为全面。研究在MR的第一步,通过排除基线患有重大疾病者以及近期有饮茶和饮酒行为改变的研究对象,进一步避免因果倒置,这是2SLS的优势;使用多种MR方法增强结果的稳健性。本研究存在局限性。第一,由于缺少中国人群的饮茶GWAS,本研究基于日本和英国人群中饮茶的GWAS选取位点,并在CKB人群中进行验证。位点存在种族差异,虽然在中国人群中得到验证,但并不能完全代表中国人群的饮茶遗传信息。不过,本研究构建的GRS与饮茶行为强相关(F > 100),一定程度上避免了这个问题。未来需要在中国人群中进行饮茶行为的GWAS。第二,构建的工具变量与饮酒存在关联,违反了MR的基本假设之一。本研究通过多种敏感性分析来排除饮酒可能带来的多效性影响,根据MR-Egger截距检验未发现存在水平多效性,但仍有可能存在其他混杂因素和多效性问题。第三,由于CKB中具有基因分型数据的研究对象仅占1/5,只能纳入常见的几种类型的恶性肿瘤进行分析,分癌种分析的统计功效也受到一定的限制。第四,本研究仅分析了饮茶量与癌症的关联,由于缺乏更多饮茶特征的GWAS和相应的工具变量,难以开展更深入的MR研究。
综上所述,本研究基于中国最大规模的前瞻性队列人群的遗传数据开展MR分析,关于饮茶与全部恶性肿瘤及部分亚型(胃癌、肝和肝内胆管癌、结肠直肠癌、气管/支气管和肺癌、女性乳腺癌)的发病风险,当前结果尚不支持它们之间的因果关联。
利益冲突 所有作者声明无利益冲突
作者贡献声明 刘春语:撰写文章、分析数据;程思:分析数据;庞元捷:构思研究、解释数据、修改文章;余灿清、孙点剑一:采集/解释数据、修改文章;裴培:采集数据;陈君石、陈铮鸣、李立明:项目管理、经费支持;吕筠:构思研究、采集/解释数据、修改文章、项目管理、经费支持
志谢 感谢所有参加中国慢性病前瞻性研究项目的队列成员和各项目地区的现场调查队调查员;感谢项目管理委员会、国家项目办公室、牛津协作中心和10个项目地区办公室的工作人员
| [1] |
管曦, 杨江帆. 中国城乡居民茶叶消费对比研究[J]. 茶叶科学, 2015, 35(4): 397-403. DOI:10.3969/j.issn.1000-369X.2015.04.019 Guan X, Yang JF. Comparative study of tea consumption between urban and rural residents in China[J]. J Tea Sci, 2015, 35(4): 397-403. DOI:10.3969/j.issn.1000-369X.2015.04.019 |
| [2] |
Li ZY, Tan YT, Liu DK, et al. Cumulative consumption of tea is associated with lower risk of liver cancer: updated results from the Shanghai women's health study[J]. Int J Cancer, 2023, 152(6): 1115-1123. DOI:10.1002/ijc.34310 |
| [3] |
Yang G, Shu XO, Li HL, et al. Prospective cohort study of green tea consumption and colorectal cancer risk in women[J]. Cancer Epidemiol Biomarkers Prev, 2007, 16(6): 1219-1223. DOI:10.1158/1055-9965.Epi-07-0097 |
| [4] |
Yang G, Zheng W, Xiang YB, et al. Green tea consumption and colorectal cancer risk: a report from the Shanghai men's health study[J]. Carcinogenesis, 2011, 32(11): 1684-1688. DOI:10.1093/carcin/bgr186 |
| [5] |
Nechuta S, Shu XO, Li HL, et al. Prospective cohort study of tea consumption and risk of digestive system cancers: results from the Shanghai women's health study[J]. Am J Clin Nutr, 2012, 96(5): 1056-1063. DOI:10.3945/ajcn.111.031419 |
| [6] |
Bao PP, Zhao GM, Shu XO, et al. Modifiable lifestyle factors and triple-negative breast cancer survival: a population- based prospective study[J]. Epidemiology, 2015, 26(6): 909-916. DOI:10.1097/ede.0000000000000373 |
| [7] |
Oh JK, Sandin S, Ström P, et al. Prospective study of breast cancer in relation to coffee, tea and caffeine in Sweden[J]. Int J Cancer, 2015, 137(8): 1979-1989. DOI:10.1002/ijc.29569 |
| [8] |
Dai Q, Shu XO, Li HL, et al. Is green tea drinking associated with a later onset of breast cancer?[J]. Ann Epidemiol, 2010, 20(1): 74-81. DOI:10.1016/j.annepidem.2009.09.005 |
| [9] |
Li XY, Yu CQ, Guo Y, et al. Association between tea consumption and risk of cancer: a prospective cohort study of 0.5 million Chinese adults[J]. Eur J Epidemiol, 2019, 34(8): 753-763. DOI:10.1007/s10654-019-00530-5 |
| [10] |
Filippini T, Malavolti M, Borrelli F, et al. Green tea (Camellia sinensis) for the prevention of cancer[J]. Cochrane Database Syst Rev, 2020, 3(3): CD005004. DOI:10.1002/14651858.CD005004.pub3 |
| [11] |
Kim TL, Jeong GH, Yang JW, et al. Tea consumption and risk of cancer: an umbrella review and Meta-analysis of observational studies[J]. Adv Nutr, 2020, 11(6): 1437-1452. DOI:10.1093/advances/nmaa077 |
| [12] |
秦雪英, 陈大方, 胡永华. 孟德尔随机化方法在流行病学病因推断中的应用[J]. 中华流行病学杂志, 2006, 27(7): 630-633. DOI:10.3760/j.issn:0254-6450.2006.07.020 Qin XY, Chen DF, Hu YH. Application of Mendelian randomization in the etiological study[J]. Chin J Epidemiol, 2006, 27(7): 630-633. DOI:10.3760/j.issn:0254-6450.2006.07.020 |
| [13] |
毋之钰, 高文静, 曹卫华, 等. 中国成年双生子饮茶行为分布特征[J]. 中华流行病学杂志, 2022, 43(8): 1241-1248. DOI:10.3760/cma.j.cn112338-20211210-00964 Wu ZY, Gao WJ, Cao WH, et al. A descriptive analysis of tea consumption in adult twins in China[J]. Chin J Epidemiol, 2022, 43(8): 1241-1248. DOI:10.3760/cma.j.cn112338-20211210-00964 |
| [14] |
Chen ZM, Chen JS, Collins R, et al. China Kadoorie Biobank of 0.5 million people: survey methods, baseline characteristics and long-term follow-up[J]. Int J Epidemiol, 2011, 40(6): 1652-1666. DOI:10.1093/ije/dyr120 |
| [15] |
李立明, 吕筠, 郭彧, 等. 中国慢性病前瞻性研究: 研究方法和调查对象的基线特征[J]. 中华流行病学杂志, 2012, 33(3): 249-255. DOI:10.3760/cma.j.issn.0254-6450.2012.03.001 Li LM, Lv J, Guo Y, et al. The China Kadoorie Biobank: related methodology and baseline characteristics of the participants[J]. Chin J Epidemiol, 2012, 33(3): 249-255. DOI:10.3760/cma.j.issn.0254-6450.2012.03.001 |
| [16] |
吕筠, 郭彧, 卞铮, 等. 中国慢性病前瞻性研究: 10个项目地区人群饮酒行为特征差异的分析[J]. 中华流行病学杂志, 2014, 35(8): 875-881. DOI:10.3760/cma.j.issn.0254-6450.2014.08.001 Lv J, Guo Y, Bian Z, et al. Regional differences in patterns of alcohol consumption: findings from the China Kadoorie Biobank study on half a million people from 10 regions[J]. Chin J Epidemiol, 2014, 35(8): 875-881. DOI:10.3760/cma.j.issn.0254-6450.2014.08.001 |
| [17] |
樊萌语, 吕筠, 郭彧, 等. 中国慢性病前瞻性研究: 10个项目地区成人体力活动和休闲静坐时间特征差异的分析[J]. 中华流行病学杂志, 2015, 36(8): 779-785. DOI:10.3760/cma.j.issn.0254-6450.2015.08.002 Fan MY, Lv J, Guo Y, et al. Regional differences on patterns of physical activity and leisure sedentary time: findings from the China Kadoorie Biobank study, including a million people from 10 regions[J]. Chin J Epidemiol, 2015, 36(8): 779-785. DOI:10.3760/cma.j.issn.0254-6450.2015.08.002 |
| [18] |
秦晨曦, 余灿清, 杜怀东, 等. 中国10个地区成年人食物摄入频率特征差异的分析[J]. 中华流行病学杂志, 2015, 36(9): 911-916. DOI:10.3760/cma.j.issn.0254-6450.2015.09.001 Qin CX, Yu CQ, Du HD, et al. Differences in diet intake frequency of adults: findings from half a million people in 10 areas in China[J]. Chin J Epidemiol, 2015, 36(9): 911-916. DOI:10.3760/cma.j.issn.0254-6450.2015.09.001 |
| [19] |
王昕, 吕筠, 郭彧, 等. 中国慢性病前瞻性研究: 10个项目地区成年人群吸烟行为特征差异分析[J]. 中华流行病学杂志, 2015, 36(11): 1200-1204. DOI:10.3760/cma.j.issn.0254-6450.2015.11.004 Wang X, Lv J, Guo Y, et al. Regional differences in adults' smoking pattern: findings from China Kadoorie Biobank study in 10 areas in China[J]. Chin J Epidemiol, 2015, 36(11): 1200-1204. DOI:10.3760/cma.j.issn.0254-6450.2015.11.004 |
| [20] |
王醴湘, 吕筠, 郭彧, 等. 中国慢性病前瞻性研究: 10个项目地区成年人超重/肥胖现况分析[J]. 中华流行病学杂志, 2015, 36(11): 1190-1194. DOI:10.3760/cma.j.issn.0254-6450.2015.11.002 Wang LX, Lv J, Guo Y, et al. Regional specific differences in prevalence of overweight/obesity in China: findings from China Kadoorie Biobank study in 10 areas in China[J]. Chin J Epidemiol, 2015, 36(11): 1190-1194. DOI:10.3760/cma.j.issn.0254-6450.2015.11.002 |
| [21] |
谭云龙, 申泽薇, 余灿清, 等. 中国成年人文化程度与体格指标的长期变化关系[J]. 中华流行病学杂志, 2019, 40(1): 26-32. DOI:10.3760/cma.j.issn.0254-6450.2019.01.007 Tan YL, Shen ZW, Yu CQ, et al. Relationship between educational level and long-term changes of body weight and waist circumference in adults in China[J]. Chin J Epidemiol, 2019, 40(1): 26-32. DOI:10.3760/cma.j.issn.0254-6450.2019.01.007 |
| [22] |
王文秀, 黄涛, 李立明. 基于"中国慢性病前瞻性研究"的遗传资源建设与应用[J]. 遗传(北京), 2021, 43(10): 972-979. DOI:10.16288/j.yczz.21-257 Wang WX, Huang T, Li LM. Construction and application of human genetic resources in the China Kadoorie Biobank[J]. Hereditas (Beijing), 2021, 43(10): 972-979. DOI:10.16288/j.yczz.21-257 |
| [23] |
Matoba N, Akiyama M, Ishigaki K, et al. GWAS of 165, 084 Japanese individuals identified nine loci associated with dietary habits[J]. Nat Hum Behav, 2020, 4(3): 308-316. DOI:10.1038/s41562-019-0805-1 |
| [24] |
Furukawa K, Igarashi M, Jia HJ, et al. A genome-wide association study identifies the association between the 12q24 locus and black tea consumption in Japanese populations[J]. Nutrients, 2020, 12(10): 3182. DOI:10.3390/nu12103182 |
| [25] |
Tanigawa Y, Qian JY, Venkataraman G, et al. Significant sparse polygenic risk scores across 813 traits in UK Biobank[J]. PLoS Genet, 2022, 18(3): e1010105. DOI:10.1371/journal.pgen.1010105 |
| [26] |
Kjaergaard AD, Marouli E, Papadopoulou A, et al. Thyroid function, sex hormones and sexual function: a Mendelian randomization study[J]. Eur J Epidemiol, 2021, 36(3): 335-344. DOI:10.1007/s10654-021-00721-z |
| [27] |
Burgess S, Thompson SG, CRP CHD Genetics Collaboration. Avoiding bias from weak instruments in Mendelian randomization studies[J]. Int J Epidemiol, 2011, 40(3): 755-764. DOI:10.1093/ije/dyr036 |
| [28] |
Deng YQ, Ge WX, Xu HL, et al. A Mendelian randomization study of the effect of tea intake on breast cancer[J]. Front Nutr, 2022, 9: 956969. DOI:10.3389/fnut.2022.956969 |
| [29] |
Deng YY, Huang JJ, Wong MCS. Associations between six dietary habits and risk of hepatocellular carcinoma: a Mendelian randomization study[J]. Hepatol Commun, 2022, 6(8): 2147-2154. DOI:10.1002/hep4.1960 |
| [30] |
Clarke TK, Adams MJ, Davies G, et al. Genome-wide association study of alcohol consumption and genetic overlap with other health-related traits in UK Biobank (N=112 117)[J]. Mol Psychiatry, 2017, 22(10): 1376-1384. DOI:10.1038/mp.2017.153 |
| [31] |
Carter P, Yuan S, Kar S, et al. Coffee consumption and cancer risk: a Mendelian randomisation study[J]. Clin Nutr, 2022, 41(10): 2113-2123. DOI:10.1016/j.clnu.2022.08.019 |
| [32] |
Hao Y, Xiao JY, Liang Y, et al. Reassessing the causal role of obesity in breast cancer susceptibility: a comprehensive multivariable Mendelian randomization investigating the distribution and timing of exposure[J]. Int J Epidemiol, 2023, 52(1): 58-70. DOI:10.1093/ije/dyac143 |
| [33] |
Sanderson E, Davey Smith G, Windmeijer F, et al. An examination of multivariable Mendelian randomization in the single-sample and two-sample summary data settings[J]. Int J Epidemiol, 2019, 48(3): 713-727. DOI:10.1093/ije/dyy262 |
| [34] |
林智, 吕海鹏, 张盛. 茶叶活性成分的化学和药理作用[J]. 中国茶叶, 2018, 40(11): 1-6. DOI:10.3969/j.issn.1000-3150.2018.11.001 Lin Z, Lv HP, Zhang S. Chemical and pharmacological actions of active components in tea[J]. Chin Tea, 2018, 40(11): 1-6. DOI:10.3969/j.issn.1000-3150.2018.11.001 |
| [35] |
Xu XY, Zhao CN, Cao SY, et al. Effects and mechanisms of tea for the prevention and management of cancers: an updated review[J]. Crit Rev Food Sci Nutr, 2020, 60(10): 1693-1705. DOI:10.1080/10408398.2019.1588223 |
| [36] |
Zhang J, Yang RD, Chen R, et al. Accumulation of heavy Metals in tea leaves and potential health risk assessment: a case study from Puan County, Guizhou province, China[J]. Int J Environ Res Public Health, 2018, 15(1): 133. DOI:10.3390/ijerph15010133 |
| [37] |
Li LH, Fu QL, Achal V, et al. A comparison of the potential health risk of aluminum and heavy Metals in tea leaves and tea infusion of commercially available green tea in Jiangxi, China[J]. Environ Monit Assess, 2015, 187(5): 228. DOI:10.1007/s10661-015-4445-2 |
| [38] |
del Rio D, Calani L, Scazzina F, et al. Bioavailability of catechins from ready-to-drink tea[J]. Nutrition, 2010, 26(5): 528-533. DOI:10.1016/j.nut.2009.06.013 |
| [39] |
Zhu M, Chen Y, Li RC. Oral absorption and bioavailability of tea catechins[J]. Planta Med, 2000, 66(5): 444-447. DOI:10.1055/s-2000-8599 |
 2023, Vol. 44
2023, Vol. 44