文章信息
- 张梦怡, 陈小萍, 孙秀丽, 马学军, 申辛欣, 郭彦言.
- Zhang Mengyi, Chen Xiaoping, Sun Xiuli, Ma Xuejun, Shen Xinxin, Guo Yanyan
- 血液中念珠菌重组人甘露聚糖结合凝集素蛋白磁珠富集联合重组酶辅助聚合酶链式反应检测方法的建立
- Establishment of a recombined mannose-binding lectin protein-magnetic beads—enriched binding recombinant enzyme-assisted polymerase chain reaction assay for Candida in blood samples
- 中华流行病学杂志, 2023, 44(5): 823-827
- Chinese Journal of Epidemiology, 2023, 44(5): 823-827
- http://dx.doi.org/10.3760/cma.j.cn112338-20230215-00079
-
文章历史
收稿日期: 2023-02-15
2. 中国疾病预防控制中心病毒病预防控制所, 国家卫生健康委员会医学病毒和病毒病重点实验室, 北京 102206;
3. 唐山工人医院检验科, 唐山 063000;
4. 中国疾病预防控制中心传染病预防控制所, 北京 102206
2. National Institute for Viral Disease Control and Prevention, Chinese Center for Disease Control and Prevention, Beijing 102206, China;
3. Clinical Laboratory, Tangshan Gongren Hospital, Tangshan 063000, China;
4. National Institute for Communicable Disease Control and Prevention, Chinese Center for Disease Control and Prevention, Beijing 102206, China
血流感染作为住院患者发病和死亡的重要原因,念珠菌血流感染在其中占据相当地位[1-2]。在美国,念珠菌血症是住院患者死亡的常见原因,并且导致了8%~10%的血流感染[3]。在过去的十几年中,随着肿瘤患者的增加、免疫抑制剂及抗菌药物的使用,念珠菌血流感染患者呈逐年上升的趋势,耐药情况亟需得到改善[4-5]。有研究显示,有效的抗真菌治疗每延迟1 d,患者的死亡风险可增加50%[6]。由于缺乏早期快速诊断的技术,临床上常用的金标准为菌株培养,但血液念珠菌往往需要5~7 d的增菌培养,并且灵敏度较低,血培养的阳性率约50%,甚至更低[7],严重干扰了临床疾病的诊断,影响患者病情和预后,因此早期对致病菌作出明确诊断对于临床相当重要。
目前对于念珠菌的实验室分子诊断包括PCR技术、实时荧光定量PCR技术、等温扩增技术、质谱技术等[8],在一定程度上为念珠菌的诊断缩短了时间,但往往建立在一段时间的培养后。本研究选择白色念珠菌和热带念珠菌高度保守的内转录间隔区(ITS)作为靶基因设计引物[9],应用重组酶介导等温扩增(RAA)技术与PCR相结合,采取重组人甘露聚糖结合凝集素蛋白(M1蛋白)磁珠富集病原体联合重组酶辅助聚合酶链式反应(RAP)的巢式核酸扩增技术对念珠菌rDNA的ITS进行核酸扩增,建立对于白色念珠菌和热带念珠菌的双重RAP检测方法[10],对血液中念珠菌达到快速检测的目的。
材料与方法1. 材料:
(1)菌株:白色念珠菌标准株(ATCC753)和热带念珠菌标准株(ATCC750)由中国CDC传染病预防控制所医院感染室提供。
(2)冰冻血浆:在知情同意的情况下,采集健康志愿者血样本置于抗凝管中,离心后收集血浆,储存于-80 ℃冰箱中备用。
(3)M1蛋白:由中国CDC传染病预防控制所医院感染室提供。
(4)主要试剂与仪器:沙氏琼脂培养基(中国北京陆桥技术股份有限公司),酵母浸出粉胨葡萄糖培养基(YPD)(中国青岛海博生物技术有限公司),1×磷酸缓冲盐溶液(PBS)(美国GIBCO公司),蛋白A磁珠(中国无锡百迈格生物科技有限公司),E.Z.N.A.® Yeast DNA Kit试剂盒(美国Omega生物技术公司),FastPure® Microbiome DNA Isolation Kit试剂盒(中国南京诺唯赞生物科技股份有限公司),RAA核酸扩增试剂盒(基础法)(中国江苏奇天基因生物科技有限公司),无核酶水(DEPC水)(中国北京索莱宝科技有限公司),Entrans qPCR Probe Set V2试剂盒(中国武汉爱博泰克生物科技有限公司),CO2培养箱(美国Thermo公司),Roche LightCycler®480 Ⅱ荧光定量PCR仪(美国罗氏诊断产品有限公司)。
2. 方法:
(1)引物设计:RAP的外部引物通过改造PCR的内部引物而成,在美国国立生物技术信息中心GenBank网站中下载白色念珠菌和热带念珠菌的ITS基因序列,通过VectorNTI 11.5.1软件进行比对,参考RAA引物探针的设计原则,使用Oligo 7软件对其引物二聚体、三级结构和GC含量等指标进行分析和评估。RAP的内部引物和探针选择参考文献[11],再选择白色念珠菌和热带念珠菌的高保守ITS基因区域设计RAA引物,引物和探针由生工生物工程(上海)股份有限公司合成。见表 1。
(2)菌株基因组DNA提取:将白色念珠菌、热带念珠菌分别挑取单个菌落溶于PBS(< 2×107个细胞)置于1.5 ml微型离心管中,根据Omega真菌提取试剂盒说明书提取基因组DNA,取2 μl使用Qubit dsDNA BR/HR检测试剂盒和Qubit 2.0荧光定量计对基因组DNA进行定量,并将核酸以10倍梯度稀释,浓度范围为10-6~10-1 ng/μl,存于-80 ℃冰箱中备用。
(3)双重RAP体系检测方法的建立:将探针分别标记白色念珠菌的FAM荧光基团与热带念珠菌的HEX荧光基团,使其能在同一RAP反应体系中同时进行检测,建立双重念珠菌RAP检测方法。反应体系:总体积50 μl,包括第一次RAA反应体系9 μl,内含缓冲液6.25 μl、DEPC水1.25 μl、RAA正反向引物各0.5 μl(10 μmol/L)、醋酸镁0.5 μl(280 mmol/L);第二次PCR反应体系40 μl,内含缓冲液12.5 μl、DEPC水22.2 μl、PCR正反向引物各1 μl(10 μmol/L),白色念珠菌和热带念珠菌PCR探针各0.5 μl(10 μmol/L)、脱氧核糖核苷三磷酸0.6 μl(脱氧腺苷三磷酸、脱氧鸟苷三磷酸、脱氧胸苷三磷酸、脱氧胞苷三磷酸各10 mmol/L)、MgCl2 1.2 μl(50 mmol/L),模板量为1 μl。将二十二烷加入预先放置好的反应单元管中PCR体系的上层,60 ℃ 1 min、4 ℃ 30 s使其凝固于PCR体系上层,然后在上层加入RAA体系。反应条件为:39 ℃ 12 min;95 ℃变性5 min;95 ℃ 15 s;60 ℃ 45 s;循环30次。
(4)双重RAP体系检测方法的灵敏度和特异性:将菌株基因组DNA核酸10倍梯度稀释,稀释后浓度为10-6~10-1 ng/μl,以DEPC水作为阴性对照,每次灵敏度检测平行进行阴性对照,每个浓度重复8次实验。使用大肠埃希菌、克柔念珠菌、近平滑念珠菌、光滑念珠菌、肺炎链球菌、肺炎克雷伯杆菌、粪肠球菌、金黄色葡萄球菌、伤寒杆菌、结核分枝杆菌、单核细胞增生李斯特菌、粪肠球菌、阴沟肠杆菌、铜绿假单胞菌核酸与白色念珠菌和热带念珠菌进行双重RAP检测方法的特异性比较。
(5)模拟样本准备:取-80 ℃冻存的菌株,接种于沙保培养基,于25 ℃培养24~48 h。挑取单克隆接种于YPD中,200 r/min,于25 ℃培养过夜。取1 ml菌液,离心,弃上清,细胞团用PBS洗3次后重悬,使用牛鲍计数板计数,通过PBS倍比稀释,制备 < 10、100、200菌落形成单位(CFU)的菌悬液(终浓度 < 1、10、20 CFU/μl,取10 μl)。实际细胞数由沙氏琼脂培养基铺板计数确定。取-80 ℃冻存的人血浆,于37 ℃水浴解冻。取 < 10 CFU的菌悬液加入1 ml人血浆中,制备人血浆的模拟样本(< 10 CFU/ml)。
(6)念珠菌的捕获和核酸的制备:将1 ml的血浆模拟样本加入14 ml的圆底试管,加入9 ml的PBS将体系补足至10 ml。制备好的M1蛋白磁珠和4 mmol/L CaCl2(pH 7.4)加入试管内,试管颠倒混匀。试管置于混悬仪上,室温下混悬1 h。试管置于磁力架上进行磁分离,弃去上清液,PBS清洗3次,未结合于M1蛋白磁珠上的血浆成分和念珠菌弃去。随后将留存的M1蛋白磁珠重悬于200 μl的PBS中,储存于-20 ℃冰箱中备用。根据诺唯赞试剂盒说明书提取念珠菌DNA,用50 μl洗脱液进行洗脱后,储存于-80 ℃冰箱中备用。
(7)模拟样本的应用与评价:使用白色念珠菌和热带念珠菌菌液梯度为10~106 CFU/ml的1 ml血浆模拟样本富集前、后提取核酸,将其作为模板进行双重RAP测定,计算变异系数(CV)评价该方法在模拟样本中的应用。使用1 ml白色念珠菌和热带念珠菌 < 10 CFU/ml菌液梯度的血浆模拟样本富集前、后提取DNA,用RAP检测方法进行扩增,并与实时荧光PCR检测结果进行比较。以上实验重复3次。
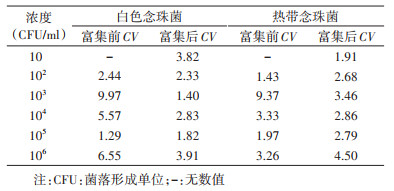
结果1. 白色念珠菌和热带念珠菌双重RAP检测方法的灵敏度及重复性: 使用白色念珠菌和热带念珠菌标准菌株评估双重RAP方法的灵敏度。8次重复试验中,该检测方法对白色念珠菌和热带念珠菌的灵敏度均为10-6 ng/μl,ITS重复出现(2.4~2.8拷贝/反应),阴性对照未出现明显扩增现象,重复试验结果一致。见图 1。
|
| 图 1 实时荧光重组酶辅助聚合酶链式反应检测白色念珠菌和热带念珠菌标准株灵敏度扩增曲线 |
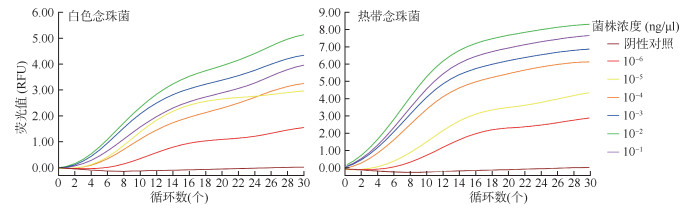
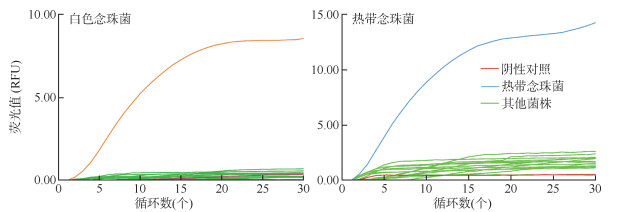
2. 白色念珠菌和热带念珠菌双重RAP检测方法的特异性: 使用建立的双重RAP检测方法对白色念珠菌株和热带念珠菌株及14种其他临床血流感染常见菌株核酸进行交叉反应,检测白色念珠菌的FAM荧光基团通道和热带念珠菌的HEX荧光基团通道均未出现扩增曲线,且阴性对照未出现扩增曲线。见图 2。
|
| 图 2 实时荧光重组酶辅助聚合酶链式反应检测白色念珠菌和热带念珠菌特异性扩增曲线 |
3. 双重RAP检测方法对白色念珠菌和热带念珠菌模拟样本检测结果比较: 白色念珠菌菌液梯度为10~106 CFU/ml的血浆模拟样本富集前、后的组间CV均 < 10.00%,表明本实验在模拟样本中重复性高、稳定性好,满足实验要求;白色念珠菌富集前实时荧光PCR与RAP对模拟样本检测限在100 CFU/ml左右,富集后在3~9 CFU/ml的8份模拟样本中,RAP检测阳性数为6份,实时荧光PCR检测阳性数为2份,RAP检测阳性数大于实时荧光PCR检测阳性数。热带念珠菌菌液梯度为10~106 CFU/ml的血浆模拟样本富集前、后的组间CV均 < 10.00%,表明本实验在模拟样本中重复性高、稳定性好,满足实验要求;热带念珠菌富集前对模拟样本检测限在300 CFU/ml左右,富集后在2~8 CFU/ml的8份模拟样本中,RAP检测阳性数为7份,而实时荧光PCR检测阳性数为3份,RAP检测阳性数大于实时荧光PCR检测阳性数。见表 2。
近年来,念珠菌导致的血流感染随着抗生素的使用、血液系统恶性肿瘤患者的不断增加,感染情况不容乐观,感染率及死亡率不断提升[12-13]。在血流感染中常见的念珠菌感染为白色念珠菌感染,作为条件致病菌可在患者免疫力低下时侵入患者血液形成播散性血流感染,在血流感染患者中病死率较高[14-15]。而热带念珠菌感染在非白色念珠菌血症中同样占相当比例,达血培养中分离的非白色念珠菌血症比例的20%~40%,是中性粒细胞减少症和血液系统恶性肿瘤患者感染真菌病原体的重要因素[16-17]。目前由于抗生素的使用,念珠菌的耐药性正在逐渐增加[18-19]。一项基于人群的研究报告称,念珠菌感染的年发病率为8/万人[20]。因此早期对念珠菌血症进行诊断,减少抗生素滥用情况,早期进行筛检,有助于指导临床用药、减缓耐药菌株的产生,促进患者疾病的预后。
在临床中,分子扩增技术对于真菌的诊断逐渐成熟,但仍不能满足临床致病菌株的快速检测需求。本研究建立的白色念珠菌和热带念珠菌双重RAP技术将RAA和PCR技术的优点相结合,在一个反应单元管中进行巢式扩增,RAA体系与PCR体系之间由固态的二十二烷隔开,前期在RAA扩增体系进行等温扩增,二十二烷在等温条件下可维持固体状态,为RAA体系扩增开辟空间。当RAA体系完成前期扩增,反应体系进入第二轮扩增阶段,温度升高至超过二十二烷熔点,RAA反应产物进入PCR体系中进行扩增,这个过程在封闭的反应单元中进行,尽可能地减少对于环境的污染,并且缩短时间至1 h内完成扩增。在 > 100 CFU/ml的模拟样本中CV < 10.00%,重复性好,在基因组DNA为2.4~2.8拷贝/反应的情况下可以完成扩增,灵敏度高,可快速准确地检测白色念珠菌和热带念珠菌。M1蛋白在结合蛋白A磁珠的情况下,可对血浆样本中的病原体进行捕获[21-22]。在检测临床样本时与M1蛋白磁珠富集病原体的技术相结合,做到在不培养的情况下,对临床样本直接检测,进一步缩短时间,通过M1蛋白磁珠对病原体富集再提取核酸,在4 h内完成对血液中更低浓度的病原体进行检测,而且经过富集后可去除血浆中其他成分对扩增过程的影响以进一步提高核酸扩增效率,实现对 < 10 CFU/ml的念珠菌进行检测。
综上所述,本研究通过对白色念珠菌和热带念珠菌的ITS设计通用型引物和探针相结合的RAP巢式核酸扩增技术,建立检测白色念珠菌和热带念珠菌双重RAP检测方法,并与M1蛋白磁珠富集病原体技术相结合,重复性好,特异性高,可对念珠菌血流感染患者做到早发现,在念珠菌血症快速检测中具有较好的应用潜力。
利益冲突 所有作者声明无利益冲突
作者贡献声明 张梦怡:实验设计、实验操作、数据整理与分析、文章撰写;陈小萍:实验设计、研究指导、材料支持;孙秀丽:实验操作;马学军:研究指导、论文修改;申辛欣:研究指导、经费支持、论文修改;郭彦言:研究指导、数据收集
| [1] |
Ahmad S, Khan Z. Invasive candidiasis: a review of nonculture-based laboratory diagnostic methods[J]. Indian J Med Microbiol, 2012, 30(3): 264-269. DOI:10.4103/0255-0857.99482 |
| [2] |
Enoch DA, Yang HN, Aliyu SH, et al. The changing epidemiology of invasive fungal infections[M]//Lion T. Human fungal pathogen identification. New York: Humana Press, 2017: 17-65. DOI: 10.1007/978-1-4939-6515-1_2.
|
| [3] |
Wisplinghoff H, Bischoff T, Tallent SM, et al. Nosocomial bloodstream infections in US hospitals: analysis of 24 179 cases from a prospective nationwide surveillance study[J]. Clin Infect Dis, 2004, 39(3): 309-317. DOI:10.1086/421946 |
| [4] |
Silva S, Negri M, Henriques M, et al. Candida glabrata, Candida parapsilosis and Candida tropicalis: biology, epidemiology, pathogenicity and antifungal resistance[J]. FEMS Microbiol Rev, 2012, 36(2): 288-305. DOI:10.1111/j.1574-6976.2011.00278.x |
| [5] |
Zhang XB, Yu SJ, Yu JX, et al. Retrospective analysis of epidemiology and prognostic factors for candidemia at a hospital in China, 2000-2009[J]. Jpn J Infect Dis, 2012, 65(6): 510-515. DOI:10.7883/yoken.65.510 |
| [6] |
McCarty TP, Pappas PG. Invasive candidiasis[J]. Infect Dis Clin North Am, 2016, 30(1): 103-124. DOI:10.1016/j.idc.2015.10.013 |
| [7] |
McMullan R, Metwally L, Coyle PV, et al. A prospective clinical trial of a real-time polymerase chain reaction assay for the diagnosis of candidemia in nonneutropenic, critically ill adults[J]. Clin Infect Dis, 2008, 46(6): 890-896. DOI:10.1086/528690 |
| [8] |
Pappas PG, Lionakis MS, Arendrup MC, et al. Invasive candidiasis[J]. Nat Rev Dis Primers, 2018, 4: 18027. DOI:10.1038/nrdp.2018.27 |
| [9] |
陈剑山, 郑服丛. ITS序列分析在真菌分类鉴定中的应用[J]. 安徽农业科学, 2007, 35(13): 3785-3786, 3792. Chen JS, Zheng FC. Application of ITS sequences in fungi classification and identification[J]. J Anhui Agric Sci, 2007, 35(13): 3785-3786, 3792. DOI:10.3969/j.issn.0517-6611.2007.13.011 |
| [10] |
Fan GH, Zhang RQ, He XZ, et al. RAP: a novel approach to the rapid and highly sensitive detection of respiratory viruses[J]. Front Bioeng Biotechnol, 2021, 9: 766411. DOI:10.3389/fbioe.2021.766411 |
| [11] |
Fujita S, Lasker BA, Lott TJ, et al. Microtitration plate enzyme immunoassay to detect PCR-amplified DNA from Candida species in blood[J]. J Clin Microbiol, 1995, 33(4): 962-967. DOI:10.1128/jcm.33.4.962-967.1995 |
| [12] |
Guo F, Yang Y, Kang Y, et al. Invasive candidiasis in intensive care units in China: a multicentre prospective observational study[J]. J Antimicrob Chemother, 2013, 68(7): 1660-1668. DOI:10.1093/jac/dkt083 |
| [13] |
Nejad EE, Almani PGN, Ali Mohammadi M, et al. Molecular identification of Candida isolates by Real-time PCR-high-resolution melting analysis and investigation of the genetic diversity of Candida species[J]. J Clin Lab Anal, 2020, 34(10): e23444. DOI:10.1002/jcla.23444 |
| [14] |
Negri M, Silva S, Henriques M, et al. Insights into Candida tropicalis nosocomial infections and virulence factors[J]. Eur J Clin Microbiol Infect Dis, 2012, 31(7): 1399-1412. DOI:10.1007/s10096-011-1455-z |
| [15] |
曹彬, 王辉, 巫琳, 等. 侵袭性念珠菌院内感染的流行病学调查[J]. 中华医学杂志, 2008, 88(28): 1970-1973. Cao B, Wang H, Wu L, et al. Epidemiological study of invasive nosocomial candidiasis in 2 teaching hospitals in Beijing[J]. Natl Med J China, 2008, 88(28): 1970-1973. DOI:10.3321/j.issn:0376-2491.2008.28.007 |
| [16] |
Fernández-Ruiz M, Puig-Asensio M, Guinea J, et al. Candida tropicalis bloodstream infection: Incidence, risk factors and outcome in a population-based surveillance[J]. J Infect, 2015, 71(3): 385-394. DOI:10.1016/j.jinf.2015.05.009 |
| [17] |
Wang D, An N, Yang YW, et al. Candida tropicalis distribution and drug resistance is correlated with ERG11 and UPC2 expression[J]. Antimicrob Resist Infect Control, 2021, 10(1): 54. DOI:10.1186/s13756-021-00890-2 |
| [18] |
Guo LN, Xiao M, Cao B, et al. Epidemiology and antifungal susceptibilities of yeast isolates causing invasive infections across urban Beijing, China[J]. Future Microbiol, 2017, 12(12): 1075-1086. DOI:10.2217/fmb-2017-0036 |
| [19] |
Chen M, Xu Y, Hong N, et al. Epidemiology of fungal infections in China[J]. Front Med, 2018, 12(1): 58-75. DOI:10.1007/s11684-017-0601-0 |
| [20] |
Yapar N. Epidemiology and risk factors for invasive candidiasis[J]. Ther Clin Risk Manag, 2014, 10: 95-105. DOI:10.2147/TCRM.S40160 |
| [21] |
Chen XL, Zheng H, Li WG, et al. Direct blood culturing of Candida spp. on solid medium by a rapid enrichment method with magnetic beads coated with recombinant Human mannan-binding lectin[J]. J Clin Microbiol, 2020, 58(4): e00057-20. DOI:10.1128/JCM.00057-20 |
| [22] |
郑皓, 李文革, 卢金星, 等. 基于M1磁珠富集血液中念珠菌快速检测方法的建立[J]. 疾病监测, 2021, 36(6): 622-627. Zheng H, Li WG, Lu JX, et al. Establishment of fast diagnostic assays of Candida spp. in blood samples based on M1 beads enrichment[J]. Disease Surveillance, 2021, 36(6): 622-627. DOI:10.3784/jbjc.202103010095 |
 2023, Vol. 44
2023, Vol. 44