文章信息
- 靳晓晶, 滕中秋, 徐佩星, 孙向荣, 王文, 覃新程, 秦天.
- Jin Xiaojing, Teng Zhongqiu, Xu Peixing, Sun Xiangrong, Wang Wen, Qin Xincheng, Qin Tian
- TaqMan-探针实时荧光定量PCR同时检测立克次体目中7种重要病原菌
- Simultaneous detection of 7 important Rickettsiales pathogens by TaqMan-probe quantitative real-time PCR
- 中华流行病学杂志, 2023, 44(5): 816-822
- Chinese Journal of Epidemiology, 2023, 44(5): 816-822
- http://dx.doi.org/10.3760/cma.j.cn112338-20221011-00875
-
文章历史
收稿日期: 2022-10-11
2. 中国疾病预防控制中心传染病预防控制所/传染病预防控制国家重点实验室, 北京 102206;
3. 南昌市疾病预防控制中心, 南昌 330038
2. National Institute for Communicable Disease Control and Prevention, Chinese Center for Disease Control and Prevention/State Key Laboratory of Infectious Disease Prevention and Control, Beijing 102206, China;
3. Nanchang Center for Disease Control and Prevention, Nanchang 330038, China
立克次体目(Rickettsiales)病原菌是一类严格细胞内寄生的原核细胞型微生物,大小介于细菌和病毒之间,天然寄生于多种吸血节肢动物体内[1-2]。当机体与立克次体感染的吸血节肢动物接触后可引发立克次体病,该类疾病是一类人兽共患的自然疫源性疾病。对人类致病的立克次体主要有立克次体科中的立克次体属、东方体属,无形体科中的无形体属、埃立克体属以及柯克斯体科柯克斯体属的贝氏柯克斯体。贝氏柯克斯体虽已归类到军团菌目,但传统上贝氏柯克斯体所导致的疾病Q热仍被归类到立克次体病范畴[3]。立克次体病在全世界范围流行,我国流行的主要疾病种类包括Q热、斑点热、流行性斑疹伤寒、地方性斑疹伤寒、恙虫病、埃立克体病和人粒细胞无形体病等[4]。
由于立克次体病主要的临床症状为高热、全身酸痛、头痛等,缺乏特异性。临床上容易出现漏诊及误诊,因而延误治疗导致病情严重,出现多种并发症,甚至造成死亡[5-6]。常用的血清学诊断在发病后的0~12 d才开始出现阳性,不能满足早期诊断的要求,并且由于立克次体之间存在广泛的抗原交叉,血清学检测只能用于分群诊断[7]。实时荧光定量PCR(qPCR)技术是一种灵敏度、特异性较高的核酸检测方法,被广泛应用于病毒、细菌的实验室快速检测[8]。本研究对立克次体目中7种重要病原菌的反应体系及反应程序进行优化验证,建立可同时检测立克次体目中7种重要病原菌的TaqMan-探针qPCR方法。
材料与方法1. 菌株与DNA: 普氏立克次体、莫氏立克次体、恙虫病东方体、斑点热群立克次体中的日本立克次体、查菲埃立克体、嗜吞噬细胞无形体、边缘无形体、牛无形体、山羊无形体、扁平无形体、犬埃立克体和贝氏柯克斯体;其他细菌DNA[嗜肺军团菌(ATCC33152)、肺炎链球菌(ATCC49619)、卡他莫拉菌(ATCC25238)、金黄色葡萄球菌(ATCC25923)、流感嗜血杆菌、羊种布鲁氏菌、大肠埃希菌(ATCC25922)、百日咳杆菌和白喉棒状杆菌],每种病原菌DNA各2个,菌株及核酸样品为本研究室库存及相关科室赠予。
2. 仪器和试剂: Line-Gene K荧光定量PCR仪(中国杭州博日科技股份有限公司)、LabCycler PCR仪(德国SensoQuest公司)、QIAamp DNA Mini Kit [德国凯杰(QIAgen)生物公司]、Premix Taq™ Version 2.0 plus dye和Premix Ex TaqTM Probe qPCR(日本TaKaRa公司),引物、探针及质粒均由生工生物工程(上海)股份有限公司合成。
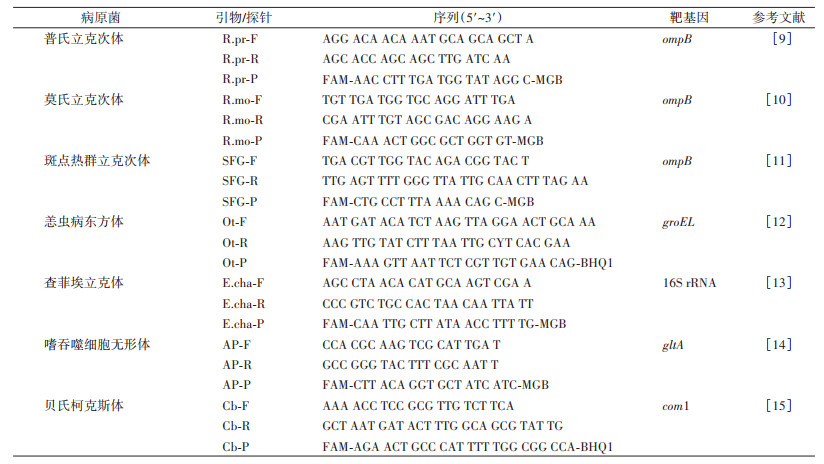
3. 引物和探针序列: 利用美国国家生物技术信息中心网站的在线引物设计工具Primer-BLAST评估引物和探针的特异性,使用Primer premier 5.0软件评估引物和探针环状发卡结构等情况(表 1)。
4. 标准品的制备及标准曲线绘制: 委托生工生物工程(上海)股份有限公司将目的基因序列插入PUC57载体构建重组阳性质粒,将该质粒作为标准DNA模板,进行qPCR方法灵敏度、特异性和重复性的验证。标准DNA模板拷贝数的计算公式:质粒拷贝数(拷贝数/μl)=质粒样品浓度(ng/μl)×10-9×6.023×1023/(660×碱基数),其中660是每个碱基的平均相对分子质量,6.023×1023为阿伏伽德罗常数。得出阳性质粒的浓度,并将其稀释至1×108拷贝数/μl,以此作为初始模板,进行10倍梯度稀释,将上述模板进行qPCR扩增反应,根据所得的Ct值与对应的标准质粒浓度,绘制标准曲线,计算决定系数(R2)、扩增效率。扩增效率=10(-1/s)-1,其中s为标准曲线线性方程的斜率。
5. 反应体系和反应程序的优化: 按照试剂Premix Ex TaqTM(Probe qPCR)所推荐的引物终浓度进行实验,实验采用10倍系列稀释标准品,每个稀释度平行3个复孔,评估灵敏度、扩增效率及R2等指标。使用梯度法对退火温度进行优化,选择56~61 ℃,6个梯度,每个温度梯度重复3次。选择最优退火温度时,应尽量满足Ct值靠前且荧光强度较强,同样的Ct值选择较高的退火温度,以避免引物二聚体和非特异性扩增。综合对比7种病原菌的最优退火温度,确定统一的退火温度。根据实验结果确定对7种病原菌的扩增效果均较优的反应体系及退火温度。
6. 灵敏度分析: 10倍梯度稀释标准品,7个连续稀释度,拷贝数分别为1×10~1×107拷贝数/μl,将其分别加到反应体系中作为qPCR反应的模板,每个稀释度平行设置3个复孔。收集并分析每个稀释度的实验结果并建立标准曲线,获得标本可检出的最低稀释度。同时使用M13通用引物对不同稀释度(1×10~1×107拷贝数/μl)样品进行普通PCR扩增,反应体系:Premix Taq酶15 μl,正反向引物(10 μmol/L)各1 μl,模板2 μl,双蒸水(ddH2O)补足至30 μl,反应程序:94 ℃预变性5 min;94 ℃变性45 s,50 ℃退火45 s,72 ℃延伸50 s,35个循环;72 ℃延伸10 min,扩增后的PCR产物进行琼脂糖凝胶电泳,比较qPCR方法与普通PCR方法的灵敏度。
7. 特异性分析: 为验证本实验中每种病原菌的特异性,分别以目标病原菌、非目标立克次体目病原菌及其他细菌的DNA为模板,设置ddH2O阴性对照,验证方法的特异性。
8. 重复性分析: ① 批内重复:分别以1×102、1×103、1×104、1×105和1×106拷贝数/μl为模板,在同一反应条件下,每个模板做3个重复孔,进行重复性试验,计算变异系数;②批间重复:以上述5个不同浓度的标准品,在不同时间重复检测3次,计算变异系数。
9. 样本的检测:
(1)模拟样本的检测:从qPCR方法检测7种病原菌均为阴性的24名健康人血样中提取DNA各9 μl,分别加入7种病原菌(普氏立克次体、莫氏立克次体、恙虫病东方体、日本立克次体、查菲埃立克体、嗜吞噬细胞无形体和贝氏柯克斯体)提取的DNA各1 μl,同时在6名健康人血样提取的DNA各9 μl中分别加入1 μl ddH2O。以ddH2O为阴性对照,以1×105拷贝数/μl目标病原菌的标准品为阳性对照,评估模拟样品的检出率。
(2)蜱虫样本及临床血标本检测:①蜱虫样本:96只游离蜱(长角血蜱76只,微小扇头蜱20只)来源于2021-2022年安徽省六安市金寨县。经无水乙醇和ddH2O清洗后,在1.5 ml的离心管加入200 μl磷酸盐缓冲液进行震荡研磨,按照QIAamp DNA Mini Kit试剂盒说明书方法进行核酸提取。采用qPCR方法检测蜱虫7种病原菌携带情况。②临床血标本:2021年安徽省和贵州省定点医院收集的不明原因发热患者DNA样本80份。采用qPCR方法检测患者的7种病原菌。③采用巢式PCR验证qPCR阳性结果。引物参考文献[16-19]。第一轮扩增反应体系:Premix Taq酶15 μl,正反向引物(10 μmol/L)各1 μl,模板2 μl,ddH2O补足至30 μl,反应程序:94 ℃预变性5 min;94 ℃变性45 s,55 ℃退火45 s,72 ℃延伸60 s,35个循环;72 ℃延伸10 min。第二轮扩增反应体系:Premix Taq酶15 μl,正反向引物(10 μmol/L)各1 μl,第一轮PCR产物2 μl,ddH2O补足至30 μl,PCR扩增产物取5 μl进行琼脂糖凝胶电泳,通过凝胶成像系统观察电泳结果,鉴定目的片段的大小。产物送北京天一辉远生物科技有限公司进行测序鉴定。使用美国国家生物技术信息中心的BLAST界面,将扩增序列与GenBank参考序列进行同源性比对。
结果1. 优化的反应体系及反应程序: 经优化后的反应体系:Primer Ex Taq(Probe qPCR)(2×)10 μl;正向引物(10 μmol/L)0.4 μl;反向引物(10 μmol/L)0.4 μl;探针(10 μmol/L)0.8 μl;DNA模板2 μl;ddH2O补足20 μl。经优化后的反应程序:95 ℃预变性30 s后,95 ℃变性5 s和59 ℃退火及延伸35 s(收集荧光信号),循环45次。
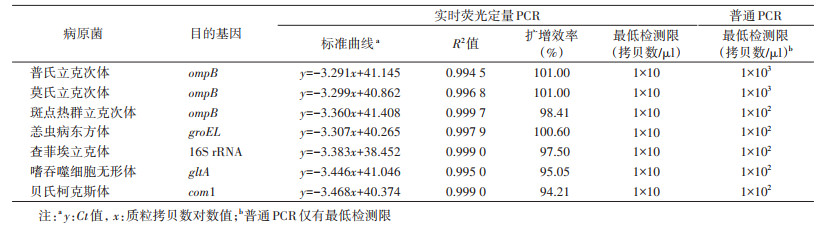
2. 标准曲线的建立及灵敏度分析: 从循环阈值(Ct值)与模板拷贝数建立的7种病原菌的标准曲线可以看出(表 2),Ct值与模板拷贝数之间呈现良好的线性关系(均R2 > 0.990 0),7种病原菌扩增效率在94.21%~101.00%之间,表明建立的qPCR具有较高的扩增效率,可以依据标准曲线公式和Ct值较准确地计算出样本中目的基因的拷贝数。以查菲埃立克体的扩增曲线和标准曲线为例,从扩增曲线可以看出,不同稀释度标准品对应Ct值距离基本相等,表明qPCR扩增稳定(图 1)。
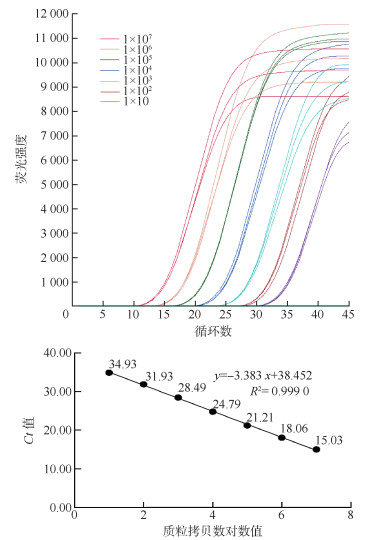
|
| 图 1 查菲埃立克体标准品扩增曲线和标准曲线 |
10倍梯度稀释标准品,以1×107拷贝数/μl为初始浓度的灵敏度试验结果显示,7种病原菌最低检测限均为1×10拷贝数/μl(表 2)。而在普通PCR中,普氏立克次体和莫氏立克次体的最低检测限为1×103拷贝数/μl,qPCR方法的灵敏度比普通PCR高100倍,其余5种病原菌的最低检测限为1×102拷贝数/μl,qPCR方法的灵敏度比普通PCR高10倍(表 2)。
3. 特异性分析: 实验结果显示7种目标病原菌有明显的阳性扩增信号,扩增结果为阳性,其他非目标立克次体目病原菌及其他细菌均未检出荧光信号,扩增结果为阴性,表明该方法中的引物和探针具有很高的特异性。
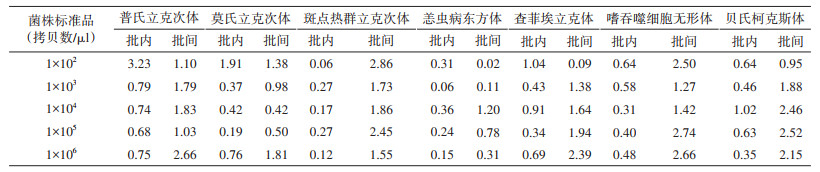
4. 重复性分析: 5份不同稀释浓度质粒标准品的批内和批间重复试验结果显示,不同稀释度下变异系数均≤3.23%,说明该方法具有良好的重复性(表 3)。
5. 样本检测:
(1)模拟样本检测:针对7种病原菌的模拟阳性样本的检测中,普氏立克次体、莫氏立克次体、恙虫病东方体、查菲埃立克体、嗜吞噬细胞无形体和贝氏柯克斯体模拟样品的检测结果均为阳性(100.0%,24/24),斑点热群立克次体的检测结果为95.8%(23/24)。针对7种病原菌的模拟阴性样本的检测中,检测结果均为阴性(100.0%,6/6)。
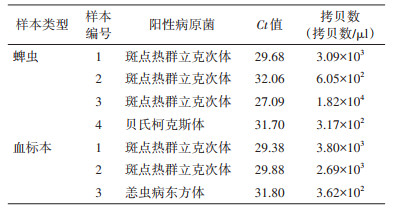
(2)实际样本检测:使用qPCR对96份蜱核酸进行检测,发现1份样本出现贝氏柯克斯体阳性扩增,3份样本出现斑点热群立克次体阳性扩增(图 2),并依据标准曲线公式和Ct值较准确地计算出样本中目的基因的拷贝数(表 4)。使用巢式PCR验证qPCR阳性结果,将巢式PCR扩增的1份贝氏柯克斯体groEL基因片段(560 bp)测序结果显示,与已知贝氏柯克斯体groEL基因同源性为99.82%。将巢式PCR扩增的3份斑点热群立克次体16S rRNA基因片段(1 024 bp)测序结果显示,3份样本测得的基因序列一致,与日本立克次体的同源性为100%。使用qPCR方法检测80份血标本DNA发现,1份样本出现恙虫病东方体阳性扩增,2份样本出现斑点热群立克次体阳性扩增。使用巢式PCR验证qPCR阳性结果。将巢式PCR扩增的1份恙虫病东方体TSA 56基因片段(411 bp)测序结果显示,与恙虫病东方体同源性为100%。将巢式PCR扩增的2份斑点热群立克次体ompA基因片段(467 bp)测序的结果显示,2份样本测得的基因序列一致,与日本立克次体的同源性为100%。
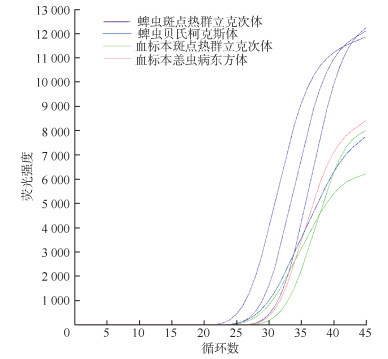
|
| 图 2 实时荧光定量PCR检测实际样本的阳性扩增结果 |
立克次体病是一类重要的急性发热性人兽共患自然疫源性疾病,随着社会的进步、器官移植的开展、免疫抑制药物的使用和全球气候变暖及旅游业的发展,立克次体病在很多国家和地区蔓延,近年来的发病率呈逐年上升趋势[20],已成为重要的公共卫生问题。立克次体病的诊断基于典型的临床症状和体征、全面的流行病学调查以及准确的实验室检测[21],但由于早期症状较轻且缺乏特异性,患者被虱、蚤、蜱和螨叮咬处出现焦痂样皮损的创面小、部位隐秘且无明显痛觉,容易被忽略,增加了流行病学调查的难度[22],因此实验室检测成为了确诊的依据。
现阶段,检测立克次体的方法多种多样,主要有病原学检测、血清学诊断以及分子生物学方法等,立克次体分离培养耗时较长、成本较高且对检测人员要求较高;血清学诊断特异性差,受限于患者血清抗体效价,不能满足早期诊断需要;普通PCR方法检测立克次体,其特异性和灵敏度均不高,改良的巢式PCR方法明显提高了检测灵敏度,但也存在假阳性率偏高问题[22],qPCR方法较好地解决这一问题,该技术融合了传统PCR的高灵敏度与高特异性、光谱技术的高灵敏度与精确定量的优点,直接探测PCR过程中荧光信号的变化获得定量的结果。近年来,随着各项技术的日益发展成熟,qPCR方法在立克次体病方面的应用越来越多,但由于所选择的目的基因、引物和探针不同,检测的灵敏度和特异性各有差异,因此,对于该类疾病系统的qPCR方法尚无统一的标准体系。本研究优化验证了立克次体目中7种重要病原菌,将7种病原菌反应体系及反应程序优化至同一方案,克服了目前不同病原菌采用不同的反应体系和反应程序的缺点,具有简便、高效和快捷的优势。相比于于永慧等[23]建立的qPCR方法,检测的病原菌较为广泛。本研究中7种病原菌的标准曲线具有良好的线性关系和扩增效率,检测的稳定性较好。本研究最低检测限均为1×10拷贝数/μl,相比于吴捷等[24]、Doyle等[25]和亚红祥和张丽娟[26]建立的qPCR方法,具有更好的灵敏度。与普通PCR方法相比,最低检测限较低、检测时间较短且被污染的概率较低。该方法能对目标病原菌特异性扩增,对非目标病原菌均无扩增,表明该方法特异性较好。重复性分析进行组内和组间重复实验,7种病原菌在不同稀释度下变异系数均≤3.23%,说明该方法有较好的重复性和结果的稳定可靠性。另外,本研究建立qPCR方法检测蜱虫样本和血标本携带病原体情况,采用巢式PCR方法验证qPCR检测结果为阳性的样本,测序结果均为所检测病原体,表明本研究建立的qPCR方法的准确性较高。
本研究存在局限性。收集发热患者的范围和样本量有限,为进一步评估qPCR方法,应收集较大规模的临床样本开展进一步研究。
综上所述,本研究建立的qPCR方法,具有良好的灵敏性、特异性及重复性,在临床应用及流行病学调查时,同步上机检测立克次体目7种重要病原菌,精确定位检测和明确感染病原菌的类型,减少延迟诊断的发生,提高对疑似患者的诊断或排除效率,为立克次体病的临床诊断和流行病学调查提供系统的检测方法。
利益冲突 所有作者声明无利益冲突
作者贡献声明 靳晓晶:查阅文献、设计实验、实验研究、论文撰写;滕中秋、徐佩星:数据整理;孙向荣、王文、覃新程:统计学分析、研究指导;秦天:研究指导、论文修改、经费支持
| [1] |
刘玮. 中国新发蜱媒病原体概况[J]. 传染病信息, 2017, 30(1): 11-14. Liu W. Emerging tick borne agents in China[J]. Infect Dis Inf, 2017, 30(1): 11-14. DOI:10.3969/j.issn.1007-8134.2017.01.005 |
| [2] |
Parola P, Raoult D. Ticks and tickborne bacterial diseases in humans: an emerging infectious threat[J]. Clin Infect Dis, 2001, 32(6): 897-928. DOI:10.1086/319347 |
| [3] |
于永慧, 王涛. 4种立克次体病的疫苗研究进展[J]. 国际检验医学杂志, 2016, 37(22): 3162-3164. Yu YH, Wang T. Progress in vaccine research of four Rickettsial diseases[J]. Int J Lab Med, 2016, 37(22): 3162-3164. DOI:10.3969/j.issn.1673-4130.2016.22.026 |
| [4] |
赵清, 逯军, 潘翔. 人感染立克次体致病研究现状[J]. 中国热带医学, 2020, 20(6): 583-588. Zhao Q, Lu J, Pan X. Research progress on the pathogenicity of human infection with Rickettsia[J]. China Trop Med, 2020, 20(6): 583-588. DOI:10.13604/j.cnki.46-1064/r.2020.06.21 |
| [5] |
Nilsson K, Wallménius K, Hartwig S, et al. Bell's palsy and sudden deafness associated with Rickettsia spp. infection in Sweden. A retrospective and prospective serological survey including PCR findings[J]. Eur J Neurol, 2014, 21(2): 206-214. DOI:10.1111/ene.12218 |
| [6] |
张文良, 甘海忠, 吴飞. 恙虫病临床特征及并发器官损伤的危险因素分析[J]. 热带医学杂志, 2020, 20(4): 550-553. Zhang WL, Gan HZ, Wu F. Epidemiological survey of tsutsugamushi disease and risk factors of organ injury in Danzhou city[J]. J Trop Med, 2020, 20(4): 550-553. DOI:10.3969/j.issn.1672-3619.2020.04.030 |
| [7] |
Mahajan SK. Rickettsial diseases[J]. J Assoc Physicians India, 2012, 60(3): 37-44. |
| [8] |
Rodríguez A, Rodríguez M, Córdoba JJ, et al. Design of primers and probes for quantitative real-time PCR methods[M]//Basu C. PCR primer design. New York: Humana Press, 2015: 31-56. DOI: 10.1007/978-1-4939-2365-6_3.
|
| [9] |
杨晓, 陈梅玲, 温博海, 等. 实时荧光定量PCR检测普氏立克次体[J]. 中华流行病学杂志, 2006, 27(11): 963-967. Yang X, Chen ML, Wen BH, et al. Detection of Rickettsia prowazekii by quantitative real-time PCR[J]. Chin J Epidemiol, 2006, 27(11): 963-967. DOI:10.3760/j.issn:0254-6450.2006.11.012 |
| [10] |
杨晓, 陈梅玲, 温博海, 等. 实时荧光定量PCR检测莫氏立克次体[J]. 解放军医学杂志, 2007, 32(10): 1054-1056. Yang X, Chen ML, Wen BH, et al. Detection of Rickettsii mooseri by real-time quantitative PCR[J]. Med J Chin People's Liberat Army, 2007, 32(10): 1054-1056. DOI:10.3321/j.issn:0577-7402.2007.10.016 |
| [11] |
牛东升, 杨晓, 陈梅玲, 等. 实时荧光定量PCR检测斑点热立克次体的方法建立[J]. 解放军医学杂志, 2008, 33(11): 1297-1299. Niu DS, Yang X, Chen ML, et al. Rapid detection of spotted fever group rickettsiae with real-time quantitative PCR[J]. Med J Chin People's Liberat Army, 2008, 33(11): 1297-1299. DOI:10.3321/j.issn:0577-7402.2008.11.006 |
| [12] |
谈忠鸣, 李志峰, 吴斌, 等. 基于GroEL基因的实时荧光定量PCR检测恙虫病东方体方法的建立及评价[J]. 中国人兽共患病学报, 2014, 30(11): 1121-1124. Tan ZM, Li ZF, Wu B, et al. Establishment and evaluation of real-time PCR assay for detection of Orientia tsutsugamushi based on the GroEL gene[J]. Chin J Zoonoses, 2014, 30(11): 1121-1124. DOI:10.3969/cjz.j.issn.1002-2694.2014.11.007 |
| [13] |
张晶波, 温博海, 陈梅玲, 等. 荧光定量PCR检测查菲埃立克体[J]. 寄生虫与医学昆虫学报, 2006, 13(4): 212-216. Zhang JB, Wen BH, Chen ML, et al. Development of a quantitative real-time polymerase chain reaction assay specific for Ehrlichiae chaffeensis[J]. Acta Parasitol Med Entomol Sin, 2006, 13(4): 212-216. DOI:10.3969/j.issn.1005-0507.2006.04.005 |
| [14] |
张晶波, 温博海, 陈梅玲, 等. 荧光定量PCR检测嗜吞噬细胞无形体[J]. 中国人兽共患病学报, 2006, 22(4): 289-293. Zhang JB, Wen BH, Chen ML, et al. Development of a quantitative real-time polymerase chain reaction assay specific for Anaplasma phagocytophila[J]. Chin J Zoonoses, 2006, 22(4): 289-293. DOI:10.3969/j.issn.1002-2694.2006.04.001 |
| [15] |
Lockhart MG, Graves SR, Banazis MJ, et al. A comparison of methods for extracting DNA from Coxiella burnetii as measured by a duplex qPCR assay[J]. Lett Appl Microbiol, 2011, 52(5): 514-520. DOI:10.1111/j.1472-765X.2011.03034.x |
| [16] |
卢志宇, 付梦姣, 熊进峰, 等. 湖北省东北部地区蜱携立克次体的调查[J]. 军事医学, 2021, 45(4): 262-266. Lu ZY, Fu MJ, Xiong JF, et al. Investigation of rickettsiae in ticks from the northeast of Hubei Province[J]. Mil Med Sci, 2021, 45(4): 262-266. DOI:10.7644/j.issn.1674-9960.2021.04.005 |
| [17] |
刁丹红, 王蒋丽, 郭文平, 等. 河北省野鼠立克次体感染调查[J]. 中国人兽共患病学报, 2022, 38(1): 84-88. Diao DH, Wang JL, Guo WP, et al. Investigation of Rickettsia infections in wild rodents in Hebei Province[J]. Chin J Zoonoses, 2022, 38(1): 84-88. DOI:10.3969/j.issn.1002-2694.2021.00.168 |
| [18] |
Bora T, Khan SA, Jampa L, et al. Genetic diversity of Orientia tsutsugamushi strains circulating in Northeast India[J]. Trans R Soc Trop Med Hyg, 2018, 112(1): 22-30. DOI:10.1093/trstmh/try019 |
| [19] |
Ishikura M, Ando S, Shinagawa Y, et al. Phylogenetic analysis of spotted fever group rickettsiae based on gltA, 17-kDa, and rOmpA genes amplified by nested PCR from ticks in Japan[J]. Microbiol Immunol, 2003, 47(11): 823-832. DOI:10.1111/j.1348-0421.2003.tb03448.x |
| [20] |
Wu XB, Na RH, Wei SS, et al. Distribution of tick-borne diseases in China[J]. Parasit Vectors, 2013, 6: 119. DOI:10.1186/1756-3305-6-119 |
| [21] |
Stephenson N, Blaney A, Clifford D, et al. Diversity of rickettsiae in a rural community in northern California[J]. Ticks Tick Borne Dis, 2017, 8(4): 526-531. DOI:10.1016/j.ttbdis.2017.02.014 |
| [22] |
张骁鹏, 李炘檑, 郑波, 等. 立克次体与立克次体病的检测与鉴定[J]. 微生物与感染, 2015, 10(3): 194-198. Zhang XP, Li XL, Zheng B, et al. Detection and identification of Rickettsia and rickettsial diseases[J]. J Microbes Infect, 2015, 10(3): 194-198. |
| [23] |
于永慧, 焦俊, 付梦姣, 等. 实时荧光定量PCR同时快速检测4类致病性立克次体?[J]. 寄生虫与医学昆虫学报, 2019, 26(2): 110-117. Yu YH, Jiao J, Fu MJ, et al. Simultaneous and rapid detection of four kinds of pathogenic rickettsia by quantitative real-time PCR[J]. Acta Parasitol Med Entomol Sin, 2019, 26(2): 110-117. DOI:10.3969/j.issn.1005-0507.2019.02.007 |
| [24] |
吴捷, 王少玲, 马焱, 等. 斑点热群立克次体实时荧光定量PCR检测方法的建立及应用[J]. 现代预防医学, 2015, 42(22): 4137-4139, 4146. DOI:CNKI:SUN:XDYF.0.2015-22-036. Wu J, Wang SL, Ma Y, et al. Establishment and application of real-time fluorescence quantitative PCR in spotted fever group rickettsiae detection[J]. Mod Prev Med, 2015, 42(22): 4137-4139, 4146. DOI:CNKI:SUN:XDYF.0.2015-22-036. |
| [25] |
Doyle CK, Labruna MB, Breitschwerdt EB, et al. Detection of medically important Ehrlichia by quantitative multicolor TaqMan real-time polymerase chain reaction of the dsb gene[J]. J Mol Diagn, 2005, 7(4): 504-510. DOI:10.1016/S1525-1578(10)60581-8 |
| [26] |
亚红祥, 张丽娟. 实时荧光定量PCR检测贝氏柯克斯体方法的建立[J]. 中国热带医学, 2011, 11(8): 916-917. Ya HX, Zhang LJ. Quantitative detection of Coxiella burneti by real-time PCR[J]. China Trop Med, 2011, 11(8): 916-917. DOI:10.13604/j.cnki.46-1064/r.2011.08.014 |
 2023, Vol. 44
2023, Vol. 44