文章信息
- 郑浩然, 王媛媛, 白璐璐, 钟佳鑫, 卢金星, 吴媛, 邓慧玲.
- Zheng Haoran, Wang Yuanyuan, Bai Lulu, Zhong Jiaxin, Lu Jinxing, Wu Yuan, Deng Huiling
- 不同来源产气荚膜梭菌β2毒素编码基因的PCR检测方法建立及遗传多态性分析
- Establishment of PCR assays and genetic polymorphism analysis of genes encoding Clostridium perfringens β2 toxin from different sources
- 中华流行病学杂志, 2023, 44(4): 636-642
- Chinese Journal of Epidemiology, 2023, 44(4): 636-642
- http://dx.doi.org/10.3760/cma.j.cn112338-20220819-00718
-
文章历史
收稿日期: 2022-08-19
2. 中国疾病预防控制中心传染病预防控制所, 北京 102206;
3. 西安市中心医院, 西安 710003
2. National Institute for Communicable Disease Control and Prevention, Chinese Center for Disease Control and Prevention, Beijing 102206, China;
3. Xi'an Central Hospital, Xi'an 710003, China
产气荚膜梭菌(Clostridium perfringens)是一种革兰染色阳性并且对外界环境具有较强抵抗能力的厌氧菌。广泛分布于自然界的土壤、水以及健康动物(包括人类)的胃肠道当中,能够利用自身产生的20余种毒素在人类和动物中引发气性坏疽、坏死性肠炎、食物中毒、抗生素相关性腹泻(AAD)等疾病[1]。
毒素分型方法是以产气荚膜梭菌菌株分类系统的基础,不同类型疾病与菌株的毒素型别息息相关,该方法于2018年被修订为7种类型即A~G型(此前为A~E型)[2]。除此之外,不同类型的菌株还可能携带一种或多种不参与分型的次要毒素,如产气荚膜梭菌溶素O/θ毒素、β2毒素等[3]。目前,参与分型的主要毒素在引发相关疾病的发病机制中已经得到充分的证明,但是大部分次要毒素(如β2毒素、唾液酸酶等)在致病过程中发挥的作用仍不清楚[3-4]。
产气荚膜梭菌β2毒素编码基因(cpb2)位于质粒,具有2种等位基因形式:共有cpb2(con-cpb2)和非典型cpb2(aty-cpb2)[5]。共有β2毒素蛋白和非典型β2毒素蛋白之间具有62.0%的氨基酸一致性和80.0%的相似性,非典型β2毒素蛋白之间的氨基酸一致性为96.2%~98.9%,相似性为97.0%~99.2%[6]。该毒素自从仔猪分离的产气荚膜梭菌菌株中发现以来,许多研究认为con-cpb2常见于猪的分离物中,aty-cpb2则更常见于产气荚膜梭菌的非猪分离物中[6-7]。最近的研究显示,儿童自闭症可能与产气荚膜梭菌β2毒素有关,但由于目前尚不清楚该毒素在菌株致病过程中发挥的作用,其病因学意义仍不清楚[8-9]。
为了解和探究我国产气荚膜梭菌β2毒素的遗传多态性及其与主要分型毒素、宿主之间的关系,本研究对2016-2021年从中国9个地区收集的产气荚膜梭菌共188株进行cpb2的筛查,通过建立及优化的PCR方法分别鉴定cpb2和aty-cpb2,结合二代测序技术,分别就地理来源、宿主来源同毒素型别与cpb2之间的关系对菌株进行分析,并探究我国β2毒素的遗传基因多态性,为我国针对产气荚膜梭菌的防控工作提供参考依据。
材料与方法1. 菌株来源:2016-2021年,本课题组在AAD的日常监测工作中分离得到188株产气荚膜梭菌。其中,62份粪便样本来自AAD患者,86份粪便样本来自健康人群,14份样本来自被产气荚膜梭菌污染的食物,其余26份样本分别来自于羊、牛、猪的粪便。
2. 菌株分离纯化鉴定:将疑似被产气荚膜梭菌污染的食品、动物粪便及人类粪便样本用浓度95%的乙醇休克处理后在72 h内送至本实验室。样本在5%羊血琼脂板上37 ℃厌氧培养24 h,挑选出疑似为产气荚膜梭菌的菌落(圆形、扁平、半透明、边缘整齐,在血平板上有双层溶血环)。通过16S rDNA序列测序的方法对这些细菌进行种属鉴定,在美国国立生物技术信息中心(NCBI)网站进行比对,以确定是否为产气荚膜梭菌,将鉴定后的菌株保存在-80 ℃冰箱中。
3. 菌株基因组DNA的提取:取10 μl产气荚膜梭菌菌株接种至5%~8%羊血琼脂板,37 ℃厌氧培养24 h,将纯化培养后的菌落悬浮在1.0 ml的蒸馏水中,12 000 r/min离心2 min后弃去悬液,使用细菌基因组提取试剂盒(天根生物科技公司),按说明书步骤进行核酸提取。
4. 引物设计与毒素基因的检测:使用Oligo 7.6软件设计引物,并在Primer-Blast网站上验证引物的特异性。采用PCR方法对cpb2进行检测,扩增反应体系为25.0 μl,模板DNA 2.0 μl,正、反向引物各1.0 μl,水8.5 μl,Taq Premix(TaKaRa,日本)12.5 μl。扩增的特异性片段使用1.5%的琼脂糖凝胶电泳法进行结果分析,每次实验均设置阴性对照。
5. 全基因组测序:根据Illumia公司提供的标准执行,使用细菌全基因组提取试剂(Promega,美国)对核酸进行提取,使用NanoDrop 2000分光光度计(Thermo,美国)测定核酸浓度,使用5400 Fragment Analyzer System(Agilent,美国)评价核酸质量和序列完整性。使用Illumina Nova技术对188株产气荚膜梭菌进行测序,提取获得cpb2的核苷酸序列。
6. β2毒素基因的遗传分析:使用Mega 11软件的最大似然法构建cpb2的系统发育树,Bootstrap设置1 000次。cpb2系统发育树中L77965等参考序列选自DNA序列数据库(GenBank)。使用Makeblastdb软件将110株菌株(107株实验室菌株所携带的cpb2序列+3条来自GenBank的cpb2序列)所携带的cpb2进行建库,使用Blastn算法进行比对,E值设置为1.0 e-2,从而得出con-cpb2和aty-cpb2之间的相似性。
7. 统计学分析:采用SPSS 19.0软件进行统计学分析,使用配对设计的χ2检验比较PCR方法与全基因组测序检测到的cpb2的结果是否存在差异,以P < 0.05为差异有统计学意义。引入一致性检验作为评价判断一致性程度的指标,0.81≤Kappa≤1.00且P < 0.05说明两种方法具有高度的一致性。
结果1. 引物设计:本研究设计了一对引物(引物1)对cpb2进行检测,并对Jost等[7]在检测aty-cpb2时所使用的引物(引物2)进行了改进(表 1)。两对引物的设计及改进原则见图 1。
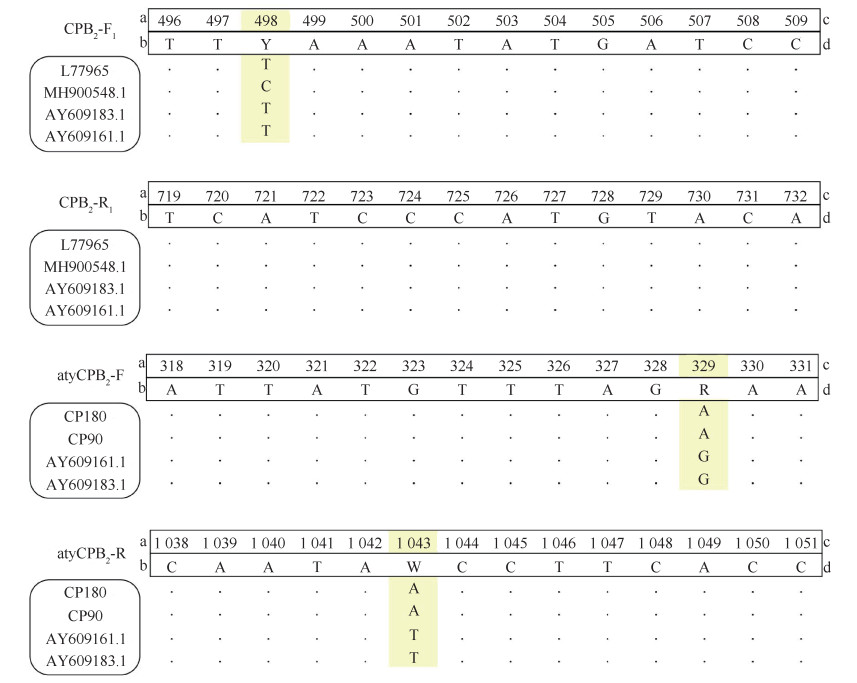
|
| 注:a引物;b目的基因(L77965、MH900548.1为con-cpb2序列,AY609183.1、AY609161.1为aty-cpb2序列,来自GenBank;CP180、CP90为aty-cpb2的序列,来自本实验室);c目的基因核苷酸序列位点;d引物序列方向为目的基因序列方向的5'~3' 图 1 两种引物兼并碱基的设计及改进原则 |
2. 特异性验证及一致性评价:基于引物1的PCR方法使用艰难梭菌、肉毒梭菌和水作为阴性对照,基于引物2的PCR方法使用艰难梭菌、肉毒梭菌、携带con-cpb2的产气荚膜梭菌菌株以及水作为阴性对照,两对引物的阴性对照中均不存在扩增反应,证实了两对引物的特异性。配对设计χ2检验及一致性检验显示,使用引物1的PCR方法对cpb2的检测结果与全基因组测序方法对cpb2的检测结果无差异且两种方法的检测结果高度一致(χ²=0.80,P=0.375;Kappa=0.946,P < 0.001)。见表 2。
3. β2毒素分型及测序鉴定:全基因组的测序结果显示,共有106株携带cpb2的产气荚膜梭菌菌株,其中携带con-cpb2的菌株共6株,携带aty-cpb2的菌株共100株。基于引物1的PCR检测方法筛选出103株携带cpb2的菌株,基于引物2的PCR检测方法筛选出101株携带aty-cpb2的菌株。对两种PCR结果为阳性而全基因组结果显示为阴性的扩增产物进行测序,将该序列在GenBank上进行BLAST序列比对,最终鉴定该菌株所携带的cpb2为aty-cpb2。
4. 不同地理来源、毒素型别和cpb2之间的流行特征分析:收集到的菌株中大多数来自山东省(84/188,44.7%),然后依次为河北省(47/188,25.0%)、云南省(16/188,8.5%)、广西壮族自治区(14/188,7.4%)、浙江省(11/188,5.8%)、北京市(6/188,3.2%)、陕西省(6/188,3.2%)以及湖南省(2/188,1.1%)和四川省(2/188,1.1%)。见表 3。cpb2在各地区之间的流行情况虽然差异无统计学意义,但aty-cpb2和con-cpb2两种等位基因在山东省、云南省出现的相对频率分别为65.5%(55/84)、18.8%(3/16),而其他地区则分别为44.2%(46/104)、1.7%(3/172)。
虽然来自各地的菌株数量不尽相同,但是大多数菌株为A型(174/188,92.6%)。唯一的D型来自河北省,唯一的E型来自山东省,二者均未携带β2毒素,其余皆为F型菌株(12/188,6.4%)。aty-cpb2是编码β2毒素的主要基因型,在A型菌株中被检测发现,在7株携带β2毒素的F型菌株中均被检测发现,而con-cpb2仅在6株A型菌株中检测发现。见表 3。
5. 不同宿主来源、毒素型别和cpb2之间的流行特征:在188株菌株中,A型普遍存在于不同种类的分离物中,携带cpb2的情况并不相同。唯一的D型来自人类,唯一的E型来自羊,二者均不含cpb2。12株F型菌株中,11株来自人类,1株来自食物,所携带的cpb2均为aty-cpb2。
共有148株产气荚膜梭菌菌株来自人类,这些菌株分别为A型(136/148,92.0%)、D型(1/148,0.6%)、F型(11/148,7.4%)。cpb2主要以aty-cpb2形式存在于A型菌株当中(72/148,48.7%),以con-cpb2形式存在于A型菌株的β2毒素仅为3.4%(5/148),其余皆为未携带β2毒素的A型菌株(59/148,39.9%)。F型菌株中检测到含有β2毒素的菌株所携带的编码基因均为aty-cpb2(6/11,54.6%),其余全部为未携带β2毒素的F型菌株(5/11,45.4%)。
从14株食物来源分离出的菌株中,大多数菌株为A型且携带编码基因为aty-cpb2的β2毒素(10/14,71.4%),仅1株为F型菌株携带β2毒素且编码基因为aty-cpb2。
从26株动物来源分离出的菌株中,毒素型别分别为A型(25/26,96.2%)、E型(1/26,3.8%)。2株分离自牛的菌株均携带β2毒素且编码基因均为aty-cpb2。分离自羊的菌株共23株,检测到携带β2毒素的有10株,均为A型且编码基因均为aty-cpb2(10/23,43.5%),其余菌株均未携带β2毒素(12/23,52.2%)。仅1株菌株分离自猪,该菌株携带β2毒素且编码基因为con-cpb2。见表 4。
6. β2毒素基因的遗传多态性:以con-cpb2的原型(L77965)及aty-cpb2原型(AY609183、AY609161)作为参照,在cpb2的系统发育树中鉴定了两个谱系(第1组和第2组)。第1组包含本研究101株菌株携带的aty-cpb2核苷酸序列和19株来自GenBank的aty-cpb2核苷酸序列,第2组包含本研究6株菌株携带的con-cpb2核苷酸序列和13株来自GenBank的con-cpb2核苷酸序列。本研究的cpb2核苷酸序列中,第1组和第2组之间的cpb2序列相似性为68.97%~70.97%,第1组组内的cpb2序列相似性均 > 98.00%,与AY609183、AY609161的相似性分别为97.99%~100.00%、97.24%~99.87%;第2组组内的cpb2序列相似性为100.00%,与L77965的相似性为90.85%。通常,对产气荚膜梭菌β2毒素进行遗传多态性分析时,引入产气荚膜梭菌β毒素核苷酸序列作为外群。见图 2。
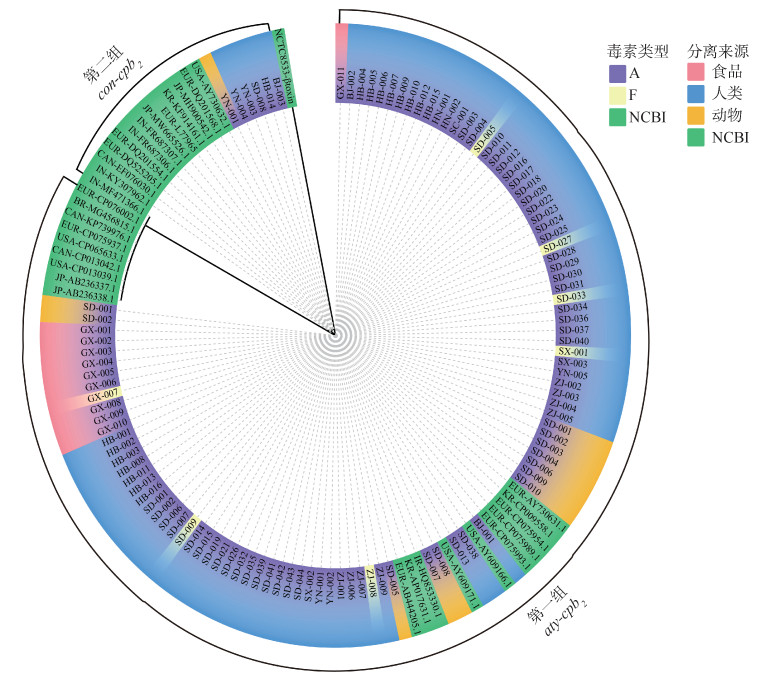
|
| 注:cpb2:产气荚膜梭菌β2毒素编码基因;aty-cpb2:非典型cpb2;con-cpb2:共有cpb2;NCBI:美国国立生物技术信息中心;BJ、GX、HB、HN、SD、SX、SC、YN、ZJ分别表示菌株分离地为北京、广西、河北、湖南、山东、陕西、四川、云南、浙江地区,编号代表实验室菌株编号;EUR、USA、JP、KR、IN、CAN、BR、IR分别表示菌株来源地为欧洲地区、美国、日本、韩国、印度、加拿大、巴西、伊朗,编号为菌株来源地-GenBank ID;菌株NCTC8533(GenBank ID:KP064408)所携带的β毒素基因为外群 图 2 cpb2系统发育树状图 |
目前研究尚无法确定β2毒素在发病机制中的真正作用,早期研究认为携带β2毒素的产气荚膜梭菌比未携带该毒素的菌株更容易导致易感宿主发生更明显的坏死性肠道病变,但是这项研究中并未使用携带相同β2毒素编码基因的菌株,并且除β2毒素以外的混杂因素也可能会影响病变的严重程度[7, 10]。除在自闭症患儿的粪便中发现了该毒素的存在外,β2毒素可能也在早产儿坏死性小肠结肠炎的发病过程中发挥一定作用[11]。由于缺乏特异性试剂(如针对β2毒素蛋白的单克隆抗体)和/或可用的高度纯化抗原,β2毒素在分子水平上的作用机制仍然未知[12],国内外学者正在开发一种有效的特定试剂以了解β2毒素真正的生物学功能以及在致病过程中发挥的真正作用[6, 13]。本研究发现,在检测过程中使用扩增体系、程序与既往研究一致的情况下,检测效果较差。因此,本研究建立了一种全新cpb2的PCR检测方法并对先前检测aty-cpb2的PCR方法进行了改进,并对两种PCR方法进行了特异性验证,结果显示,该方法消除了之前检测aty-cpb2时产生非特异性扩增条带影响结果判断的劣势。
本研究中提供了有关中国存在的不同产气荚膜梭菌毒素型别中cpb2在不同地区、不同宿主之间的分布情况。遗传多态性分析表明,cpb2的不同基因型之间核苷酸序列差异大。本研究在对携带β2毒素的菌株在毒素分型的基础上进行遗传分组并引入原型相关组,更好地确定了该毒素编码基因的不同基因型在我国不同物种和不同地区间的流行情况。
值得注意的是,β2毒素被认为是可以广泛地存在于各种毒素型别产气荚膜梭菌中的一种次要毒素[3, 14]。但在我国中部地区一家医院进行的临床腹泻患者粪便产气荚膜梭菌的调查显示,β2毒素的检出率仅为3.3%[15],类似的研究在日本也得到了相似的结果,β2毒素的检出率为1.4%[16]。但由于本研究存在样本来源分散、时间跨度大且缺少宿主的健康状况的局限,无法分析造成检出率出现差异的原因,也无法分析不同编码基因的β2毒素在产气荚膜梭菌引发疾病中发挥的真正作用。
本研究结果可用于监测系统,为该领域的相关学者提供有关数据以更好地控制携带β2毒素的产气荚膜梭菌菌株所带来的危害,有助于在全国范围建立监测系统,了解由产气荚膜梭菌不同毒素型别的菌株在我国引发人类和动物相关疾病及可能存在的某些联系。
利益冲突 所有作者声明无利益冲突
作者贡献声明 郑浩然:查阅文献、实验操作、采集/整理/分析解释数据、论文撰写;王媛媛:数据整理、实验操作;白璐璐:采集/分析解释数据;钟佳鑫:实验操作;卢金星:论文指导/审核;吴媛:研究设计、论文指导/修改、经费支持、论文审核;邓慧玲:论文指导/修改/审核
| [1] |
Revitt-Mills SA, Rood JI, Adams V, et al. Clostridium perfringens extracellular toxins and enzymes: 20 and counting[J]. Microbiol Austr, 2015, 36(3): 114-117. DOI:10.1071/MA15039 |
| [2] |
Rood JI, Adams V, Lacey J, et al. Expansion of the Clostridium perfringens toxin-based typing scheme[J]. Anaerobe, 2018, 53: 5-10. DOI:10.1016/j.anaerobe.2018.04.011 |
| [3] |
Gohari IM, Navarro MA, Li JH, et al. Pathogenicity and virulence of Clostridium perfringens[J]. Virulence, 2021, 12(1): 723-753. DOI:10.1080/21505594.2021.1886777 |
| [4] |
Chiarezza M, Lyras D, Pidot SJ, et al. The NanI and NanJ sialidases of Clostridium perfringens are not essential for virulence[J]. Infect Immun, 2009, 77(10): 4421-4428. DOI:10.1128/iai.00548-09 |
| [5] |
Gibert M, Jolivet-Renaud C, Popoff MR. Beta2 toxin, a novel toxin produced by Clostridium perfringens[J]. Gene, 1997, 203(1): 65-73. DOI:10.1016/s0378-1119(97)00493-9 |
| [6] |
Serroni A, Magistrali CF, Pezzotti G, et al. Expression of deleted, atoxic atypical recombinant beta2 toxin in a baculovirus system and production of polyclonal and monoclonal antibodies[J]. Microb Cell Factor, 2017, 16(1): 94. DOI:10.1186/s12934-017-0707-8 |
| [7] |
Jost BH, Billington SJ, Trinh HT, et al. Atypical cpb2 genes, encoding beta2-toxin in Clostridium perfringens isolates of nonporcine origin[J]. Infect Immun, 2005, 73(1): 652-656. DOI:10.1128/IAI.73.1.652-656.2005 |
| [8] |
Góra B, Gofron Z, Grosiak M, et al. Toxin profile of fecal Clostridium perfringens strains isolated from children with autism spectrum disorders[J]. Anaerobe, 2018, 51: 73-77. DOI:10.1016/j.anaerobe.2018.03.005 |
| [9] |
Finegold SM, Summanen PH, Downes J, et al. Detection of Clostridium perfringens toxin genes in the gut microbiota of autistic children[J]. Anaerobe, 2017, 45: 133-137. DOI:10.1016/j.anaerobe.2017.02.008 |
| [10] |
Manteca C, Daube G, Jauniaux T, et al. A role for the Clostridium perfringens β2 toxin in bovine enterotoxaemia?[J]. Vet Microbiol, 2002, 86(3): 191-202. DOI:10.1016/s0378-1135(02)00008-1 |
| [11] |
Sim K, Shaw AG, Randell P, et al. Dysbiosis anticipating necrotizing enterocolitis in very premature infants[J]. Clin Infect Dis, 2015, 60(3): 389-397. DOI:10.1093/cid/ciu822 |
| [12] |
Forti K, Ferroni L, Pellegrini M, et al. Molecular characterization of Clostridium perfringens strains isolated in Italy[J]. Toxins (Basel), 2020, 12(10): 650. DOI:10.3390/toxins12100650 |
| [13] |
Zeng J, Song FY, Yang Y, et al. The generation and characterization of Clostridium perfringens recombinant protein and antibodies of Beta2 toxin[J]. J Immunol Res, 2016, 2016: 5708468. DOI:10.1155/2016/5708468 |
| [14] |
Li JH, Adams V, Bannam TL, et al. Toxin plasmids of Clostridium perfringens[J]. Microbiol Mol Biol Rev, 2013, 77(2): 208-233. DOI:10.1128/mmbr.00062-12 |
| [15] |
Wang BY, Dong WJ, Ma LY, et al. Prevalence and genetic diversity of Clostridium perfringens isolates in hospitalized diarrheal patients from central China[J]. Infect Drug Resist, 2021, 14: 4783-4793. DOI:10.2147/idr.S338593 |
| [16] |
Matsuda A, Aung MS, Urushibara N, et al. Prevalence and genetic diversity of toxin genes in clinical isolates of Clostridium perfringens: coexistence of alpha-toxin variant and binary enterotoxin genes (bec/cpile)[J]. Toxins (Basel), 2019, 11(6): 326. DOI:10.3390/toxins11060326 |
 2023, Vol. 44
2023, Vol. 44






