文章信息
- 张笑, 张梅, 李纯, 黄正京, 于梦婷, 王丽敏.
- Zhang Xiao, Zhang Mei, Li Chun, Huang Zhengjing, Yu Mengting, Wang Limin
- 我国不同海拔水平下糖化血红蛋白与血糖指标的关联研究
- Associations between glycated hemoglobin and glucose indicators in adults in areas at different altitude in China
- 中华流行病学杂志, 2023, 44(3): 401-407
- Chinese Journal of Epidemiology, 2023, 44(3): 401-407
- http://dx.doi.org/10.3760/cma.j.cn112338-20220814-00710
-
文章历史
收稿日期: 2022-08-14
近些年随着饮食模式和生活习惯的转变,我国糖尿病患病人数呈逐渐上升的趋势。根据最新慢性病及危险因素监测的结果,我国成年人糖尿病患病率已从2013年的10.9%增长到2018年的12.4%[1]。2019年全球疾病负担估计我国糖尿病相关伤残调整寿命年率高达696/10万[2]。鉴于糖尿病从发生至出现明显临床症状需经过较长时间,早期诊断对于改善糖尿病治疗效果和预防心血管并发症至关重要。在临床实践中,通常用FPG和服糖后2 h血糖(OGTT-2 h)诊断糖尿病。相比于这两个指标,糖化血红蛋白(HbA1c)测量前不需要保持空腹且简便易行,常被用来反映过去2~3个月血糖的平均水平。早在2010年,美国糖尿病协会就修订了诊断标准,添加HbA1c≥6.5%以辅助糖尿病诊断[3]。随着HbA1c检测标准化的推进,2020版中国2型糖尿病防治指南也正式将HbA1c纳入到糖尿病诊断标准中[4]。但实际上除了检测方法,HbA1c水平还可能受到自然环境的影响[5]。
高海拔是以空气中氧气含量降低为特征的极端环境。随着海拔升高,机体会代偿性提升血红蛋白浓度以运输更多氧气。先前有小样本研究提示高海拔地区居民HbA1c水平高于低海拔地区居民[6]。此外,高海拔可能会影响体内血糖稳态的调控机制[7]。中国糖化血红蛋白教育计划指出,高海拔地区HbA1c可能无法很好地反映血糖水平,检测结果解释需谨慎[8]。尽管如此,很少有研究在全国层面探讨不同海拔水平下HbA1c与血糖指标的关联。本研究拟利用2018-2019年全国慢性病及危险因素监测数据,分析不同海拔地区HbA1c与FPG和OGTT-2 h的关联是否存在差异,并比较相应环境下HbA1c对糖尿病的诊断能力。
对象与方法1. 研究对象:研究人群来自2018-2019年慢性病及危险因素监测,监测采用多阶段分层整群抽样的方法,具体的抽样方法和纳入排除标准见文献[9]。监测通过了中国CDC慢性非传染性疾病预防控制中心伦理委员会审查(审批号:201819),调查对象均签署了知情同意书。最终完成调查184 876人,应答率为94.9%。排除调查前已被医疗机构诊断为糖尿病的13 433人,排除HbA1c和血糖指标缺失12 073人,排除协变量缺失2 093人,最终纳入157 277人。
2. 调查方法:采用面对面询问的方式进行调查,问卷内容包括社会人口学特征、吸烟、饮酒、身体活动、常见慢性病诊断治疗情况。用TGZ型身高坐高计测量身高,用TC200K型电子体重秤测量体重。采集所有调查对象空腹静脉血。无糖尿病病史调查对象口服75 g无水葡萄糖,于2 h后再次采集静脉血。用己糖激酶法测定血浆FPG和OGTT-2 h,用高效液相色谱法测定HbA1c。用Hemocue Hb201+型血红蛋白便携式分析仪测定全血血红蛋白。用胆固醇氧化酶氨基安替吡啉酚法测定血清TC。用磷酸甘油氧化酶4-氯酸法测定血清TG。生化指标均由罗氏Cobas8000型全自动生化免疫分析仪在收到样本后7 d内完成检测。
3. 指标定义:①海拔:县/区级CDC通过查阅资料上传各自的海拔高度至监测信息收集与管理平台。国家工作组从中随机抽取10%进行复核,结果显示两批数值的组内相关系数为0.958。根据我国地势三级阶梯的划分(第一阶梯海拔 > 2 000 m,第二阶梯海拔在1 000~2 000 m,第三阶梯海拔 < 1 000 m)及以往研究已在海拔≥3 000 m的地区观察到HbA1c与血糖指标关联发生改变[10],本研究将县/区分为海拔 < 2 000、2 000~、≥3 000 m三组。②糖尿病:FPG≥7.0 mmol/L或OGTT-2 h≥11.1 mmol/L[4]。③糖尿病前期(mmol/L):6.1≤FPG < 7.0且0 < OGTT-2 h < 11.1或0 < FPG < 6.1且7.8≤OGTT-2 h < 11.1[4]。④现在吸烟:调查时仍在吸烟,包括每日吸烟和非每日吸烟。⑤现在饮酒:过去12个月内喝过酒。⑥身体活动不足:每周中等强度体力活动时长 < 150 min[11]。⑦BMI:体重(kg)/身高(m)2。
4. 统计学分析:用x±s和方差分析描述和比较年龄、BMI、血红蛋白在不同组的情况。用M(Q1,Q3)和Kruskal-Wallis秩和检验描述和比较FPG、OGTT-2 h、HbA1c、TC、TG在不同组的情况。用例数(百分比)和χ2检验描述和比较分类变量在不同组的情况。考虑到HbA1c与血糖指标的关联可能受到不同浓度范围的影响[12],分别在HbA1c处于正常范围(< 5.7%)和超出正常范围(≥5.7%)时用多因素线性回归分析其与血糖指标间的关联,回归模型校正年龄、性别、文化程度、城乡、现在吸烟、现在饮酒、身体活动不足、BMI、TC、TG、血红蛋白。血糖指标纳入回归前,先进行自然对数转换以改善正态性和减少极端值的影响。用三明治法计算整群稳健的标准误。用Cochran's Q检验评价不同海拔地区间关联的差异。用限制性立方样条拟合HbA1c与血糖指标的关系曲线,样条的节点数由赤池信息准则确定。用曲线下面积判断HbA1c对糖尿病和糖尿病前期的诊断能力,用Delong检验比较不同海拔下曲线下面积的差异。用约登指数(灵敏度+特异度-1)确定HbA1c诊断糖尿病的最佳切点。统计学分析均采用R 3.6.0软件,以双侧P < 0.05为差异有统计学意义。
结果1. 基本情况:共纳入信息完整的研究对象157 277人,其中男性69 665人(44.3%),年龄为(54.4±13.8)岁。与纳入人群相比,未纳入人群男性比例更高但身体活动不足比例更低。按海拔高低分组后,高海拔地区研究对象较低海拔地区男性比例、身体活动不足率更高,年龄、文化程度、居住在城市比例、现在吸烟率、TC更低。见表 1。
2. 血糖和HbA1c水平:随着海拔升高,研究对象FPG和OGTT-2 h水平逐渐降低。具体来说,海拔 < 2 000 m地区FPG和OGTT-2 h的中位数分别为5.5和6.3 mmol/L,而海拔≥3 000 m地区FPG和OGTT-2 h的中位数分别为4.8和5.1 mmol/L。相应地,海拔 < 2 000 m地区研究对象糖尿病和糖尿病前期患病率分别为9.5%和24.8%,而海拔≥3 000 m地区糖尿病和糖尿病前期患病率分别为3.1%和9.7%。虽然海拔2 000~和≥3 000 m地区研究对象血红蛋白水平高于 < 2 000 m地区,但HbA1c水平在三组间差异不大。见表 1。
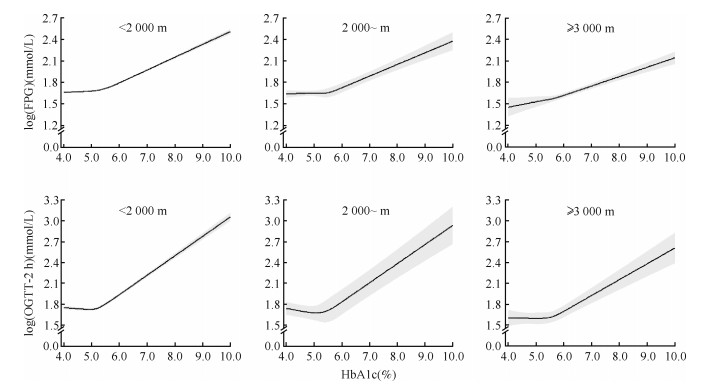
3. 不同海拔下HbA1c与血糖指标的关联:当HbA1c < 5.7%时,HbA1c与FPG和OGTT-2 h的关联在不同海拔地区间差异不大。校正混杂因素后,HbA1c每上升一个标准差,海拔 < 2 000、2 000~、≥3 000 m地区FPG分别升高1.62%(95%CI:1.37%~1.86%)、0.61%(95%CI:-1.30%~2.57%)、2.16%(95%CI:0.40%~3.95%)(P=0.501),OGTT-2 h分别升高1.98%(95%CI:1.57%~2.39%)、0.34%(95%CI:-2.50%~3.26%)、0.33%(95%CI:-1.83%~2.53%)(P=0.200)。但当HbA1c≥5.7%时,HbA1c与FPG和OGTT-2 h的关联较HbA1c < 5.7%时更强,且与FPG的关联在不同海拔地区间存在差异。校正混杂因素后,HbA1c每上升一个标准差,海拔 < 2 000 m地区FPG升高15.45%(95%CI:14.71%~16.18%),而海拔2 000~和≥3 000 m地区FPG分别升高13.08%(95%CI:10.46%~15.76%)和11.41%(95%CI:9.32%~13.53%)(P=0.001)。类似地,HbA1c每上升一个标准差,海拔 < 2 000 m地区OGTT-2 h升高24.54%(95%CI:23.18%~25.91%),而海拔2 000~和≥3 000 m地区OGTT-2 h分别升高21.72%(95%CI:16.39%~27.31%)和20.03%(95%CI:15.38%~24.86%)(P=0.146)。见表 2。限制性立方样条进一步证实了回归的结果。当HbA1c < 5.7%时,HbA1c与FPG和OGTT-2 h关联的形状整体较为平坦。需要注意的是,海拔 < 2 000和2 000~m地区FPG和OGTT-2 h开始升高对应HbA1c的浓度要高于海拔≥3 000 m地区。当HbA1c≥5.7%时,FPG和OGTT-2 h随着HbA1c升高而逐渐升高,且海拔 < 2 000 m地区较海拔2 000~和≥3 000 m地区升高得更为陡峭。相应地,海拔 < 2 000、2 000~、≥3 000 m地区FPG为7.0 mmol/L时对应的HbA1c浓度分别为6.8%、7.3%、8.5%,OGTT-2 h为11.1 mmol/L时对应的HbA1c浓度分别为7.7%、8.1%、9.1%。见图 1。
|
| 注:OGTT-2 h:服糖后2 h血糖;HbA1c:糖化血红蛋白;校正年龄、性别、文化程度、城乡、现在吸烟、现在饮酒、身体活动不足、BMI、TC、TG、血红蛋白 图 1 不同海拔地区HbA1c对FPG和OGTT-2 h的限制性立方样条 |
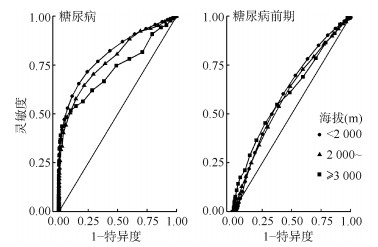
4. 不同海拔下HbA1c诊断糖尿病的能力:海拔 < 2 000和2 000~ m地区HbA1c诊断糖尿病的最佳切点均为5.7%。海拔 < 2 000 m地区最佳切点对应的灵敏度和特异度分别为65.4%(95%CI:64.6%~66.2%)和83.0%(95%CI:82.8%~83.2%),海拔2 000~ m地区最佳切点对应的灵敏度和特异度分别为57.7%(95%CI:52.3%~62.9%)和85.5%(95%CI:84.5%~86.5%)。相应的曲线下面积分别为0.808(95%CI:0.803~0.812)和0.778(95%CI:0.750~0.807)。不同的是,海拔≥3 000 m地区HbA1c诊断糖尿病的最佳切点为6.0%,灵敏度和特异度分别为48.3%(95%CI:37.4%~59.2%)和93.7%(95%CI:92.7%~94.5%)。曲线下面积为0.728(95%CI:0.660~0.796),低于海拔 < 2 000 m地区对应的曲线下面积,差异有统计学意义(P=0.022)。而当用HbA1c诊断糖尿病前期时,不同海拔地区曲线下面积均为0.600左右,提示区分效果不佳。见图 2。
|
| 注:OGTT-2 h:服糖后2 h血糖;糖尿病:FPG≥7.0 mmol/L和(或)OGTT-2 h≥11.1 mmol/L;糖尿病前期(mmol/L):6.1≤FPG < 7.0且0 < OGTT-2 h < 11.1或0 < FPG < 6.1且7.8≤OGTT-2 h < 11.1 图 2 不同海拔地区糖化血红蛋白诊断糖尿病和糖尿病前期的受试者工作特征曲线 |
我国幅员辽阔,不同地区海拔不尽相同。本研究借助最新一轮具有全国代表性的慢性病及危险因素监测发现当HbA1c≥5.7%时,海拔2 000~和≥3 000 m地区HbA1c与FPG和OGTT-2 h的关联强度较 < 2 000 m地区降低,受试者工作特征曲线进一步表明海拔≥3 000 m地区HbA1c诊断糖尿病的曲线下面积低于 < 2 000 m地区。这些结果为制定不同海拔地区糖尿病的诊断策略提供了科学依据。
杨历新等[6]曾调查了我国青海和江苏地区165名健康居民,结果表明青海省格尔木地区居民血红蛋白和HbA1c水平(5.8% vs. 5.4%)高于江苏省苏州地区,差异有统计学意义。本研究分析了全国31个省(自治区、直辖市)近16万人的数据,未发现不同海拔地区HbA1c水平存在明显差异。同样,Bazo-Alvarez等[10]报道秘鲁海平面和高海拔地区居民HbA1c均值分别为5.9%和5.8%。Grossman等[13]在一项回归性队列研究中未发现HbA1c与血红蛋白存在线性相关(r=-0.083)。这可能因为虽然血红蛋白绝对浓度升高,但HbA1c反映的是血红蛋白的糖化比例。不同于HbA1c,本研究发现高海拔地区调查对象血糖水平低于低海拔地区,这可能与高海拔环境下肝糖原输出降低和骨骼肌摄入葡萄糖增多有关[7]。空腹状态下,血糖主要来源于肝糖原的输出。有研究表明海拔升高后机体对胰高血糖素的应答降低[14]。此外,缺氧可通过激活腺苷酸激活蛋白激酶通路刺激骨骼肌对葡萄糖的转运[15]。
探究HbA1c,尤其当其浓度≥5.7%时,与FPG和OGTT-2 h的关系有助于理解不同海拔水平下HbA1c对血糖指标的预测能力和对糖尿病的诊断能力。一方面,本研究发现HbA1c与FPG和OGTT-2 h的关联在HbA1c≥5.7%时较HbA1c < 5.7%时更强,这与我国东北农村地区心血管健康研究的结果一致。该研究发现FPG浓度处于≥7.0、5.6~、< 5.6 mmol/L时,其与HbA1c的相关系数分别为0.76、0.19、0.07[12]。尽管如此,HbA1c < 5.7%时海拔 < 2 000和2 000~m地区FPG和OGTT-2 h开始升高对应HbA1c的浓度高于海拔≥3 000 m地区,提示在正常浓度范围内HbA1c在高海拔地区较在低海拔地区能够更灵敏地反映FPG的变化情况。相似地,Bazo-Alvarez等[10]发现分别用两次曲线和直线拟合海平面和高海拔地区HbA1c与FPG的关系效果最好。另一方面,HbA1c≥5.7%时FPG和OGTT-2 h与HbA1c的关联强度在高海拔地区均较低海拔地区减弱。考虑到HbA1c的变化用标准差表示,且FPG和OGTT-2 h的变化用相对数表示,上述关联强度的差异不太可能完全归因于不同海拔地区HbA1c和血糖指标浓度范围的差异。一种可能的解释是缺氧可通过促进糖化反应介导缺氧诱导因子上调[16]。糖化反应指葡萄糖通过非酶促反应与核酸、蛋白质、脂质等大分子生产结合产物。促进糖化反应过程,意味着相同血糖水平下可能有更多的葡萄糖与血红蛋白结合,生成HbA1c。另一种可能的解释是缺氧对红细胞的寿命存在影响。慢性缺氧可通过减少细胞内钙离子浓度和增加整合素相关蛋白CD47抑制红细胞凋亡[17]。红细胞寿命延长使血红蛋白接触血糖的时间更长,进而导致HbA1c浓度升高[18]。未来需要更深入地研究不同海拔水平下HbA1c与血糖指标关联差异的潜在生物学机制。
虽然几大国际组织一致推荐6.5%作为HbA1c诊断糖尿病的切点,但同时也指出这个切点可能不够灵敏,且随种族不同可能发生改变[19]。本研究中,在海拔 < 3 000 m的地区用HbA1c诊断糖尿病的最佳切点为5.7%,这与先前的一些研究结果十分接近。Zhang等[20]在619名≥45岁的广州市居民中探索了HbA1c预测糖尿病的截断值,发现当HbA1c为5.8%时曲线下面积最大,Guan等[12]在3 710名东北地区居民中观察到了相同的结果。相比之下,Bao等[21]在4 886名上海市居民中得到的HbA1c诊断切点(6.3%)略高一些,这可能与调查覆盖的地理区域和调查对象的年龄不同有关。值得注意的是,当分析局限于居住在海拔≥3 000 m地区的研究对象时,HbA1c诊断糖尿病的切点从5.7%上升到6.0%,同时曲线下面积从0.808下降到了0.728。Bazo-Alvarez等[10]用FPG≥7.0 mmol/L作为诊断糖尿病的金标准,发现海平面和高海拔地区HbA1c对应的曲线下面积分别为0.946和0.738。不同海拔地区血糖指标临床诊断切点对应HbA1c水平的差异一定程度上可解释这些结果。本研究海拔 < 2 000 m地区FPG为7.0 mmol/L或OGTT-2 h为11.1 mmol/L时对应的HbA1c浓度分别为6.8%和7.7%,而在海拔≥3 000 m地区HbA1c对应的浓度分别为8.5%和9.1%。
良好的国家代表性、充足的样本量、完善的实验室检测为系统地评价不同海拔下HbA1c与血糖指标的关联提供了独特机会。本研究存在局限性。一是调查时未收集肝脏疾病、脾脏疾病等影响HbA1c水平的患病信息,所以不能完全排除观察到的关联受到残余混杂影响的可能。二是FPG和OGTT-2 h仅为一次测量的结果,可能无法完全准确地反映调查对象的血糖水平。
综上所述,当HbA1c≥5.7%时,其与血糖指标的关联强度随着海拔升高而降低。在海拔≥3 000 m的地区,用HbA1c诊断糖尿病可能效果不佳,仍需测定FPG和OGTT-2 h。未来需要用队列研究进一步探讨不同海拔水平下HbA1c和血糖指标与心血管并发症风险的关联。
利益冲突 所有作者声明无利益冲突
作者贡献声明 张笑:数据整理、统计学分析、文章撰写;张梅:实施研究、采集数据;李纯、黄正京:采集数据;于梦婷:对文章的知识性内容作批评性审阅;王丽敏:研究指导、论文修改、经费支持
| [1] |
Wang L, Peng W, Zhao Z, et al. Prevalence and Treatment of Diabetes in China, 2013-2018[J]. JAMA, 2021, 326(24): 2498-2506. DOI:10.1001/jama.2021.22208 |
| [2] |
GBD 2019 Diseases and Injuries Collaborators. Global burden of 369 diseases and injuries in 204 countries and territories, 1990-2019: a systematic analysis for the Global Burden of Disease Study 2019[J]. Lancet, 2020, 396(10258): 1204-1222. DOI:10.1016/S0140-6736(20)30925-9 |
| [3] |
American Diabetes Association. Diagnosis and classification of diabetes mellitus[J]. Diabetes Care, 2010, 33(Suppl 1): S62-69. DOI:10.2337/dc10-S062 |
| [4] |
中华医学会糖尿病学分会. 中国2型糖尿病防治指南(2020年版)[J]. 中华糖尿病杂志, 2021, 13(4): 315-409. Chinese Diabetes Society. Guideline for the prevention and treatment of type 2 diabetes mellitus in China (2020 edition)[J]. Chin J Diabetes Mellitus, 2021, 13(4): 315-409. DOI:10.3760/cma.j.cn115791-20210221-00095 |
| [5] |
He MZ, Kloog I, Just AC, et al. Intermediate- and long-term associations between air pollution and ambient temperature and glycated hemoglobin levels in women of child bearing age[J]. Environ Int, 2022, 165: 107298. DOI:10.1016/j.envint.2022.107298 |
| [6] |
杨历新, 米娜, 王叶, 等. 不同海拔地区非糖尿病成人糖化血红蛋白水平及影响因素研究[J]. 中华内分泌代谢杂志, 2012, 28(5): 412-413. Yang LX, Mi N, Wang Y, et al. Glycated hemoglobin levels in non-diabetic adults residing at different altitudes and influencing factors[J]. Chin J Endocrinol Metab, 2012, 28(5): 412-413. DOI:10.3760/cma.j.issn.1000-6699.2012.05.013 |
| [7] |
Woolcott OO, Ader M, Bergman RN. Glucose homeostasis during short-term and prolonged exposure to high altitudes[J]. Endocr Rev, 2015, 36(2): 149-173. DOI:10.1210/er.2014-1063 |
| [8] |
纪立农, 宁光. 糖化血红蛋白[M]. 北京: 人民卫生出版社, 2013. Ji LN, Ning G. Glycosylated hemoglobin[M]. Beijing: People's Medical Publishing House, 2013. |
| [9] |
张梅, 吴静, 张笑, 等. 2018年中国成年居民高血压患病与控制状况研究[J]. 中华流行病学杂志, 2021, 42(10): 1780-1789. Zhang M, Wu J, Zhang X, et al. Prevalence and control of hypertension in adults in China, 2018[J]. Chin J Epidemiol, 2021, 42(10): 1780-1789. DOI:10.3760/cma.j.cn112338-20210508-00379 |
| [10] |
Bazo-Alvarez JC, Quispe R, Pillay TD, et al. Glycated haemoglobin (HbA1c) and fasting plasma glucose relationships in sea-level and high-altitude settings[J]. Diabet Med, 2017, 34(6): 804-812. DOI:10.1111/dme.13335 |
| [11] |
World Health Organization. WHO guidelines on physical activity and sedentary behaviour[EB/OL]. (2020-11-25) [2022-08-30]. https://www.who.int/publications/i/item/9789240015128.
|
| [12] |
Guan X, Zheng L, Sun G, et al. The changing relationship between HbA1c and FPG according to different FPG ranges[J]. J Endocrinol Invest, 2016, 39(5): 523-528. DOI:10.1007/s40618-015-0389-1 |
| [13] |
Grossman A, Gafter-Gvili A, Schmilovitz-Weiss H, et al. Association of glycated hemoglobin with hemoglobin levels in elderly nondiabetic subjects[J]. Eur J Intern Med, 2016, 36: 32-35. DOI:10.1016/j.ejim.2016.08.024 |
| [14] |
Siervo M, Riley HL, Fernandez BO, et al. Effects of prolonged exposure to hypobaric hypoxia on oxidative stress, inflammation and gluco-insular regulation: the not-so-sweet price for good regulation[J]. PLoS One, 2014, 9(4): e94915. DOI:10.1371/journal.pone.0094915 |
| [15] |
Fujii N, Jessen N, Goodyear LJ. AMP-activated protein kinase and the regulation of glucose transport[J]. Am J Physiol Endocrinol Metab, 2006, 291(5): E867-877. DOI:10.1152/ajpendo.00207.2006 |
| [16] |
Khan MI, Rath S, Adhami VM, et al. Hypoxia driven glycation: Mechanisms and therapeutic opportunities[J]. Semin Cancer Biol, 2018, 49: 75-82. DOI:10.1016/j.semcancer.2017.05.008 |
| [17] |
Tang F, Feng L, Li RL, et al. Inhibition of Suicidal Erythrocyte Death by Chronic Hypoxia[J]. High Alt Med Biol, 2019, 20(2): 112-119. DOI:10.1089/ham.2017.0159 |
| [18] |
Leow MK. Glycated Hemoglobin (HbA1c): Clinical Applications of a Mathematical Concept[J]. Acta Inform Med, 2016, 24(4): 233-238. DOI:10.5455/aim.2016.24.233-238 |
| [19] |
Lim WY, Ma S, Heng D, et al. Screening for diabetes with HbA1c: Test performance of HbA1c compared to fasting plasma glucose among Chinese, Malay and Indian community residents in Singapore[J]. Sci Rep, 2018, 8(1): 12419. DOI:10.1038/s41598-018-29998-z |
| [20] |
Zhang R, Wang J, Luo J, et al. Cutoff value of HbA1c for predicting diabetes and prediabetes in a Chinese high risk population aged over 45[J]. Asia Pac J Clin Nutr, 2015, 24(3): 360-366. DOI:10.6133/apjcn.2015.24.3.14 |
| [21] |
Bao Y, Ma X, Li H, et al. Glycated haemoglobin A1c for diagnosing diabetes in Chinese population: cross sectional epidemiological survey[J]. BMJ, 2010, 340: c2249. DOI:10.1136/bmj.c2249 |
 2023, Vol. 44
2023, Vol. 44