文章信息
- 史可香, 朱蕴卿, 余灿清, 吕筠, 郭彧, 裴培, 杨玲, 杜怀东, 陈怡平, 陈君石, 陈铮鸣, 李立明, 代表中国慢性病前瞻性研究项目协作组.
- Shi Kexiang, Zhu Yunqing, Yu Canqing, Lyu Jun, Guo Yu, Pei Pei, Yang Ling, Du Huaidong, Chen Yiping, Chen Junshi, Chen Zhengming, Li Liming, for the China Kadoorie Biobank Collaborative Group
- 中国成年人慢性阻塞性肺疾病与骨密度的相关性分析
- The relationship between chronic obstructive pulmonary disease and bone mineral density in Chinese adults
- 中华流行病学杂志, 2023, 44(2): 221-228
- Chinese Journal of Epidemiology, 2023, 44(2): 221-228
- http://dx.doi.org/10.3760/cma.j.cn112338-20220425-00341
-
文章历史
收稿日期: 2022-04-25
2. 北京大学公众健康与重大疫情防控战略研究中心, 北京 100191;
3. 中国医学科学院阜外医院/国家心血管病中心, 北京 100037;
4. 英国牛津大学医学研究委员会人口健康研究组, 牛津OX3 7LF;
5. 英国牛津大学临床与流行病学研究中心纳菲尔德人群健康系, 牛津OX3 7LF;
6. 国家食品安全风险评估中心, 北京 100022
2. Peking University Center for Public Health and Epidemic Preparedness & Response, Beijing 100191, China;
3. Fuwai Hospital, Chinese Academy of Medical Sciences, National Center for Cardiovascular Diseases, Beijing 100037, China;
4. Medical Research Council Population Health Research Unit at the University of Oxford, Oxford Population Health, Oxford OX3 7LF, United Kingdom;
5. Clinical Trial Service Unit and Epidemiological Studies Unit, Nuffield Department of Population Health, University of Oxford, Oxford OX3 7LF, United Kingdom;
6. China National Center for Food Safety Risk Assessment, Beijing 100022, China
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是一种常见的、可预防和可治疗的疾病,其特征是持续性气流受限和呼吸道症状。随着疾病进展,COPD常并发心血管疾病、骨骼肌功能障碍、骨质疏松症等[1]。有证据表明,COPD患者全身性炎症水平升高[2],其中炎性细胞因子白细胞介素(IL)-1β、IL-6和肿瘤坏死因子-α(TNF-α)是骨代谢和骨重塑的重要调节剂,可通过对基质细胞的影响来调节破骨细胞生成,也可以直接作用于破骨细胞及其前体,还可以作用于骨质疏松症相关的信号通路[3],导致骨密度降低。随着人口老龄化的加剧,我国COPD和骨质疏松症的患病率不断上升,带来的疾病负担也随之增加[4-5]。既往研究发现,COPD患者的骨质减少症和骨质疏松症的患病率高于健康人群,骨质疏松症的患病风险是健康人群的2.83倍[6]。但既往研究主要集中于气流受限严重的COPD患者[7],一般人群中COPD与骨密度的相关性研究较少,且结论不一致[8-10];COPD相关的许多因素可以加速骨密度降低,但关于COPD疾病本身对骨密度的影响研究较少。因此,本研究使用中国慢性病前瞻性研究(China Kadoorie Biobank,CKB)项目第二次重复调查的数据,探讨我国一般人群中COPD与骨密度的相关性,以及COPD严重程度对骨密度的影响。
对象与方法1. 研究对象:CKB项目选定中国10个地区,包括5个城市地区(黑龙江省哈尔滨市、山东省青岛市、江苏省苏州市、广西壮族自治区柳州市、海南省海口市)和5个农村地区(河南省辉县市、甘肃省天水市、四川省彭州市、浙江省桐乡市、湖南省浏阳市)[11-13]。基线调查开展于2004年6月至2008年7月,共纳入512 726名研究对象,随后每4~5年在每个项目地区通过整群随机抽样设计抽取约5%的队列成员进行重复调查。第二次重复调查开展于2013年8月至2014年9月,增加了对骨密度指标的测量。本研究以参加第二次重复调查的25 041名研究对象为基础,在分析中国成年人COPD与骨密度的相关性时,剔除1秒用力呼气容积(forced expiratory volume in one second,FEV1)或用力肺活量(forced vital capacity,FVC)缺失者(n=779)、FEV1/FVC > 1者(n=42)、跟骨骨密度任一数据缺失者(n=360)、腰围和/或臀围测量缺失者(n=9),最终纳入23 876名研究对象。在分析COPD气流受限严重程度与骨密度的相关性时,进一步剔除基线自报慢性支气管炎或肺气肿或肺心病、且FEV1/FVC≥0.7者(n=506),共纳入23 370名研究对象。CKB项目获得英国牛津大学(批准文号:025-04)和中国CDC伦理委员会审查批准(批准文号:005/2004),研究对象参与调查前均签署了知情同意书。
2. 研究内容:在第二次重复调查中由经过培训的技术人员使用手握微型电子肺功能仪,测量研究对象的坐位FEV1和FVC,未使用支气管扩张剂。每名研究对象记录两个合格的测定结果,取较大值进行分析。根据慢性阻塞性肺疾病全球倡议(Global Initiative for Chronic Obstructive Lung Disease,GOLD)标准[1],结合我国基层COPD诊断不足的现状[14],本研究将COPD患病定义为FEV1/FVC < 0.7或基线自报患慢性支气管炎或肺气肿或肺心病。根据全球肺功能行动(Global Lung Function Initiative)提出的FEV1预计值计算公式[15],进一步对COPD患者进行气流受限的严重程度分级,对FEV1/FVC < 0.7的患者:FEV1≥80%预计值为GOLD-1;50%预计值≤FEV1 < 80%预计值为GOLD-2;30%预计值≤FEV1 < 50%预计值为GOLD-3;FEV1 < 30%预计值为GOLD-4。
本研究使用定量超声法评估骨密度。由经过培训的技术人员使用GE Achilles EXP Ⅱ定量超声骨密度仪测定研究对象左右足跟骨骨密度,在200 kHz~1.5 MHz频率下直接测得或计算出以下指标[16]:①宽带超声衰减(broadband ultrasound attenuation)表示超声穿过足跟后的衰减,以dB/MHz表示,反映骨密度和骨结构;②超声声速(speed of sound)表示超声穿过足跟时的速度,以m/s表示,反映骨质量和骨密度;③强度指数(stiffness index)=[(0.67×宽带超声衰减)+(0.28×超声声速)-420],综合反映骨强度。本研究取左右足跟骨骨密度的均值作为结局进行分析。
问卷调查内容由经过统一培训的调查员面对面询问获得,与本研究相关的变量包括年龄、性别、地区(10个项目地区)、文化程度(小学及以下、中学、大专及以上)、职业(工农业劳动者、非工农业劳动者、家务/待业/下岗/其他)、家庭年收入(< 20 000、20 000~、≥50 000元)、婚姻状况(已婚、丧偶、离异、未婚)、吸烟状况(从不或偶尔吸烟、非因病戒烟、每日吸烟1~、15~、≥25支)、饮酒状况(从不或偶尔饮酒、戒酒、每周饮酒、每日饮酒1~、15~、30~、≥60 g)、钙铁锌补充剂摄入(是、否)、牛奶摄入频率(每天、4~6 d/周、1~3 d/周、每月、从不或很少)、酸奶摄入频率(每天、4~6 d/周、1~3 d/周、每月、从不或很少)、其他乳制品摄入频率(每天、4~6 d/周、1~3 d/周、每月、从不或很少)、体力活动水平[代谢当量(MET)-h/d]、女性绝经状况(未绝经、在绝经期、绝经年龄 < 45岁、绝经年龄45~49岁、绝经年龄≥50岁)、自评健康状况(良好、较好、一般、较差)。与本研究相关的体格检查指标由经过培训的技术人员按照统一的操作流程现场测量,包括身高、体重、腰围、臀围。体质指数(BMI)=体重(kg)/身高(m)2,腰臀比=腰围(cm)/臀围(cm),并根据《中国成年人超重和肥胖症预防控制指南》[17],以BMI(kg/m2)进行体重分类:< 18.5为低体重,18.5~23.9为正常体重,24.0~27.9为超重,≥28.0为肥胖。
3. 统计学分析:本研究分性别进行分析。采用一般线性模型(连续变量)或logistic回归模型(二分类变量),比较健康人群组和COPD组的研究对象第二次重复调查时的分布特征,报告调整年龄、地区后的均数或构成比。以3个骨密度指标为因变量,以COPD患病状态为自变量,采用线性回归分析COPD患病与骨密度的相关性。以COPD的GOLD分级为自变量,其中健康人群为参照组,进一步分析COPD严重程度与骨密度的相关性,评价剂量反应关系。采用似然比方法检验性别差异是否具有统计学意义。模型分步调整可能的混杂因素:模型1调整年龄、10个项目地区;模型2进一步调整文化程度、职业、家庭年收入、婚姻状况、吸烟状况、饮酒状况、钙铁锌补充剂摄入、牛奶摄入频率、酸奶摄入频率、其他乳制品摄入频率、体力活动水平、BMI、腰臀比、绝经状况(仅女性调整)、自评健康状况。为检验效应值的稳健性,在COPD与骨密度的相关性分析中,基于模型2进行敏感性分析:分别剔除哮喘患者(n=236),或剔除糖尿病患者(n=2 295),或进一步调整茶、咖啡、鸡蛋的摄入以及自报患有哮喘,或进一步调整是否接受COPD治疗[因肺病住院、为缓解呼吸困难服用抗生素(消炎药)、口服用固醇类药物、注射用固醇类药物、因肺病进行家庭氧疗,有任何一项即为接受过COPD治疗]。为探讨年龄(< 60岁,≥60岁)、吸烟状况(是、否)、饮酒状况(是、否)、体力活动水平(按中位数分层,低水平体力活动为 < 14.62 MET-h/d、高水平体力活动为≥14.62 MET-h/d)、钙铁锌补充剂摄入(是、否)、超重/肥胖(是、否)对COPD与骨密度的相关性有无效应修饰作用,基于模型2对上述因素进行分层分析,采用似然比检验比较有、无交互项的模型是否存在统计学差异。使用BH方法计算错误发现率(false discovery rate,FDR)[18],对交互作用P值进行FDR校正。采用Stata 15.0软件进行统计学分析,双侧检验,检验水准α=0.05。
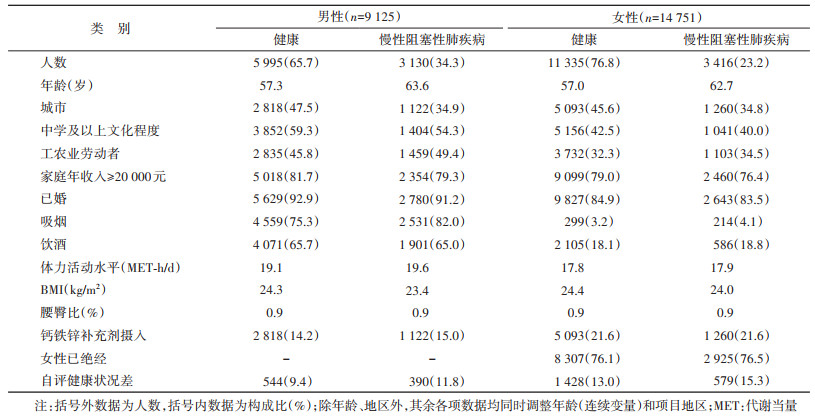
结果1. 基本特征:本研究共纳入CKB项目第二次重复调查的23 876人,年龄为(58.8±10.1)岁,女性占61.8%(14 751/23 876),城市居民占43.1%(10 293/23 876)。男性中COPD患者占34.3%(3 130/9 125),其中包括FEV1/FVC < 0.7者(2 959人,94.54%)、基线自报慢性支气管炎患者(420人,13.42%)、肺气肿患者(110人,3.51%)、肺心病患者(19人,0.61%);女性中COPD患者占23.2%(3 416/14 751),其中包括FEV1/FVC < 0.7者(3 081人,90.19%)、基线自报慢性支气管炎患者(577人,16.89%)、肺气肿患者(54人,1.58%)、肺心病患者(14人,0.41%)。与健康男性相比,男性COPD患者年龄较大,工农业劳动者、吸烟、钙铁锌补充剂摄入、自评健康状况较差的比例较高、体力活动水平较高,城市、中学及以上文化程度、家庭年收入≥20 000元、已婚、饮酒比例较低、BMI较低。女性的基本特征分布与男性相似,但女性中COPD组的饮酒者和已绝经者比例较高,钙铁锌补充剂摄入者比例无明显差别。见表 1。
2. COPD与骨密度的相关性:调整潜在的混杂因素后,以健康男、女性为参照,男、女性COPD患者的宽带超声衰减、超声声速、强度指数均降低,男性对应的β值(95%CI)分别为-0.87(-1.37~ -0.36)、-3.42(-5.42~-1.43)、-1.53(-2.34~-0.71),女性对应的β值(95%CI)分别为-0.66(-1.09~ -0.23)、-2.24(-3.92~-0.55)、-1.06(-1.71~-0.40),男性中下降幅度更大(交互作用均P < 0.05)。见表 2。上述结果在剔除哮喘患者或剔除糖尿病患者或额外调整其他因素后,两者的相关性在敏感性分析中未发生明显变化(结果未展示)。
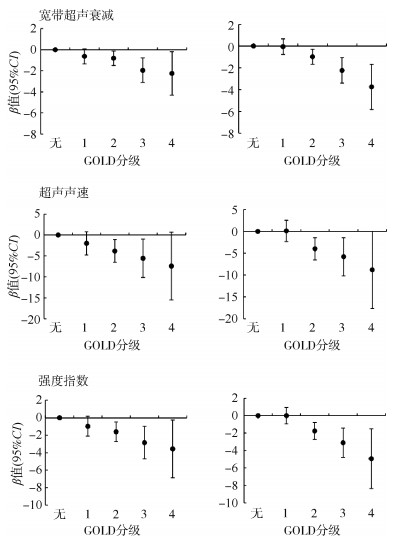
进一步对COPD患者气流受限严重程度分级,分析结果与上述结果保持一致,且呈线性趋势(线性趋势检验均P < 0.001),见图 1。与健康人群相比,男性GOLD-4组宽带超声衰减、超声声速、强度指数对应的β值(95%CI)分别为-2.25(-4.31~ -0.19)、-7.42(-15.53~0.69)、-3.56(-6.87~-0.25),女性对应的β值(95%CI)分别为-3.75(-5.99~ -1.51)、-8.79(-17.60~0.02)、-4.94(-8.36~-1.52)。
男性中,年龄、体力活动水平、超重/肥胖对COPD与骨密度指标相关性存在效应修饰作用。与 < 60岁组相比,≥60岁组中COPD患者骨密度下降幅度更大(宽带超声衰减、超声声速、强度指数FDR校正的交互作用P值分别为 < 0.001、0.005、< 0.001);与高体力活动水平组相比,低体力活动水平组的下降幅度更大(超声声速、强度指数中FDR校正的交互作用P值分别为0.005、0.006);与超重/肥胖组相比,非超重/肥胖组的下降幅度更大(宽带超声衰减中FDR校正的交互作用P值为0.031)。在女性中,仅超重/肥胖对COPD与宽带超声衰减的相关性存在效应修饰作用,与超重/肥胖者相比,非超重/肥胖者中的下降幅度更大(FDR校正的交互作用P值为0.004)。见表 3。
本研究结果显示,我国成年男性和女性中,COPD患者的骨密度水平低于健康成年人,男性中下降幅度更大;且COPD患者气流受限严重程度越高,骨密度水平越低。亚组分析显示,男性年龄≥60岁、男性低体力活动水平者、非超重/肥胖者中COPD患者骨密度的下降幅度更大。
本研究调整了已知的骨质疏松症的危险因素后,COPD患病、GOLD分级与骨密度呈负相关,提示COPD对骨密度可能具有疾病特异性影响。既往大部分研究是以骨密度定义的骨质疏松症或骨质减少症为结局,结论与本研究相似[19-21],但其中许多研究在前往医院接受治疗的中重度气流受限患者中开展,而不是一般人群。一项基于第三次美国国家营养与健康调查的研究显示,气流受限者骨质疏松症的患病风险是非气流受限者的1.9倍,且该风险随气流受限严重程度的增加而增加,但在最轻等级中不显著[9],与本研究结论一致,提示气流受限严重的患者骨质疏松症和骨质减少症的患病风险更大。另有一项来自挪威的以骨密度Z值为结局的研究得到类似结论[10]。
COPD与骨密度间相关性的机制尚不明确,目前较多的解释是COPD导致的全身性炎症[22]。COPD患者炎症标志物如TNF-α、C反应蛋白、IL-6等的血清浓度高于健康人群,同时这些标志物在骨质疏松症患者中的水平也较高[23]。炎性细胞因子会引起OPG-RANK-RANKL、Wnt-β-catenin信号通路紊乱[24],导致骨形成减少和骨吸收增加,进而导致骨密度降低。此外,维生素D缺乏、皮质类固醇的使用也是可能的原因[22]。
本研究发现男性COPD患者骨密度下降更明显。既往关于不同性别中COPD与骨密度的相关性分析较少且结论不一致。一项年龄匹配的病例对照研究显示,男性中COPD患者的骨密度低于对照组,而女性中该差异无统计学意义[7]。美国的一项研究显示,调整潜在混杂因素后,气流受限与骨质疏松症之间的相关性无性别差异[9]。不同研究结论之间的差异可能与研究对象的特征以及混杂因素的控制不同有关,如种族、年龄、BMI、维生素D摄入、糖皮质激素使用等。因此,两者之间的相关性是否存在性别差异,还需要更高质量的前瞻性研究进行证实。然而,男性中COPD患病率较高,且男性一般不会进行骨密度的常规检测,造成男性COPD患者骨质疏松症的诊断和治疗不足[25]。因此,建议重视男性COPD患者的骨密度水平,及时评估其骨质疏松症的患病风险。
本研究结果显示,男性中年龄与COPD存在交互作用,年龄大的男性中COPD与骨密度指标呈负相关,未在低年龄组的男性中发现此关系,可能是因为衰老也会引起慢性低度炎症[26],从而与COPD产生协同的交互作用。提示老年男性应定期体检,关注肺部疾病和骨骼健康。此外,男性低体力活动水平者中下降幅度更大。可能因为体力活动缺乏会导致肌肉力量下降,包括呼吸肌组织的强度和肺活量,加速呼吸衰退[27],进一步导致体力活动降低,形成恶性循环。规律的体力活动具有长期的全身抗炎作用[28],在一定程度上抵消COPD导致的炎症水平升高,提示体力活动可能减少COPD对骨密度下降的影响,强调了体力活动在骨骼健康方面的重要性。因此对于COPD患者,尤其是男性COPD患者,可以通过肺康复训练改善呼吸困难和运动耐量,加强耐力训练和力量训练,如游泳、散步、骑自行车[29],提高体力活动水平,控制COPD对骨密度的影响。本研究显示,男性和女性非超重/肥胖者中下降幅度更大,但仅宽带超声衰减中该效应修饰作用有统计学意义。荷兰一项研究发现,与非肥胖组相比,肥胖组COPD患者骨质疏松症的发病率较低[30]。研究显示COPD患者全身性炎症水平升高,低体重可加剧其全身性炎症[31],同时可改变维持骨细胞代谢的激素水平及骨转换率[32],降低促进骨骼形成的机械负荷,导致COPD患者骨密度进一步降低。此外,约35%~60%的中重度COPD患者BMI较低[33],提示BMI较低的COPD患者病情较重。在日常实践中,鉴于BMI较低对COPD患者骨密度的负面影响,应加强对非超重/肥胖的COPD患者骨密度的关注,但不建议盲目增重,避免高血压、糖尿病等合并症的发病率升高[30]。
与既往研究相比,本研究的研究对象来自中国一般人群,且样本量相对较大,可以进一步研究不同特征人群中的相关性;本研究包含较多的人口学特征、生活方式等信息,尽可能控制已知混杂因素;肺功能指标、骨密度指标均为客观测量结果,减少信息偏倚。本研究存在局限性。第一,本研究属于横断面研究,无法判断因果,只能提示COPD与骨密度的相关性;第二,本研究使用定量超声法测量跟骨骨密度,而非通常使用的双能X线吸收测定法,但定量超声法是其真实、可靠的替代方法,测量结果与双能X线吸收测定法测量的骨密度高度相关,且易操作、成本低、无辐射[34];第三,本研究未对气流受限者使用支气管扩张剂,因此COPD患者中的少数个体可能为哮喘患者,但在敏感性分析中剔除自报哮喘的患者后,结果无明显变化;第四,本研究未收集炎症因子信息,未能探究慢性炎症在COPD与骨密度相关性中的作用。
本研究使用CKB项目第二次重复调查的数据进行分析,发现我国成年男性和女性中,COPD患者的骨密度水平低于健康成年人,且老年男性、体力活动水平较低的男性、非超重/肥胖患者中COPD患者骨密度下降幅度更大。研究结果提示中国COPD患者管理中,特别是老年男性和体重正常的患者中,应定期进行骨密度检查,以便及早发现、诊断骨质疏松症,及时干预。同时,COPD患者应注意保持适当的体力活动水平,降低COPD对骨密度的影响。
利益冲突 所有作者声明无利益冲突
作者贡献声明 史可香:数据整理、统计分析、结果解释、论文撰写;朱蕴卿:统计分析;余灿清、吕筠:分析方案确定、结果解释、经费支持;郭彧、裴培、杨玲、杜怀东、陈怡平:实施研究、采集数据;陈君石、陈铮鸣、李立明:项目设计和方案制定
志谢 感谢所有参加中国慢性病前瞻性研究项目的队列成员和各项目地区的现场调查队调查员;感谢项目管理委员会、国家项目办公室、牛津协作中心和10个项目地区办公室的工作人员
| [1] |
Vogelmeier CF, Criner GJ, Martinez FJ, et al. Global strategy for the diagnosis, management, and prevention of chronic obstructive lung disease 2017 report. GOLD executive summary[J]. Am J Respir Crit Care Med, 2017, 195(5): 557-582. DOI:10.1164/rccm.201701-0218PP |
| [2] |
Barnes PJ. Inflammatory mechanisms in patients with chronic obstructive pulmonary disease[J]. J Allergy Clin Immunol, 2016, 138(1): 16-27. DOI:10.1016/j.jaci.2016.05.011 |
| [3] |
Bai P, Sun YC, Jin JM, et al. Disturbance of the OPG/RANK/RANKL pathway and systemic inflammation in COPD patients with emphysema and osteoporosis[J]. Respir Res, 2011, 12(1): 157. DOI:10.1186/1465-9921-12-157 |
| [4] |
Wang C, Xu JY, Yang L, et al. Prevalence and risk factors of chronic obstructive pulmonary disease in China (the China Pulmonary Health study): a national cross-sectional study[J]. Lancet, 2018, 391(10131): 1706-1717. DOI:10.1016/s0140-6736(18)30841-9 |
| [5] |
Chen P, Li ZZ, Hu YH. Prevalence of osteoporosis in China: a meta-analysis and systematic review[J]. BMC Public Health, 2016, 16(1): 1039. DOI:10.1186/s12889-016-3712-7 |
| [6] |
Chen YW, Ramsook AH, Coxson HO, et al. Prevalence and risk factors for osteoporosis in individuals with COPD: a systematic review and meta-analysis[J]. Chest, 2019, 156(6): 1092-1110. DOI:10.1016/j.chest.2019.06.036 |
| [7] |
Adas-Okuma MG, Maeda SS, Gazzotti MR, et al. COPD as an independent risk factor for osteoporosis and fractures[J]. Osteoporos Int, 2020, 31(4): 687-697. DOI:10.1007/s00198-019-05235-9 |
| [8] |
Lee IS, Leem AY, Lee SH, et al. Relationship between pulmonary function and bone mineral density in the Korean National Health and Nutrition Examination Survey[J]. Korean J Intern Med, 2016, 31(5): 899-909. DOI:10.3904/kjim.2015.127 |
| [9] |
Sin DD, Man JP, Man SFP. The risk of osteoporosis in Caucasian men and women with obstructive airways disease[J]. Am J Med, 2003, 114(1): 10-14. DOI:10.1016/s0002-9343(2)01297-4 |
| [10] |
Kjensli A, Mowinckel P, Ryg MS, et al. Low bone mineral density is related to severity of chronic obstructive pulmonary disease[J]. Bone, 2007, 40(2): 493-497. DOI:10.1016/j.bone.2006.09.005 |
| [11] |
Chen ZM, Lee L, Chen JS, et al. Cohort profile: the Kadoorie Study of Chronic Disease in China (KSCDC)[J]. Int J Epidemiol, 2005, 34(6): 1243-1249. DOI:10.1093/ije/dyi174 |
| [12] |
Chen ZM, Chen JS, Collins R, et al. China Kadoorie Biobank of 0.5 million people: survey methods, baseline characteristics and long-term follow-up[J]. Int J Epidemiol, 2011, 40(6): 1652-1666. DOI:10.1093/ije/dyr120 |
| [13] |
李立明, 吕筠, 郭彧, 等. 中国慢性病前瞻性研究: 研究方法和调查对象的基线特征[J]. 中华流行病学杂志, 2012, 33(3): 249-255. Li LM, Lv J, Guo Y, et al. The China Kadoorie Biobank: related methodology and baseline characteristics of the participants[J]. Chin J Epidemiol, 2012, 33(3): 249-255. DOI:10.3760/cma.j.issn.0254-6450.2012.03.001 |
| [14] |
孙永昌. 慢性阻塞性肺疾病在中国基层医疗机构面临的挑战和应对[J]. 中华结核和呼吸杂志, 2020, 43(1): 14-16. Sun YC. Chronic obstructive pulmonary disease: challenges for primary care in China[J]. Chin J Tuberc Respir Dis, 2020, 43(1): 14-16. DOI:10.3760/cma.j.issn.1001-0939.2020.01.005 |
| [15] |
Quanjer PH, Stanojevic S, Cole TJ, et al. Multi-ethnic reference values for spirometry for the 3-95-yr age range: the global lung function 2012 equations[J]. Eur Respir J, 2012, 40(6): 1324-1343. DOI:10.1183/09031936.00080312 |
| [16] |
乔雨嘉, 李夏, 吴曼, 等. 中国10个地区成年人跟骨骨密度的描述性分析[J]. 中华流行病学杂志, 2018, 39(4): 422-427. Qiao YJ, Li X, Wu M, et al. Levels of calcaneus bone mineral density in adults from 10 regions of China[J]. Chin J Epidemiol, 2018, 39(4): 422-427. DOI:10.3760/cma.j.issn.0254-6450.2018.04.007 |
| [17] |
陈春明, 孔灵芝. 中国成年人超重和肥胖症预防控制指南[M]. 北京: 人民卫生出版社, 2006. Chen CM, Kong LZ. The guideline for prevention and control of overweight and obesity in Chinese adults[M]. Beijing: People's Medical Publishing House, 2006. |
| [18] |
Glickman ME, Rao SR, Schultz MR. False discovery rate control is a recommended alternative to Bonferroni-type adjustments in health studies[J]. J Clin Epidemiol, 2014, 67(8): 850-857. DOI:10.1016/j.jclinepi.2014.03.012 |
| [19] |
Graat-Verboom L, Wouters EFM, Smeenk FWJM, et al. Current status of research on osteoporosis in COPD: a systematic review[J]. Eur Respir J, 2009, 34(1): 209-218. DOI:10.1183/09031936.50130408 |
| [20] |
Hattiholi J, Gaude GS. Prevalence and correlates of osteoporosis in chronic obstructive pulmonary disease patients in India[J]. Lung India, 2014, 31(3): 221-227. DOI:10.4103/0970-2113.135759 |
| [21] |
Lin CW, Chen YY, Chen YJ, et al. Prevalence, risk factors, and health-related quality of life of osteoporosis in patients with COPD at a community hospital in Taiwan[J]. Int J Chron Obstruct Pulmon Dis, 2015, 10(1): 1493-1500. DOI:10.2147/copd.S85432 |
| [22] |
Inoue D, Watanabe R, Okazaki R. COPD and osteoporosis: links, risks, and treatment challenges[J]. Int J Chron Obstruct Pulmon Dis, 2016, 11(1): 637-648. DOI:10.2147/copd.S79638 |
| [23] |
Bon JM, Zhang YZ, Duncan SR, et al. Plasma inflammatory mediators associated with bone metabolism in COPD[J]. COPD: J Chron Obstruct Pulmon Dis, 2010, 7(3): 186-191. DOI:10.3109/15412555.2010.482114 |
| [24] |
Hardy R, Cooper MS. Bone loss in inflammatory disorders[J]. J Endocrinol, 2009, 201(3): 309-320. DOI:10.1677/joe-08-0568 |
| [25] |
Morden NE, Sullivan SD, Bartle B, et al. Skeletal health in men with chronic lung disease: rates of testing, treatment, and fractures[J]. Osteoporos Int, 2011, 22(6): 1855-1862. DOI:10.1007/s00198-010-1423-y |
| [26] |
Franceschi C, Garagnani P, Vitale G, et al. Inflammaging and 'Garb-aging'[J]. Trends Endocrinol Metab, 2017, 28(3): 199-212. DOI:10.1016/j.tem.2016.09.005 |
| [27] |
Lau RY, Guo X. A review on current osteoporosis research: with special focus on disuse bone loss[J]. J Osteoporos, 2011, 2011, 293808. DOI:10.4061/2011/293808 |
| [28] |
Fuertes E, Carsin AE, Antó JM, et al. Leisure-time vigorous physical activity is associated with better lung function: the prospective ECRHS study[J]. Thorax, 2018, 73(4): 376-384. DOI:10.1136/thoraxjnl-2017-210947 |
| [29] |
Fiorentino G, Esquinas AM, Annunziata A. Exercise and chronic obstructive pulmonary disease (COPD)[M]//Xiao JJ. Physical exercise for human health. Singapore: Springer, 2020: 355-368. DOI: |
| [30] |
Zewari S, Hadi L, van den Elshout F, et al. Obesity in COPD: comorbidities with practical consequences?[J]. COPD: J Chron Obstruct Pulmon Dis, 2018, 15(5): 464-471. DOI:10.1080/15412555.2018.1509951 |
| [31] |
Pitsiou G, Kyriazis G, Hatzizisi O, et al. Tumor necrosis factor-alpha serum levels, weight loss and tissue oxygenation in chronic obstructive pulmonary disease[J]. Respir Med, 2002, 96(8): 594-598. DOI:10.1053/rmed.2002.1322 |
| [32] |
Rosen CJ, Klibanski A. Bone, fat, and body composition: evolving concepts in the pathogenesis of osteoporosis[J]. Am J Med, 2009, 122(5): 409-414. DOI:10.1016/j.amjmed.2008.11.027 |
| [33] |
Berry JK, Baum C. Reversal of chronic obstructive pulmonary disease-associated weight loss: are there pharmacological treatment options?[J]. Drugs, 2004, 64(10): 1041-1052. DOI:10.2165/00003495-200464100-00002 |
| [34] |
Glüer CC. Quantitative ultrasound techniques for the assessment of osteoporosis: expert agreement on current status[J]. J Bone Miner Res, 1997, 12(8): 1280-1288. DOI:10.1359/jbmr.1997.12.8.1280 |
 2023, Vol. 44
2023, Vol. 44