文章信息
- 窦媛燕, 杜江波, 蒋杨倩, 宋词, 马红霞, 林苑, 沈洪兵, 胡志斌.
- Dou Yuanyan, Du Jiangbo, Jiang Yangqian, Song Ci, Ma Hongxia, Lin Yuan, Shen Hongbing, Hu Zhibin
- 中国国家出生队列研究的理念与实践
- Principles and practice of China National Birth Cohort
- 中华流行病学杂志, 2023, 44(1): 54-59
- Chinese Journal of Epidemiology, 2023, 44(1): 54-59
- http://dx.doi.org/10.3760/cma.j.cn112338-20221025-00909
-
文章历史
收稿日期: 2022-10-25
2. 南京医科大学生殖医学国家重点实验室, 南京 211166;
3. 南京医科大学公共卫生学院儿少卫生与妇幼保健学系, 南京 211166;
4. 南京医科大学姑苏学院/南京医科大学附属苏州医院(苏州市立医院)生殖医学国家重点实验室苏州分中心, 苏州 215002
2. State Key Laboratory of Reproductive Medicine, Nanjing Medical University, Nanjing 211166, China;
3. Department of Maternal, Child and Adolescent Health, School of Public Health, Nanjing Medical University, Nanjing 211166, China;
4. State Key Laboratory of Reproductive Medicine (Suzhou Municipal Hospital), The Affiliated Suzhou Hospital of Nanjing Medical University, Suzhou Municipal Hospital, Gusu School, Nanjing Medical University, Suzhou 215002, China
出生队列研究作为队列研究的一种类型,在孕前或者孕期招募参与者,对孕期、分娩以及出生后母亲与儿童健康结局进行跟踪随访,进而发现影响疾病和健康的多种因素。其着眼于生命孕育早期,是研究生命早期环境、遗传、生活行为习惯危险因素与胚胎发育、胎儿、婴幼儿以及青少年健康之间关联的有效方法[1]。出生队列的发展已经历了一个多世纪,较早可以追溯至欧洲一些国家基于当地登记系统数据建立起来的从母亲怀孕到分娩直至子代死亡的覆盖生命全周期的大型国家出生队列,如丹麦国家出生队列[2],挪威母亲与儿童队列[2]以及芬兰北部出生队列[3]等。此类队列省时省力,在较低的成本下便可通过出生、疾病和死亡登记等多个数据系统的匹配获取大样本人群的健康状况信息。然而,受到登记系统记录信息的局限,有关研究对象健康行为方式、亚临床表型以及生物样本信息等收集尚不够全面。采用前瞻性招募和面对面随访相结合的模式可以有效解决这一问题,如荷兰R世代队列研究,英国埃文郡父母儿童纵向研究队列(Avon Longitudinal Study of Parents and Children)以及国内的上海出生队列(Shanghai Birth Cohort)、安徽出生队列(China-Anhui Birth Cohort Study)、广州出生队列(the Born in Guangzhou Cohort Study)等[4-8],这些队列通过从母亲怀孕至子代出生乃至成年后各阶段密集的随访,重复收集了研究对象各期详细的暴露信息、健康结局信息以及多种类型的生物样本,凭借更为丰富的数据集探索生命早期暴露与远期健康结局之间的关联。
目前已经建立的大型出生队列大多基于自然受孕人群进行招募和随访。近年来随着社会经济的发展,心理、社会、环境问题凸显,全球育龄夫妇不孕症的患病率不断攀升[9]。辅助生殖技术使用越来越广泛,但其所可能带来的母婴健康风险尚未得到充分研究[10]。美国纽约上州儿童队列(Upstate KIDS)较早开展相关人群研究,采用频数匹配的方式从纽约出生登记系统中随机选取了大约1 300个辅助生殖家庭和3 700个未经辅助治疗的家庭,通过对这些家庭活产子代进行多时点的问卷随访,监测其心脏代谢疾病风险,并结合多个登记数据库获取重要的健康结局,从而系统比较辅助生殖和自然妊娠子代近远期健康[11]。然而,登记系统获取的数据往往缺乏辅助治疗前夫妻双方健康状况和详细的辅助生殖治疗方案,也无法大规模收集生物样本开展相关检测和评估。相比之下,从医院前瞻性地招募研究对象,详细收集其临床诊疗数据以及生物样本可建立更精细的队列。美国环境与生殖健康队列(Environment and Reproductive Health)在马萨诸塞州综合医院生殖中心招募了寻求辅助生殖治疗的夫妇,并从辅助治疗前、治疗中和整个孕期多个时点收集了研究对象的问卷信息和生物样本,然而该研究目的主要是为了评估环境和生活方式等因素对不孕和妊娠结局的影响,后期的子代随访仅在小部分人群中开展[12]。
南京医科大学联合全国26家合作单位在国家重点研发计划“生殖健康及重大出生缺陷防控研究”重点专项的支持下启动了中国国家出生队列(China National Birth Cohort,CNBC)的建设。本队列采用两组对比的设计,在医院和社区同步招募辅助生殖和自然受孕人群,在孕前、妊娠期间直至子代出生后多时间点随访并采集健康相关信息和生物样本。队列覆盖范围广泛,辅助和自然同步纳入增强了人群的可比性,随访跨度较长且时间点密集,信息收集更为全面。其主要目标为评估使用辅助生殖技术后诞生的子代发育和健康状况,发现与不良出生结局和儿童期疾病相关的危险因素,为提升出生人口质量的策略制定提供科学依据[13]。以下简要介绍CNBC建设概况和标志性成果,并探讨出生队列建设和研究所面临的挑战及未来展望。
一、队列建设概况辅助生殖受孕家庭和自然受孕家庭分别于辅助生殖治疗之前及孕早期纳入队列并在纳入时收集男、女方基线信息,成功受孕并且胚胎发育正常的辅助受孕家庭在孕中期、孕晚期、分娩期及子代生后42 d、6个月、1岁和3岁时与自然受孕家庭完成并轨随访。见图 1。项目组在多个随访节点收集母亲孕期及子代的问卷,获得多时点母亲孕期生活行为方式、膳食补充、心理、睡眠以及子代喂养、因病住院等信息。从医院摘录母亲产前护理及住院分娩病案信息,通过面对面的随访获取子代1岁和3岁的体检信息。同时,队列还收集了血液、尿液、精浆、精子、卵泡液、脐血以及子代血液等多时点多类型的生物样本。截至2021年6月30日,已累计在全国招募7.2万个家庭,包括辅助生殖家庭3.9万个和自然妊娠家庭3.3万个。纳入人群覆盖我国华北、华东、华中、华西、华南等地二十余个省(自治区、直辖市)。基于队列云端信息化平台,共收集“无纸化”调查问卷和临床信息问卷50万余份。各中心累计向项目组样本库汇交生物样本100万余管。在所有队列现场中,江苏省的现场启动最早。基于江苏出生队列(Jiangsu Birth Cohort,JBC),项目组开展了多项组学检测,包括环境暴露组(尿液元素和邻苯二甲酸酯)检测、全基因组测序、甲基化测序、尿液和血浆代谢组学检测、粪便微生物16S rRNA测序等。旨在从遗传、表观遗传、代谢、环境暴露等多维度系统阐述辅助生殖技术、父源与母源因素对孕妇妊娠期、围产期并发症及出生后子代生长发育和远期健康状况的影响和潜在机制,为相关疾病的个体化精准防治提供科学依据。
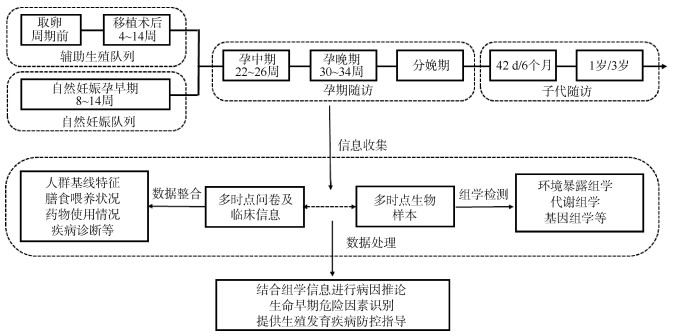
|
| 图 1 中国国家出生队列设计流程 |
1. 多角度比较辅助生殖与自然妊娠子代健康和表型特征:基于JBC数据,项目组利用宏观和组学数据系统地比较了辅助生殖与自然妊娠子代的发育健康。①出生缺陷发病率:项目组比较了自2016年8月至2019年5月孕满20周的1 825个辅助生殖和3 483个自然妊娠家庭子代截至1岁的出生缺陷(包含重大和微小出生缺陷)发病率,发现辅助生殖子代和自然妊娠子代出生缺陷的发病率分别为13.9%和7.0%,辅助生殖受孕的子代出生缺陷风险显著增加,其中双胎妊娠能够解释31.1%辅助生殖受孕子代中增加的出生缺陷风险[14]。这一发现进一步强调了推行单胚胎移植降低双胎妊娠率和加强双胎产前筛查、出生后长期随访的重要性。②子代新生突变(de novo mutation):项目组基于全基因组测序数据分析发现,辅助生殖子代的新生突变数量显著高于自然妊娠的子代,平均每个子代增加了4.59个突变,并且新生突变的增加与辅助生殖受孕子代先天性心脏病风险增加有关。此外,项目组评估多种因素后发现,新生突变增加与父亲不良生殖特征,如患少弱畸形精子症显著相关,而辅助生殖技术本身可能并非是新生突变增加的主要原因[15]。该结果也提示了在应用辅助生殖技术前,对家庭的男性进行详细的健康评估同样至关重要。③子代肠道菌群:通过对两组队列人群新生儿粪便样本的16S rRNA基因测序分析发现,与自然妊娠组相比,辅助生殖组新生儿胎便微生物多样性降低,并且拟杆菌门相对丰度显著下调。辅助生殖用药和给药途径可能影响辅助生殖新生儿肠道拟杆菌门的定植;追踪婴幼儿体格发育后,项目组进一步发现拟杆菌门相对丰度和肠道微生物多样性可影响早期生长[16]。上述结果揭示了辅助生殖技术可影响新生儿肠道微生物群落结构。
2. 探索子代神经发育的影响因素:项目组在子代1岁时开展贝利Ⅲ筛查试验(Bayley-Ⅲ screening test)评估子代认知、语言理解、语言表达、精细运动和大运动5个维度的神经发育状况,结合队列在产前收集的环境暴露、临床诊疗、生活行为习惯等多维度多时点数据,评估了一系列生命早期暴露对子代神经发育的影响。①孕期PM2.5暴露:项目组研究发现,孕期PM2.5暴露显著增加子代大运动发育迟缓的风险,孕中期可能是关键暴露窗口。而在PM2.5组分中,硫酸根对神经发育迟缓的影响需要重点关注[17];②产前用药:此外,项目组发现产前使用皮质类固醇药物,尤其是地塞米松用药会显著增加子代认知发育迟缓的风险,这一效应在孕中、孕晚期尤为显著,提示孕期相关用药应严格权衡利弊[18];③孕期膳食模式:根据多时点的膳食问卷信息,项目组研究发现在整个孕期坚持“水产品和菌藻类”的饮食模式显著增加子代1岁认知、粗大运动和语言表达多个维度的评分,提示此种饮食模式对子代神经发育具有良好的保护作用,该发现有利于为母亲孕期科学膳食提供指导[19]。此外,项目组正在开展辅助生殖技术和用药、妊娠期并发症、儿童睡眠等一系列复杂因素暴露对子代发育和健康的影响,为保障儿童健康提供科学线索。
三、挑战1. 队列建设的组织与协调:出生队列的建设有赖于医疗卫生行政部门、科研单位、医院、社区等多家部门单位和高校的紧密合作,往往涉及多方面资源的整合和调度,随访过程中需要投入大量的人力物力和长期的资金支持。因此在队列建设过程中,需要协调各部门工作,优化资源配置以提高资源利用度,合理组织调度才能使得现场工作高效开展。
2. 随访质量的保障:大型出生队列的建立会为今后的多项研究提供充足的数据和样本资源。然而,大样本人群的随访工作却十分艰巨。在不断纳入成员的同时,控制失访率、提高数据收集质量是队列工作的重点和难点。随访率的高低主要取决于研究对象的依从性,因此在队列建设工作中需要采取一些可行有效的措施提升队列人群对项目的信任度、参与感和获得感。为此,项目组应从研究对象角度出发,优化纳入和随访全流程,推动队列内涵文化活动建设,举办成员内部活动,保持公众号的更新,以各种形式的互动强化项目组与纳入成员之间的联系。
3. 研究发现需与时俱进:出生队列的研究成果往往基于过去几年甚至几十年来收集的数据,而人们的生活环境、行为习惯、临床诊疗标准等随着时代的推动都在发生着翻天覆地的变化,这就要求进行队列研究时应具有敏锐的洞察力,抓住当今时代背景下与健康相关的重点难点,不断与时俱进,寻求创新突破,为生殖发育疾病防治和出生人口质量提升提供新的循证医学证据。
4. 关联结果的验证:确定生命早期暴露与远期不良结局的因果关系对于提出改善出生人口健康的早期干预措施至关重要。然而,因果关联的发现仅依靠观察性的队列研究是远远不够的,尤其对于一些距终点事件较远的早期暴露。目前已有一些研究开始利用遗传工具变量、随机干预试验等进行因果机制验证[20-21]。因此,对于队列研究中发现的关联结果须持谨慎的态度,应结合机制研究(如构建动物模型和类器官)或开展随机对照试验等多种方法进行重复验证以确认关联的可靠性。
5. 数据安全与隐私保护:队列工作开展过程中会产生大量的隐私数据。大数据的安全存储与安全访问和研究对象的隐私保护至关重要。在研究开始之前,就应设置数据安全和隐私保护措施。例如在收集研究对象的资料后,应对数据进行脱敏处理,避免直接使用研究对象身份证号、手机号等敏感信息;队列开展过程中涉及的纸质材料(如知情同意书、早期纸质问卷等)应统一存放至资料室以保障安全;所涉及的电子数据(如电子问卷、问卷录音等)应防止网络入侵,定期做好数据备份;相关研究人员应在上岗前进行数据安全培训并签订数据安全与保密协议,使用数据时严格遵照规定;从数据收集、传输及使用的过程中,应设有专岗专员进行登记备份及督察,及时发现并纠正各种可能导致隐私泄露的不当操作。
四、未来展望1. 子代随访的延续:队列建设任重而又道远,队列建设的成功有赖于长期并且无限期持续的随访,是大型队列研究中极为重要和艰巨的工作,也是研究取得突破的关键。目前,队列的子代随访仅延续至子代3岁,受制于较短的回访年限,生命早期暴露对子代远期健康的影响尚未可知。自队列启动至今,许多队列成员的子代已满6岁,子代远期的随访工作亟待开展,亟需成立专家委员会商讨并制定标准化工作流程,寻求各部门单位的通力协作,通过试点单位的试运行敲定最终随访方案。
2. 新兴技术的运用:队列已完成了尿液元素组学、血浆代谢组学、基因组学的检测。新兴技术的不断涌现能够使对感兴趣的分子进行捕获和高通量检测,从而深入探究病因机制。近年来,随着单细胞测序技术、类器官技术的发展,使得人们既能从单个细胞水平去捕获遗传变异[22],又能通过体外模拟器官发育系统地探究结构和功能的改变机制[23]。因此,在队列建设过程中,应利用好队列多种类多时点样本的优势,秉持不断学习,开放交流的态度,合理利用新兴技术,才能与时俱进。以科学问题掌舵,以新兴技术作桨,通过多学科多组学交叉融合,才能在科学研究中不断攻坚克难。
3. 数据开放共享机制:队列数据的产生有赖于多方合作,为了使资源和数据最大限度地发挥科学价值,应当秉承“公开、共享、合作、共赢”的理念。为了实现资源共享,项目组制定了包括《队列研究中心数据共享方案》《队列研究中心数据平台使用协议》和《数据安全和保密协议》的队列数据库公开共享制度,并在队列伦理审查委员会和科学咨询委员会的监督和指导下,通过开放课题的形式逐步开放多渠道数据和样本资源共享。未来将不断完善数据安全体系建设,着力搭建数据共享平台,为学术共同体打造专用于研究的公共产品,充分实现出生队列数据与资源的共享,推进数字资源相关产业的发展。
建立出生队列联盟:我国出生队列研究在过去10年内陆续兴起,这给妇幼和生殖健康研究以及疾病早期起源相关研究提供了重要机遇。但是,各地开展的出生队列研究样本量差异较大,各研究所涉及内容深浅不一,并存在各种局限性。例如,单一出生队列研究中部分暴露因素异质性较低,难以研究这些暴露因素对于健康的影响;多数出生队列研究因样本量有限,难以开展对于效应比较弱的暴露和危险因素、罕发疾病事件等相关研究;部分研究结果缺乏验证,统计效能较低,结果的可信度和可推广性存疑;单一出生队列常无法研究暴露和疾病事件的纵向变化趋势和地理分布特征。此外,中国各地人口遗传背景、生活方式仍存在较大的差异,单一队列仅能够代表当地人群,外推性较差。与此同时,在循证医学和精准防控大背景下,我国妇幼和生殖健康领域相关政策和临床指南亦需要具有较好全国代表性的出生队列证据的支撑。鉴于此,有必要发起全国性出生队列研究联盟,整合我国各地出生队列研究资源,发挥出生队列的大样本前瞻性研究的优势。
利益冲突 所有作者声明无利益冲突
作者贡献声明 窦媛燕:资料整合、制定论文框架、论文撰写与修改;蒋杨倩、杜江波、宋词:收集资料、论文修改建议;马红霞、林苑:论文审阅、行政技术与材料支持;沈洪兵、胡志斌:论文构思、指导与审阅、经费支持
| [1] |
Lawlor DA, Andersen AMN, Batty GD. Birth cohort studies: past, present and future[J]. Int J Epidemiol, 2009, 38(4): 897-902. DOI:10.1093/ije/dyp240 |
| [2] |
Olsen J, Melbye M, Olsen SF, et al. The danish national Birth cohort—its background, structure and aim[J]. Scand J Public Health, 2001, 29(4): 300-307. DOI:10.1177/14034948010290040201 |
| [3] |
Nordstrom T, Miettunen J, Auvinen J, et al. Cohort profile: 46 years of follow-up of the Northern Finland Birth cohort 1966 (NFBC1966)[J]. Int J Epidemiol, 2022, 50(6): 1786-1787j. DOI:10.1093/ije/dyab109 |
| [4] |
Kooijman MN, Kruithof CJ, van Duijn CM, et al. The generation R study: design and cohort update 2017[J]. Eur J Epidemiol, 2016, 31(12): 1243-1264. DOI:10.1007/s10654-016-0224-9 |
| [5] |
Golding J. The avon longitudinal study of parents and children (ALSPAC)—study design and collaborative opportunities[J]. Eur J Endocrinol, 2004, 151(Suppl 3): U119-123. DOI:10.1530/eje.0.151u119 |
| [6] |
Zhang J, Tian Y, Wang WY, et al. Cohort profile: the Shanghai Birth Cohort[J]. Int J Epidemiol, 2019, 48(1): 21-21 g. DOI:10.1093/ije/dyy277 |
| [7] |
Tao FB, Hao JH, Huang K, et al. Cohort profile: the China-Anhui birth cohort study[J]. Int J Epidemiol, 2013, 42(3): 709-721. DOI:10.1093/ije/dys085 |
| [8] |
Qiu X, Lu JH, He JR, et al. The born in Guangzhou cohort study (BIGCS)[J]. Eur J Epidemiol, 2017, 32(4): 337-346. DOI:10.1007/s10654-017-0239-x |
| [9] |
Inhorn MC, Patrizio P. Infertility around the globe: new thinking on gender, reproductive technologies and global movements in the 21st century[J]. Hum Reprod Update, 2015, 21(4): 411-426. DOI:10.1093/humupd/dmv016 |
| [10] |
Kawwass JF, Badell ML. Maternal and fetal risk associated with assisted reproductive technology[J]. Obstet Gynecol, 2018, 132(3): 763-772. DOI:10.1097/AOG.0000000000002786 |
| [11] |
Louis GMB, Hediger ML, Bell EM, et al. Methodology for establishing a population-based birth cohort focusing on couple fertility and children's development, the Upstate KIDS Study[J]. Paediatr Perinat Epidemiol, 2014, 28(3): 191-202. DOI:10.1111/ppe.12121 |
| [12] |
Messerlian C, Williams PL, Ford JB, et al. The environment and reproductive health (EARTH) study: a prospective preconception cohort[J]. Hum Reprod Open, 2018, 2018(2): hoy001. DOI:10.1093/hropen/hoy001 |
| [13] |
胡志斌, 杜江波, 徐欣, 等. 中国国家出生队列建设背景和设计简介[J]. 中华流行病学杂志, 2021, 42(4): 569-574. Hu ZB, Du JB, Xu X, et al. Profile of China National Birth Cohort[J]. Chin J Epidemiol, 2021, 42(4): 569-574. DOI:10.3760/cma.j.cn112338-20201211-01402 |
| [14] |
Lv H, Diao FY, Du JB, et al. Assisted reproductive technology and birth defects in a Chinese birth cohort study[J]. Lancet Reg Health West Pac, 2021, 7: 100090. DOI:10.1016/j.lanwpc.2020.100090 |
| [15] |
Wang C, Lv H, Ling XF, et al. Association of assisted reproductive technology, germline de novo mutations and congenital heart defects in a prospective birth cohort study[J]. Cell Res, 2021, 31(8): 919-928. DOI:10.1038/s41422-021-00521-w |
| [16] |
Lu Q, Lin Y, Chen T, et al. Alterations of gut microbiota composition in neonates conceived by assisted reproductive technology and its relation to infant growth[J]. Gut Microbes, 2020, 12(1): 1794466. DOI:10.1080/19490976.2020.1794466 |
| [17] |
Xu X, Tao SY, Huang L, et al. Maternal PM2.5 exposure during gestation and offspring neurodevelopment: Findings from a prospective birth cohort study[J]. Sci Total Environ, 2022, 842: 156778. DOI:10.1016/j.scitotenv.2022.156778 |
| [18] |
Tao SY, Du JB, Chi X, et al. Associations between antenatal corticosteroid exposure and neurodevelopment in infants[J]. Am J Obstet Gynecol, 2022, 227(5): 759.e1-759.e15. DOI:10.1016/j.ajog.2022.05.060 |
| [19] |
Lv SY, Qin R, Jiang YQ, et al. Association of maternal dietary patterns during gestation and offspring neurodevelopment[J]. Nutrients, 2022, 14(4): 730. DOI:10.3390/nu14040730 |
| [20] |
Morales E, Sunyer J, Julvez J, et al. GSTM1 polymorphisms modify the effect of maternal smoking during pregnancy on cognitive functioning in preschoolers[J]. Int J Epidemiol, 2009, 38(3): 690-697. DOI:10.1093/ije/dyp141 |
| [21] |
Kramer MS, Matush L, Vanilovich I, et al. Effects of prolonged and exclusive breastfeeding on child height, weight, adiposity, and blood pressure at age 6.5 y: evidence from a large randomized trial[J]. Am J Clin Nutr, 2007, 86(6): 1717-1721. DOI:10.1093/ajcn/86.5.1717 |
| [22] |
Ziegenhain C, Vieth B, Parekh S, et al. Comparative analysis of single-cell RNA sequencing methods[J]. Mol Cell, 2017, 65(4): 631-643.e4. DOI:10.1016/j.molcel.2017.01.023 |
| [23] |
Rossi G, Manfrin A, Lutolf MP. Progress and potential in organoid research[J]. Nat Rev Genet, 2018, 19(11): 671-687. DOI:10.1038/s41576-018-0051-9 |
 2023, Vol. 44
2023, Vol. 44


