文章信息
- 吴秀贞, 刘宗超, 覃向向, 李毅, 张兰福, 李哲轩, 张阳, 周彤, 张婧莹, 刘卫东, 游伟程, 潘凯枫, 李文庆.
- Wu Xiuzhen, Liu Zongchao, Qin Xiangxiang, Li Yi, Zhang Lanfu, Li Zhexuan, Zhang Yang, Zhou Tong, Zhang Jingying, Liu Weidong, You Weicheng, Pan Kaifeng, Li Wenqing
- 基于胃癌高发区人群筛查队列的不同胃黏膜病变进展为胃癌风险的前瞻性研究
- The risk of incident gastric cancer for populations with different precancerous gastric lesions: a prospective follow-up study
- 中华流行病学杂志, 2022, 43(12): 1972-1978
- Chinese Journal of Epidemiology, 2022, 43(12): 1972-1978
- http://dx.doi.org/10.3760/cma.j.cn112338-20220817-00716
-
文章历史
收稿日期: 2022-08-17
2. 北京大学肿瘤医院暨北京市肿瘤防治研究所流行病学研究室, 北京 100142;
3. 山东省临朐县胃癌防治研究所, 临朐 262600
2. Department of Cancer Epidemiology, Peking University Cancer Hospital and Institute, Beijing 100142, China;
3. Institute for Gastric Cancer Prevention of Linqu of Shandong Province, Linqu 262600, China
胃癌居全球和我国癌症发病谱及死因谱的前列[1],全球每年有近半数胃癌新发和死亡病例发生在我国[2]。大部分早期胃癌通过内镜下黏膜切除术或内镜黏膜下剥离术即可获得根除性治疗。然而,由于胃癌的早期症状不典型且病情隐匿,多数胃癌一经诊断即为进展期。进展期胃癌即使接受手术治疗,仍预后不佳。近年来,我国胃癌防治能力虽逐渐提升,但胃癌早期检出率和五年生存率仍较低[3-4],胃癌仍将长期是我国癌症防控工作的重点之一。
鉴于大规模人群中胃癌一级预防的可行性仍在持续论证[5-6],以早发现、早诊断和早治疗为主要目标的二级预防是当前政府层面胃癌防控的主要关注点[7-8]。胃癌尤其是肠型胃癌的发生是多阶段演变的过程,正常胃黏膜经历浅表性胃炎(superficial gastritis,SG)、慢性萎缩性胃炎(chronic atrophic gastritis,CAG)、肠上皮化生(intestinal metaplasia,IM)、低级别上皮内瘤变(low-grade intraepithelial neoplasia,LGIN)多个阶段,最终进展为高级别上皮内瘤变(high-grade intraepithelial neoplasia,HGIN)和浸润性胃癌[9-10]。这一多阶段演进特征为识别胃黏膜病变进展和胃癌发生的高危人群从而开展有针对性的胃癌预防提供了可能。然而,与其他癌症的筛查模式相似[11],我国胃癌防控目前仍处“粗放型”阶段,缺乏精细的研究证据,亟须进一步提升浓缩高危人群和分级干预的能力。明确目前我国胃癌高发区居民胃黏膜病变的分布情况,并精确量化不同胃黏膜病变进展的风险,可为现阶段制定科学的胃癌筛查策略、合理分配防控资源提供重要证据。
对象与方法1. 研究对象:本研究依托山东省临朐县胃癌高发区开展的国家上消化道癌早诊早治项目既往已收集的胃镜检查和前瞻性随访数据进行统计分析[8]。该早诊早治项目受试者均为40~69岁,2012年1月1日至2018年12月31日期间首次接受胃镜检查,胃黏膜组织病理学诊断遵循《新悉尼标准(1996年)》[12]和《中国慢性胃炎共识意见(2006年)》[13],由轻至重依次为:正常、SG、CAG、IM、LGIN、HGIN和浸润性胃癌。每例受检者不同部位的组织病理诊断中,以最严重病变作为最终病理诊断。按照上消化道癌早诊早治项目要求,对病理诊断为重度CAG、重度IM和LGIN者,每年接受1次内镜随访;对HGIN、黏膜内癌患者建议采取内镜下治疗如内镜黏膜切除术或内镜黏膜下剥离术等;对黏膜下癌以上病变的患者采取外科手术、辅助化疗或其他治疗手段。患者接受治疗后填写治疗情况登记表;拒绝治疗者,至少每6个月随访1次,并签署拒绝治疗知情同意书。由于HGIN的生物学特点与早期浸润性胃癌近似,且两者在早诊早治技术方案遵循基本一致的临床治疗原则,因此早诊早治项目将HGIN及浸润性胃癌统一视为胃癌[14]。
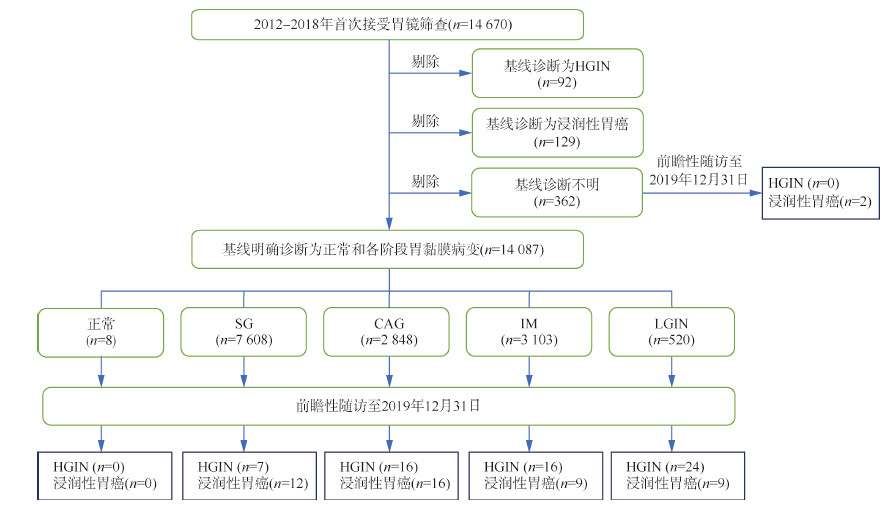
本研究将具有明确胃黏膜病理诊断且未患HGIN或浸润性胃癌的14 087例受试者(包括胃黏膜正常或患有各种级别胃黏膜病变)纳入分析(图 1),分析各级别胃黏膜病变患病情况,并前瞻性随访探讨其进展为胃癌的风险。
|
| 注:CAG:慢性萎缩性胃炎;HGIN:高级别上皮内瘤变;IM:肠上皮化生;LGIN:低级别上皮内瘤变;SG:浅表性胃炎 图 1 研究设计 |
研究对象初次接受内镜检查的时间视为纳入研究的时间,前瞻性随访判定胃癌的发生情况,随访截止于2019年12月31日。研究对象的观测结局通过被动与主动随访相结合的方式进行确认。被动随访包括通过重复胃镜筛查、肿瘤登记系统报告及医院信息管理系统中摘抄的临床病历对发病结局进行联合判定。主动随访包括对当地村医以及胃癌早诊早治项目工作组成员进行电话和入村随访。研究对象的发病、死亡及生存信息均经身份证号多次匹配和核对。研究对象均已签署知情同意书。
2. 统计学分析:研究对象的基本资料以例数(%)进行描述。采用χ2检验比较受检者首次内镜筛查病理诊断检出胃黏膜病变的患病率与高发区既往筛查(1989年,2 628例受检者)检出病变情况的差异。为探索不同胃黏膜病变阶段人群进展至胃癌的风险,采用Poisson回归模型对比不同胃黏膜病变人群的HGIN、浸润性胃癌及合并胃癌(HGIN和浸润性癌)的发病风险,计算调整年龄、性别后的相对危险度(relative risk,RR)和95%CI。由于基线胃黏膜完全正常的个体仅8例,故将其与SG合并作为回归模型的参照组。为确保研究结果的稳健性,开展敏感性分析,排除随访一年内即发生胃癌的研究对象后,再次计算不同胃黏膜病变阶段人群进展至胃癌的风险。此外,根据年龄开展分层分析(40~、50~、60~69岁)。使用Nelson-Aalen法绘制不同基线胃黏膜病变组随访期间的胃癌累积发病风险曲线。
结果1. 基本信息:14 670例研究对象中,排除129例经内镜检查和病理诊断确诊为浸润性胃癌者、92例诊断为HGIN者以及362例基线病理诊断不明者,本研究共纳入年龄在40~69岁、具有明确胃黏膜病理诊断的14 087例研究对象,其中胃黏膜正常者8例(0.06%),最高病理诊断为SG、CAG、IM和LGIN者分别为7 608例(54.00%)、2 848例(20.22%)、3 103例(22.03%)和520例(3.69%)。与既往依托高发区的研究相似[5, 13],上消化道癌早诊早治项目中高发区胃黏膜完全正常的个体极少。研究对象的年龄、性别分布情况见表 1。
2.不同胃黏膜病变进展至胃癌的风险:研究对象随访时间[M(Q1,Q3)]为5.1(3.1,6.6)年,共新发63例HGIN和46例浸润性胃癌。其中基线诊断为正常胃黏膜者随访期间无胃癌发生,而基线诊断为SG、CAG、IM和LGIN者分别有0.25%(19/7 608)、1.12%(32/2 848)、0.81%(25/3 103)和6.35%(35/520)进展为胃癌(图 1)。进一步采用Poisson回归分析显示,与基线正常或仅有SG的个体相比,胃黏膜病变为CAG、IM、LGIN的个体进展为胃癌(包括HGIN和浸润性胃癌)的风险依次增加为3.85倍(RR=3.85,95%CI:2.04~7.28)、5.18倍(RR=5.18,95%CI:2.79~9.60)和19.08倍(RR=19.08,95%CI:9.97~36.53)(图 2A)。随基线病变严重程度增加,HGIN和浸润性胃癌的发生风险均呈现级联增加趋势。与基线正常/SG组相比,胃黏膜病变为CAG、IM、LGIN的个体进展为HGIN的风险依次增加为4.47(95%CI:1.91~10.45)倍、7.24(95%CI:3.24~16.20)倍和22.96(95%CI:9.71~54.27)倍(图 2B),而进展为浸润性胃癌的风险依次增加为3.14(95%CI:1.19~8.26)倍、2.80(95%CI:1.00~7.77)倍和14.64(95%CI:5.37~39.93)倍(图 2C)。

|
| 注:A:包括高级别上皮内瘤变和浸润性胃癌;B:高级别上皮内瘤变;C:浸润性胃癌;SG:浅表性胃炎;CAG:慢性萎缩性胃炎;IM:肠化生;LGIN:低级别上皮内瘤变 图 2 各阶段胃黏膜病变者胃癌累积发生风险 |
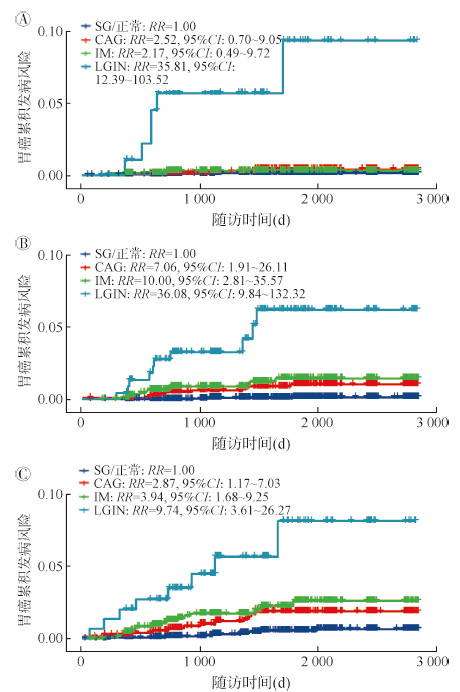
3. 各阶段胃黏膜病变进展为胃癌风险的年龄变化趋势:为探究不同年龄组人群各阶段胃黏膜病变进展为胃癌的风险,进一步按年龄进行分层分析。结果显示,与基线正常/SG组相比,各年龄组均呈现出LGIN者随访期间胃癌发生风险的显著增加。此外,在50~59岁和60~69岁人群中,基线患CAG或IM者进展为胃癌的风险也均显著增加。然而,在40~49岁组,未发现基线CAG或IM者随访期间胃癌发生风险的显著改变。见图 3。
|
| 注:A:40~49岁;B:50~59岁;C:60~69岁;SG:浅表性胃炎;CAG:慢性萎缩性胃炎;IM:肠上皮化生;LGIN:低级别上皮内瘤变 图 3 各阶段胃黏膜病变者年龄别胃癌累积发生风险 |
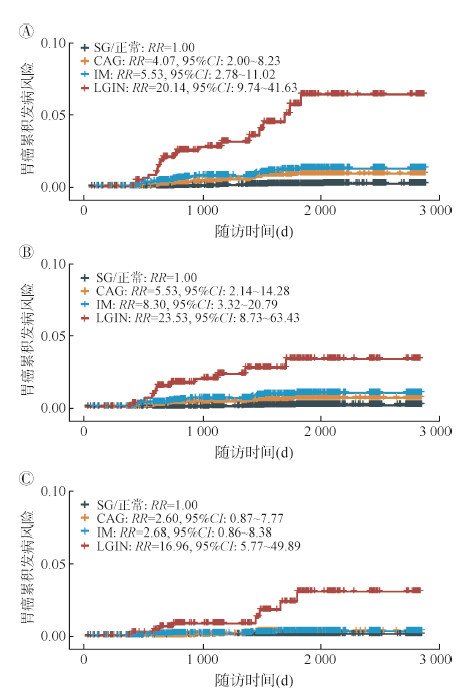
4. 敏感性分析:经前瞻性随访发现的新发胃癌病例中,有11例HGIN和7例浸润性癌病例在研究对象随访一年内即被确诊。排除随访一年内确诊者后,胃黏膜病变严重程度与HGIN和浸润性胃癌发生风险之间的关联与前述分析保持一致。与基线正常/SG组相比,胃黏膜病变为CAG、IM和LGIN的个体进展为胃癌(包括HGIN和浸润性胃癌)、仅HGIN或浸润性胃癌的风险均呈现级联递增趋势(图 4)。
|
| 注:排除随访一年内确诊的胃癌病例;A:高级别上皮内瘤变和浸润性胃癌;B:高级别上皮内瘤变;C:浸润性胃癌;SG:浅表性胃炎;CAG:慢性萎缩性胃炎;IM:肠上皮化生;LGIN:低级别上皮内瘤变 图 4 各阶段胃黏膜病变者胃癌累积发生风险的敏感性分析 |
山东省临朐县是我国北方胃癌高发区,本团队依托临朐县现场的研究成果已成为多个胃癌防控指南的重要依据[5-8, 10, 15-22]。本团队研究发现,临朐县居民正常胃黏膜的比例极低,其中50%以上患有IM及更严重的胃黏膜病变,5年胃镜随访研究证实胃癌发生风险与胃黏膜病变严重程度呈正相关[10, 18, 22],明确了根除幽门螺杆菌感染可显著降低胃癌的发生[20, 23]和死亡风险[5],并为内镜筛查效果的科学评价发出中国声音[8]。另外,随着当地经济与卫生条件的显著改善,临朐县胃癌发病率和死亡率近年来呈明显下降趋势[24]。
与团队1989年在临朐县开展的研究(n=2 628)相比[10],本研究轻度胃黏膜病变(SG和CAG)的相对占比明显增加(74.22% vs. 47.97%),而重度胃黏膜病变(IM:22.03% vs. 32.57%;LGIN:3.69% vs. 19.46%,均P < 0.000 1)占比则下降。然而,当前上消化道癌早诊早治项目在胃镜检查和活检组织取材部位、取材数量、组织病理诊断标准等方面均存在差异,可能影响了研究结果与既往结果的可比性。前瞻性随访研究结果与Correa[9]胃癌多阶段发病模型高度相符,且与既往研究报道的关联强度相当[25-26]。
本研究提示,胃癌的筛查及防控策略可在明确患者病变和年龄的基础上进行细化:对年龄偏高者应更关注特定病变类型所面临的癌变风险,及时采取合适的干预或治疗措施;对筛查过程中检出LGIN者,应重点关注其进展至胃癌的风险,采取合适的治疗策略。此外,考虑到仅有少部分LGIN会进展至胃癌,未来研究仍需致力于寻找理想的胃黏膜病变进展为胃癌的生物标志物,尤其是高灵敏度标志物用于初筛,改善当前胃癌防控的粗放型模式。
不同胃黏膜病变发生胃癌的相对风险在不同年龄段差异较大。Change等[27]发现对50~80岁人群进行筛查最符合成本效用;新加坡一项研究则发现对50~70岁华裔男性筛查的成本效益优势[28];日本学者Mizota和Yamamoto[29]通过计算人群筛查数和人群需召回数两个指标,平衡筛查的收益和损害,建议可不对40~54岁人群进行筛查。为进一步优化符合我国国情的胃癌筛查策略,仍需进一步提供人群随机对照和前瞻性研究证据,结合多维度高危暴露因素和风险预测方法,明确适宜筛查年龄等筛查关键要素,促进胃癌防控精准化。
本研究存在局限性。首先,研究可能存在选择偏倚。由于内镜筛查要求受试者未患严重禁忌症,可能具有更强的健康意识和更良好的身体状况。其次,胃癌结局事件通过主动和被动随访相结合的形式获取,其中HGIN只能通过重复性胃镜筛查诊断。由于仅有一部分研究对象进行重复性胃镜筛查,可能导致HGIN漏诊。再次,上消化道癌早诊早治项目开展初期并未完备收集幽门螺杆菌感染及生活方式信息,导致无法在分析中校正这些因素。最后,研究结果向低发区一般居民推广时可能受限。
综上所述,基于胃癌高发区的大样本研究显示,绝大多数40~69岁居民患有不同级别胃黏膜病变,但病变严重程度整体相较30年前有明显下降。随病变严重程度增加,随访期间发生胃癌的风险呈级联上升趋势。该研究结果表明我国胃癌高发区积极开展胃癌防控项目的重要性,为基于胃黏膜病变患病情况进行胃癌分级干预提供了重要科学依据。
利益冲突 所有作者声明无利益冲突
作者贡献声明 吴秀贞、刘宗超:数据整理、统计学分析、论文撰写、经费支持;覃向向:数据采集和质控、数据整理、统计学分析;李毅、张兰福、刘卫东:现场维护与资源调度、数据采集和质控;李哲轩、张阳:数据整理、现场维护与资源调度;周彤、张婧莹:现场维护与资源调度;游伟程、潘凯枫、李文庆:研究设计、论文修改、经费支持
| [1] |
Sung H, Ferlay J, Siegel RL, et al. Global cancer statistics 2020:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2021, 71(3): 209-249. DOI:10.3322/caac.21660 |
| [2] |
刘宗超, 李哲轩, 张阳, 等. 2020全球癌症统计报告解读[J]. 肿瘤综合治疗: 电子杂志, 2021, 7(2): 1-13. Liu ZC, Li ZX, Zhang Y, et al. Interpretation on the report of Global Cancer Statistics 2020[J]. Journal of Multidisciplinary Cancer Management: Electronic Version, 2021, 7(2): 1-13. DOI:10.12151/JMCM.2021.02-01 |
| [3] |
Zeng H, Ran X, An L, et al. Disparities in stage at diagnosis for five common cancers in China: a multicentre, hospital-based, observational study[J]. Lancet Glob Health, 2021, 6(12): e877-887. DOI:10.1016/S2468-2667(21)00157-2 |
| [4] |
Zeng H, Chen W, Zheng R, et al. Changing cancer survival in China during 2003-15:a pooled analysis of 17 population-based cancer registries[J]. Lancet Glob Health, 2018, 6(5): e555-567. DOI:10.1016/S2214-109X(18)30127-X |
| [5] |
Li WQ, Zhang JY, Ma JL, et al. Effects of Helicobacter pylori treatment and vitamin and garlic supplementation on gastric cancer incidence and mortality: follow-up of a randomized intervention trial[J]. BMJ, 2019, 366: 15016. DOI:10.1136/bmj.l5016 |
| [6] |
Pan KF, Zhang L, Gerhard M, et al. A large randomised controlled intervention trial to prevent gastric cancer by eradication of Helicobacter pylori in Linqu County, China: baseline results and factors affecting the eradication[J]. Gut, 2016, 65(1): 9-18. DOI:10.1136/gutjnl-2015-309197 |
| [7] |
Fan X, Qin X, Zhang Y, et al. Screening for gastric cancer in China: Advances, challenges and visions[J]. Chin J Cancer Res, 2021, 33(2): 168-180. DOI:10.21147/j.issn.1000-9604.2021.02.05 |
| [8] |
Li WQ, Qin XX, Li ZX, et al. Beneficial effects of endoscopic screening on gastric cancer and its optimal screening interval: a population-based study[J]. Endoscopy, 2022, 54(9): 848-858. DOI:10.1055/a-1728-5673 |
| [9] |
Correa P. Human gastric carcinogenesis: a multistep and multifactorial process-first American Cancer Society award lecture on cancer epidemiology and prevention[J]. Cancer Res, 1992, 52(24): 6735-6740. |
| [10] |
You WC, Li JY, Blot WJ, et al. Evolution of precancerous lesions in a rural Chinese population at high risk of gastric cancer[J]. Int J Cancer, 1999, 83(5): 615-619. DOI:10.1002/(sici)1097-0215(19991126)83:5<615:aid-ijc8>3.0.co;2-l |
| [11] |
Fitzgerald RC, Antoniou AC, Fruk L, et al. The future of early cancer detection[J]. Nat Med, 2022, 28(4): 666-677. DOI:10.1038/s41591-022-01746-x |
| [12] |
Dixon MF, Genta RM, Yardley JH, et al. Classification and grading of gastritis: the updated Sydney system[J]. Am J Surg Pathol, 1996, 20(10): 1161-1181. DOI:10.1097/00000478-199610000-00001 |
| [13] |
You WC, Blot WJ, Li JY, et al. Precancerous gastric lesions in a population at high risk of stomach cancer[J]. Cancer Res, 1993, 53(6): 1317-1321. |
| [14] |
国家消化道早癌防治中心联盟, 中华医学会消化病学分会幽门螺杆菌学组. 中国胃黏膜癌前状态和癌前病变的处理策略专家共识(2020年)[J]. 中华消化杂志, 2020, 40(11): 734-741. National Clinical Research Center for Digestive Disease (Shanghai), National Early Gastrointestinal-Center Prevention & Treatment Center Alliance, Helicobacter Pylori Group, Chinese Society of Gastroenterology, Chinese Medical Association, et al. Chinese consensus on management of gastric epithelial precancerous conditions and lesions (2020)[J]. Chin J Dig, 2020, 40(11): 731-741. DOI:10.3760/cma.j.cn311367-20200915-00554 |
| [15] |
You WC, Blot W J, Chang YS, et al. Diet and high risk of stomach cancer in Shandong, China[J]. Cancer Res, 1988, 48(12): 3518-3523. |
| [16] |
You WC, Blot W J, Chang YS, et al. Allium vegetables and reduced risk of stomach cancer[J]. J Natl Cancer Inst, 1989, 81(2): 162-164. DOI:10.1093/jnci/81.2.162 |
| [17] |
You WC, Zhang L, Gail MH, et al. Helicobacter pylori infection, garlic intake and precancerous lesions in a Chinese population at low risk of gastric cancer[J]. Int J Epidemiol, 1998, 27(6): 941-944. DOI:10.1093/ije/27.6.941 |
| [18] |
You WC, Zhang L, Gail MH, et al. Gastric dysplasia and gastric cancer: Helicobacter pylori, serum vitamin C, and other risk factors[J]. J Natl Cancer Inst, 2000, 92(19): 1607-1612. DOI:10.1093/jnci/92.19.1607 |
| [19] |
You WC, Brown LM, Zhang L, et al. Randomized double-blind factorial trial of three treatments to reduce the prevalence of precancerous gastric lesions[J]. J Natl Cancer Inst, 2006, 98(14): 974-983. DOI:10.1093/jnci/djj264 |
| [20] |
Ma JL, Zhang L, Brown LM, et al. Fifteen-Year Effects of Helicobacter pylori, Garlic, and Vitamin Treatments on Gastric Cancer Incidence and Mortality[J]. J Natl Cancer Inst, 2012, 104(6): 488-492. DOI:10.1093/jnci/djs003 |
| [21] |
Li WQ, Ma JL, Zhang L, et al. Effects of Helicobacter pylori treatment on gastric cancer incidence and mortality in subgroups[J]. J Natl Cancer Inst, 2014, 106(7): dju116. DOI:10.1093/jnci/dju116 |
| [22] |
You WC, Zhao L, Chang YS, et al. Progression of precancerous gastric lesions[J]. The Lancet, 1995, 345(8953): 866-867. DOI:10.1016/s0140-6736(95)93006-x |
| [23] |
Herrero R, Parsonnet J, Greenberg ER. Prevention of gastric cancer[J]. JAMA, 2014, 312(12): 1197-1198. DOI:10.1001/jama.2014.10498 |
| [24] |
覃向向, 李文庆, 李哲轩, 等. 2012-2019年山东省临朐县胃癌发病与死亡趋势分析[J]. 中国肿瘤, 2021, 30(6): 415-421. Qin XX, Li WQ, Li ZX, et al. Trends of Gastric Cancer Incidence and Mortality from 2012 to 2019 in Linqu County, Shandong Province[J]. China Cancer, 2021, 30(6): 415-421. DOI:10.11735/j.issn.1004-0242.2021.06.A03 |
| [25] |
de Vries AC, van Grieken NC, Looman CW, et al. Gastric cancer risk in patients with premalignant gastric lesions: a nationwide cohort study in the Netherlands[J]. Gastroenterology, 2008, 134(4): 945-952. DOI:10.1053/j.gastro.2008.01.071 |
| [26] |
Song H, Ekheden IG, Zheng Z, et al. Incidence of gastric cancer among patients with gastric precancerous lesions: observational cohort study in a low risk Western population[J]. BMJ, 2015, 351: h3867. DOI:10.1136/bmj.h3867 |
| [27] |
Change HS, Park EC, Chung W, et al. Comparing Endoscopy and Upper Gastrointestinal X-ray for Gastric Cancer Screening in South Korea: A Cost-utility Analysis [J/OL]. Asian Pac J Cancer Prev, 2012, 13(6): 2721-2728. DOI: 10.7314/apjcp.2012.13.6.2721.
|
| [28] |
Dan YY, So J, Yeoh KG. Endoscopic screening for gastric cancer[J]. Clin Gastroenterol Hepatol, 2006, 4(6): 709-716. DOI:10.1016/j.cgh.2006.03.025 |
| [29] |
Mizota Y, Yamamoto S. How long should we continue gastric cancer screening? From an epidemiological point of view[J]. Gastric Cancer, 2019, 22(3): 456-462. DOI:10.1007/s10120-018-0877-z |
 2022, Vol. 43
2022, Vol. 43