文章信息
- 罗瑶, 李玥, 黄亚兰, 张晓敏, 熊玲红, 张仁利, 阳帆.
- Luo Yao, Li Yue, Huang Yalan, Zhang Xiaomin, Xiong Linghong, Zhang Renli, Yang Fan
- 深圳市啮齿动物感染汉坦病毒的基因特征研究
- Genetic characteristics of hantavirus detected in rodents in Shenzhen
- 中华流行病学杂志, 2022, 43(11): 1804-1810
- Chinese Journal of Epidemiology, 2022, 43(11): 1804-1810
- http://dx.doi.org/10.3760/cma.j.cn112338-20220629-00576
-
文章历史
收稿日期: 2022-06-29
2. 深圳市疾病预防控制中心病原生物研究所, 深圳 518055
2. Institute of Pathogenic Biology, Shenzhen Center for Disease Prevention and Control, Shenzhen 518055, China
汉坦病毒是一种分节段的负链单股RNA病毒,属于布尼亚病毒科(Bunyaviridae)汉坦病毒属(Genus hantavirus)。汉坦病毒不同的血清型可以引起不同的疾病,主要是肾综合征出血热(hemorrhagic fever with renal syndrome,HFRS)和汉坦病毒肺综合征(hantavirus pulmonary syndrome,HPS),HFRS在中国呈高度流行,占世界病例总数的90%[1],HPS在我国还未出现相关病例。汉坦病毒在中国流行的两种血清型,汉滩病毒和汉城病毒主要由黑线姬鼠和褐家鼠携带,是HFRS的两种主要病原体[2]。汉坦病毒含有小(S)、中(M)和大(L)3个基因片段,分别编码核衣壳蛋白(nucleocapsid protein,NP)、糖蛋白前体蛋白(glycoprotein precursor,GPC)和L蛋白或病毒RNA依赖的RNA聚合酶[3]。GPC翻译后可被水解为Gn和Gc两个糖蛋白,其中Gc含有主要的中和抗原决定簇能诱导机体产生中和抗体,对感染汉坦病毒的动物和人体具有保护作用,所以国内外大多数研究选择Gc基因(即G2)进行扩增进而对汉坦病毒分型[4-5]。
我国HFRS发病呈现明显的地域差异,北方地区发病率显著高于南方[6]。在2014年的调查中,广东省的HFRS报告发病数处于全国排名第9位,珠三角地区(广州、深圳、佛山、珠海、东莞)的发病率较广东省其他地市高[7-8],其中深圳市自2015年以来HFRS疫情呈现下降趋势,但每年仍然有不少病例出现[9]。为从病原学上得出HFRS病原体的分子流行病学特征,本研究于2021年9-11月在深圳市开展鼠类动物携带汉坦病毒病原学监测。
材料与方法1. 标本来源:2021年9-11月由深圳市CDC及其下属单位组织,在深圳市龙岗、宝安、光明、罗湖、龙华区及大鹏新区采用笼日法布点布笼捕鼠。将捕获的啮齿动物经分类鉴定和记录编号后,以无菌操作取鼠肺,标本放-80 ℃冰箱中冷冻保存。
2. 汉坦病毒检测与分型:将2 ml含1个不锈钢珠(直径5 mm)的微离心管放置在干冰上至少预冷15 min。取30 mg新鲜或冷冻鼠肺组织转移至预冷的微离心管中,于干冰上孵育15 min后,再放入无菌组织研磨器中室温下孵育2 min,加入适当体积裂解缓冲液,研磨充分后取上清,使用瑞士罗氏公司MagNA Pure 96 Cellular RNA Large Volume Kit核酸提取试剂盒、MagNA Pure 96全自动核酸纯化仪按照操作手册提取鼠肺研磨液中的RNA。采用中国上海伯杰医疗科技股份有限公司生产的汉滩病毒/汉城病毒核酸检测试剂盒(双重荧光PCR法,SJ-BM-202-2)对核酸进行检测及分型。
3. 反转录-巢式PCR:汉滩病毒和汉城病毒特异性引物参照文献[10]。取荧光PCR阳性且Ct≤30的核酸样品,使用PrimeScriptTM1 st strand cDNA Synthesis Kit(日本TaKaRa公司)试剂盒进行反转录合成cDNA,反应条件:50 ℃,60 min;70 ℃,15 min灭活反转录酶。获得cDNA后使用Ex Taq® Hot Start Version(日本TaKaRa公司)试剂盒进行巢式PCR,两轮反应条件相同。反应条件:98 ℃,10 s;55 ℃,30 s;72 ℃,1 min,30个循环。取5 μl第1轮PCR反应产物为模板,使用不同型别的内引物进行第2轮PCR反应,反应总体积均为50 μl。使用1%琼脂糖凝胶电泳对扩增产物验证,选择具有代表性的汉坦病毒阳性样品送往深圳市华大基因科技有限公司进行M(G2)基因和S基因部分片段PCR产物测序。
4. 序列同源性分析及进化树的构建:通过BioEdit、Mega 11.0软件对测序结果进行拼接修剪、多序列比对;采用MegAlign软件进行同源性分析;采用Mega 11.0软件以邻接法构建系统发生树,检验方法用Bootstrap法重复1 000次分析,iTOL在线网站对进化树进行美化(https//itol.embl.de/)。采用DNAMAN 9.0和SnapGene软件分析氨基酸突变位点以及蛋白质二级结构预测。对亚型分析参考序列来源于美国国家生物技术信息中心(NCBI)(http//www.ncbi.nlm.nih.gov)。
5. 统计学分析:采用Excel软件对鼠类监测数据进行整理汇总,采用SPSS 21.0软件对鼠类病原学监测结果进行统计学分析,以P < 0.05为差异有统计学意义。
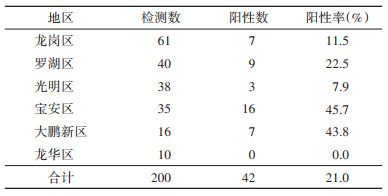
结果1. 鼠类携带汉坦病毒病原学监测:在深圳市6个行政区共捕获200只鼠类动物,其中,龙岗区61只(30.5%),罗湖区40只(20.0%),光明区38只(19.0%),宝安区35只(17.5%),大鹏新区16只(8.0%),龙华区10只(5.0%);包括3个鼠种:褐家鼠189只、黄胸鼠9只和小家鼠2只。荧光PCR检出汉坦病毒阳性鼠肺42份,均为汉城病毒,带毒率为21.0%。褐家鼠汉坦病毒检出阳性率为20.1%(38/189),9只黄胸鼠中4只检出汉坦病毒,小家鼠未检出,鼠种间的检出率差异经Fisher确切概率检验结果显示差异无统计学意义(χ2=3.20,P > 0.05)。各个行政区的鼠类汉坦病毒检出情况见表 1,各区汉坦病毒阳性率差异有统计学意义(χ2=25.60,P < 0.05)。
2. 序列测定及同源性分析:根据标本采集地区、鼠种和编号命名各区检出的汉坦病毒序列(LG=龙岗区、GM=光明区、BA=宝安区、DP=大鹏新区,其中龙华区鼠肺未检出,则LH为罗湖区的标本序列名称)。对测序结果进行修剪,去掉引物和多余序列,得到M片段和S片段各25条,比较的核苷酸序列长度分别为300 bp(2 003~2 302 nt)和368 bp(613~980 nt)。
(1)M片段序列同源性分析:对核酸序列结果同源性分析结果显示,获得的M片段序列相互间的相似性为95.3%~100.0%,与汉滩病毒标准株76-118相似性为70.7%~72.0%,与汉城病毒标准株80-39的相似性为94.3%~96.3%。与深圳市历年分离出的SZ2082株核苷酸相似性达96.3%~98.7%,与深圳市以往检出的汉坦病毒标本(lh072、lh034、ba066、ba013)序列相似性为95.0%~99.0%[10-11]。与其他国内外发现的汉城病毒毒株核酸序列同源性最高的是来自广州市的GZ325,相似性达到96.3%~100.0%。
(2)S片段序列同源性分析:对核酸序列结果同源性分析结果显示,获得的25条S片段序列相互间相似性为97.6%~100.0%,与汉滩病毒标准株76-118相似性为66.6%~67.1%,与汉城病毒标准株80-39的相似性为94.6%~95.9%。与历年分离株SZ2082的核苷酸相似性达98.4%~99.7%,与以往检出汉坦病毒标本(lh072、lh034、ba066、ba013)相似性为97.3%~100.0%。与其他汉城病毒序列同源性最高的是来自广州市越秀区的GZRn98,相似性为98.1%~100.0%。由此可见,此次在深圳市发现的汉坦病毒毒株均为汉城病毒。
3. 核苷酸与氨基酸变异位点分析:以汉城病毒标准株80-39为参考序列,核苷酸序列中碱基置换突变(点突变)较多,对于M(G2)基因编码的糖蛋白,仅发现全部序列第2 092位碱基由G变为A,与BA-131第2 093位由G变为A,导致第29位精氨酸R变为赖氨酸K,但与疫苗株L99、Z37相比则未见变异位点。见图 1。在S基因编码的核衣壳蛋白中有1个特异的氨基酸位点差异,为BA-111序列第973位由G变为A,导致氨基酸发生突变,由丙氨酸A变为苏氨酸T。见图 2。在所有的氨基酸突变位点中未发现与相关免疫抗原表位有关的位点。

|
| 图 1 深圳市汉坦病毒M片段(2 003~2 302 nt)与周边地区代表毒株核苷酸与氨基酸差异位点比较 |

|
| 图 2 深圳市汉坦病毒S片段(613~980 nt)与周边地区代表毒株核苷酸与氨基酸差异位点比较 |
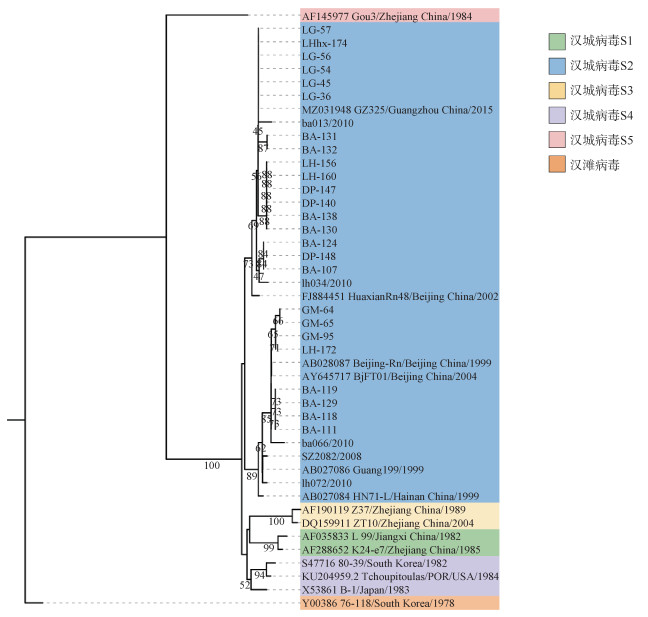
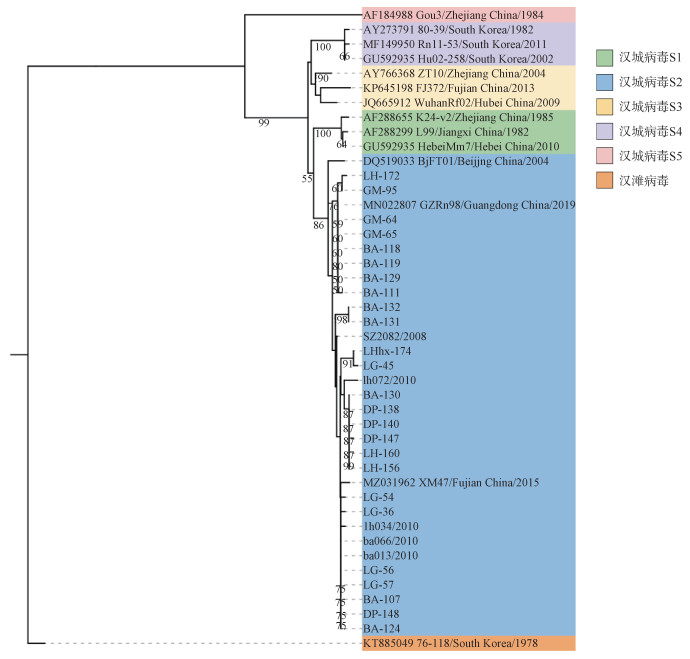
4. 系统进化树分析:根据测序结果获得的25株M和S基因核苷酸序列以及参考国内外汉坦病毒各基因亚型代表序列,利用Mega 11.0软件构建系统进化树。本研究所获得的鼠类汉坦病毒毒株M片段(2 003~2 302 nt)核酸序列与汉城病毒-S2亚型的几株参考序列在同一枝大分支上,与BjFT01、Beijing-Rn、GZ325等的遗传变异度均较小。见图 3。根据S片段(613~980 nt)构建的系统发育树可以得出和M片段同样的结果,与北京市的BjFT01、广东省的GZRn98和福建省的XM47属于同一分支(图 4)。2条片段基因序列均与汉滩病毒标准株76-118基因差异跨度较大,与S2亚型参考序列处于同一分支可以证明该25株汉坦病毒属于汉城病毒的S2亚型。此外,不同行政区的M和S片段样本序列在系统发育树中的S2分支均有不同程度的聚集。
|
| 图 3 深圳市汉坦病毒M片段(G2区)核苷酸序列(2 003~2 302 nt)系统进化树 |
|
| 图 4 深圳市汉坦病毒S片段核苷酸序列(613~980 nt)系统进化树 |
本研究在深圳市部分地区共捕获啮齿动物200只,汉坦病毒检测阳性42份,优势鼠种为褐家鼠,其次为黄胸鼠和小家鼠。阳性样本经荧光PCR分型均为汉城病毒,与既往研究结果相同[10-11],即深圳市属于HFRS疫源地家鼠型(汉城病毒)疫区。有学者研究发现深圳市宝安区为HFRS高发区,此结果与本研究中宝安区鼠类汉坦病毒带毒率(45.7%)最高的现象相呼应[9]。宝安区捕鼠布点均为城中村,该区城中村用地面积达27.6 km2,人口密度超出全市平均数值,餐饮、商业等服务场所密集,每日产生大量生活、餐厨垃圾,易出现鼠类泛滥的情况。汉坦病毒的传播主要是人类与啮齿动物直接接触或吸入受感染动物的排泄物或分泌物中的污染气溶胶[12],所以有理由认为HFRS病例出现与当地鼠类汉坦病毒感染率相关。
过去普遍认为汉坦病毒具有宿主特异性,具体表现为不同型别的汉坦病毒在与宿主长期共存的过程中形成各自独特的基因特征,每一型的汉坦病毒主要由一种或几种亲缘关系密切的鼠类动物携带并传播[13]。但在本研究中发现汉坦病毒阳性鼠肺中有4份来自黄胸鼠,通过系统发育树分析黄胸鼠携带的汉坦病毒的序列与褐家鼠处于同一分支且同源性极高,都能携带同一亚型的汉城病毒。比如LHhx-174(黄胸鼠)与LG-45(褐家鼠)等几株毒株扩增出的S以及M基因序列在进化树中呈现一定的区域聚集性,可能是在罗湖与龙岗相邻两区的布点范围周边褐家鼠与黄胸鼠接触活动密切,提示汉城病毒在不同宿主体内适应性强,具有跨种传播的可能性,以及在进化过程中病毒可能从褐家鼠“溢出”到黄胸鼠[14]。我国云南、河南等省份的调查中亦出现了此种“溢出”现象[15],表现为褐家鼠、黄胸鼠和小家鼠均能携带S1和S3型的汉城病毒。Plyusnin和Morzunov[13]提出宿主选择性替换假说来推翻之前的宿主决定论,即汉坦病毒可以跨越宿主-物种屏障,建立新的病毒/宿主系统,当宿主动物与潜在宿主(通常是密切相关的啮齿动物物种)共处时,可能会发生宿主转换事件。
本研究分别对M片段(G2区)和S片段进行核苷酸序列比对,结果显示M片段序列的核苷酸同源性为95.3%~100.0%,S片段序列为97.6%~100.0%,M和S片段序列与汉城病毒参考序列同源性高于汉滩病毒。结合分析系统发育树后发现样本核苷酸序列均与BjFT01等S2亚型参考序列处于同一大分支,种群遗传距离不大,其中与M片段和S片段同源性最高的分别为广州市病毒毒株GZ325和GZRn98,最高均达到100.00%,因此推测深圳市部分汉坦病毒阳性样本极有可能由广州市疫源地传入。珠三角地区口岸众多,对外贸易十分频繁,据一项调查表明在广东省机场口岸、铁路口岸、客运港口岸和货运海港口岸中,海港口岸的鼠形动物及种类最多,客运港口岸鼠密度和汉坦病毒携带率最高,且汉坦病毒检出阳性标本均为汉城病毒的S2亚型[16],与本研究以及过去对深圳市鼠类携带汉坦病毒基因分型的研究结果相符[10-11]。其次,不同行政区之间的汉坦病毒分布呈现出相对的地区聚集性,以及在与深圳市不同区过去获得的汉坦病毒核苷酸序列比对中显示出较高的同源性(ba013与DP-148、LG-57,ba066与DP-148、LG-57同源性达到100%),推测是由于各区鼠类流窜,相邻区甚至距离较远的区域之间鼠类流动性都较强,且核苷酸变异较小所致。尽管汉坦病毒毒株可能来自于不同宿主、不同年代,但对基因的同源性和系统进化影响较小,体现在不同年代的同一地区分离株或不同地区的分离株都处于同一分支,表明汉城病毒还是以地理聚集性为主[17]。值得一提的是,由于有充足的栖息地、食物和水供应,城市环境也已被证明会促进鼠类动物数量的增长和相关人畜共患病的传播[18],汉城病毒高发极有可能与宿主物种和城市环境直接相关[19]。
汉坦病毒M片段基因的变异往往较其他片段更活跃,一个碱基的突变就可能导致病毒毒力、传染性的变化[14]。对样本序列与汉城病毒国际标准株、疫苗株以及来自周边省市(广州市、福建省、海南省等)的代表性毒株序列进行核苷酸与氨基酸变异位点分析后发现,核衣壳蛋白中存在1个氨基酸位点差异,为BA-111第121位由丙氨酸A变为苏氨酸T,其余则多为同义突变。糖蛋白中未见明显特异性氨基酸突变,表明深圳市汉坦病毒与邻近地区汉坦病毒同源性较大,流行性出血热疫苗对于人群预防HFRS也依旧具有有效的保护作用。
本研究对深圳市的鼠类种群、汉坦病毒的分子流行病学进行了调查,明确了深圳市汉坦病毒鼠类宿主所携带的汉坦病毒基因型为汉城病毒的S2型,与广东省汉城病毒主要流行亚型相同,且与福建省、海南省等地毒株同源性较高,汉坦病毒核衣壳蛋白存在1个氨基酸变异位点。优势鼠种为褐家鼠,亦是深圳市HFRS的主要传染源,各区应根据当地的生态环境特点以及鼠类动物的活动习性制定不同的防治措施以预防此类自然疫源性疾病的发生,在控制家鼠类动物孳生的同时也应加大对黄胸鼠的灭除。
利益冲突 所有作者声明无利益冲突
作者贡献声明 罗瑶:设计实验、实验操作、统计学分析、论文撰写;李玥、黄亚兰、张晓敏、熊玲红:数据采集与整理、实验操作;张仁利:研究审阅指导;阳帆:实验设计、研究指导、论文修改
| [1] |
Fang LQ, Wang XJ, Liang S, et al. Spatiotemporal trends and climatic factors of hemorrhagic fever with renal syndrome epidemic in Shandong Province, China[J]. PLoS Negl Trop Dis, 2010, 4(8): e789. DOI:10.1371/journal.pntd.0000789 |
| [2] |
Liu J, Liu DY, Chen W, et al. Genetic analysis of hantaviruses and their rodent hosts in central-south China[J]. Virus Res, 2012, 163(2): 439-447. DOI:10.1016/j.virusres.2011.11.006 |
| [3] |
Avšič-Županc T, Saksida A, Korva M. Hantavirus infections[J]. Clin Microbiol Infect, 2019, 21: e6-16. DOI:10.1111/1469-0691.12291 |
| [4] |
Zhang FL, Wu XA, Luo W, et al. The expression and genetic immunization of chimeric fragment of Hantaan virus M and S segments[J]. Biochem Biophys Res Commun, 2007, 354(4): 858-863. DOI:10.1016/j.bbrc.2007.01.020 |
| [5] |
车雷, 张国斌, 高丹, 等. 沈阳市鼠携带汉坦病毒G2片段基因分型及序列特征分析[J]. 中国媒介生物学及控制杂志, 2019, 30(1): 91-94. Che L, Zhang GB, Gao D, et al. Genotyping and sequence analysis of G2 segment of hantavirus carried by rats in Shenyang, China[J]. Chin J Vector Biol Control, 2019, 30(1): 91-94. DOI:10.11853/j.issn.1003.8280.2019.01.022 |
| [6] |
陈俊江, 国天赐, 宋姝璇, 等. 中国肾综合征出血热流行特征及时空分析模型进展[J]. 中华流行病学杂志, 2020, 41(10): 1735-1740. Chen JJ, Guo TC, Song SX, et al. Epidemiological characteristics and the development of spatiotemporal analysis models on hemorrhagic fever with renal syndrome in China[J]. Chin J Epidemiol, 2020, 41(10): 1735-1740. DOI:10.3760/cma.j.cn112338-20191108-00794 |
| [7] |
王芹, 李建东, 张全福, 等. 2014年全国肾综合征出血热监测总结和疫情分析[J]. 疾病监测, 2016, 31(3): 192-199. Wang Q, Li JD, Zhang QF, et al. Surveillance for hemorrhagic fever with renal syndrome in China, 2014[J]. Dis Surveill, 2016, 31(3): 192-199. DOI:10.3784/j.issn.1003-9961.2016.03.005 |
| [8] |
余靓, 梁丽君, 黄平, 等. 广东地区肾综合征出血热流行特征与气象因素的ARIMA模型分析[J]. 中华疾病控制杂志, 2016, 20(8): 851-855. Yu L, Liang LJ, Huang P, et al. An ARIMA model of epidemiological features of hemorrhagic fever with renal syndrome and its meteorological factors in Guangdong[J]. Chin J Dis Control Prev, 2016, 20(8): 851-855. DOI:10.16462/j.cnki.zhjbkz.2016.08.024 |
| [9] |
王敬忠, 廖异, 程聪. 深圳市2010-2019年肾综合征出血热流行病学特征[J]. 中国热带医学, 2021, 21(3): 244-246. Wang JZ, Liao Y, Cheng C. Epidemiologic characteristics of hemorrhagic fever with renal syndrome in Shenzhen, 2010-2019[J]. China Trop Med, 2021, 21(3): 244-246. DOI:10.13604/j.cnki.46-1064/r.2021.03.10 |
| [10] |
阳帆, 何建凡, 刘建军, 等. 深圳市HFRS疫源地鼠携带汉坦病毒与人感染汉坦病毒的基因特征对应性研究[J]. 中华微生物学和免疫学杂志, 2010, 30(12): 1092-1096. Yang F, He JF, Liu JJ, et al. Analysis of the gene characteristic correspondence on rats with Hantavirus and the human infected Hantavirus in natural epidemic areas of HFRS in Shenzhen[J]. Chin J Microbiol Immunol, 2010, 30(12): 1092-1096. DOI:10.3760/cma.j.issn.0254-5101.2010.12.007 |
| [11] |
阳帆, 刘建军, 何建凡, 等. 深圳市肾综合征出血热疫源地宿主动物汉坦病毒分离株的基因分型[J]. 中华传染病杂志, 2008, 26(3): 138-142. Yang F, Liu JJ, He JF, et al. Genotypes of isolated strains of Hantaviruses from reservoir animals captured in natural epidemic areas of hemorrhagic fever with renal syndrome in Shenzhen[J]. Chin J Infect Dis, 2008, 26(3): 138-142. DOI:10.3321/j.issn:1000-6680.2008.03.003 |
| [12] |
He WQ, Fu JQ, Wen YQ, et al. Detection and genetic characterization of Seoul virus in liver tissue samples from Rattus norvegicus and Rattus tanezumi in urban areas of southern China[J]. Front Vet Sci, 2021, 8: 748232. DOI:10.3389/fvets.2021.748232 |
| [13] |
Plyusnin A, Morzunov SP. Virus evolution and genetic diversity of hantaviruses and their rodent hosts[M]//Schmaljohn CS, Nichol ST. Hantaviruses. Berlin, Heidelberg: Springer, 2001: 47-75. DOI: 10.1007/978-3-642-56753-7_4.
|
| [14] |
杨其松, 张天琛, 刘晓青, 等. 汉坦病毒及其与宿主基因相互作用研究进展[J]. 中华疾病控制杂志, 2018, 22(7): 751-754. Yang QS, Zhang TC, Liu XQ, et al. Research progress of Hantavirus and its interaction with host genes[J]. Chin J Dis Control Prev, 2018, 22(7): 751-754. DOI:10.16462/j.cnki.zhjbkz.2018.07.022 |
| [15] |
邹洋, 张海林, 张云智, 等. 云南省褐家鼠与黄胸鼠中汉坦病毒的流行病学研究[J]. 中国媒介生物学及控制杂志, 2006, 17(5): 399-403. Zou Y, Zhang HL, Zhang YZ, et al. The epidemiologic investigation and characterization of hantavirus carried by Rattus in Yunnan[J]. Chin J Vector Biol Control, 2006, 17(5): 399-403. DOI:10.3969/j.issn.1003-4692.2006.05.017 |
| [16] |
高云霞, 李小波, 方盛藩, 等. 广东口岸鼠形动物间鼠疫耶尔森菌和汉坦病毒感染状况调查[J]. 中国媒介生物学及控制杂志, 2016, 27(2): 137-140. Gao YX, Li XB, Fang SF, et al. Investigation of Yersinia pestis and Hantavirus carried by small mammal hosts at Guangdong entry-exit ports[J]. Chin J Vector Biol Control, 2016, 27(2): 137-140. DOI:10.11853/j.issn.1003.8280.2016.02.011 |
| [17] |
刘源, 杨章女, 黄鹏, 等. 2005-2017年邻近5省肾综合征出血热病毒演变规律与病原分子进化研究[J]. 现代预防医学, 2019, 46(16): 3009-3013. Liu Y, Yang ZN, Huang P, et al. Study on the spatial-temporal evolution pattern and the Co-evolutionary relationship between hosts and pathogens of hemorrhagic fever with renal syndrome in China southeast coastal area from 2005 to 2017[J]. Mod Prev Med, 2019, 46(16): 3009-3013. |
| [18] |
Tian HY, Hu SX, Cazelles B, et al. Urbanization prolongs hantavirus epidemics in cities[J]. Proc Natl Acad Sci USA, 2018, 115(18): 4707-4712. DOI:10.1073/pnas.1712767115 |
| [19] |
Su QQ, Chen Y, Li M, et al. Genetic characterization and molecular evolution of urban Seoul virus in southern China[J]. Viruses, 2019, 11(12): 1137. DOI:10.3390/v11121137 |
 2022, Vol. 43
2022, Vol. 43