文章信息
- 陈宏利, 周业胜, 郝静静, 张佳欣, 胡婧, 宋畅, 李苗苗, 李丹, 冯毅, 廖玲洁, 阮玉华, 邢辉, 邵一鸣.
- Chen Hongli, Zhou Yesheng, Hao Jingjing, Zhang Jiaxin, Hu Jing, Song Chang, Li Miaomiao, Li Dan, Feng Yi, Liao Lingjie, Ruan Yuhua, Xing Hui, Shao Yiming
- 抗病毒治疗前耐药对HIV感染者治疗3年后病毒学应答的影响
- Effects of pretreatment HIV drug resistance on the virological response of HIV-infected patients after 3-year antiretroviral therapy
- 中华流行病学杂志, 2022, 43(11): 1778-1783
- Chinese Journal of Epidemiology, 2022, 43(11): 1778-1783
- http://dx.doi.org/10.3760/cma.j.cn112338-20220112-00028
-
文章历史
收稿日期: 2022-01-12
截至2021年12月31日,全国报告现存活HIV感染者超100万例,正在抗病毒治疗的HIV感染者占所有现存活HIV感染者的92.9%[1]。扩大检测和抗病毒治疗是进一步降低HIV感染者死亡和二代传播的重要手段之一,但其效果会由于HIV耐药株的传播流行而下降。一项全国2015年开展的HIV耐药调查结果表明,我国HIV感染者抗病毒治疗前耐药率为3.6%,出现频率较高的传播性耐药相关突变位点与抗病毒治疗使用的一线抗病毒治疗药物有关[2]。我国HIV感染者抗病毒治疗前耐药率有一定的上升趋势,在一些艾滋病重点地区HIV感染者抗病毒治疗前耐药率在5.0%以上,其中少数地区达10.0%[3-6]。抗病毒治疗前耐药包括从未抗病毒治疗、以前使用过抗病毒药物(母婴阻断、暴露前预防)或重新开始一线抗病毒治疗HIV感染者,其携带的耐药株可能为传播性或获得性耐药毒株[7]。抗病毒治疗前耐药严重影响HIV抗病毒治疗效果[8-9],而我国的研究报道很少见。本研究通过较大样本量的前瞻性随访调查了解HIV感染者抗病毒治疗前耐药对抗病毒治疗3年后病毒学影响情况。
对象与方法1. 研究对象:2018年开始抗病毒治疗的HIV感染者。纳入标准:①既往有抗病毒药物暴露史(母婴阻断、暴露前预防,之前接受过抗病毒治疗后停药时间≥90 d的HIV感染者)或未接受过抗病毒治疗;②年龄≥18岁;③抗病毒治疗和随访时间为2018-2021年;④完成知情同意。本研究通过中国CDC性病艾滋病预防控制中心伦理委员会审批(批准文号:X140617334)。
2. 研究方法:参考WHO治疗前HIV耐药监测指南及在2017年我国部分地区的HIV耐药调查试点工作情况[4, 10],以2018年全国31个省(自治区、直辖市)市级及县级抗病毒治疗定点医疗机构为基本抽样单位,在近1~2年报告的HIV阳性者人数处于本省份报告人数的中位位置,对其进行治疗前HIV耐药横断面调查[11],在2021年对研究对象进行抗病毒治疗3年后的随访调查,以病毒载量≥50拷贝数/ml作为抗病毒治疗3年后病毒学抑制失败的标准。
3. 现场调查:
(1)2018年在抗病毒治疗定点医疗机构门诊点开展现场调查,收集年龄、性别、民族、文化程度、职业、婚姻状况、感染途径和初始抗病毒治疗方案等信息。
(2)2021年开展第二次现场调查,收集最近1次抗病毒治疗方案、情感支持、行为特征和服药依从性。
4. 实验室检测:现场采用EDTA抗凝采血管采集静脉血8 ml,血样分装处理后保存于-80 ℃冰箱,运送到中国CDC进行实验室检测。CD4+T淋巴细胞(CD4)计数和病毒载量检测由当地CDC实验室完成。抗病毒治疗前全部血样和抗病毒治疗后病毒载量≥50拷贝数/ml血样,采用QIAsymphonySP仪器全自动核酸提取仪(凯杰企业管理有限公司)从200 μl的血浆中提取HIV-1 RNA,应用RT-PCR法进行扩增,获得序列后,使用Sequencer 5.4.6软件进行序列拼接,BioEdit 7.1软件进行比对和清理。通过邻接法(Neighbor-Joining)构建系统进化树,设置bootstrap为1 000且校验值≥70%判定亚型。
5. 相关定义:耐药判定采用美国斯坦福大学耐药数据库(https://hivdb.stanford.edu),标准为2014年WHO耐药监测指南推荐的12种监测药物中有至少一种耐药评分≥15分即判定为耐药[6]。抗病毒治疗前耐药率的计算以治疗前血样获得的序列的样本数为分母,抗病毒治疗后耐药率以治疗后病毒载量≥50拷贝数/ml血样获得序列的样本数为分母。
6. 统计学分析:采用EpiData 3.1软件录入和整理数据。采用SAS 9.4软件进行统计学分析。采用单因素logistic回归模型分析抗病毒治疗3年后病毒学抑制失败的影响因素,单因素分析后进行多因素分析,筛选自变量的标准为0.05。双侧检验,检验水准α=0.05。
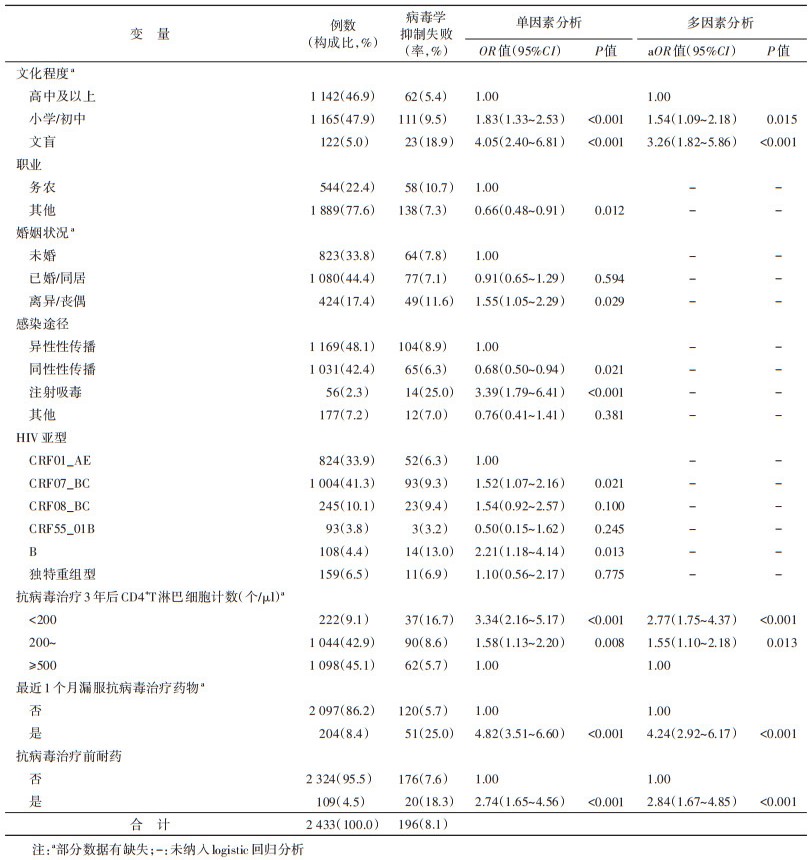
结果1. 基本情况:2 433例研究对象中,18~、35~和≥50岁分别占41.6%(1 012/2 433)、32.1%(781/2 433)和26.3%(640/2 433);男性和女性分别占82.8%(2 015/2 433)和17.2%(418/2 433);汉族和少数民族分别占84.1%(2 047/2 433)和15.9%(386/2 433)。文盲、小学/初中、高中及以上文化程度分别占5.0%、47.9%、46.9%;务农和其他职业分别占22.4%和77.6%;未婚、已婚/同居、离异/丧偶分别占33.8%、44.4%、17.4%;异性性传播、同性性传播和注射吸毒传播分别占48.1%、42.4%和2.3%。HIV亚型以CRF07_BC为主(41.3%),CRF01_AE、CRFO8_BC、CRF55_01B、B和独特重组型(URFs)分别占33.9%、10.1%、3.8%、4.4%和6.5%。见表 1。
2. HIV感染者抗病毒治疗3年后病毒学应答情况:2018年纳入合格样本量3 348例,随访3年后,死亡146例,随访2 433例,随访率72.7%(2 433/3 348)。抗病毒治疗3年后HIV感染者病毒载量≥50拷贝数/ml的为196例(8.1%,196/2 433)(95%CI:7.0%~9.1%),其中病毒载量≥1 000拷贝数/ml的比例为4.4%(107/2 433)(95%CI:3.6%~5.2%)。抗病毒治疗前耐药和不耐药的HIV感染者中,抗病毒治疗3年后病毒载量≥50拷贝数/ml分别占18.3%(20/109)(95%CI:11.1%~25.6%)和7.6%(176/2 324)(95%CI:6.5%~8.6%),差异有统计学意义。对196例血样进行基因型耐药检测,获得127例的血样pol区基因序列,扩增成功率为64.8%(127/196),抗病毒治疗3年后HIV耐药率为2.5%(60/2 433)(95%CI:1.9%~3.2%),其中抗病毒治疗前耐药和不耐药的HIV感染者抗病毒治疗3年后耐药率分别为4.6%(5/109)(95%CI:0.7%~8.5%)和2.4%(55/2 324)(95%CI:1.7%~2.9%)。
3. 抗病毒治疗3年后病毒学抑制失败的影响因素:单因素logistic回归模型分析结果显示,抗病毒治疗3年后病毒学抑制失败的影响因素包括文化程度、职业、婚姻状况、感染途径、HIV亚型,抗病毒治疗3年后CD4计数、最近1个月漏服抗病毒治疗药物和抗病毒治疗前耐药。多因素logistic回归模型分析结果显示,抗病毒治疗3年后病毒学抑制失败的危险因素包括文盲(aOR=3.26,95%CI:1.82~5.86)、小学/初中文化程度(aOR=1.54,95%CI:1.09~2.18)、抗病毒治疗3年后CD4计数分别为 < 200个/μl(aOR=2.77,95%CI:1.75~4.37)和200~499个/μl(aOR=1.55,95%CI:1.10~2.18)、最近1个月漏服抗病毒治疗药物(aOR=4.24,95%CI:2.92~6.17)和抗病毒治疗前耐药(aOR=2.84,95%CI:1.67~4.85)。见表 1。
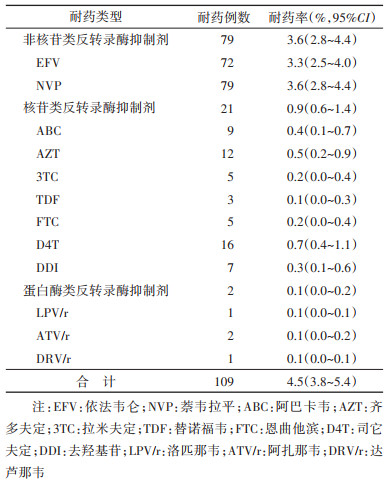
4. HIV感染者抗病毒治疗前耐药突变情况:抗病毒治疗前耐药率为4.5%(109/2 433,95%CI:3.8%~5.4%)。非核苷类反转录酶抑制剂(NNRTIs)耐药率为3.6%(79/2 433),远高于核苷类反转录酶抑制剂(NRTIs)耐药率(0.9%,21/2 433)和蛋白酶类反转录酶抑制剂(PIs)耐药率(0.1%,2/2 433)。见表 2。在耐药突变主要位点中,非核苷类的为V179E/D/N/I占1.7%(37/2 433),其次为K103N/R/N占1.2%(27/2 433)和E138G/N/K占0.8%(23/2 433);核苷类的为T215I/D/N/A/S占0.3%(6/2 433);蛋白酶类的为V82F/I和I54V均占0.1%(1/2 433)。
本研究发现,HIV感染者抗病毒治疗前耐药率为4.5%。参照WHO对耐药传播警戒线的规定,耐药率 < 5%为低度流行,5%~为中度流行,> 15%为高度流行[10]。我国2018年抗病毒治疗前耐药水平为低度流行。我国部分地区的调查结果显示,2004-2005、2003-2014、2015和2017年HIV感染者抗病毒治疗前耐药率分别3.8%、4.7%、3.6%和6.8%[2, 4, 12-13]。我国HIV感染者抗病毒治疗前耐药率呈缓慢上升趋势,少数艾滋病重点地区HIV耐药达中度流行[3-6]。WHO发布的2019年耐药监测报告数据显示,非洲、美洲和亚洲西太平洋的多数国家或地区抗病毒治疗前耐药达中度流行,其中非核苷类耐药率也超过10%,未接受治疗人群的耐药率均呈上升趋势[14-17]。
本研究中,HIV感染者抗病毒治疗3年后病毒学抑制失败率为8.1%。WHO发布的2019年耐药监测报告建议抗病毒治疗病毒学抑制率 > 90%,非洲、美洲和亚洲西太平洋的大多数国家或地区抗病毒治疗效果未能达到该目标值[7]。在本研究中,抗病毒治疗前耐药与不耐药HIV感染者相比,抗病毒治疗3年后病毒学抑制失败率分别为18.3%和7.6%,差异有统计学意义,HIV感染者病毒学抑制失败aOR值(95%CI)为2.84(1.67~4.85)。欧洲国家和撒哈拉以南非洲国家的HIV感染者抗病毒治疗队列研究发现,相比于抗病毒治疗前不耐药的HIV感染者,在抗病毒治疗前耐药的HIV感染者中,HIV感染者抗病毒治疗后病毒学抑制失败率aOR值分别为3.13和2.13[8, 17]。
本研究发现,抗病毒治疗前NNRTIs的耐药率(3.6%)高于NRTIs(0.9%)和PIs(0.1%)。我国部分地区HIV感染者抗病毒治疗前耐药的横断面调查发现,NNRTIs、NRTIs和PIs耐药率分别为4.6%、2.2%和0.6%[4],这与本研究发现的抗病毒治疗前耐药主要为NNRTIs耐药的结论相一致,由于NNRTIs类药物为低基因屏障药物。国外研究发现,与抗病毒治疗前不耐药HIV感染者相比,抗病毒前耐药且以NNRTIs为初始治疗方案的HIV感染者病毒学抑制失败的风险较大[8]。本研究发现,抗病毒治疗3年后病毒学抑制失败的危险因素包括文化程度较低、抗病毒治疗后CD4计数较低和漏服抗病毒治疗药物。文化程度较低的HIV感染者病毒学抑制失败率较高,可能因为其对抗病毒治疗认知程度有限,影响到服药依从性。有研究报道,HIV感染者在CD4计数较低的情况下,开始抗病毒治疗并不影响病毒学抑制,可能会增加死亡风险[18]。HIV感染者的服药依从性较差是抗病毒治疗后病毒学抑制失败的危险因素,建议加强医疗卫生人员抗病毒治疗相关培训和HIV感染者服药依从性宣传教育[19]。
综上所述,我国HIV感染者抗病毒治疗前耐药处于低流行水平,抗病毒治疗3年后病毒学抑制失败率较高。建议加强HIV感染者的耐药监测,重视抗病毒治疗前耐药对抗病毒治疗效果的影响,进一步降低HIV感染者死亡和二代传播风险。
利益冲突 所有作者声明无利益冲突
作者贡献声明 陈宏利:数据整理和分析、论文撰写;周业胜、郝静静、张佳欣、胡婧、宋畅、李苗苗:实验室检测和数据整理;李丹、冯毅、廖玲洁:研究指导;阮玉华、邢辉、邵一鸣:研究设计
| [1] |
中国疾病预防控制中心. 全国艾滋病/性病/丙肝综合防治数据信息年报[R]. 北京: 中国疾病预防控制中心性病控制中心, 2021. Chinese Center for Disease Control and Prevention. Annals of information on comprehensive prevention and treatment for AIDS, STD and hepatitis C [R]. Beijing: Center for STD Control, Chinese Center for Disease Control and Prevention, 2021. |
| [2] |
Zhao S, Feng Y, Hu J, et al. Prevalence of transmitted HIV drug resistance in antiretroviral treatment naïve newly diagnosed individuals in China[J]. Sci Rep, 2018, 8(1): 12273. DOI:10.1038/s41598-018-29202-2 |
| [3] |
Xu XS, Luo LH, Song C, et al. Survey of pretreatment HIV drug resistance and the genetic transmission networks among HIV-positive individuals in southwestern China, 2014-2020[J]. BMC Infect Dis, 2021, 21(1): 1153. DOI:10.1186/s12879-021-06847-5 |
| [4] |
Kang RH, Liang SJ, Ma YL, et al. Pretreatment HIV drug resistance in adults initiating antiretroviral therapy in China, 2017[J]. Infect Dis Poverty, 2020, 9(1): 54. DOI:10.1186/s40249-020-00668-5 |
| [5] |
Yuan D, Yu B, Li YP, et al. Prevalence and molecular epidemiology of transmitted drug resistance and genetic transmission networks among newly diagnosed people living with HIV/AIDS in a minority area, China[J]. Front Public Health, 2021, 9: 731280. DOI:10.3389/fpubh.2021.731280 |
| [6] |
董敖渤, 肖琳, 梁姝, 等. 凉山彝族自治州HIV/AIDS抗病毒治疗前HIV-1耐药情况及其影响因素分析[J]. 中华流行病学杂志, 2019, 40(6): 648-653. Dong AB, Xiao L, Liang S, et al. HIV-1 drug resistance and influencing factors among people living with HIV/AIDS before antiretroviral therapy in Liangshan Yi Autonomous prefecture[J]. Chin J Epidemiol, 2019, 40(6): 648-653. DOI:10.3760/cma.j.issn.0254-6450.2019.06.009 |
| [7] |
World Health Organization. HIV drug resistance report 2019[EB/OL]. (2019-07-20)[2021-12-31]. https://apps.who.int/iris/handle/10665/325891.
|
| [8] |
Hamers RL, Schuurman R, Sigaloff KC, et al. Effect of pretreatment HIV-1 drug resistance on immunological, virological, and drug-resistance outcomes of first-line antiretroviral treatment in sub-Saharan Africa: a multicentre cohort study[J]. Lancet Infect Dis, 2012, 12(4): 307-317. DOI:10.1016/S1473-3099(11)70255-9 |
| [9] |
Bertagnolio S, Hermans L, Jordan MR, et al. Clinical impact of pretreatment human immunodeficiency virus drug resistance in people initiating nonnucleoside reverse transcriptase inhibitor-containing antiretroviral therapy: a systematic review and meta-analysis[J]. J Infect Dis, 2021, 224(3): 377-388. DOI:10.1093/infdis/jiaa683 |
| [10] |
World Health Organization. Surveillance of HIV drug resistance in adults initiating antiretroviral therapy (pre-treatment HIV drug resistance)[EB/OL]. (2014-03-01)[2021-12-31]. http://apps.who.int/iris/bitstream/handle/10665/112802/9789241507196_eng.pdf?sequence=1.
|
| [11] |
Hao JJ, Zheng S, Gan MZ, et al. Changing proportions of HIV-1 subtypes and transmitted drug resistance among newly diagnosed HIV/AIDS individuals-China, 2015 and 2018[J]. China CDC Wkly, 2021, 3(53): 1133-1138. DOI:10.46234/ccdcw2021.251 |
| [12] |
Liao LJ, Xing H, Shang H, et al. The prevalence of transmitted antiretroviral drug resistance in treatment-naive HIV-infected individuals in China[J]. J Acquir Immune Defic Syndr, 2010, 53 Suppl 1(Suppl 1): S10-14. DOI:10.1097/QAI.0b013e3181c7d363 |
| [13] |
刘大锦, 冯孟贤, 刘民. 中国未接受抗病毒治疗的人类免疫缺陷病毒/获得性免疫缺陷综合征(HIV/AIDS)人群HIV原发耐药的Meta分析[J]. 北京大学学报: 医学版, 2015, 47(3): 474-482. Liu DJ, Feng MX, Liu M. Primary drug resistance of human immunodeficiency virus (HIV) among the treatment-naive individuals with HIV in China: a Meta-analysis[J]. J Peking University: Health Sciences, 2015, 47(3): 474-482. DOI:10.3969/j.issn.1671-167X.2015.03.020 |
| [14] |
Rhee SY, Kassaye SG, Barrow G, et al. HIV-1 transmitted drug resistance surveillance: shifting trends in study design and prevalence estimates[J]. J Int AIDS Soc, 2020, 23(9): e25611. DOI:10.1002/jia2.25611 |
| [15] |
Hattori J, Shiino T, Gatanaga H, et al. Characteristics of transmitted drug-resistant HIV-1 in recently infected treatment-naive patients in Japan[J]. J Acquir Immune Defic Syndr, 2016, 71(4): 367-373. DOI:10.1097/QAI.0000000000000861 |
| [16] |
Kassaye SG, Grossman Z, Balamane M, et al. Transmitted HIV drug resistance is high and longstanding in metropolitan Washington, DC[J]. Clin Infect Dis, 2016, 63(6): 836-843. DOI:10.1093/cid/ciw382 |
| [17] |
Wittkop L, Günthard HF, de Wolf F, et al. Effect of transmitted drug resistance on virological and immunological response to initial combination antiretroviral therapy for HIV (EuroCoord-CHAIN joint project): a European multicohort study[J]. Lancet Infect Dis, 2011, 11(5): 363-371. DOI:10.1016/S1473-3099(11)70032-9 |
| [18] |
Wakooko P, Gavamukulya Y, Wandabwa JN. Viral load suppression and associated factors among HIV patients on antiretroviral treatment in Bulambuli district, eastern Uganda: a retrospective cohort study[J]. AIDS Res Ther, 2020, 13: 1178633720970632. DOI:10.1177/1178633720970632 |
| [19] |
Liu PT, Xing H, Liao LJ, et al. HIV drug resistance in patients in China's national HIV treatment programme who have been on first-line ART for at least 9 months[J]. AIDS Res Ther, 2020, 17(1): 9. DOI:10.1186/s12981-020-00264-5 |
 2022, Vol. 43
2022, Vol. 43