文章信息
- 魏明伟, 李靖欣, 储凯, 朱加宏, 朱凤才.
- Wei Mingwei, Li Jingxin, Chu Kai, Zhu Jiahong, Zhu Fengcai
- b型流感嗜血杆菌结合疫苗接种后5年的免疫持久性观察
- Five-year immunity persistence following immunization with haemophilus influenzae type b conjugate vaccine
- 中华流行病学杂志, 2022, 43(11): 1768-1772
- Chinese Journal of Epidemiology, 2022, 43(11): 1768-1772
- http://dx.doi.org/10.3760/cma.j.cn112338-20220526-00467
-
文章历史
收稿日期: 2022-05-26
2. 江苏省涟水县疾病预防控制中心项目办公室, 淮安 223499
2. Program Office, Lianshui County Center for Disease Control and Prevention, Huai'an 223499, China
b型流感嗜血杆菌(haemophilus influenzae type b,Hib)是一种仅感染人类的细菌性病原体,属于革兰阴性菌,主要通过呼吸飞沫和呼吸分泌物直接接触传播[1-3]。Hib导致的严重感染主要发生在5岁以下儿童,尤其是 < 2岁婴幼儿,可引起脑膜炎、肺炎、菌血症等多种严重疾病[4-6]。据Wahl等[7]估计,Hib曾每年导致800多万儿童感染,30多万儿童死亡,中国2015年仍有约3 400人因Hib死亡。目前,接种Hib结合疫苗是预防Hib相关侵袭性疾病有效的手段。目前,全球已有193个WHO成员国和地区将Hib结合疫苗纳入国家免疫规划[8-9]。我国现有4种可用于预防Hib感染的疫苗(包括Hib疫苗、百白破-Hib联合疫苗、百白破-脊灰-Hib联合疫苗和A群C群脑膜炎球菌-Hib联合疫苗),但均为非免疫规划疫苗[10]。某国产Hib结合疫苗已于2014年完成Ⅲ期临床试验[11-12],于2017年5月18日被批准上市,并于2022年5月5日获得药品再注册批准通知书。在前期临床试验中,该疫苗的免疫原性结果仅局限于基础免疫和1年后加强接种28 d,长期免疫原性尚有待研究。因此,有必要延长免疫原性监测,评估该疫苗的免疫持久性。
对象与方法1. 疫苗和免疫程序:Hib结合疫苗,每剂至少含10 μg纯化Hib荚膜多糖/0.5 ml,由成都欧林生物科技股份有限公司生产。各年龄组的免疫程序不同:①3~5月龄婴儿,0-28-56 d,基础免疫接种3针,1年后加强接种1针;②6~11月龄婴儿,0-28 d,2针;③1~5岁幼儿,0 d,1针。本研究已通过江苏省CDC伦理委员会的审批(批准文号:JSJK2019-A018-01)。
2. 研究设计:在江苏省涟水县开展的3月龄至5岁的健康人群中进行的一项随机、盲态、阳性对照设计的Ⅲ期临床试验以及加强免疫研究基础上[11-12],2019年11-12月开展接种后5年队列的持久性研究。此项研究仅针对于试验疫苗组中完成Hib结合疫苗的基础接种和加强接种的研究对象进行重新招募,采血检测抗Hib-荚膜多糖(PRP)抗体,并且进行免疫持久性评价。此外,结合前期临床研究中,接种前、全程接种后28 d和1年后加强接种后28 d的免疫原性检测结果,进行免疫持久性变化趋势分析。
3. 免疫原性检测:选取符合条件的研究对象采集接种后5年的静脉全血,分离血清,送中国食品药品检定研究院,采用间接ELISA法检测每份血清抗Hib-PRP抗体含量。依据WHO对Hib结合疫苗临床血清学的要求[13-14]:①当≥70%免疫血清抗Hib-PRP抗体,浓度≥1.0 μg/ml,则认为试验疫苗免疫原性良好,为≥70%的研究对象提供长期保护;②当≥85%免疫血清抗Hib-PRP抗体,浓度≥0.15 μg/ml,则认为试验疫苗免疫原性良好,为≥85%的研究对象提供短期保护。相关定义:①长期保护率为血清抗Hib-PRP抗体浓度≥1.0 μg/ml的比例;②短期保护率为血清抗Hib-PRP抗体浓度≥0.15 μg/ml的比例。
4. 统计学分析:采用SPSS 23.0软件对结果进行统计学分析。研究对象性别比和抗体阳性率采用χ2检验;抗体浓度经对数转换,以几何平均浓度(GMC)、几何平均浓度增长倍数(GMFI)、标准差及95%CI表示,采用方差分析检验;以P < 0.05为差异有统计学意义。
结果1. 基本情况:580例研究对象中,男性292例(50.34%)、女性288例(49.66%);3~5月龄组、6~11月龄组以及1~5岁组分别有158例(男女性别比为1.03∶1)、207例(男女性别比为1.03∶1)和215例(男女性别比为0.99∶1),各年龄组性别差异无统计学意义(χ2=0.05,P=0.977)。
2. 接种后5年抗Hib-PRP抗体长期保护率和短期保护率:3~5月龄、6~11月龄和1~5岁组研究对象接种后5年的长期保护率和短期保护率均分别为89.24%、90.34%和98.60%,差异有统计学意义(均P < 0.001);男性和女性各组内不同年龄组的长期保护率和短期保护率差异均有统计学意义(P < 0.05)。见表 1。
3. 接种后5年抗Hib-PRP抗体GMC:3~5月龄、6~11月龄和1~5岁组研究对象接种后5年的GMC分别为3.95、3.11和10.01 μg/ml,差异有统计学意义(P < 0.001);男、女性各组内的不同年龄组的GMC间差异均有统计学意义(P < 0.001)。见表 1。
4. 接种后5年抗Hib-PRP抗体GMFI:3~5月龄、6~11月龄和1~5岁组研究对象接种后5年的GMFI分别为29.04、11.01和3.26,差异有统计学意义(P < 0.001);男、女性各组内的不同年龄组的GMFI间差异均有统计学意义(P < 0.001)。见表 1。
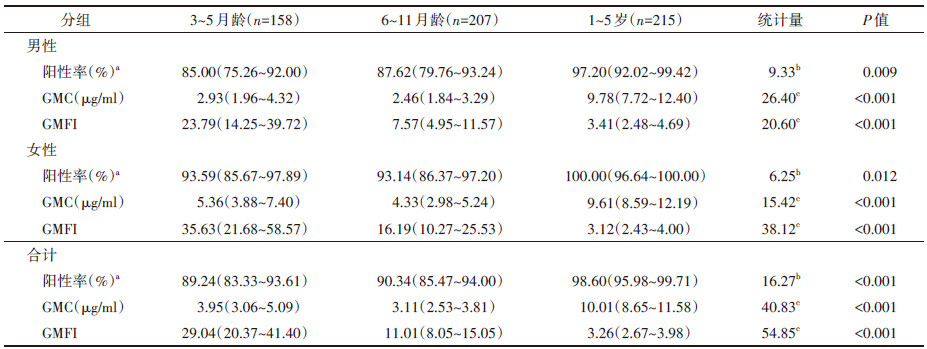
5. 接种后5年持久性变化趋势:3~5月龄研究对象在接种前、全程接种后28 d、1年后加强接种后28 d和接种后5年的长期保护率分别为14.73%、100.00%、100.00%和89.24%,GMC分别为0.13、15.73、57.21和3.95 μg/ml。6~11月龄研究对象在接种前、全程接种后28 d和接种后5年的长期保护率分别为38.10%、100.00%和90.34%,GMC分别为0.32、14.94和3.11 μg/ml。1~5岁研究对象在接种前、全程接种后28 d和接种后5年的长期保护率分别为88.65%、100.00%和98.60%,GMC分别为3.12、131.47和10.01 μg/ml。见图 1,2。
|
| 图 1 b型流感嗜血杆菌(Hib)结合疫苗免疫前及接种后5年抗Hib-PRP抗体长期保护率 |

|
| 图 2 b型流感嗜血杆菌(Hib)结合疫苗免疫前及接种后5年抗Hib-PRP抗体几何平均浓度变化趋势 |
Hib结合疫苗的接种对于Hib感染所致疾病的控制作用在全球范围内已得到公认且被纳入国家免疫规划,而我国由于Hib结合疫苗纳入计划免疫后免疫程序选择的困难、6月龄以内婴儿排针困难、免费针次的问题、Hib所致疾病的监测以及卫生经济学评价的不完善等原因[15],导致Hib结合疫苗是否能被纳入国家免疫规划、以何种方式纳入国家免疫规划,尚亟待解决。目前,我国已上市的多家Hib结合疫苗在儿童中均能产生良好的免疫原性和安全性,但该疫苗在中国人群中接种后的免疫持久性研究未见报道。本研究在前期Hib结合疫苗Ⅲ期临床试验以及基础接种1年后加强免疫试验基础上[11-12],重点对国产Hib结合疫苗组的研究对象接种后5年的免疫原性结果进行分析,以期为完善我国Hib结合疫苗免疫策略提供参考依据。
本研究发现,3~5月龄、6~11月龄和1~5岁组的研究对象接种后5年血清抗Hib-PRP抗体浓度≥1.0 μg/ml和≥0.15 μg/ml的百分比均超过了89%,虽然低于Ⅲ期临床试验基础免疫和加强免疫的100%,但仍满足WHO规定的至少70%的研究对象血清PRP抗体浓度≥1.0 μg/ml和至少85%的研究对象血清PRP抗体浓度≥0.15 μg/ml的要求。此外,上述各年龄组接种后5年的GMC(3.95、3.11和10.01 μg/ml)与接种前水平(0.13、0.32和3.12 μg/ml)[11]相比仍均有显著提高且GMFI > 3.0倍(29.04、11.01和3.26),均说明该国产Hib结合疫苗接种后5年仍具有良好的免疫原性。国外的研究报道Hib结合疫苗接种后的免疫持久性能保持2~8年[16-18],与本研究结果基本一致。本研究还发现,接种后5年GMFI随年龄的升高而降低,这可能受各年龄组基线抗体水平影响所致,也进一步证实了前期的研究发现[11]。
本研究是基于前期临床研究队列进行的我国单价Hib结合疫苗的免疫持久性研究,样本量相对较大,覆盖了我国Hib所致疾病的高危人群(3月龄至5岁)[19],且抗体检测均在中国食品药品检定研究院完成,前后研究结果具有可比性,研究结果具有较强的说服力。目前我国尚未将Hib导致的疾病纳入传染病报告,但有研究发现,随着年龄增大,自然感染率逐渐降低,这可能是年龄越大越容易获得Hib结合疫苗接种和/或自然免疫所产生的保护性抗体[11]。自然状态下暴露于Hib的PRP或交叉反应抗原而持续免疫自然增强现象是常见的[20],但由于前期临床研究队列采用的是阳性对照疫苗和本研究仅选择疫苗组的受试者为研究对象,导致本研究无法设置阴性对照组,难以排除接种后5年期间Hib自然感染而导致免疫自然增强的效应。据报道,体液免疫和细胞免疫是影响Hib结合疫苗免疫持久性的2个重要方面[21],本研究仅从体液免疫角度评估该疫苗的免疫持久性存在一定不足。
综上所述,在3月龄至5岁的婴幼儿中,该国产Hib结合疫苗接种后5年仍具有良好的免疫持久性,且无需加强免疫。本研究结果为Hib结合疫苗的长期免疫持久性提供了初步证据,并为免疫接种指南制定提供参考证据。需要进一步加强Hib所致疾病的病原学和流行病的监测,为Hib结合疫苗免疫策略的优化提供进一步的参考依据。
利益冲突 所有作者声明无利益冲突
作者贡献声明 魏明伟:研究设计和实施、查阅文献、论文撰写、论文修改;张丽莺:研究设计、查阅文献、数据整理、修改论文;李靖欣、储凯:研究设计、研究指导、论文指导;朱加宏:研究实施、数据收集;朱凤才:研究设计、获取研究经费、研究指导、论文指导、修改论文
| [1] |
Dajani AS, Asmar BI, Thirumoorthi MC, et al
. Haemophilus influenzae type b vaccines[M]. 7th ed. Philadelphia: Elsevier, 2018: 301-318.
|
| [2] |
张海军, 方海. b型流感嗜血杆菌疫苗纳入免疫规划的卫生经济学研究系统评价[J]. 中国疫苗和免疫, 2020, 26(4): 455-459, 473. Zhang HJ, Fang H. Health economics evaluation of introducing Haemophilus influenzae type b vaccine into the expanded program on Immunization: a systematic evaluation[J]. Chin J Vaccin Immun, 2020, 26(4): 455-459, 473. |
| [3] |
代子瑞, 栾琳, 田健美, 等. 苏州地区b型流感嗜血杆菌结合疫苗对减少儿童住院肺炎有效性的观察性研究[J]. 中华疾病控制杂志, 2021, 25(2): 192-197. Dai ZR, Luan L, Tian JM, et al. Effectiveness of Haemophilus influenzae type b conjugate vaccine on hospitalized pneumonia among children in Suzhou: an observational study[J]. Chin J Dis Control Prev, 2021, 25(2): 192-197. DOI:10.16462/j.cnki.zhjbkz.2021.02.014 |
| [4] |
杨来宝, 周翠萍, 肖绍坦, 等. 上海市浦东新区2012~2016年含b型流感嗜血杆菌成分疫苗预防接种不良反应特征分析[J]. 中国生物制品学杂志, 2019, 32(1): 57-61, 65. Yang LB, Zhou CP, Xiao ST, et al. Characteristics of adverse events following immunization of Haemophilus influenzae b-containing vaccines in Pudong New District, Shanghai during 2012-2016[J]. Chin J Biologicals, 2019, 32(1): 57-61, 65. DOI:10.13200/j.cnki.cjb.002442 |
| [5] |
赵颖, 陈蕊, 安晶, 等. b型和不可分型流感嗜血杆菌疫苗的研究进展[J]. 现代预防医学, 2021, 48(1): 161-165. Zhao Y, Chen R, An J, et al. Research progress on type b and nonseparable Haemophilus influenzae vaccine[J]. Mod Prev Med, 2021, 48(1): 161-165. |
| [6] |
中华医学会儿科学分会感染学组, 中国儿童感染性疾病病原学及细菌耐药监测协作组, 中华儿科杂志编辑委员会. 儿童流感嗜血杆菌感染诊断及治疗专家建议[J]. 中华儿科杂志, 2019, 57(9): 663-668. The Subspeciality Group of Infectious Diseases, The Society of Pediatrics, Chinese Medical Association, The Group of Infectious Disease Surveillance of Pediatrics, The Editorial Board, Chinese Journal of Pediatrics. Expert consensus on diagnosis and treatment of Haemophilus influenzae infection in children[J]. Chin J Pediatr, 2019, 57(9): 663-668. DOI:10.3760/cma.j.issn.0578-1310.2019.09.004 |
| [7] |
Wahl B, O'Brien KL, Greenbaum A, et al. Burden of Streptococcus pneumoniae and Haemophilus influenzae type b disease in children in the era of conjugate vaccines: global, regional, and national estimates for 2000-15[J]. Lancet Glob Health, 2018, 6(7): e744-757. DOI:10.1016/S2214-109X(18)30247-X |
| [8] |
Zhang HJ, Garcia C, Yu WZ, et al. National and provincial impact and cost-effectiveness of Haemophilus influenzae type b conjugate vaccine in China: a modeling analysis[J]. BMC Med, 2021, 19(1): 181. DOI:10.1186/s12916-021-02049-7 |
| [9] |
International Vaccine Access Center. VIEW-hub report: global vaccine introduction and implementation[EB/OL]. [2022-03-31]. https://www.jhsph.edu/ivac/wp-content/uploads/2021/02/VIEW-hubReport_Dec2020.pdf.
|
| [10] |
WHO. Global immunization coverage 2021[EB/OL]. (2021-07-15)[2022-03-31]. https://www.who.int/en/news-room/fact-sheets/detail/immunization-coverage.
|
| [11] |
王文娟, 储凯, 孟繁岳, 等. 一种国产b型流感嗜血杆菌结合疫苗的安全性及免疫原性研究[J]. 江苏预防医学, 2017, 28(6): 640-643. Wang WJ, Chu K, Meng FY, et al. Safety and immunogenicity of a China-made Haemophilus influenza type b conjugate vaccine[J]. Jiangsu J Prev Med, 2017, 28(6): 640-643. DOI:10.13668/j.issn.1006-9070.2017.06.11 |
| [12] |
张丽莺, 储凯, 朱加宏, 等. 国产b型流感嗜血杆菌结合疫苗的免疫原性[J]. 中国卫生工程学, 2018, 17(6): 841-843. Zhang LY, Chu K, Zhu JH, et al. Immunogenicity of primary immunization with Hib PRP-TT conjugates vaccine[J]. Chin J Public Health Eng, 2018, 17(6): 841-843. |
| [13] |
WHO. Recommendations for the production and control of Haemophilus influenzae type b conjugate vaccines[R]. Geneva: WHO, 2000.
|
| [14] |
WHO. Haemophilus influenzae type b (Hib) vaccination position paper-July 2013[J]. Wkly Epidemiol Rec, 2013, 88(39): 413-426. |
| [15] |
Ning GJ, Yin ZD, Li YX, et al. Cost-effectiveness of the Haemophilus influenzae type b vaccine for infants in mainland China[J]. Hum Vaccin Immunother, 2018, 14(1): 36-44. DOI:10.1080/21645515.2017.1385687 |
| [16] |
Hutter J, Pasetti MF, Sanogo D, et al. Naturally acquired and conjugate vaccine-induced antibody to Haemophilus influenzae type b (Hib) polysaccharide in Malian children: serological assessment of the Hib immunization program in Mali[J]. Am J Trop Med Hyg, 2012, 86(6): 1026-1031. DOI:10.4269/ajtmh.2012.11-0807 |
| [17] |
Booy R, Richmond P, Nolan T, et al. Three-year antibody persistence and safety after a single dose of combined Haemophilus influenzae type b (Hib)-Neisseria meningitidis serogroup C-tetanus toxoid conjugate vaccine in Hib-primed toddlers[J]. Pediatr Infect Dis J, 2013, 32(2): 169-174. DOI:10.1097/INF.0b013e3182787bff |
| [18] |
Mäkelä PH, Käyhty H, Leino T, et al. Long-term persistence of immunity after immunisation with Haemophilus influenzae type b conjugate vaccine[J]. Vaccine, 2003, 22(2): 287-292. DOI:10.1016/s0264-410x(03)00524-3 |
| [19] |
Watt JP, Wolfson LJ, O'Brien KL, et al. Burden of disease caused by Haemophilus influenzae type b in children younger than 5 years: global estimates[J]. Lancet, 2009, 374(9693): 903-911. DOI:10.1016/S0140-6736(09)61203-4 |
| [20] |
Oh SY, Griffiths D, John T, et al. School-aged children: a reservoir for continued circulation of Haemophilus influenzae type b in the United Kingdom[J]. J Infect Dis, 2008, 197(9): 1275-1281. DOI:10.1086/586716 |
| [21] |
Perrett KP, John TM, Jin C, et al. Long-term persistence of immunity and B-cell memory following Haemophilus influenzae type B conjugate vaccination in early childhood and response to booster[J]. Clin Infect Dis, 2014, 58(7): 949-959. DOI:10.1093/cid/ciu001 |
 2022, Vol. 43
2022, Vol. 43