文章信息
- 国家免疫规划技术工作组流感疫苗工作组.
- National Immunization Advisory Committee (NIAC) Technical Working Group (TWG), Influenza Vaccination TWG
- 中国流感疫苗预防接种技术指南(2022-2023)
- Technical guidelines for seasonal influenza vaccination in China (2022-2023)
- 中华流行病学杂志, 2022, 43(10): 1515-1544
- Chinese Journal of Epidemiology, 2022, 43(10): 1515-1544
- http://dx.doi.org/10.3760/cma.j.cn112338-20220825-00734
-
文章历史
收稿日期: 2022-08-25
流行性感冒(流感)是流感病毒引起的对人类健康危害较重的呼吸道传染病,流感病毒抗原性易变,传播迅速,每年可引起季节性流行,在学校、托幼机构和养老院等人群聚集的场所可发生暴发疫情。人群对流感病毒普遍易感,孕妇、婴幼儿、老年人和慢性病患者等高危人群感染流感后危害更为严重。尤其是全球新型冠状病毒肺炎(新冠肺炎)疫情严重流行态势仍在持续,今年我国南方部分省份出现夏季流感流行高峰,今冬明春可能会出现新冠肺炎与流感等呼吸道传染病叠加流行的情况。接种流感疫苗是预防流感、减少流感相关重症和死亡的有效手段,可以减少流感相关疾病带来的健康危害及对医疗资源的挤兑。受国家卫生健康委员会委托,2018年以来,中国CDC在每年流感流行季之前均印发更新《中国流感疫苗预防接种技术指南》。一年来,新的研究证据在国内外发表,为更好地指导我国流感预防控制和疫苗应用工作,国家免疫规划技术工作组流感疫苗工作组综合国内外最新研究进展,在2021年版指南的基础上进行了更新和修订,形成了《中国流感疫苗预防接种技术指南(2022-2023)》。
本指南更新的内容主要包括:第一,增加了新的研究证据,尤其是我国的研究结果,包括流感疾病负担、疫苗效果、疫苗安全性监测、疫苗预防接种成本效果等;第二,更新了一年来国家出台的有关流感防控政策和措施;第三,更新了我国2022-2023年度国内批准上市及批签发的流感疫苗种类;第四,更新了本年度三价和四价流感疫苗组分;第五,更新了2022-2023年度的流感疫苗接种建议。
一、病原学基础、临床特点和实验室诊断流感病毒属于正粘病毒科,是单股、负链、分节段的RNA病毒。根据病毒核蛋白和基质蛋白,分为甲、乙、丙、丁(或A、B、C、D)型[1]。甲型流感病毒根据病毒表面的血凝素(hemagglutinin,HA)和神经氨酸酶(neuraminidase,NA)的蛋白结构和基因特性,可分为多种亚型。目前,发现的HA和NA分别有18个(H1~18)和11个(N1~11)亚型。甲型流感病毒除感染人外,在动物中广泛存在,如禽类、猪、马、海豹以及鲸鱼和水貂等。乙型流感病毒分为Victoria系和Yamagata系,可在人群中循环,最近数据显示海豹也可被感染[2-3]。丙型流感病毒感染人、狗和猪,仅导致上呼吸道感染的散发病例[4]。丁型流感病毒,主要感染猪、牛等,尚未发现感染人[5-6]。目前,引起流感季节性流行的病毒是甲型流感病毒中的H1N1、H3N2亚型及乙型流感病毒中的Victoria和Yamagata系。
流感感染主要以发热、头痛、肌痛和全身不适起病,体温可达39℃~40℃,可有畏寒、寒战,多伴全身肌肉关节酸痛、乏力、食欲减退等全身症状,常有咽喉痛、干咳,可有鼻塞、济涕、胸骨后不适,颜面潮红,眼结膜充血等。儿童的发热程度通常高于成年人,患乙型流感时恶心、呕吐、腹泻等消化道症状也较成年人多见。新生儿可仅表现为嗜睡、拒奶、呼吸暂停等。无并发症者病程呈自限性,大多于发病3~5 d后发热逐渐消退,全身症状好转,但咳嗽、体力恢复常需较长时间[7]。部分患者症状轻微或无症状,轻症流感常与普通感冒表现相似,但其发热和全身症状更明显。可能出现的严重并发症包括肺炎、心肌炎、脑炎或肌炎和横纹肌溶解、败血症和多器官衰竭。继发性细菌性肺炎作为流感常见的并发症,通常由肺炎链球菌、流感嗜血杆菌或金黄色葡萄球菌引起[8]。流感的症状是临床常规诊断和治疗的主要依据,但由于缺乏特异性,易与普通感冒和其他上呼吸道感染相混淆[9]。流感确诊有赖于实验室诊断,检测方法包括病毒核酸检测、病毒分离培养、抗原检测和血清学检测[10]。
二、流行病学 (一) 传染源、传播方式、易感人群流感患者和无症状感染者是季节性流感的主要传染源。流感病毒主要通过打喷嚏和咳嗽等飞沫传播,经口腔、鼻腔、眼睛等黏膜直接或间接接触感染。接触被病毒污染的物品也可通过上述途径感染。在特定场所,如人群密集且密闭或通风不良的房间内,也可能通过气溶胶的形式传播[11]。人群普遍易感,儿童相对于成年人更易罹患流感。
(二) 流行病学参数1. 潜伏期:指感染者从暴露感染到出现临床症状和体征的间隔时间。研究显示,流感病毒常见潜伏期为1~4 d,平均为2 d,其中甲型流感病毒中位潜伏期为1.4 d(95%CI:1.3~1.5),乙型流感病毒中位潜伏期仅为0.6 d(95%CI:0.5~0.6)[12]。流感感染者从潜伏期末到发病的急性期均具有传染性。
2. 排毒期:指感染者首次排出病毒核酸到末次排出病毒核酸的间隔。感染者在临床症状出现前1~2 d即可排出病毒,排毒量在发病后12~24 h内显著增加,发病后1 d内达到高峰[13]。成年人和较大年龄儿童一般持续排毒3~8 d(平均5 d)。住院成年患者可在发病后持续1周或更长的时间排毒,排毒量也更大[4]。低龄儿童发病时的排毒量与成年人相同,但排毒量下降更慢,排毒时间相对更长[14]。与成年人相比,婴幼儿病例中,排毒时间延长很常见(约1~3周)。老年人和HIV感染者等免疫功能低下或缺陷人群的病毒清除能力更差,排毒时间更长[13, 15]。
3. 代间距:指原发病例的发病日期与其传染导致的续发病例发病日期的时间间隔。一篇关于呼吸道传染病代间距的文献综述提示,感染A(H1N1)pdm09亚型流感病毒患者间的代间距范围为1.9~4.5 d,感染A(H3N2)亚型流感病毒患者间的代间距范围为3.1~3.5 d,乙型流感病毒患者间的代间距范围为3.4~4.9 d[16]。
4. 续发率:是指在某一个特定群体(如家庭、集体宿舍、学校、密切接触者人群)中第一例病例发生后,在该病的最短潜伏期到最长潜伏期之间,易感接触者中因受其感染而发病的续发病例占所有易感接触者总数的百分比。流感的续发率在不同场所、不同人群和不同流行年度差异较大。一项基于27篇原始研究的系统综述发现A(H1N1)pdm09亚型流感病毒引起的家庭续发率在3%~38%之间[17]。英格兰一项在连续两个流行季评估流感续发率的研究综合发现在乙型流感病毒为优势株的2012-13季节,流感的家庭续发率为30.5%,在甲型流感为优势株的2013-14季节,流感的家庭续发率为25.7%[18]。
5. 基本再生数(R0):表示一个传染源进入到易感人群中,在未加干预的情况下,平均可感染的二代病例个数,是描述疾病传播能力的指标之一。据一项系统综述估计,季节性流感病毒的R0的中位数为1.3(IQR:1.2~1.4)[19]。我国一项研究显示,从2010-2019年间我国季节性流感的R0范围在0.98~1.47之间变动,均值为1.21[20]。
(三) 流感在我国的流行特点和季节性流感在温带地区表现为每年冬春季的季节性流行和高发[21-23]。热带地区尤其在亚洲,流感的季节性呈高度多样化,既有半年或全年周期性流行,也有全年循环[22-25]。
2013年,一项针对我国不同区域流感季节性的研究显示,我国甲型流感的年度周期性随纬度增加而增强,且呈多样化的空间模式和季节性特征:北纬33°以北的北方省份,呈冬季流行模式,每年1-2月单一年度高峰;北纬27°以南的最南方省份,每年4-6月单一年度高峰;两者之间的中纬度地区,每年1-2月和6-8月的双周期高峰;而乙型流感在我国大部分地区呈单一冬季高发[26]。2018年一项研究对我国2005-2016年度乙型流感流行特征进行了系统分析,总体而言,我国乙型流感的流行强度低于甲型;但在部分地区和部分年份,乙型流感的流行强度高于甲型,且B/Yamagata系和B/Victoria系交替占优势,以冬春季流行为主,不同系的流行强度在各年间存在差异[27]。
新冠肺炎疫情的发生对流感流行造成了一定影响。自2020年3月开始,流感在我国呈极低流行水平;南方省份从2020年底至2021年9月流感活动呈缓慢升高,北方省份仅2021年3-5月有短期低水平流行;自2021年10月左右,南北方省份开始进入秋冬高发季节并在2022年初达到冬季峰值,2022年3月逐步回落至低水平,以B(Victoria)系为主[28]。2022年5月以来,我国南方省份流感活动再次呈持续升高趋势,进入夏季高发期,达到近5年同期最高水平,以A(H3N2)亚型为绝对优势株;同期北方省份流感活动处于低水平[29]。
(四) 疾病负担1. 健康负担:在新冠肺炎疫情全球大流行的背景下,流感活动一旦复苏可能会带来叠加效应负担。英国一项研究评估了新冠肺炎病毒与流感等呼吸道病毒合并感染的临床结局,研究纳入了2020年2月6日至2021年12月8日期间累计212 446名住院的新冠肺炎成年人患者,通过对其中6 965名新冠肺炎患者进行呼吸道多病原检测发现,8.4%的患者具有多病原感染,与单一新型冠状病毒(新冠病毒)感染相比,新冠病毒合并流感病毒感染的住院患者,机械通气风险增加4.14倍(95%CI:2.00~8.49),院内死亡的风险增加2.35倍(95%CI:1.07~5.12)[30]。如果新冠肺炎与流感共同流行,将会出现大量具有相似呼吸道感染症状的病例就诊,会增加医疗机构对新冠肺炎病例鉴别诊断的复杂性,导致部分新冠肺炎病例可能难以得到及时发现和管理,将加剧新冠病毒传播风险。呼吸道感染相关重症住院病例也将导致病床、呼吸机、ICU的需求加剧增加。
(1) 全人群:据WHO估计,流感在全球每年可导致300万~500万的重症和29万~65万呼吸道疾病相关死亡[31]。尽管人群对流感病毒普遍易感,但各年龄组间存在差异,儿童罹患率高于成年人。根据一项对全球32个流感疫苗接种随机对照试验(randomized controlled trial,RCT)中未接种疫苗人群的流感罹患率统计,有症状流感罹患率在儿童(< 18岁)中为12.7%(95%CI:8.5%~18.6%),在成年人中为4.4%(95%CI:3.0%~6.3%),≥65岁老年人为7.2%(95%CI:4.3%~12.0%);不同人群感染率(包括无症状感染)分别为:儿童22.5%(95%CI:9.0%~46.0%),成年人10.7%(95%CI:4.5%~23.2%),老年人8.8%(95%CI:7.0%~10.8%)[32]。
一项基于全国流感监测数据的研究,使用乘法模型估算了我国季节性流感的感染、发病和就诊情况,结果显示:2010-2020年间中国流感感染、发病和就诊的累计数分别为8 945.3万人次[95%不确定区间(uncertainty interval,UI):4 989.7万人次~ 17 050.4万人次]、5 921.6万人次(95%UI:3 365.6万人次~11 106.4万人次)和3 841.5万人次(95%UI:2 342.0万人次~6 703.0万人次),年平均发生率分别为6.5人次/千人(95%UI:3.6~12.4)、4.3人次/千人(95%UI:2.4~8.1)和2.8人次/千人(95%UI:1.7~4.9)[33]。一项研究利用全国门急诊流感样病例(influenza like illness,ILI)和流感病原学监测数据,估算流感相关门诊就诊疾病负担,结果显示:在2006-2015年间,中国平均每年流感相关ILI超额门诊就诊负担为2.5人次/千人,最高为2009年甲型H1N1流感大流行时的7.8人次/千人;≤14岁儿童ILI门诊就诊负担最重(4.5人次/千人),显著高于15~59岁成年人(2.3人次/千人)和≥60岁老年人(1.1人次/千人)[34]。另一项关于中国2006-2019年间流感疾病负担研究的估计结果:我国每年流感导致的ILI超额门急诊就诊例数平均为300.5万(95%CI:216.5万~391.2万),严重急性呼吸道感染(severe acute respiratory infection,SARI)住院病例数平均为234.6万(95%CI:185.7万~288.7万),呼吸系统疾病超额死亡例数平均为9.2万(95%CI:7.5万~11.2万)[35]。基于全国流感监测和死因监测数据,一项研究使用线性回归模型估计流感相关超额呼吸系统疾病死亡,结果显示:2010-11至2014-15流行季,全国平均每年有8.8万(95%CI:8.4万~9.2万)流感相关呼吸系统疾病超额死亡,占呼吸系统疾病死亡的8.2%(95%CI:7.8%~9.6%);全年龄组的超额死亡率平均为6.5/10万人年(95%CI:6.3/10万人年~6.8/10万人年);≥60岁老年人的流感相关超额死亡数占全人群的80%,其超额死亡率显著高于 < 60岁人群(38.5/10万人年vs. 1.5/10万人年)[36]。
(2) 慢性基础性疾病患者:与同龄健康人相比,慢性基础疾病患者感染流感后,更易发展为重症甚至死亡,其流感相关住院率和超额死亡率更高。近期一项研究基于全球流感住院监测网络数据分析发现,2017-18流行季,超过10%的流感相关住院病例出现需要机械通气、进入ICU或死亡等严重临床结局,而患有慢性基础性疾病者出现上述严重临床结局的风险更高[37]。2018-19流行季,美国一项针对患有慢性基础性疾病对儿童流感相关住院影响的回顾性研究发现,患至少一种基础性疾病的儿童的住院风险是健康儿童的6.84倍(95%CI:3.78~12.37),其中患糖尿病者是健康儿童的14.57倍(95%CI:4.68~45.31),患心脏病者是健康儿童的3.70倍(95%CI:1.43~9.62),肥胖者是健康儿童的1.68倍(95%CI:0.21~13.65)[38]。
(3) 孕妇:孕期感染流感是常见的。我国苏州市18 724名中位年龄28岁的孕妇队列观察显示,2015-18三个流行季流感发病率(/100人月)分别为0.7、1.0、2.1[39-40]。印度、泰国和秘鲁2017-2018季节观察了11 277名中位年龄26岁的孕妇,发现流感季节孕妇每个月的流感发病风险为0.7%~0.9%[41]。
妊娠后机体会出现免疫和生理上的变化[42-43],可能导致罹患流感时严重程度增加[44],导致住院、严重疾病和死亡风险增高,并增加死产风险[45]。2019年一项队列和病例对照研究的单个病例数据Meta分析,纳入了33项研究中的36 498名感染流感的育龄女性个案数据,发现孕妇感染流感后住院风险是非孕妇的6.80倍(95%CI:6.02~7.68)[46]。美国流感住院数据分析显示,2010-2019连续9个流行季流感住院的育龄女性中约1/3为孕妇(育龄女性平均每年仅9%妊娠),流感住院孕妇中5%需要收治ICU、2%需要机械通气、0.3%出现死亡[47];诊断流感的产妇出现严重并发症的风险是未感染者的2.24倍(95%CI:2.17~2.31)[48]。我国2009年大流行期间A(H1N1)pdm09住院病例的研究发现,孕妇仅占育龄妇女人口数的3%,但A(H1N1)pdm09死亡的育龄女性中20%为孕妇;与未妊娠的健康育龄妇女相比,孕妇出现严重疾病的风险增加3.3倍(95%CI:2.7~4.0),孕中期(OR=6.10,95%CI:3.12~19.94)和孕晚期(OR=7.62,95%CI:3.99~14.55)出现严重疾病的风险进一步增加[49]。北京大学一项系统综述纳入了截至2020年11月的17项队列研究,目标人群超过200万,发现妊娠期间感染流感增加死产风险(RR=3.62,95%CI:1.60~8.20),但对早产、胎儿死亡、小于胎龄、低出生体重的影响未见统计学意义[45]。
(4) 儿童:每年流感流行季节,儿童流感罹患率约为20%~30%[50],在某些高流行季节,儿童流感年感染率可高达50%左右[51-52]。一项关于流感罹患率(包括有症状和无症状的感染)的综述研究提示[32],< 18岁儿童流感罹患率约为22.5%(95%CI:9.0%~46.0%),而成年人流感罹患率约为10.7%(95%CI:4.5%~23.2%)。一项关于我国北方2018-19流行季儿童和成年人流感感染率的研究发现,儿童季节性流感总体感染率(31%)和A(H3N2)亚型感染率(17%)均显著高于成年人感染率(21%,10%)[53]。2017-18流行季,北京市流感发病率研究提示,0~4岁组和5~14岁组发病率最高,分别为33.0%(95%CI:26.4%~43.1%)和21.7%(95%CI:17.4%~28.4%)[54]。上海市一项基于流感监测、死因和住院监测数据,建立贝叶斯模型估计流感疾病负担的研究显示,2010-2017年间,0~14岁儿童的平均每年流感相关ILI门诊就诊率最高,达到1 430.9/10万(95%CI:1 096.9/10万~1 773.4/10万)[55]。2011-2017流行季苏州市 < 5岁儿童确诊流感导致的ILI就诊率为6.4/100人年,其中2011-2012流行季就诊率最高,达到20.5/100人年[56]。
< 5岁儿童感染流感后出现重症的风险较高。一项对全球 < 5岁儿童开展的流感相关呼吸系统感染疾病负担系统综述模型研究提示:2018年全球 < 5岁儿童约有10 950万(UR:6 310万~19 060万)感染流感病毒,1 010万(UR:680万~1 510万)流感相关急性下呼吸道感染(acute lower respiratory infection,ALRI),87万(UR:54.3万~141.5万)流感相关ALRI住院病例,1.53万(UR:0.58万~4.38万)流感相关ALRI住院病例死亡,3.48万(UR:1.32万~9.72万)流感相关ALRI病例死亡[57]。湖北省荆州市一项基于人群的研究表明,流感导致的SARI住院患者中69%为 < 5岁儿童,该年龄组流感相关SARI住院率达2 021/10万人年~2 349/10万人年,其中6~11月龄婴儿住院率最高(3 603/10万人年~3 805/10万人年)[58]。苏州市开展的2011-2016流行季 < 5岁儿童流感确诊住院率研究提示,研究期间 < 5岁儿童流感确诊SARI住院率最低为2012-13流行季的是4(95%CI:2~5)人次/千人,最高为2011-12流行季的16(95%CI:14~19)人次/千人[59]。儿童感染流感可导致死亡,患基础性疾病的儿童死亡风险显著高于健康儿童,但也有将近半数的死亡病例发生在健康儿童[50]。一项对全球流感相关死亡的模型研究估计,纳入的92个国家每年约有9 243~105 690名 < 5岁儿童死于流感相关呼吸系统疾病[31]。
(5) 学生:学校作为封闭的人群密集场所,容易发生流感病毒的传播[60-61],以学校为基础的流感疫情暴发往往早于并加剧季节性和大流行性流感在社区的传播[62]。我国每年报告的流感暴发疫情中,90%以上发生在学校和托幼机构。与其他人群相比,学龄儿童的流感感染率最高[63]。2019-20流行季,我国内地各类型学校和托幼机构报告ILI(含流感)暴发疫情3 802起,占全年度暴发疫情的98.45%,其中小学和中学为暴发疫情的最主要场所,共报告3 382起(87.53%)[64]。杭州市2018年9月至2020年1月学生因流感样症状缺勤监测资料分析发现,因流感样症状缺勤人天数占总因病缺勤人天数的17.29%,缺勤率为0.11%[65]。学龄儿童在学校、家庭和社区的流感传播中发挥重要的作用,流感流行可引起大量学龄儿童缺课和父母缺勤[66-67]。
(6) 医务人员:由于职业因素,在日常诊疗、疾病防控工作中暴露于流感病毒的风险高,是流感感染的高危人群[68]。一项对1957-2009年全球29项研究的Meta分析显示,未接种流感疫苗的医务人员每季节实验室确诊的流感发病率平均为18.7%(95%CI:15.8%~22.1%),是健康成年人的3.4倍(95%CI:1.2~5.7)[69]。医务人员感染流感可导致缺勤率升高,造成医疗服务中断[70]。美国俄亥俄州一项针对大型三级卫生中心的研究显示罹患流感样症状医护人员的出勤率为92%[71],带病工作可能会增加医务人员将流感传染给其他医务人员及患者的风险。此外,感染流感的医务人员可能会使其患者发生院内感染,面临严重疾病、并发症和死亡的高风险[8, 72]。目前,新冠肺炎疫情在全球仍处于大流行阶段,流感和新冠肺炎可能出现相似症状,且有出现合并感染的可能[73]。一项研究提示,由于新冠肺炎疫情防控措施压制了流感流行态势,一旦流感出现反弹,将高于以往的流行水平[74]。医务人员作为季节性流感与新冠肺炎的高风险人群,造成的疾病负担和所需医疗资源具有高度一致性,季节性流感一旦反弹,不仅造成巨大的健康损失,更对新冠肺炎疫情防控造成严重的干扰和医疗资源的紧缺[75]。
(7) 老年人:研究表明,老年人对流感病毒普遍易感。2018年,一项纳入32项RCT研究的系统综述发现,未接种流感疫苗的≥65岁人群中,实验室确诊的有症状流感罹患率为7.2%(95%CI:4.3%~12.0%),高于成年人4.4%(95%CI:3.0%~6.3%)的罹患率[32]。北京市基于SARI监测的研究显示,≥60岁老年人在2014-16流行季中流感相关SARI住院率分别为105/10万(95%CI:85/10万~129/10万)和66/10万(95%CI:50/10万~86/10万),远高于25~59岁的10/10万(95%CI:7/10万~13/10万)和4/10万(95%CI:3/10万~7/10万)[76]。
流感也可导致老年人出现相当高的住院负担。在2010-12流行季湖北省荆州市基于人群的研究中发现,≥65岁老年人中确诊流感导致的SARI病例住院率为89/10万~141/10万[58]。
老年人罹患流感后易出现严重并发症,重症和死亡风险较高。2018年,一项关于全球流感超额死亡率的模型研究表明,< 65岁人群中因流感相关呼吸道超额死亡率为0.1/10万~6.4/10万,65~74岁年龄组中超额死亡率为2.9/10万~44/10万,≥75岁年龄组为17.9/10万~223.5/10万[31]。2017-18流行季(以B型流感为主)欧洲一项超额死亡研究提示,≥65岁老年人流感相关全死因超额死亡率为154.1/10万(95%CI:149.4/10万~158.9/10万)[77]。我国香港、广州及全国范围的流感超额死亡研究显示,≥65岁老年人流感相关的呼吸和循环系统疾病、全死因超额死亡率分别为64/10万~147/10万、75/10万~186/10万[78-80],与新加坡[79, 81]、葡萄牙[82]、美国[83]等发达国家接近。与其他年龄组相比,流感相关死亡风险在老年人中最高。≥65岁老年人流感相关超额死亡率远高于0~64岁组,80%~95%的流感相关超额死亡发生在≥65岁老年人[36, 78-80, 84]。我国每年大约有71 000例老年人流感相关呼吸道疾病超额死亡,占呼吸道疾病死亡人数的80%[36]。
此外,养老院、疗养院等老年人集体居住的机构容易出现流感暴发疫情[85]。
2. 经济负担和健康效用:我国现有流感相关经济负担研究大多集中在经济较发达地区,如广东[86-89]、山东[90]、江苏[91-93]、上海[94-96]、浙江[97-98]、天津[99-101]、北京[102-103]和江西[104]等。流感门诊病例直接医疗费用在186~804元之间,直接非医疗费用在7~212元之间,间接费用在139~963元之间,总经济负担在464~1 320元之间[98, 105-106];流感住院病例直接医疗费用在2 625~20 712元之间,直接非医疗费用为1 200~1 809元之间,间接费用在204~2 408元之间,总经济负担在9 832~25 768元之间[105-106]。研究显示,2019年全国流感相关经济负担为263.81亿元,约占当年国内生产总值的0.266%,其中住院病例、门急诊病例和早亡引起生产力损失占比分别占总经济负担的86.4%、11.3%和2.4%[35]。
流感相关经济负担在不同人群亚组间存在较大差异。2013年,我国≥65岁老年人流感门急诊病例的总经济负担为129美元/人,其中直接医疗成本占47%。老年人流感住院病例的总经济负担(2 735美元/人)约为门诊病例的20倍以上;高于其他年龄组(1 417~1 621美元/人)[107]。2019年的一项综述研究显示,我国老年人罹患流感医疗负担进一步加重,直接医疗费用为14 250~19 349元,平均住院成本是其他成年人的2倍,其家庭看护等间接经济成本更是难以估量[105]。而儿童和18~60岁人群误工成本较高因而间接经济负担较重[106];城市地区病例经济负担高于农村地区[105];有慢性基础性疾病的流感患者其门诊和住院费均高于无基础性疾病的流感患者[107];未接种流感疫苗的老年ILI经济负担显著高于接种者(639元vs. 418元)[108]。
超过60%的流感门诊和住院病例报告具有疼痛、不适和焦虑、沮丧[109]。在罹患流感期间,患者的健康效用值显著下降,门诊病例的健康效用值介于0.50~0.70之间,住院病例介于0.23~0.62之间[109-112]。门诊和住院病例在感染前后的健康效用值下降高达0.43和0.59[110]。不同亚组流感患者的生存质量也存在一定差异,与无基础性疾病的流感病例相比,有基础性疾病的门诊和住院病例的健康效用值较低(门诊:0.57 vs. 0.63,住院:0.54 vs. 0.63)[109];接种流感疫苗的病例健康效用值较高(37.73 vs. 29.55,SF-8量表测量)[112]。尽管流感患病期间健康效用值下降幅度较大,但由于病程较短,且绝大部分人能完全恢复到感染前健康水平,因此患者的质量调整生命年(quality adjusted life days,QALY)损失有限,门诊和住院流感病例在患病期间的QALY损失仅为0.004 0~0.009 7年和0.009~0.031年[109-110, 112]。
(五) 流感的预防和治疗措施每年接种流感疫苗是预防流感的有效手段,可以显著降低接种者罹患流感和发生严重并发症的风险。奥司他韦、扎那米韦、帕拉米韦等神经氨酸酶抑制剂、血凝素抑制剂阿比多尔和聚合酶抑制剂法匹拉韦等是甲型和乙型流感的有效治疗药物,早期尤其是发病48 h之内应用抗流感病毒药物能显著降低流感重症和死亡的发生率。抗病毒药物应在医生的指导下使用。药物预防不能代替疫苗接种,只能作为没有接种疫苗或接种疫苗后尚未获得免疫能力的重症流感高危人群的紧急临时预防措施,可使用奥司他韦、扎那米韦等。
采取日常防护措施也可以有效减少流感的感染和传播,包括:保持良好的呼吸道卫生习惯,咳嗽或打喷嚏时,用纸巾、毛巾等遮住口鼻;勤洗手,尽量避免触摸眼睛、鼻或口;均衡饮食,适量运动,充足休息等;避免近距离接触流感样症状患者;流感流行季节,尽量减少去人群聚集场所。一旦出现流感样症状,应居家休息,进行健康观察,不带病上班、上课,接触家庭成员时戴口罩,减少疾病传播;病情如出现进行性加重,则需要去医院就诊,患者及陪护人员要戴口罩,避免交叉感染。
三、流感疫苗 (一) 国内外上市的流感疫苗全球已上市的流感疫苗分为流感灭活疫苗、流感减毒活疫苗和重组流感疫苗。按照疫苗所含组分,流感疫苗包括三价和四价,三价疫苗组分含有A(H3N2)亚型、A(H1N1)pdm09亚型和B型毒株的一个系,四价疫苗组分含A(H3N2)亚型、A(H1N1)pdm09亚型和B型Victoria系、Yamagata系。根据生产工艺,又可分为基于鸡胚、基于细胞培养和重组流感疫苗。国外还上市了针对特定人群的高抗原含量灭活流感疫苗、佐剂疫苗以及皮内接种疫苗等。
我国现已批准上市的流感疫苗有三价灭活流感疫苗(IIV3)、四价灭活流感疫苗(IIV4)和三价减毒活疫苗(LAIV3)。IIV3包括裂解疫苗和亚单位疫苗,IIV4为裂解疫苗,LAIV3为减毒疫苗。截至2022年8月14日,已有11家厂家供应流感疫苗,具体流感疫苗生产企业及其产品信息见表 1。
免疫原性(immunogenicity)是指抗原能够刺激机体形成特异抗体或致敏淋巴细胞的能力,评价指标主要为病毒毒株特异性HI抗体滴度和血清抗体阳转率,评价结果会受接种者年龄、免疫功能和接种前抗体水平的影响。疫苗的效力(efficacy)通常是指其在上市前RCT中理想条件下的有效性;疫苗的效果(effectiveness)则指其在人群中实际应用的有效性。评价流感疫苗效力和效果的结局指标主要包括实验室确诊流感、急性呼吸道疾病或ILI就诊、流感和肺炎相关住院或死亡等。
目前,我国供应的流感灭活疫苗,其接种后A(H3N2)、A(H1N1)pdm09亚型和B/Yamagata、B/Victoria系的HI抗体阳转率、HI抗体几何平均效价(GMT)平均增长倍数和血清抗体保护率均达到上述标准,具有较好的免疫原性[113-115]。2020年我国批准上市了一种冻干鼻喷三价减毒活疫苗,在婴幼儿、学龄儿童的免疫反应较成年人好[116-118],具有良好免疫原性[119-120]。2022年5月底,适用于6月龄至3岁儿童的IIV4在我国内地获批上市。
1. 全人群:灭活流感疫苗在健康成年人中免疫原性良好[121]。一项纳入了2011-2020流行季9项国内外RCT研究的Meta分析显示,在18~64岁人群中,对于甲型流感病毒株(A/H1N1、A/H3N2)和IIV3中包含的B系,IIV4和IIV3的血清阳转率和血清保护率的差异无统计学意义。但IIV4对IIV3中未包括的B系血清阳转率和血清保护率差异有统计学意义[122]。2018-19流行季,我国河南省开展的一项四价流感亚单位疫苗的Ⅰ期RCT研究,纳入320名6月龄及以上全年龄段人群,结果显示四价灭活亚单位疫苗安全性和免疫原性非劣效于IIV4[123],随后的Ⅲ期RCT研究进一步证实了该研究结论[124]。国外RCT实验的系统综述和Meta分析显示,在≥18岁的成年人和老年人中,与IIV3相比,IIV4对减少实验室确诊流感的保护效力未发现统计学差异,但是LAIV3的保护效力较差。在儿童中,与IIV3相比,LAIV3和三价灭活佐剂(MF59/AS03)疫苗保护效力更好[125]。
在健康成年人中,根据RCT的系统综述估计,接种灭活流感疫苗可预防59%(95%CI:51%~66%)的实验室确诊流感[126-127];当疫苗株和流行株匹配时,接种灭活流感疫苗可减少42%(95%CI:9%~63%)的ILI就诊[127]。在全年龄组人群中,检测阴性病例对照研究的系统综述(包含2004-2015年的56项研究)发现流感疫苗对不同型别和亚型的流感的预防效果有明显差异,其中B型为54%(95%CI:46%~61%),A(H1N1)pdm09亚型(2009年及以后)为61%(95%CI:57%~65%),H1N1亚型(2009年之前)为67%(95%CI:29%~85%),H3N2亚型为33%(95%CI:26%~39%)[128]。一篇纳入20篇国内外病例对照研究和检测阴性设计研究的系统综述和Meta分析发现,仅在当前季节接种疫苗的保护效果对于所有类型/亚型流感高于任一季节未接种疫苗,两个季节接种疫苗对于H1N1和乙型流感提供的保护效果优于只在前一季接种[129]。
一项针对儿童和青少年的系统综述纳入了截至2019年2月12日比较IIV4和IIV3在儿童和青少年中的免疫原性和安全性的随机对照临床试验显示[130],在6月龄至3岁儿童中,IIV4独有的B型流感系的血清保护率高于IIV3;在3~18岁年龄组中,IIV4独有的B型流感系血清保护率和血清阳转率高于IIV3。此外,IIV4与IIV3具有相同的安全性。一项纳入37项检测阴性病例对照研究的随机效应Meta分析表明,在≤17岁儿童和青少年中,流感疫苗对任何亚型流感患者的住院预防效果为53.3%(95%CI:47.2%~58.8%),其中对A(H1N1)pdm09亚型的住院治疗预防效果最高为68.7%(95%CI:56.9%~77.2%),对A(H3N2)亚型流感的住院治疗预防效果最低为35.8%(95%CI:23.4%~46.3%),且当流行的流感毒株与疫苗毒株抗原匹配时,住院治疗的预防效果较高为59.3%(95%CI:48.3%~68.0%)[131]。
2. 孕妇:研究显示孕妇接种灭活流感疫苗,具有良好免疫原性[132-134]。除HIV感染孕妇的抗体反应较低持续时间相对较短外[135],孕妇和非孕妇对流感疫苗的抗体反应类似[133, 136]。
一项研究对在南非和马里孕妇接种IIV3免疫原性的RCT研究进行了总结[137-139],发现与接种安慰剂组(生理盐水)相比,接种IIV3一个月后A(H1N1)pdm09、A(H3N2)、B(Victoria)抗体滴度比基线分别增加9.4、6.0和9.6倍,抗体阳转率分别为77.0%、64.8%和84.5%,血清抗体保护率分别为93%、83%和91%。
孕妇接种流感疫苗,不仅保护孕妇自身降低孕期患流感、孕期发热、子痫前期、胎盘早破的风险,也可通过胎传抗体保护6月龄内无法接种流感疫苗的新生儿免于罹患流感[140-143]。观察性研究显示,孕妇接种IIV3可以预防实验室确诊流感,保护效果点估计值为44%~65%[144-146]。在4项RCT研究和3项观察性研究的Meta分析中,孕期接种流感疫苗对6月龄以下婴儿实验室确诊流感的保护效果为48%(95%CI:33%~59%);在4项观察性研究的Meta分析中,孕期接种流感疫苗对6月龄以下婴儿实验室确诊的流感相关住院的保护率为72%(95%CI:39%~87%)[147]。2019年一项Meta分析指出[148],相较于孕早期接种流感疫苗,孕晚期接种流感疫苗的孕妇及其新生儿体内血凝抑制试验(haemagglutination inhibition,HI)抗体滴度上升倍数更高,且孕晚期接种流感疫苗更有利于抗体传递给胎儿。英国研究者对孕妇接种流感疫苗的时间与婴儿出生时抗体水平的观察性研究也发现,与孕早期相比,孕妇在孕中期或孕晚期接种流感疫苗其婴儿体内的抗体滴度会更高[149]。多国的回顾性队列观察累计超过35万人群,显示产前接种流感疫苗总体上可降低早产发生率(OR=0.78,95%CI:0.74~0.82)、降低出生时小于胎龄的发生率(OR=0.83,95%CI:0.79~0.87),但不同研究间结果差异较大,可能与研究对象健康选择偏倚、未调整接种和暴露时间间隔、接种时的孕期、疫苗组分与流行株匹配程度等因素有关[150]。
3. 儿童:
(1) IIV:6月龄以上儿童按推荐的免疫程序接种IIV后对流感病毒感染有保护作用。一项在2~18岁人群中开展的IIV4 RCT显示,按规定程序完成接种后,4种疫苗株的GMT均有升高,对实验室确诊流感的保护效果为55%(95%CI:46%~62%)[151]。2017-2020年间在欧洲和亚洲开展的一项多中心随机对照试验中,IIV4对6~35月龄儿童的实验室确诊流感的总体保护效果为54%(95%CI:37%~66%),对匹配流行株的保护效果达到68%(95%CI:45%~81%)[152]。国外研究提示,< 9岁儿童首次接种IIV3时,接种2剂次比1剂次能提供更好的保护作用,如5~8岁儿童接种2剂IIV3后,针对A(H1N1)pdm09、A(H3N2)和B型流感病毒产生的抗体滴度显著高于接种1剂次[153]。日本对2013-18流行季6月龄至12岁儿童的研究提示:无论接种1剂次还是2剂次流感灭活疫苗,均对儿童感染流感具有保护效果,但接种2剂次疫苗在部分年度对B型流感的保护效果更好[154]。中国香港地区对2011-2019流行季因急性呼吸道感染住院的6月龄至9岁儿童开展了接种2剂次和1剂次流感疫苗效果研究[155],发现首次接种流感疫苗完成2剂次程序和仅接种1剂次对流感确诊住院病例的保护效果分别为73%(95%CI:69%~77%)和31%(95%CI:8%~48%)。
我国多项研究也显示了接种IIV对 > 6月龄儿童预防实验室确诊流感有显著效果。一项在浙江省永康市和义乌市开展的流感疫苗保护效果研究中,将2016-18流行季当地监测到的6~72月龄ILI作为研究对象,发现总体流感疫苗保护效果为58%(95%CI:31%~74%)[156]。另一项以苏州大学附属儿童医院2011-2021年间的6~59月龄ILI和SARI病例为研究对象的病例对照研究中,流感疫苗总体保护效果为37%(95%CI:-5%~62%),对ILI和SARI的保护效果分别为27%(95%CI:-35%~60%)和53%(95%CI:-17%~81%);对6~35月龄儿童,部分接种和完全接种的保护效果分别为22%(95%CI:-65%~62.7%)和41%(95%CI:-66%~79%)[157]。一项评估我国大陆地区流感疫苗效果的综述,纳入21篇在2010-11至2017-18流行季开展的研究,通过Meta分析发现6~35月龄儿童接种一剂次流感疫苗的效果为45%(95%CI:18%~64%),接种2剂次流感疫苗的效果为57%(95%CI:50%~64%)[158]。因此,低龄儿童首次接种流感疫苗应接种2剂,才能获得最大程度的保护。
研究提示,IIV4与IIV3相比增加一种B型流感抗原组分的保护,在儿童中对共同包含的B型流感的免疫原性非劣效于IIV3。2018年在我国南方地区开展的一项随机、双盲、接种IIV3为对照的临床试验,比较了在6~35月龄儿童中IIV3和IIV4的免疫原性,发现IIV4对于共享的A型毒株(A/H1N1和A/H3N2)和相应的B型毒株(B/Victoria或B/Yamagata)的GMT和血清阳转率非劣效于IIV3组[114]。
接种流感疫苗可降低儿童的流感相关医疗机构就诊和住院,并预防相关并发症。我国香港地区2017-18流行季节一项6月龄至17岁儿童流感疫苗效果研究[159],共纳入1 078名儿童,研究对象接种的大多为IIV4,结果显示流感疫苗对确诊流感住院总的保护效果为65.6%(95%CI:42.7%~79.3%),对A型和B型流感的保护效果分别为66.0%(95%CI:3.4%~88.0%)和65.3%(95%CI:39.5%~80.1%)。北京市对2013-2016季节流感疫苗效果模型研究发现,对于5~14岁儿童,3个季节接种流感疫苗分别可以减少约104 000例(95%CI:101 000~106 000)、23 000例(95%CI:22 000~23 000)和21 000例(95%CI:21 000~22 000)流感相关门急诊就诊[160]。2016-17流行季北京市流感疫苗对减少流感相关门急诊就诊效果为25%(95%CI:0%~43%),对A(H1N1)pdm09为中等保护效果,而对A(H3N2)为低保护效果[161]。苏州地区一项关于6~59月龄儿童在2011年10月至2016年9月流行季接种流感疫苗效果的研究发现,在25万名儿童中,接种流感疫苗预估将减少731例(95%CI:549~960)流感住院病例,预防分数(prevented fraction,PF,指由于采取了适当干预措施或者对某些危险因素管控从而在特定人群中避免疾病发生的比例)为6.2%(95%CI:5.8%~6.6%);减少10 024例(95%CI:7 593~12 937)ILI(PF=6.5%,95%CI:6.4%~6.7%)[162]。随着流感疫苗接种覆盖率的下降,每年的PF也在下降,如果50%的研究人群接种了流感疫苗,那么预估将减少4 059例(95%CI:3 120~5 762)ILI(PF=27.2%,95%CI:26.4%~ 27.9%);减少56 215例(95%CI:42 925~78 849)ILI(PF=28.5%,95%CI:28.3%~28.7%)[162]。一项针对6~35月龄儿童的随机、多中心、安慰剂对照研究中显示,与对照组相比,接种IIV4的儿童确诊流感后急性中耳炎风险降低31%(95%CI:9%~89%)、ARLI风险降低22%(95%CI:6%~59%)、医疗保健行为风险减少41%(95%CI:30%~56%)、父母旷工风险减少30%(95%CI:12%~67%)[163]。
一项关于流感疫苗对实验室确诊的儿童流感相关住院的疫苗保护效果的综述,对纳入的37篇检测阴性设计的研究进行Meta分析发现,流感疫苗对儿童流感引起的住院的总保护效果为53.3%(95%CI:47.2%~58.8%)[164]。对A(H1N1)pdm09亚型所引起的儿童流感相关住院的保护效果较高为68.7%(95%CI:56.9%~77.2%),对A(H3N2)亚型所引起的儿童流感相关住院的保护效果35.8%(95%CI:23.4%~46.3%);其中流感减毒活疫苗对儿童流感相关住院的保护效果为44.3%(95%CI:30.1%~55.7%),灭活疫苗对儿童流感相关住院的保护效果为68.9%(95%CI:53.6%~79.2%)[164]。我国香港地区在2019-20流行季,流感疫苗对儿童住院的保护效果为65%(95%CI:46%~78%),其中对A(H1N1)pdm09亚型流感病毒住院的保护效果为74%(95%CI:54%~85%)[165]。
儿童接种流感疫苗还能对其他人群起到间接保护作用。我国香港地区的一项基于家庭的随机对照研究探索了儿童接种流感疫苗对于家庭成员的保护作用,使用模型量化得出流感疫苗的直接保护效果为71%(95%CI:53%~83%),同时对其他家庭成员可减少约20%的感染风险[166]。
另外,接种流感疫苗还可以减少抗生素的使用。美国南加州开展的一项研究提示[167],6月龄至17岁儿童使用流感疫苗可以降低门诊处方抗生素的使用率,流感疫苗接种率每提高1%,门诊抗生素处方使用下降3人次/千人月。在全球开展的一项随机、多中心、安慰剂对照研究中,6~35月龄儿童使用IIV4后降低了39%(95%CI:27%~56%)的抗生素使用[163]。
(2) LAIV:LAIV中含有鼻腔接种后可在鼻咽部复制的减毒流感病毒,其所含疫苗株具有3个特点:毒力衰减(限制其反应原性和致病性)、温度敏感性(限制其在下呼吸道复制)和冷适应性(允许其在鼻咽部复制)[168]。经鼻腔接种LAIV后可诱导血清和鼻黏膜均产生抗体,同时也可诱导细胞介导的免疫反应[169]。
一项关于评价LAIV在预防2~17岁儿童季节性流感的保护效果的研究,对2003-2018年之间的14篇相关文献进行了Meta分析,结果显示LAIV预防儿童季节性流感的保护效果为49%(95%CI:40%~57%),预防A(H1N1)pdm09亚型、A(H3N2)亚型和B型流感的保护效果分别为35%(95%CI:5%~56%)、35%(95%CI:21%~46%)和71%(95%CI:55%~82%);LAIV3和LAIV4在儿童中的保护效果分别为56%(95%CI:48%~63%)和44%(95%CI:27%~57%);LAIV在欧洲地区和北美洲地区的保护效果分别为65%(95%CI:47%~77%)和46%(95%CI:36%~55%)[170]。一项2016-2017流行季在我国东部地区3~17岁儿童中开展的随机、双盲、对照试验评价了LAIV3的效力[171],结果发现疫苗对所有亚型流感的效力为62.5%(95%CI:27.6%~80.6%),对A(H3N2)亚型流感的效力为63.3%(95%CI:27.5%~81.5%)。
除对实验室确诊流感有保护效果外,一项RCT提示,LAIV3可减少21%(95%CI:11%~30%)的发热性疾病,也可减少30%(95%CI:18%~45%)的中耳炎[172]。对6项安慰剂对照试验研究的Meta分析提示,LAIV3对6~83月龄儿童实验室确诊流感合并急性中耳炎的保护效果为85%(95%CI:78%~90%)[173]。
4. 学生:开展基于学校的流感疫苗接种可有效减少学龄儿童流感感染的发生。2014-2015流行季,北京市基于中小学校流感集中发热疫情的研究表明,在确诊流感的学生中,接种流感疫苗的学生与未接种的学生相比,出现38℃以上发热的风险显著减低(OR=0.42,95%CI:0.19~0.93)[174]。疫苗株与流行株匹配的季节,北京市流感疫苗大规模集中接种可使流感集中发热疫情的发生风险大幅降低(OR=0.11,95%CI:0.075~0.17)[175]。在疫苗株与流行株不完全匹配的情况下,北京市流感疫苗大规模集中接种仍可使流感集中发热疫情的发生风险大幅降低(OR=0.50,95%CI:0.34~0.75),且在该流行季推荐的中小学校流感疫苗接种率阈值为51%[176]。2016-2017流行季,北京市中小学生接种流感疫苗的总体保护效果为69%(95%CI:51%~ 81%),其中对A(H1N1)pdm09和A(H3N2)亚型流感的保护效果分别为60%(95%CI:-15%~86%)和73%(95%CI:52%~84%)[177]。在2011-17的6个连续流行季,一项在美国开展的回顾性队列研究,对比了实施学校接种流感疫苗计划(school-located influenza vaccination,SLIV)的公立学校和私立学校学生,研究表明SLIV组的接种率比对照组高8%~11%,SLIV组的学生在2015-2017流行季的奥司他韦处方量分别降低了3.5/千人(95%CI:-5.5/千人~-1.5/千人)和4.0/千人(95%CI:-6.5/千人~-1.6/千人),此外SLIV还可以对 > 65岁的老年人急性呼吸道疾病就诊率产生一定影响,在实施SLIV地区的老年人在2014-2017连续3个流行季的急性呼吸道疾病就诊率发病率分别下降了13.2/千人(95%CI:-23.2/千人~-3.2/千人)、21.5/千人(95%CI:-31.1/千人~-11.9/千人)和13.0/千人(95%CI:-23.2/千人~-2.9/千人)[178]。
2016-17流行季韩国的一项研究发现,韩国小学生接种流感疫苗后2周以上、3周以上以及4周以上预防流感的效果分别为17.6%(95%CI:4.6%~28.9%)、22.5%(95%CI:10.3%~33.0%)和28.7%(95%CI:17.5%~38.3%)[179]。2018-19流行季,我国香港地区的一项研究发现,接种流感疫苗的小学生与未接种的小学生相比,ILI发生率显著降低(7.7% vs. 14.1%),保护效果达45.3%[180]。同时,学生接种流感疫苗还可减少由于罹患流感导致的缺勤缺课。深圳市在2017年12月至2020年6月在286所小学开展的实证研究显示,相比于非入校接种和低接种率,入校接种和高接种率可有效降低缺课的发生风险,对缺课的预防效果分别为32.6%(95%CI:17.0%~45.3%)和53.0%(95%CI:42.1%~61.8%)[181]。
5. 老年人:2018年一篇对8个RCT的Meta分析发现,老年人接种流感疫苗预防流感的保护效力为58%(95%CI:34%~73%)[182]。2015-16、2016-17、2017-18和2019-20四个流行季,美国≥65岁老年人接种流感疫苗预防因流感导致的急性呼吸道疾病就诊的效果分别为42%(95%CI:6%~64%)、46%(95%CI:4%~70%)、18%(95%CI:-25%~47%)和12%(95%CI:-31%~40%)[183-186]。2017年一项对检测阴性病例对照研究设计的社区老年人流感疫苗效果的Meta分析发现,无论流感疫苗与流行株是否匹配,接种流感疫苗均有效,疫苗株与流行株匹配时保护效果为44.4%(95%CI:22.6%~60.0%),不匹配时保护效果为20.0%(95%CI:3.5%~33.7%)[187]。我国一项对1998-2008年流感疫苗效果研究的Meta分析发现,针对老年人的队列研究,流感疫苗对≥60岁老年人的流感样疾病的预防效果为53%(95%CI:20%~72%)[188]。
接种流感疫苗还可降低老年人流感相关并发症发生率,减少流感相关住院及死亡。2013年一篇对95项研究的Meta分析发现,在流感季节,老年人接种流感疫苗能预防28%(95%CI:26%~30%)的流感相关致命性或非致命性并发症、39%(95%CI:35%~43%)的流感样症状、49%(95%CI:33%~62%)的确诊流感[189]。2010-11至2015-16连续6个流行季,加拿大安大略省一项检测阴性病例对照研究表明,接种流感疫苗对≥65岁老年人流感病毒感染死亡的总体保护效果为20%(95%CI:7%~30%),其中对甲型H1N1、H3N2亚型流感和乙型流感感染后死亡的保护效果分别为48%(95%CI:15%~68%)、30%(95%CI:11%~45%)和26%(95%CI:-2%~47%)[190]。2017-18流行季,美国 > 65岁老年人接种流感疫苗减少了715 073人发病,400 441人就诊,65 007人住院,6 796人死亡[191];2018-19流行季,则减少了300 879人发病,168 492人就诊,28 695人住院,2 625人死亡[192]。然而2020年英国一项基于生态学研究的结果提示,流感疫苗接种并不能降低肺炎全死因死亡率[193]。
多项研究表明,老年人接种标准剂量的流感疫苗所产生的抗体水平、保护效力和保护效果与年轻人比较相对较低[126, 194-197],但我国江苏省开展的一项四价灭活疫苗的三期临床试验提示,> 60岁人群接种后血清抗体阳转率与18~59岁人群基本持平[198]。为提高流感疫苗在老年人中的免疫应答、保护效力和保护效果,2009年美国食品药品监督管理局批准了高剂量三价灭活流感疫苗,将每种抗原组分的含量由标准的15 μg提高到60 μg[199]。与接种标准剂量流感疫苗相比,老年人接种高剂量流感疫苗可产生较高水平的流感抗体[200-204],对于预防流感确诊感染具有相对较好保护效力[203-204],同时对于预防流感确诊感染、流感相关就诊、住院和死亡具有相对较好的保护效果[205-209]。同时,除高剂量灭活疫苗外,国外还上市了佐剂疫苗、重组疫苗等。2018-19流行季的一项多中心随机对照试验的非劣效性研究发现,重组四价病毒样颗粒流感疫苗对 > 65岁老年人保护效果并不劣于四价灭活疫苗,其对流感所致ILI的相对保护效果为8.8%(95%CI:-16.7%~28.7%)[210]。
6. 慢性基础性疾病患者:我国开展的队列研究表明,接种IIV3可以减少慢性阻塞性肺疾病(chronic obstructive pulmonary diseases,COPD)和慢性支气管炎的急性感染和住院[211-212]。成都市的一项队列研究发现,与未接种疫苗的对照组相比,IIV3接种3个月、6个月后COPD急性加重的住院天数分别减少3.3、7.1 d[211]。流感疫苗对儿童和成年人哮喘患者有较好免疫原性[213];哮喘患者接种流感疫苗能够有效减少流感感染和哮喘发作[214]。流感疫苗在心血管疾病患者中免疫原性良好,能够保护心血管病患者减少流感感染。冠心病患者接种流感疫苗后,可以减少急性冠脉综合征(acute coronary syndromes,ACS)患者的心血管不良事件发生率,降低其住院风险和与心脏病相关的死亡率[215],减少ACS患者与流感有关的直接和间接医疗成本,符合成本效益[216-217]。近期一项系统综述纳入2000-2021年期间进行的6项RCTs研究,共纳入9 001例患者,平均年龄65.5岁,52.3%的患者具有心脏病史,研究发现接种流感疫苗将心血管不良事件发生风险降低34%(95%CI:17%~47%),ACS发生风险降低45%(95%CI:25%~49%)[218]。流感疫苗还可降低心衰患者的死亡风险,丹麦的一项队列研究提示,在随访期间(中位随访时间为3.7年),校正相关混杂因素后,接种≥1剂次流感疫苗可使心力衰竭患者的全因死亡风险降低18%(HR=0.82,95%CI:0.81~0.84),心血管死亡风险也降低18%(HR=0.82,95%CI:0.81~0.84)[219]。18~64岁的糖尿病患者接种流感疫苗对住院的保护效果为58%;老年人糖尿病患者接种流感疫苗,对住院的保护效果为23%,对全死因死亡的保护效果为38%~56%[220]。另外,研究显示接种流感疫苗可以减少免疫功能受损的流感住院儿童并发症的发生风险,缩短住院时间[221]。2021年的一项研究表明,高剂量流感疫苗在HIV感染者和其他免疫缺陷患者中产生较强的免疫原性反应[222]。目前上市的疫苗中LAIV不推荐用于免疫功能低下的个体[8]。
7. 医务人员:WHO流感疫苗立场文件(2022年版)指出,目前所有可获得的灭活或重组季节性流感疫苗研究均显示,与不接种相比,接种疫苗更有益处,因此推荐为卫生工作者接种流感疫苗[8]。医务人员接种流感疫苗的重要作用不仅在于保护其自身,还在于减少患者流感相关疾病。大量文献研究证实接种流感疫苗可以降低医务人员流感发病率,减少医务人员带病工作的风险,对保障医疗安全有重要意义[223-225]。研究显示,医务人员流感疫苗覆盖率与患者发生院内感染的概率呈负相关(OR=0.97,95%CI:0.94~0.99)[226]。一项收录了1980-2018年研究结果的系统综述显示,疫苗接种组实验室确诊的流感发病率明显低于未接种组(RR=0.40,95%CI:0.23~0.69),并且由ILI导致的缺勤率降低(合并RR=0.62,95%CI:0.45~0.85)[225]。一项系统综述研究表明接种流感疫苗可降低新冠肺炎的严重程度[227]。在新冠肺炎疫情大流行期间推荐医务人员作为接种流感疫苗的最高优先级人群,减少由于流感导致的缺勤、阻断从医护人员到患者的流感传播、降低卫生系统更广泛的负担[228]。接种流感疫苗还能有效降低新冠肺炎患者发生卒中、败血症和深静脉血栓的风险,同时降低患者急诊、住院或全因死亡率[229-230]。
(三) 免疫持久性人体对感染流感病毒或接种流感疫苗后获得的免疫力会随时间衰减,衰减程度与人的年龄和身体状况、疫苗抗原等因素有关,临床试验的证据提示,接种灭活流感疫苗对抗原类似毒株的保护作用可维持6~8个月[231]。接种一年后血清抗体水平显著降低[232-234],但部分毒株的保护作用持续时间可更长。近期研究表明血清抗体降低与骨髓浆细胞数量下降相关,即特异性骨髓浆细胞在流感疫苗接种4周后增加,但在1年后降至接种前水平[235]。
为匹配不断变异的流感病毒,WHO在多数季节推荐的流感疫苗组分会更新一个或多个毒株,疫苗毒株与前一季节完全相同的情况也存在。为保证接种人群得到最大程度的保护,即使流感疫苗组分与前一季节完全相同,鉴于多数接种者抗体滴度已显著下降,因此不管前一季节是否接种流感疫苗,仍建议在当年流感季节来临前接种。
疫苗效果研究同样证实了重复接种的必要性。据我国香港地区对2012-17连续5个流行季儿童住院病例中流感疫苗效果的分析估计[236],流感疫苗接种后每个月效果约下降2%~5%,接种后0.5~2个月时疫苗效果估计为79%(95%CI:64%~88%),至接种后7~9个月时疫苗效果仅余45%(95%CI:22%~61%)。浙江省的一项前瞻性研究提示,在 > 60岁的老年人中针对B(Victoria)系病毒毒株诱导的保护性抗体持续时间未超过6个月[237]。此外,数学模型结果提示每年接种流感疫苗后前几季接种的流感疫苗在当季仍存在一定保护作用[238]。
(四) 安全性疑似预防接种异常反应(adverse event following immunization,AEFI)是指在预防接种后发生的怀疑与预防接种有关的不良反应或医学事件。《全国疑似预防接种异常反应监测方案》(2022年版)要求责任报告单位和报告人发现属于报告范围的AEFI(包括接到受种者或其监护人的报告)后应当及时向受种者所在地的县级卫生行政部门、药品监督管理部门报告,相关信息将通过国家AEFI信息管理系统进行网络直报。
1. IIV:通过肌肉注射接种IIV是安全的,所有年龄段人群(包括慢性基础病人群和孕妇)均具有良好的耐受性。流感疫苗常见的不良反应主要表现为局部反应(接种部位红晕、肿胀、硬结、疼痛、烧灼感等)和全身反应(发热、头痛、头晕、嗜睡、乏力、肌痛等)。通常是轻微的、自限的,一般在1~2 d内自行消退,极少出现重度反应。近年来我国IIV4的使用量逐年增加,研究数据表明IIV4在低龄儿童、成年人、老年人中的安全性良好,与IIV3在安全性上没有差别[239-248]。适合6月龄至3岁儿童接种的IIV4首次在我国上市使用,RCT研究显示6月龄至3岁儿童接种IIV4耐受性良好,不良反应率在IIV4接种组和非流感疫苗接种组间无差异[152]。2015-2018年AEFI信息管理系统的监测数据分析显示,所有接种IIV不良反应中报告最多的为发热(腋温≥37.1 ℃),其中高热(腋温≥38.6 ℃)发生率为4.274/10万剂,儿童型疫苗略高于成年人型(4.47/10万剂vs. 4.17/10万剂);非严重异常反应中,以过敏性皮疹(442例,0.53/10万剂)和血管性水肿(70例,0.084/10万剂)报告最多;严重异常反应的报告发生率低,为0.14/10万剂,排名前两位为热性惊厥(27例,0.032/10万剂)和过敏性紫癜(21例,0.025/10万剂)[249]。热性惊厥在儿童中较为常见,2%~5%的6月龄至5岁儿童至少经历过一次热性惊厥,几乎所有出现热性惊厥的儿童均会快速康复[250],单独接种IIV未显著增加发生热性惊厥的风险[251-252]。≥65岁老年人或18~64岁患有一种或多种慢性疾病的住院患者在接种IIV后不良事件发生率无差别[253]。孕妇接种灭活流感疫苗后未见孕妇并发症、不良妊娠结局等不良反应的发生风险增加[254]。
2. LAIV:在健康儿童和成年人中的安全性良好,具有良好的耐受性。一项系统综述显示,与接种安慰剂或IIV相比,接种LAIV后自限性的流鼻涕或鼻塞、咽痛、发热等症状的发生更常见[255]。一项针对2~17岁儿童接种LAIV3疫苗安全性的大型队列研究发现,接种LAIV后不良反应的风险没有显著增加,在该队列中仅观察到1例与接种LAIV相关的过敏反应(发生率为1.7/100万)和5例晕厥(发生率为8.5/100万)[152]。2016-17流行季在我国开展了一项针对3~17岁健康儿童接种LAIV3的Ⅲ期RCT研究共纳入2 000名健康儿童,其中998名接种LAIV疫苗,1 001名接种安慰剂,疫苗组和安慰剂组分别报告7起和4起不良事件,均被认为与接种疫苗无关,但疫苗组发热发生率比安慰剂组高,且在3~9岁年龄组更加明显(26.9% vs. 18.8%)[171]。
经鼻腔喷雾免疫后,减毒活疫苗毒株的排出是正常现象。孟加拉国一项2期RCT研究评估24~59月龄儿童接种LAIV的病毒脱落,接种组(150名)中78.0%的儿童在一周内能够检测到至少一种疫苗株病毒脱落[256]。英国在2016-17和2017-18流行季连续开展队列研究观察接种LAIV后病毒脱落情况[257],研究显示,在连续两个流行季,A(H1N1)pdm09、A(H3N2)、B(Victoria)、B(Yamagata)4种疫苗株病毒脱落检出率为8.2%、19.3%、31.0%、27.9%,并且受接种者年龄越小,发生疫苗株病毒脱落的风险越大[257]。疫苗成分中的流感减毒病毒导致无免疫力的人感染极为罕见,不具有公共卫生意义。
我国目前的流感疫苗预防接种指南尚不推荐2~4岁患有哮喘的儿童接种LAIV,但近几年的研究发现,患有哮喘病的儿童接种LAIV并没有报道更多的安全问题发生[258-260]。另外,接种LAIV在鸡蛋过敏的2~17岁儿童和青少年中也具有良好的耐受性[261]。
(五) 疫苗成本效果、成本效益接种流感疫苗能有效减少流感相关门急诊、住院和死亡人数,继而降低治疗费用,产生明显的经济效益。广州、西宁和潍坊等地采用回顾性队列、病例对照和横断面研究发现,儿童和老年人接种流感疫苗均有较高的成本效益[89, 262-263]。
一项北京地区的最新研究通过构建决策树模型,从全社会角度评估了学龄儿童、老年人和医务人员接种IIV3和IIV4的卫生经济学效果。该研究发现,学龄儿童、老年人和医务人员接种IIV3,其流感确诊病例为1 506.6/10万,住院为80.8/10万,死亡为8.0/10万;相对于接种IIV3,接种IIV4可以减少流感确诊病例364.1/10万,住院12.9/10万,死亡1.0/10万;每获得一个QALYs需多支付13 580(95%CI:13 294~13 867)美元,低于3倍人均GDP,接种IIV4具有成本效果[264]。
一项评估深圳市≥60岁人群免费接种流感疫苗的成本效果的研究,通过构建马尔科夫状态转换模型,从社会的角度来评估与不接种疫苗相比,每年接种流感疫苗预防流感的成本效果,研究发现与不接种疫苗相比,≥60岁市民免费接种流感疫苗可以人均节约总成本35元并且多获得0.007个QALYs,人均获得的净货币效益为529元,每年接种流感疫苗是一项成本节约的疾病预防策略[265]。
我国香港地区的一项研究通过构建数学模型究发现,相比于未接种疫苗,≥50岁人群每年接种流感疫苗同时在50岁和65岁时各接种一剂次23价肺炎链球菌,以及≥65岁人群每年接种流感疫苗且在65岁时接种一剂次23价肺炎链球菌均可节省成本,增量成本效果比分别为49.5美元/QALY和94.9美元/QALY[266]。
尚未检索到我国相关研究评估接种LAIV的卫生经济学效果。英国的最新一项基于传播动力学模型的研究表明,与其他基于年龄的接种策略(2~4岁、12~16岁、2~11岁、2~4岁/12~16岁、5~16岁、2~16岁)相比,5~11岁儿童接种四价LAIV是最具有成本效果的,以现行接种策略(即接种人群为≥65岁且无基础疾病者,以及6月龄至65岁且具有基础疾病者)为参照,每获得一个QALY需多支付639(95%CI:-389~1 666)英镑,低于支付意愿阈值(20 000英镑)[267]。
(六) 流感疫苗与其他疫苗或药物的同时使用1. 与非新冠疫苗的使用:我国开展的3~7岁儿童IIV3与23价肺炎球菌多糖疫苗[Pneumococcal Polysaccharide Vaccine (23-valent),PPSV23]联合接种的免疫原性和安全性研究显示,IIV3与PPSV23联合接种在免疫原性方面非劣效于两种疫苗单独接种的免疫原性,在安全性方面,一级不良反应在不同接种组之间差异无统计学意义,联合接种组的二级不良反应略高于单独接种组,各组间未发生三级及以上不良反应[268]。既往研究亦提示,除了低年龄组婴儿出现热性惊厥的风险有可能增加外,IIV与儿童常规接种的免疫规划疫苗同时接种不影响疫苗免疫原性和安全性[8],也有研究指出,6~23月龄儿童中IIV与PCV13联合接种会导致接种后0~1 d发热风险增加[269],IIV与PCV7、PCV13、破伤风疫苗及百日咳疫苗联合使用会导致接种后0~1 d热性惊厥风险增加[251-252],但大多数此类发热反应发作短暂且预后良好[270],儿童同时接种LAIV、麻腮风疫苗及水痘疫苗,与单独接种相比不会降低任何一种成分的免疫原性[271]。
国外研究提示,成年人同时接种PCV13[272-273]、破伤风疫苗或百日咳疫苗[274]、IIV,可观察到免疫原性降低,但无明确临床意义。≥50岁人群中的研究发现,IIV与带状疱疹减毒活疫苗同时接种和间隔4周接种相比,产生的抗体反应基本相同[275-276]。≥65岁人群中研究发现,同时接种IIV4和PPSV23与间隔两周接种相比,同时接种组4~6周后对B亚型流感抗原的血清保护率较低,但在接种6个月后,4种流感抗原的血清保护率没有差异[277]。此外,IIV与带状疱疹减毒活疫苗[275-276]、PCV13[272-273]、PPSV23[277-278]、破伤风类毒素[274]或百日咳疫苗[274]分别同时接种于成年人,具有可靠的安全性。
上述研究结果提示,绝大部分研究均未发现影响IIV和联合接种疫苗的免疫原性减弱和安全性降低的明确证据;仅少数研究提示疫苗免疫原性可能有所降低,但并无明确临床意义。虽然目前LAIV与其他疫苗联合接种研究相对有限,但均未发现安全性问题。WHO和美国CDC也在其流感疫苗预防接种技术指南中推荐灭活流感疫苗可以与其他灭活疫苗及减毒活疫苗同时或依次接种,而减毒流感疫苗则需要间隔一定时间后才能接种其他减毒疫苗[8, 168]。
2. 与新冠病毒疫苗的使用:2021年10月,WHO发布了季节性流感疫苗与新冠疫苗同时接种的建议[279],虽然上述两种疫苗同时接种的证据有限,但现有证据未显示同时接种会导致不良反应增加或产生抗体干扰。因此,考虑到流感病毒和新冠病毒可能带来的严重疾病影响,认为灭活流感疫苗与任何类型的新冠疫苗同时接种是可以接受的,建议加强接种后的不良反应监测。2022年5月,WHO更新的流感疫苗立场文件[8],认为基于现有有限证据,IIV与现行使用的新冠疫苗同时接种未观察到疫苗安全性和有效性受到影响,亦建议灭活流感疫苗可以与新冠疫苗同时接种。
英国在18~59岁人群中开展一项流感疫苗和新冠疫苗同时接种的Ⅳ期RCT研究[280],研究对象在接种第2剂次新冠疫苗(分别为腺病毒载体新冠疫苗和mRNA新冠疫苗)时同时接种流感疫苗(分别为三价佐剂疫苗、细胞培养的四价疫苗、重组四价疫苗),结果发现同时接种两种疫苗不良反应发生的概率未提示存在差异,且两种疫苗的抗体阳转率及抗体滴度亦未减弱。另一项英国对≥18岁人群开展的流感疫苗和新冠疫苗同时接种的Ⅲ期RCT研究亦提示[281],流感疫苗(三价佐剂疫苗和细胞培养的四价疫苗)与重组蛋白新冠疫苗同时接种未对疫苗安全性产生影响,与单独接种新冠疫苗的人群相比,同时接种未对疫苗保护效力产生影响。一项针对≥65岁老年人开展的第三剂次新冠疫苗(mRNA疫苗)与高剂量四价流感疫苗同时接种的Ⅱ期RCT研究提示[282],同时接种疫苗安全性未产生差异,两种疫苗的抗体阳转率及抗体滴度在同时和间隔接种组间亦未存在差异。美国开展了一项关于mRNA新冠疫苗加强剂和流感疫苗同时接种反应原性的真实世界回顾性队列研究[283],2021年9月22日至2022年5月1日期间累计981 099名≥12岁的接种者在V-safe APP主动报告疫苗接种信息,研究表明,与单独接种mRNA新冠疫苗加强针相比,同时接种mRNA新冠疫苗加强针和季节性流感疫苗在疫苗接种后1周内报告全身不良反应的风险有所增加,但多为疲乏、头痛、肌肉酸痛等轻中度不良反应。2021年3-5月,我国一项在18~59岁组人群开展的IIV4与新冠灭活疫苗同时接种的非劣效、Ⅳ期RCT研究,纳入480名研究对象进行分析,研究结果提示同时接种未增加不良事件发生风险,且流感疫苗的抗体阳性率和阳转率在同时接种组和间隔接种组间亦未存在显著差异[284]。同期开展的另一项IIV4和新冠灭活疫苗同时接种的多中心、非劣效、Ⅳ期RCT研究,进一步扩大了样本量(1 132名参与者)和人群范围(≥18岁),研究结果也支持IIV4和新冠灭活疫苗同时接种具有较好的安全性和免疫原性[285]。目前缺乏LAIV与国产新冠疫苗同时接种的有效性和安全性有关数据。
结合WHO立场文件及其关于新冠疫苗和流感疫苗同时接种的建议,以及目前国际上发表的和我国已开展的有限的关于同时接种研究结果,经审慎考虑,认为≥18岁人群同时接种灭活流感疫苗和新冠疫苗安全性和免疫原性是可以接受的,可以降低感染流感病毒或新冠病毒后出现严重疾病的风险,能够提高免疫接种效率,减少接种者前往接种门诊的次数。同时接种时应在两侧肢体接种部位分别进行接种。另一方面,还需要加强疫苗接种后不良事件监测,并开展更多的研究以积累更充分的同时接种的证据。对于接种LAIV以及 < 18岁的未成年人,由于目前和新冠疫苗同时接种的证据缺乏,建议仍参照我国《新冠疫苗接种技术指南(第一版)》的建议,与新冠疫苗接种间隔 > 14 d。
3. 与药物的使用:免疫抑制剂(如皮质类激素、细胞毒性药物或放射治疗)的使用可能影响接种后的免疫效果[286-288],为避免可能的药物间相互作用,任何正在进行的治疗均应咨询医生。服用流感抗病毒药物预防和治疗期间也可以接种IIV[168]。由于LAIV含有活的流感减毒,抗流感病毒药物的使用可能会影响其接种后的免疫反应,不建议两者同时使用[168]。
四、2022-2023年度接种建议每年接种流感疫苗是预防流感经济有效的措施。目前,流感疫苗在我国属于非免疫规划疫苗,公民自愿接种。2022年4月国务院印发的《“十四五”国民健康规划》,要求强化疫苗预防接种,做好流感疫苗供应保障,推动重点人群流感疫苗接种。
国务院应对新型冠状病毒肺炎疫情联防联控机制综合组2021年印发的《关于做好2021-2022年流行季流感防控工作的通知》(联防联控机制综发〔2021〕109号)要求高度重视流感防控工作,继续实施“强化监测预警、免疫重点人群、推进多病共防、规范疫情处置、落实医疗救治、广泛宣传动员”的综合举措:一是有序推进流感疫苗接种工作,按照优先顺序对重点和高风险人群开展接种,鼓励有条件的地方对其实施免费接种,提升流感疫苗接种率,减少流感聚集性疫情的发生;二是提升流感疫苗接种服务能力和接种便利性,合理规划或增设流感疫苗接种单位,统筹做好新冠疫苗、流感疫苗和其他常规疫苗接种工作。鼓励各地实行预约优先接种,为社会公众、接种机构提供便捷、可靠的疫苗接种预约工具和途径,落实延长接种周期、开展分时接种、增加每日服务时间等措施,鼓励在学校、幼儿园、养老机构等单位组织开展集中接种,为群众提供便利化服务,引导群众有序接种,三是加强流感疫苗采购调配管理及接种数据信息化管理。
为指导公众科学认识和预防流感,提升防护意识和健康素养,逐步提高重点人群的疫苗覆盖率,各级CDC要积极组织开展科学普及、健康教育、风险沟通和疫苗政策推进活动,组织指导疫苗接种时,应重点把握好剂型选择、优先接种人群、接种程序、接种禁忌和接种时机等技术环节。
(一) 抗原组分WHO推荐的2022-2023年度北半球基于鸡胚生产的三价流感疫苗组分为:A/Victoria/2570/2019(H1N1)pdm09类似株、A/Darwin/9/2021(H3N2)类似株和B/Austria/1359417/2021(Victoria系)类似株。四价流感疫苗组分包含B型毒株的两个系,为上述3个毒株及B/Phuket/3073/2013(Yamagata系)类似株。与上一年度相比,A(H3N2)亚型、B(Victoria)系病毒更换了毒株。
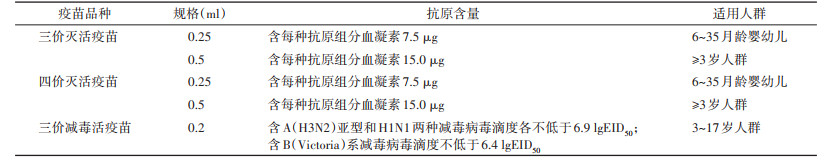
(二) 疫苗种类及适用年龄组我国批准上市的流感疫苗包括三价灭活疫苗(IIV3)、三价减毒活疫苗(LAIV3)和四价灭活疫苗(IIV4),其中IIV3有裂解疫苗和亚单位疫苗,可用于≥6月龄人群接种,包括0.25 ml和0.5 ml两种剂型;LAIV3为冻干制剂,用于3~17岁人群,每剂次0.2 ml;IIV4为裂解疫苗,可用于≥6月龄人群接种,包括0.25 ml和0.5 ml两种剂型。0.25 ml剂型含每种组分血凝素7.5 μg,适用于6~35月龄婴幼儿;0.5 ml剂型含每种组分血凝素15.0 μg,适用于≥36月龄的人群;0.2 ml剂型含A(H1N1)pdm09和A(H3N2)两种减毒病毒滴度各不低于6.9 lg EID50 (50% egg infectious dose,EID50),含B(Victoria)系减毒病毒滴度不低于6.4 lg EID50。对可接种不同类型、不同厂家疫苗产品的人群,可自愿接种任何一种流感疫苗,无优先推荐(表 2)。
流感疫苗安全、有效。原则上,接种单位应为≥6月龄所有愿意接种疫苗且无接种禁忌的人提供免疫接种服务。结合新冠肺炎和流感疫情形势,为尽可能降低流感的危害和对新冠肺炎疫情防控的影响,优先推荐以下重点和高风险人群及时接种。
1. 医务人员:包括临床救治人员、公共卫生人员、卫生检疫人员等。新冠肺炎疫情大流行期间的流感疫苗使用,应优先考虑保护医务人员。医务人员接种流感疫苗既可预防个人因感染流感导致工作效率低下或缺勤影响医疗机构运转,又可有效避免传染流感给同事或患者,保障和维持医疗机构的正常接诊和救治能力。
2. 大型活动参加人员和保障人员:全国和地方两会等重大活动、体育赛事人员密度高,容易发生聚集性疫情。建议要求所有的活动参加人员,包括代表、委员、参赛人员、列席人员、工作人员、服务人员、保障人员等至少提前两周接种流感疫苗。其中活动保障人员,若无接种禁忌要求强制接种。
3. 养老机构、长期护理机构、福利院等人群聚集场所脆弱人群及员工:对以上人员接种流感疫苗,可降低此类集体场所聚集性疫情发生的风险,同时降低老年人群罹患流感及感染后发生严重临床结局的风险。
4. 重点场所人群:托幼机构、中小学校的教师和学生,监所机构的在押人员及工作人员等是容易发生流感和新冠肺炎暴发疫情的重点场所,对此类场所人群接种流感疫苗,可降低人群罹患流感风险和流感聚集性疫情的发生。
5. 其他流感高风险人群:包括≥60岁的居家老年人、6月龄至5岁儿童、特定慢性病患者、< 6月龄婴儿的家庭成员和看护人员,以及孕妇或准备在流感季节妊娠的女性,降低此类高危人群罹患流感及感染后发生严重临床结局的风险。
(1)≥60岁的居家老年人:患流感后死亡风险最高,也是新冠病毒感染后重症和病死的高危人群,是流感疫苗接种的重要目标人群。
(2) 6~23月龄的婴幼儿:患流感后出现重症的风险高,流感住院负担重,应优先接种流感疫苗。疫苗在该年龄组的效果受疫苗株与循环毒株匹配程度影响较大。
(3) 2~5岁儿童:流感疾病负担也较高,但低于2岁以下儿童。该年龄组儿童接种流感疫苗免疫应答反应通常优于2岁以下儿童。
(4) 罹患一种或多种慢性病者:心血管疾病(单纯高血压除外)、慢性呼吸系统疾病、肝肾功能不全、血液病、神经系统疾病、神经肌肉功能障碍、代谢性疾病(包括糖尿病)等慢性病患者、患有免疫抑制疾病或免疫功能低下者,患流感后出现重症的风险很高,应优先接种流感疫苗。
(5) < 6月龄婴儿的家庭成员和看护人员:由于现有流感疫苗不可以直接给 < 6月龄婴儿接种,该人群可通过母亲孕期接种和对婴儿的家庭成员和看护人员接种流感疫苗,以预防流感。
(6) 孕妇:国内外大量研究证实孕妇罹患流感后发生重症、死亡和不良妊娠结局的风险更高,国外对孕妇在孕期任何阶段接种流感疫苗的安全性证据充分,同时接种疫苗对预防孕妇罹患流感及通过胎传抗体保护6月龄以内婴儿的效果明确。但由于国内缺乏孕妇接种流感疫苗的安全性评价数据,我国上市的部分流感疫苗产品说明书仍将孕妇列为接种禁忌。为降低我国孕妇罹患流感及严重并发症风险,本指南建议孕妇可在妊娠任何阶段接种流感疫苗。
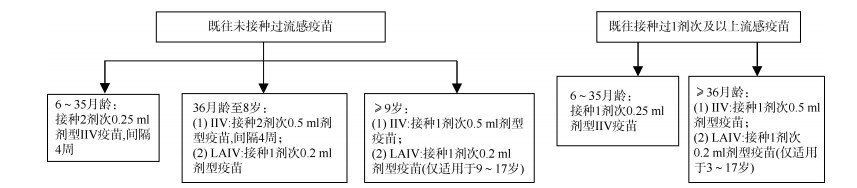
(四) 接种剂次1. 6月龄至8岁儿童:对IIV,首次接种流感疫苗的6月龄至8岁儿童应接种2剂次,间隔≥4周;2021-2022年度或以前接种过1剂或以上流感疫苗的儿童,则建议接种1剂。对LAIV,无论是否接种过流感疫苗,仅接种1剂次。
2. ≥9岁儿童和成年人:仅需接种1剂。见图 1。
|
| 图 1 各年龄组流感疫苗接种剂次图示 |
通常接种流感疫苗2~4周后,可产生具有保护水平的抗体。我国各地每年流感活动高峰出现的时间和持续时间不同,为保证受种者在流感高发季节前获得免疫保护,建议各地在疫苗可及后尽快安排接种工作,最好在当地流感流行季前完成免疫接种,接种单位在整个流行季节都可以提供免疫服务。同一流感流行季节,已按照接种程序完成全程接种的人员,无需重复接种。
孕妇在孕期的任一阶段均可接种流感疫苗,建议只要本年度的流感疫苗开始供应,可尽早接种。
(六) 接种部位及方法IIV的接种采用肌肉注射。成年人和 > 1岁儿童首选上臂三角肌接种疫苗,6月龄至1岁婴幼儿的接种部位以大腿前外侧为最佳。LAIV的接种采用鼻内喷雾法,严禁注射[289]。
(七) 疫苗储存IIV和LAIV的储存及运输都应保持在2~8 ℃条件下,严禁冻结。接种单位日常使用,应按照《预防接种工作规范》和《疫苗储存和运输管理规范》的要求,做好温度监测。
(八) 接种禁忌对疫苗中所含任何成分(包括辅料、甲醛、裂解剂及抗生素)过敏者或有过任何一种流感疫苗接种严重过敏史者,禁止接种。
患有急性疾病、严重慢性疾病或慢性疾病的急性发作期以及发热患者,建议痊愈或者病情稳定控制后接种。既往接种流感疫苗后6周内出现格林-巴利综合征(Guillain-Barre syndrome,GBS)的患者,建议由医生评估后考虑是否接种[168]。
以下人群禁止接种LAIV[8, 168]:①因使用药物、HIV感染等任何原因造成免疫功能低下者;②长期使用含有阿司匹林或水杨酸成分药物治疗的儿童及青少年;③2~4岁患有哮喘的儿童;④孕妇;⑤有GBS病史者;⑥接种前48 h使用过奥司他韦、扎那米韦等抗病毒药物者,或接种前5天使用过帕拉米韦,或接种前17天使用过巴洛沙韦者。
《中华人民共和国药典》(2015版和2020版)均未将鸡蛋过敏者作为接种禁忌。药典规定流感全病毒灭活疫苗中卵清蛋白含量应不高于250 ng/剂,裂解疫苗中卵清蛋白含量应不高于200 ng/ml,暂无减毒活疫苗说明。我国常用的流感疫苗中的卵蛋白含量测量显示含量最高不超过140 ng/ml[290]。国外学者对于鸡蛋过敏者接种IIV或LAIV的研究表明未见发生严重过敏反应[261, 291-293]。美国免疫实践咨询委员会(Advisory Committee on Immunization Practices,ACIP)自2016年以来开始建议对鸡蛋过敏者亦可接种流感疫苗。因此不建议将鸡蛋过敏作为流感疫苗接种禁忌。
(九) 与其他疫苗同时接种和药物对疫苗的影响1. 与非新冠疫苗同时接种:综合考虑风险与收益,IIV与其他灭活疫苗及减毒活疫苗如肺炎球菌疫苗、带状疱疹疫苗、水痘疫苗、麻腮风疫苗、百白破疫苗可同时在不同部位接种[168];但在接种LAIV后,必须间隔 > 28 d才可接种其他减毒活疫苗[168]。> 65岁老年人可同时接种灭活流感疫苗和肺炎球菌疫苗[294-299]。
2. 与新冠疫苗同时接种:结合WHO立场文件及其关于新冠疫苗和流感疫苗同时接种的建议,以及目前国际上发表的和我国已开展的有限的关于同时接种研究的初步结果,经审慎考虑,认为≥18岁人群同时接种灭活流感疫苗和新冠疫苗是可以接受的,可以降低感染流感病毒或新冠病毒后出现严重疾病的风险,提高免疫接种效率,减少接种者前往接种门诊的次数。同时接种时应在两侧肢体接种部位分别进行接种。另一方面,还需要加强疫苗接种后不良事件监测,并开展更多的研究以积累更充分的同时接种的证据。对于接种LAIV者以及 < 18岁的未成年人,由于目前和新冠疫苗同时接种的证据缺乏,建议仍参照我国《新冠病毒疫苗接种技术指南(第一版)》的建议,与新冠病毒疫苗接种间隔 > 14 d。
3. 药物对流感疫苗的影响:免疫抑制剂(如皮质类激素、细胞毒性药物或放射治疗)的使用可能影响接种后的免疫效果[287-288]。服用流感抗病毒药物预防和治疗期间也可以接种IIV[168]。如正在或近期曾使用过任何其他疫苗或药物,包括非处方药,请接种前告知接种医生。为避免可能的药物间相互作用,任何正在进行的治疗均应咨询医生。
(十) 接种注意事项各接种单位要按照《预防接种工作规范》的要求开展流感疫苗接种工作。接种过程应遵循“三查七对一验证”的原则,同时要注意以下事项:
1. 疫苗瓶有裂纹、标签不清或失效者,疫苗出现浑浊等外观异物者均不得使用。
2. 严格掌握疫苗剂量和适用人群的年龄范围,不能将0.5 ml剂型分为2剂次(每剂次0.25 ml)使用。
3. 国外同类产品显示哮喘患者(任何年龄)、活动性喘息或反复喘息发作的儿童(5岁以下)接种LAIV后喘息发作的风险增高,国内临床试验没有此类受试者的数据,建议慎用。
4. LAIV为鼻内喷雾接种,严禁注射。
5. LAIV与其他减毒活疫苗接种应至少间隔4周。
6. 接种完成后应告知接种对象留下观察至少30 min再离开。
7. 建议注射现场备1∶1 000肾上腺素等药品和其他抢救设施,以备偶有发生严重过敏反应时供急救使用。
(十一) 接种记录及评估1. 实施接种后,医疗卫生人员应当在预防接种证/接种凭证以及预防接种信息系统登记疫苗接种的相关信息,包括疫苗的品种、上市许可持有人、最小包装单位的识别信息、有效期、接种时间、实施接种的医疗卫生人员、受种者等接种信息,确保接种信息可追溯、可查询。接种记录应当保存至疫苗有效期满后不少于五年备查。
2. 由接种单位、乡(镇)卫生院、社区卫生服务中心、疾病预防控制机构,按照规定的报告程序和报告内容,上报或收集、统计辖区接种实施情况。
3. 由疾病预防控制机构评价流感疫情监测及控制情况、疑似AEFI监测情况。发现疑似AEFI的按照《全国疑似预防接种异常反应监测方案》(2022版)规定及时进行报告和定期分析。
指南编写专家组:中国疾病预防控制中心传染病管理处彭质斌、郑亚明、郑建东、秦颖;中国疾病预防控制中心病毒病预防控制所王大燕、陈涛;中国医学科学院北京协和医学院群医学及公共卫生学院冯录召;北京市疾病预防控制中心传染病地方病控制所杨鹏、孙瑛;复旦大学公共卫生学院杨娟;河南省疾病预防控制中心免疫预防与规划所张延炀;上海市疾病预防控制中心综合保障处陈健;深圳市南山区疾病预防控制中心免疫规划科姜世强;青海省疾病预防控制中心慢性非传染性疾病预防控制所徐莉立;广东省疾病预防控制中心传染病预防控制所康敏
指南编写专家组秘书:中国疾病预防控制中心传染病管理处杨孝坤、赵宏婷
审定专家:中国疾病预防控制中心张彦平、王华庆、尹遵栋、马超;中华预防医学会冯子健
利益冲突 所有作者声明无利益冲突
志谢 中国疾病预防控制中心(Lawrence Everett Rodewald)
| [1] |
WHO. Fact sheet on influenza (seasonal) [EB/OL]. (2018-11-06)[2022-07-30]. https://www.who.int/news-room/fact-sheets/detail/influenza-(seasonal).
|
| [2] |
Bodewes R, Morick D, de Mutsert G, et al. Recurring influenza B virus infections in seals[J]. Emerg Infect Dis, 2013, 19(3): 511-512. DOI:10.3201/eid1903.120965 |
| [3] |
Osterhaus AD, Rimmelzwaan GF, Martina BE, et al. Influenza B virus in seals[J]. Science, 2000, 288(5468): 1051-1053. DOI:10.1126/science.288.5468.1051 |
| [4] |
Bischoff WE, Swett K, Leng I, et al. Exposure to influenza virus aerosols during routine patient care[J]. J Infect Dis, 2013, 207(7): 1037-1046. DOI:10.1093/infdis/jis773 |
| [5] |
李茜, 李霆, 吴绍强, 等. D型流感病毒研究概述[J]. 检验检疫学刊, 2017, 27(4): 73-75. Li Q, Li T, Wu SQ, et al. An overview of research progress on influenza D viruses Overview of Research on Influenza Virus D[J]. J Inspec Quar, 2017, 27(4): 73-75. |
| [6] |
Yu J, Li T, Wen Z, et al. Identification of D/Yama2019 lineage-like influenza D virus in Chinese cattle[J]. Front Vet Sci, 2022, 9: 939456. DOI:10.3389/fvets.2022.939456 |
| [7] |
国家卫生健康委员会, 国家中医药管理局. 流行性感冒诊疗方案(2020年版)[J]. 中华临床感染病杂志, 2018, 11(1): 1-5. National Health and Family Planning Commission. Protocol for diagnosis and treatment of influenza (2018 revised version)[J]. Chin J Clin Infect Dis, 2018, 11(1): 1-5. DOI:10.3760/cma.j.issn.1674-2397.2020.06.001 |
| [8] |
WHO. Vaccines against influenza: WHO position paper-May 2022[J]. Wkly Epidemiol Rec, 2022, 97(19): 185-208. |
| [9] |
Nicholson KG, Wood JM, Zambon M. Influenza[J]. Lancet, 2003, 362(9397): 1733-1745. DOI:10.1016/S0140-6736(03)14854-4 |
| [10] |
Kim DK, Poudel B. Tools to detect influenza virus[J]. Yonsei Med J, 2013, 54(3): 560-566. DOI:10.3349/ymj.2013.54.3.560 |
| [11] |
Cowling BJ, Ip DK, Fang VJ, et al. Aerosol transmission is an important mode of influenza A virus spread[J]. Nat Commun, 2013, 4: 1935. DOI:10.1038/ncomms2922 |
| [12] |
Lessler J, Reich NG, Brookmeyer R, et al. Incubation periods of acute respiratory viral infections: a systematic review[J]. Lancet Infect Dis, 2009, 9(5): 291-300. DOI:10.1016/S1473-3099(09)70069-6 |
| [13] |
World Health Organization Writing Group, Bell D, Nicoll A, et al. Non-pharmaceutical interventions for pandemic influenza, international measures[J]. Emerg Infect Dis, 2006, 12(1): 81-87. DOI:10.3201/eid1201.051370 |
| [14] |
Lau LL, Ip DK, Nishiura H, et al. Heterogeneity in viral shedding among individuals with medically attended influenza A virus infection[J]. J Infect Dis, 2013, 207(8): 1281-1285. DOI:10.1093/infdis/jit034 |
| [15] |
Carrat F, Vergu E, Ferguson NM, et al. Time lines of infection and disease in human influenza: a review of volunteer challenge studies[J]. Am J Epidemiol, 2008, 167(7): 775-785. DOI:10.1093/aje/kwm375 |
| [16] |
Vink MA, Bootsma MC, Wallinga J. Serial intervals of respiratory infectious diseases: a systematic review and analysis[J]. Am J Epidemiol, 2014, 180(9): 865-875. DOI:10.1093/aje/kwu209 |
| [17] |
Lau LL, Nishiura H, Kelly H, et al. Household transmission of 2009 pandemic influenza A (H1N1): a systematic review and meta-analysis[J]. Epidemiology, 2012, 23(4): 531-542. DOI:10.1097/EDE.0b013e31825588b8 |
| [18] |
Yom-Tov E, Johansson-Cox I, Lampos V, et al. Estimating the secondary attack rate and serial interval of influenza-like illnesses using social media[J]. Influenza Other Respir Viruses, 2015, 9(4): 191-199. DOI:10.1111/irv.12321 |
| [19] |
Biggerstaff M, Cauchemez S, Reed C, et al. Estimates of the reproduction number for seasonal, pandemic, and zoonotic influenza: a systematic review of the literature[J]. BMC Infect Dis, 2014, 14: 480. DOI:10.1186/1471-2334-14-480 |
| [20] |
Zhou N, Dai H, Zha W, et al. The development trend of influenza in China from 2010 to 2019[J]. Hum Vaccin Immunother, 2022, 2071558. DOI:10.1080/21645515.2022.2071558 |
| [21] |
Lipsitch M, Viboud C. Influenza seasonality: lifting the fog[J]. Pans, 2009, 106(10): 3645-3646. DOI:10.1073/pnas.0900933106 |
| [22] |
Viboud C, Alonso WJ, Simonsen L. Influenza in tropical regions[J]. PLoS Med, 2006, 3(4): e89. DOI:10.1371/journal.pmed.0030089 |
| [23] |
Azziz Baumgartner E, Dao CN, Nasreen S, et al. Seasonality, timing, and climate drivers of influenza activity worldwide[J]. J Infect Dis, 2012, 206(6): 838-846. DOI:10.1093/infdis/jis467 |
| [24] |
Bloom-Feshbach K, Alonso WJ, Charu V, et al. Latitudinal variations in seasonal activity of influenza and respiratory syncytial virus (RSV): a global comparative review[J]. PLoS One, 2013, 8(2): e54445. DOI:10.1371/journal.pone.0054445 |
| [25] |
Zou J, Yang H, Cui H, et al. Geographic divisions and modeling of virological data on seasonal influenza in the Chinese mainland during the 2006-2009 monitoring years[J]. PLoS One, 2013, 8(3): e58434. DOI:10.1371/journal.pone.0058434 |
| [26] |
Yu H, Alonso WJ, Feng L, et al. Characterization of regional influenza seasonality patterns in China and implications for vaccination strategies: spatio-temporal modeling of surveillance data[J]. PLoS Med, 2013, 10(11): e1001552. DOI:10.1371/journal.pmed.1001552 |
| [27] |
Yang J, Lau YC, Wu P, et al. Variation in influenza B virus epidemiology by lineage, China[J]. Emerg Infect Dis, 2018, 24(8): 1536-1540. DOI:10.3201/eid2408.180063 |
| [28] |
Huang WJ, Cheng YH, Tan MJ, et al. Epidemiological and virological surveillance of influenza viruses in China during 2020-2021[J]. Infect Dis Poverty, 2022, 11(1): 74. DOI:10.1186/s40249-022-01002-x |
| [29] |
Chinese National Influenza Center. Chinese Weekly Influenza Surveillance Report [EB/OL]. (2022-07-09)[2022-07-10]. https://ivdc.chinacdc.cn/cnic/.
|
| [30] |
Swets MC, Russell CD, Harrison EM, et al. SARS-CoV-2 co-infection with influenza viruses, respiratory syncytial virus, or adenoviruses[J]. Lancet, 2022, 399(10334): 1463-1464. DOI:10.1016/s0140-6736(22)00383-x |
| [31] |
Iuliano AD, Roguski KM, Chang HH, et al. Estimates of global seasonal influenza-associated respiratory mortality: a modelling study[J]. Lancet, 2018, 391(10127): 1285-1300. DOI:10.1016/S0140-6736(17)33293-2 |
| [32] |
Somes MP, Turner RM, Dwyer LJ, et al. Estimating the annual attack rate of seasonal influenza among unvaccinated individuals: A systematic review and meta-analysis[J]. Vaccine, 2018, 36(23): 3199-3207. DOI:10.1016/j.vaccine.2018.04.063 |
| [33] |
Wang Q, Yang L, Liu C, et al. Estimated incidence of seasonal influenza in China from 2010 to 2020 using a multiplier model[J]. JAMA Netw Open, 2022, 5(4): e227423. DOI:10.1001/jamanetworkopen.2022.7423 |
| [34] |
Feng L, Feng S, Chen T, et al. Burden of influenza-associated outpatient influenza-like illness consultations in China, 2006-2015: A population-based study[J]. Influenza Other Respir Viruses, 2020, 14(2): 162-172. DOI:10.1111/irv.12711 |
| [35] |
龚慧, 申鑫, 严涵, 等. 2006-2019年中国季节性流感疾病负担估计[J]. 中华医学杂志, 2021, 101(8): 560-567. Gong H, Shen X, Yan H, et al. Estimating the disease burden of seasonal influenza in China, 2006-2019[J]. Natl Med J China, 2021, 101(8): 560-567. DOI:10.3760/cma.j.cn112137-20201210-03323 |
| [36] |
Li L, Liu Y, Wu P, et al. Influenza-associated excess respiratory mortality in China, 2010-15: a population-based study[J]. Lancet Public Health, 2019, 4(9): e473-481. DOI:10.1016/S2468-2667(19)30163-X |
| [37] |
Lina B, Georges A, Burtseva E, et al. Complicated hospitalization due to influenza: results from the Global Hospital Influenza Network for the 2017-2018 season[J]. BMC Infect Dis, 2020, 20(1): 465. DOI:10.1186/s12879-020-05167-4 |
| [38] |
Mylonakis SC, Mylona EK, Kalligeros M, et al. How comorbidities affect hospitalization from influenza in the pediatric population[J]. Int J Environ Res Public Health, 2022, 19(5): 2811. DOI:10.3390/ijerph19052811 |
| [39] |
Chen L, Zhou S, Zhang Z, et al. Cohort profile: China respiratory illness surveillance among pregnant women (CRISP), 2015-2018[J]. BMJ Open, 2018, 8(4): e019709. DOI:10.1136/bmjopen-2017-019709 |
| [40] |
Chen L, Zhou S, Bao L, et al. Incidence rates of influenza illness during pregnancy in Suzhou, China, 2015-2018[J]. Influenza Other Respir Viruses, 2022, 16(1): 14-23. DOI:10.1111/irv.12888 |
| [41] |
Dawood FS, Kittikraisak W, Patel A, et al. Incidence of influenza during pregnancy and association with pregnancy and perinatal outcomes in three middle-income countries: a multisite prospective longitudinal cohort study[J]. Lancet Infect Dis, 2021, 21(1): 97-106. DOI:10.1016/S1473-3099(20)30592-2 |
| [42] |
Racicot K, Kwon JY, Aldo P, et al. Understanding the complexity of the immune system during pregnancy[J]. Am J Reprod Immunol, 2014, 72(2): 107-116. DOI:10.1111/aji.12289 |
| [43] |
Soma-Pillay P, Nelson-Piercy C, Tolppanen H, et al. Physiological changes in pregnancy[J]. Cardiovasc J Afr, 2016, 27(2): 89-94. DOI:10.5830/CVJA-2016-021 |
| [44] |
Sappenfield E, Jamieson DJ, Kourtis AP. Pregnancy and susceptibility to infectious diseases[J]. Infect Dis Obstet Gynecol, 2013, 2013, 752852. DOI:10.1155/2013/752852 |
| [45] |
Wang R, Yan W, Du M, et al. The effect of influenza virus infection on pregnancy outcomes: A systematic review and meta-analysis of cohort studies[J]. Int J Infect Dis, 2021, 105: 567-578. DOI:10.1016/j.ijid.2021.02.095 |
| [46] |
Mertz D, Lo CK, Lytvyn L, et al. Pregnancy as a risk factor for severe influenza infection: an individual participant data meta-analysis[J]. BMC Infect Dis, 2019, 19(1): 683. DOI:10.1186/s12879-019-4318-3 |
| [47] |
Holstein R, Dawood FS, O'Halloran A, et al. Characteristics and outcomes of hospitalized pregnant women with influenza, 2010 to 2019: A repeated cross-sectional study[J]. Ann Intern Med, 2022, 175(2): 149-158. DOI:10.7326/M21-3668 |
| [48] |
Wen T, Arditi B, Riley LE, et al. Influenza complicating delivery hospitalization and its association with severe maternal morbidity in the United States, 2000-2018[J]. Obstet Gynecol, 2021, 138(2): 218-227. DOI:10.1097/AOG.0000000000004462 |
| [49] |
Yu H, Feng Z, Uyeki TM, et al. Risk factors for severe illness with 2009 pandemic influenza A (H1N1) virus infection in China[J]. Clin Infect Dis, 2011, 52(4): 457-465. DOI:10.1093/cid/ciq144 |
| [50] |
Fraaij PL, Heikkinen T. Seasonal influenza: the burden of disease in children[J]. Vaccine, 2011, 29(43): 7524-7528. DOI:10.1016/j.vaccine.2011.08.010 |
| [51] |
Monto AS, Koopman JS, Longini IM, Jr. Tecumseh study of illness. XIII. Influenza infection and disease, 1976-1981[J]. Am J Epidemiol, 1985, 121(6): 811-822. DOI:10.1093/oxfordjournals.aje.a114052 |
| [52] |
Cowling BJ, Perera RA, Fang VJ, et al. Incidence of influenza virus infections in children in Hong Kong in a 3-year randomized placebo-controlled vaccine study, 2009-2012[J]. Clin Infect Dis, 2014, 59(4): 517-524. DOI:10.1093/cid/ciu356 |
| [53] |
Xu C, Liu L, Ren B, et al. Incidence of influenza virus infections confirmed by serology in children and adult in a suburb community, northern China, 2018-2019 influenza season[J]. Influenza Other Respir Viruses, 2021, 15(2): 262-269. DOI:10.1111/irv.12805 |
| [54] |
张惺惺, 吴双胜, 王全意, 等. 北京市2017-2018流行季流感感染率和发病率研究[J]. 国际病毒学杂志, 2019, 26(2): 73-76. Zhang XX, Wu SS, Wang QY, et al. Estimated infection rates and incidence rates of seasonal influenza in Beijing during the 2017-2018 influenza season[J]. Int J Virol, 2019, 26(2): 73-76. DOI:10.3760/cma.j.issn.1673-4092.2019.02.001 |
| [55] |
Li J, Wang C, Ruan L, et al. Development of influenza-associated disease burden pyramid in Shanghai, China, 2010-2017: a Bayesian modelling study[J]. BMJ Open, 2021, 11(9): e047526. DOI:10.1136/bmjopen-2020-047526 |
| [56] |
高君玫, 陈立凌, 田健美, 等. 2011-2017年苏州市区5岁以下儿童流感相关门诊就诊率的估计[J]. 中华疾病控制杂志, 2019, 23(1): 34-38. Gao JM, Chen LL, Tian JM, et al. The estimation of influenza-related outpatient rate in children under 5 years in Suzhou from 2011 to 2017[J]. Chin J Dis Cont Prev, 2019, 23(1): 34-38. DOI:10.13315/j.cnki.zhjcep.2019.01.008 |
| [57] |
Wang X, Li Y, O'Brien KL, et al. Global burden of respiratory infections associated with seasonal influenza in children under 5 years in 2018: a systematic review and modelling study[J]. Lancet Glob Health, 2020, 8(4): e497-510. DOI:10.1016/S2214-109X(19)30545-5 |
| [58] |
Yu H, Huang J, Huai Y, et al. The substantial hospitalization burden of influenza in central C hina: surveillance for severe, acute respiratory infection, and influenza viruses, 2010–2012[J]. Influenza Other Respir Viruses, 2014, 8(1): 53-65. DOI:10.1111/irv.12205 |
| [59] |
Yu J, Zhang X, Shan W, et al. Influenza-associated hospitalization in children younger than 5 years of age in Suzhou, China, 2011-2016[J]. Pediatr Infect Dis J, 2019, 38(5): 445-452. DOI:10.1097/INF.0000000000002178 |
| [60] |
Finnie TJ, Copley VR, Hall IM, et al. An analysis of influenza outbreaks in institutions and enclosed societies[J]. Epidemiol Infect, 2014, 142(1): 107-113. DOI:10.1017/S0950268813000733 |
| [61] |
Gaglani MJ. Editorial commentary: school-located influenza vaccination: why worth the effort?[J]. Clin Infect Dis, 2014, 59(3): 333-335. DOI:10.1093/cid/ciu344 |
| [62] |
Uscher-Pines L, Schwartz HL, Ahmed F, et al. Feasibility of social distancing practices in US schools to reduce influenza transmission during a pandemic[J]. J Public Health Manag Pract, 2020, 26(4): 357-370. DOI:10.1097/phh.0000000000001174 |
| [63] |
Fiore AE, Epperson S, Perrotta D, et al. Expanding the recommendations for annual influenza vaccination to school-age children in the United States[J]. Pediatrics, 2012, 129 Suppl 2: S54-62. DOI:10.1542/peds.2011-0737C |
| [64] |
曾晓旭, 谢怡然, 陈涛, 等. 中国2019-2020监测年度流感暴发疫情特征分析[J]. 国际病毒学杂志, 2021, 28(5): 359-363. Zeng XX, Xie YR, Chen T, et al. Analysis on epidemiological characteristics of influenza outbreaks in Chinese mainland from 2019 to 2020[J]. Int J Virol, 2021, 28(5): 359-363. DOI:10.3760/cma.j.issn.1673-4092.2021.05.002 |
| [65] |
刘牧文, 王婧, 杨旭辉, 等. 2018-2020年浙江省杭州市学生因流感样症状缺勤监测结果分析[J]. 疾病监测, 2020, 35(11): 1008-1013. Liu MW, Wang J, Yang XH, et al. Surveillance for school absence due to influenza like illness in children in Hangzhou, Zhejiang, 2018-2020[J]. Disease Surveillance, 2020, 35(11): 1008-1013. DOI:10.3784/j.issn.1003-9961.2020.11.01/ |
| [66] |
Neuzil KM, Hohlbein C, Zhu Y. Illness among schoolchildren during influenza season: effect on school absenteeism, parental absenteeism from work, and secondary illness in families[J]. Arch Pediatr Adolesc Med, 2002, 156(10): 986-991. DOI:10.1001/archpedi.156.10.986 |
| [67] |
Chiu SS, Chan KH, So LY, et al. The population based socioeconomic burden of pediatric influenza-associated hospitalization in Hong Kong[J]. Vaccine, 2012, 30(10): 1895-1900. DOI:10.1016/j.vaccine.2011.12.027 |
| [68] |
Jenkin DC, Mahgoub H, Morales KF, et al. A rapid evidence appraisal of influenza vaccination in health workers: An important policy in an area of imperfect evidence[J]. Vaccine X, 2019, 2: 100036. DOI:10.1016/j.jvacx.2019.100036 |
| [69] |
Kuster SP, Shah PS, Coleman BL, et al. Incidence of influenza in healthy adults and healthcare workers: a systematic review and meta-analysis[J]. PLoS One, 2011, 6(10): e26239. DOI:10.1371/journal.pone.0026239 |
| [70] |
Pereira M, Williams S, Restrick L, et al. Healthcare worker influenza vaccination and sickness absence-an ecological study[J]. Clin Med (Lond), 2017, 17(6): 484-489. DOI:10.7861/clinmedicine.17-6-484 |
| [71] |
Mossad SB, Deshpande A, Schramm S, et al. Working despite having influenza-like illness: Results of an anonymous survey of healthcare providers who care for transplant recipients[J]. Infect Control Hosp Epidemiol, 2017, 38(8): 966-969. DOI:10.1017/ice.2017.91 |
| [72] |
Haviari S, Bénet T, Saadatian-Elahi M, et al. Vaccination of healthcare workers: A review[J]. Hum Vaccin Immunother, 2015, 11(11): 2522-2537. DOI:10.1080/21645515.2015.1082014 |
| [73] |
Hashemi SA, Safamanesh S, Ghafouri M, et al. Co-infection with COVID-19 and influenza A virus in two died patients with acute respiratory syndrome, Bojnurd, Iran[J]. J Med Virol, 2020, 92(11): 2319-2321. DOI:10.1002/jmv.26014 |
| [74] |
Feng L, Zhang T, Wang Q, et al. Impact of COVID-19 outbreaks and interventions on influenza in China and the United States[J]. Nat Commun, 2021, 12(1): 3249. DOI:10.1038/s41467-021-23440-1 |
| [75] |
Zhang T, Wang Q, Leng Z, et al. A scenario-based evaluation of COVID-19-related essential clinical resource demands in China[J]. Engineering (Beijing), 2021, 7(7): 948-957. DOI:10.1016/j.eng.2021.03.020 |
| [76] |
Zhang Y, Muscatello DJ, Wang Q, et al. Hospitalizations for influenza-associated severe acute respiratory infection, Beijing, China, 2014-2016[J]. Emerg Infect Dis, 2018, 24(11): 2098-2102. DOI:10.3201/eid2411.171410 |
| [77] |
Nielsen J, Vestergaard LS, Richter L, et al. European all-cause excess and influenza-attributable mortality in the 2017/18 season: should the burden of influenza B be reconsidered?[J]. Clin Microbiol Infect, 2019, 25(10): 1266-1276. DOI:10.1016/j.cmi.2019.02.011 |
| [78] |
Wang H, Fu C, Li K, et al. Influenza associated mortality in Southern China, 2010-2012[J]. Vaccine, 2014, 32(8): 973-978. DOI:10.1016/j.vaccine.2013.12.013 |
| [79] |
Yang L, Ma S, Chen PY, et al. Influenza associated mortality in the subtropics and tropics: results from three Asian cities[J]. Vaccine, 2011, 29(48): 8909-8914. DOI:10.1016/j.vaccine.2011.09.071 |
| [80] |
Wu P, Goldstein E, Ho LM, et al. Excess mortality associated with influenza A and B virus in Hong Kong, 1998-2009[J]. J Infect Dis, 2012, 206(12): 1862-1871. DOI:10.1093/infdis/jis628 |
| [81] |
Chow A, Ma S, Ling AE, et al. Influenza-associated deaths in tropical Singapore[J]. Emerg Infect Dis, 2006, 12(1): 114-121. DOI:10.3201/eid1201.050826 |
| [82] |
Nunes B, Viboud C, Machado A, et al. Excess mortality associated with influenza epidemics in Portugal, 1980 to 2004[J]. PLoS One, 2011, 6(6): e20661. DOI:10.1371/journal.pone.0020661 |
| [83] |
Thompson WW, Shay DK, Weintraub E, et al. Mortality associated with influenza and respiratory syncytial virus in the United States[J]. JAMA, 2003, 289(2): 179-186. DOI:10.1001/jama.289.2.179 |
| [84] |
Feng L, Shay DK, Jiang Y, et al. Influenza-associated mortality in temperate and subtropical Chinese cities, 2003-2008[J]. Bull World Health Organ, 2012, 90(4): 279-288B. DOI:10.2471/BLT.11.096958 |
| [85] |
Gallagher N, Johnston J, Crookshanks H, et al. Characteristics of respiratory outbreaks in care homes during four influenza seasons, 2011-2015[J]. J Hosp Infect, 2018, 99(2): 175-180. DOI:10.1016/j.jhin.2017.08.020 |
| [86] |
徐郁, 周伴群, 周勇, 等. 珠海市甲型H1N1流感患者经济负担分析[J]. 实用预防医学, 2012, 19(06): 827-829. DOI: 10.3969/j.issn.1006-3110.2012.06.009. Xu Y, Zhou BQ, Zhou Y, et al. Estimation of Economic Burden of Pandemic Influenza A (H1N1) in Zhuhai, 2012, 19(006): 827-829. DOI: 10.3969/j.issn.1006-3110.2012.06.009. |
| [87] |
郑慧贞, 郭汝宁, 李灵辉, 等. 广东省城乡居民流感样疾病2周患病及经济负担人户调查[J]. 现代预防医学, 2010(2): 201-203. Zheng HZ, Guo RN, Li LH, et al. Household Survey Of 2-Week-Incidence and Economic Burden For Influenza-like Illness In Guangdong Residents[J]. Mod Prev Med, 2010(2): 201-203. |
| [88] |
Guo RN, Zheng HZ, Li JS, et al. A population-based study on incidence and economic burden of influenza-like illness in south China, 2007[J]. Public Health, 2011, 125(6): 389-395. DOI:10.1016/j.puhe.2011.03.004 |
| [89] |
向蓥飞, 周德谦, 钟杰伟, 等. 广州市越秀区托幼机构流感样病例暴发疫情经济负担评估和流感疫苗卫生经济学评价[J]. 华南预防医学, 2021, 47(10): 1231-1235. Xiang YF, Zhou DQ, Zhong JW, et al. Economic burden of influenza like outbreaks in childcare settings and health economic evaluation of influenza vaccines in Yuexiu District, Guangzhou[J]. South China J Prev Med, 2021, 47(10): 1231-1235. DOI:10.12183/j.scjpm.2021.1231 |
| [90] |
田雪莹, 王显军, 张圣洋, 等. 183例甲型H1N1流感确诊病例住院费用及影响因素分析[J]. 中国卫生经济, 2012, 31(7): 34-36. Tian XY, Wang XJ, Zhang SY, et al. Analysis of the Cost and its Related Factors of 183 Laboratory-confirmed Influenza A H1N1 Cases[J]. Chin Heal Econ, 2012, 31(7): 34-36. DOI:10.3969/j.issn.1003-0743.2012.07.011 |
| [91] |
于佳, 张涛, 王胤, 等. 苏州市2011-2017年5岁以下儿童流感门诊病例临床特征及疾病负担[J]. 中华流行病学杂志, 2018, 39(6): 847-851. Yu J, Zhang T, Wang Y, et al. Clinical characteristics and economic burden of influenza among children under 5 years old, in Suzhou, 2011-2017[J]. Chin J Epidemiol, 2018, 39(6): 847-851. DOI:10.3760/cma.j.issn.0254-6450.2018.06.029 |
| [92] |
Wang D, Zhang T, Wu J, et al. Socio-economic burden of influenza among children younger than 5 years in the outpatient setting in Suzhou, China[J]. PLoS One, 2013, 8(8): e69035. DOI:10.1371/journal.pone.0069035 |
| [93] |
Zhang X, Zhang J, Chen L, et al. Pneumonia and influenza hospitalizations among children under 5 years of age in Suzhou, China, 2005-2011[J]. Influenza Other Respir Viruses, 2017, 11(1): 15-22. DOI:10.1111/irv.12405 |
| [94] |
张涛, 蔡华, 顾宝柯, 等. 上海市甲型H1N1流感患者经济负担估计[J]. 中国卫生经济, 2011, 30(5): 25-38. Zhang T, Cai H, Gu BK, et al. Economic Burden Estimation of Pandemic Influenza A H1N1 in Shanghai[J]. Chin Health Econ, 2011, 30(5): 25-38. DOI:10.3969/j.issn.1003-0743.2011.05.009 |
| [95] |
何晓定, 徐云蕴, 李颖, 等. 上海市长宁区某医院流感样病例的经济负担分析[J]. 中国初级卫生保健, 2012, 26(10): 75-76. He XD, Xu YY, Li Y, et al. Economic Burden Analysis of ILI Cases in Changning District, Shanghai[J]. Chin Prim Health Care, 2012, 26(10): 75-76. |
| [96] |
王相诗, 蔡洁皓, 姚玮蕾, 等. 上海地区某医院门诊儿童流感社会经济负担调查[J]. 中华流行病学杂志, 2015, 36(1): 27-30. Wang XS, Cai JH, Yao WL, et al. Socio-economic impact of influenza in children: a single-centered hospital study in Shanghai[J]. Chin J Epidemiol, 2015, 36(1): 27-30. DOI:10.3760/cma.j.issn.0254-6450.2015.01.007 |
| [97] |
王慎玉, 甘正凯, 邵燕志, 等. 2016-2018年杭州市农村地区学校和幼托机构流感疾病负担研究[J]. 中华预防医学杂志, 2019, 53(7): 713-718. Wang SY, Gan ZK, Shao YZ, et al. Disease burden of influenza in schools and child care settings in rural areas of Hangzhou, 2016-2018[J]. Chin J Prev Med, 2019, 53(7): 713-718. DOI:10.3760/cma.j.issn.02539624.2019.07.011 |
| [98] |
吴一峰, 李萍萍, 赵凤敏, 等. 宁波市江北区≥60岁老年人群接种流感疫苗后流感样疾病经济负担[J]. 中国疫苗和免疫, 2021, 27(4): 414-419. Wu YF, Li PP, Zhao FM, et al. Economic burden of influenza-like illness among ≥60-year-old people after influenza vaccination in Jiangbei district of Ningbo city[J]. Chin J of Vaccines and Immunization, 2021, 27(4): 414-419. DOI:10.19914/j.CJVI.2021070 |
| [99] |
李琳, 张颖, 董晓春, 等. 2015年天津市流感确诊病例流行病学特征分析及疾病负担评估[J]. 职业与健康, 2017, 33(2): 216-218, 222. Li L, Zhang Y, Dong XC, et al. Analysis on epidemiological characteristics and evaluation on disease burden of confirmed influenza cases in Tianjin in 2015[J]. Occup Health, 2017, 33(2): 216-218, 222. DOI:10.13329/j.cnki.zyyjk.2017.0064 |
| [100] |
董晓春, 徐文体, 李琳, 等. 基于天津市汉沽街社区流行性感冒监测结果的疾病负担研究[J]. 疾病监测, 2011, 26(10): 785-787. Dong XC, Xu WT, Li L, et al. Disease burden based on community influenza surveillance in Hangu street, Tianjin municipality[J]. Dis Surveill, 2011, 26(10): 785-787. DOI:10.3784/j.issn.1003-9961.2011.10.009 |
| [101] |
孙淑苍, 王文娟, 王德全, 等. 流行性感冒流行期间学生缺课率、带病上课率、医药费用及疫苗接种效果调查[J]. 中华流行病学杂志, 2003, 24(3): 243. Sun SC, Wang WJ, Wang DQ, et al. Investigation on the rate of students' absenteeism, attendance rate with illness, medical expenses and effect of vaccination during influenza epidemic[J]. Chin J Epidemiol, 2003, 24(3): 243. DOI:10.3760/j.issn:0254-6450.2003.03.028 |
| [102] |
吴双胜, 马春娜, 张莉, 等. 北京市成年流感样病例就诊行为及其经济负担研究[J]. 国际病毒学杂志, 2019, 26(2): 82-86. Wu SS, Ma CN, Zhang L, et al. Medical-seeking behaviors and economic burden of adult influenza-like illness cases in Beijing[J]. Int J Virol, 2019, 26(2): 82-86. DOI:10.3760/cma.j.issn.1673-4092.2019.02.003 |
| [103] |
李晓光, 林菲, 陈静, 等. 发热门诊流感样病例经济负担及临床结局的前瞻性研究[J]. 中华医院感染学杂志, 2021, 31(8): 1272-1276. Li XG, Lin F, Chen J, et al. Clinical outcomes and economic burden of patients with initial influenza-like illness at fever clinic: a prospective cohort study[J]. Chin J Nosocomiol, 2021, 31(8): 1272-1276. DOI:10.1186/cn.ni.2021-202720 |
| [104] |
涂正波, 万刚凤, 肖红茂. 2017-2018年南昌市城区流感病例经济负担和影响因素分析[J]. 现代预防医学, 2021, 48(1): 152-156. Tu ZB, Wan GF, Xiao HM. Economic burden and influencing factors of influenza cases in urban area of Nanchang City, 2017-2018[J]. Mod Prev Med, 2021, 48(1): 152-156. |
| [105] |
朱爱琴, 郑亚明, 秦颖, 等. 中国流感经济负担研究系统综述[J]. 中华预防医学杂志, 2019, 53(10): 1043-1048. Zhu AQ, Zheng YM, Qin Y, et al. A systematic review of the economic burden of influenza in China[J]. Chin J Prev Med, 2019, 53(10): 1043-1048. DOI:10.3760/cma.j.issn.0253-9624.2019.10.017 |
| [106] |
Zhou L, Situ S, Huang T, et al. Direct medical cost of influenza-related hospitalizations among severe acute respiratory infections cases in three provinces in China[J]. PLoS One, 2013, 8(5): e63788. DOI:10.1371/journal.pone.0063788 |
| [107] |
Yang J, Jit M, Leung KS, et al. The economic burden of influenza-associated outpatient visits and hospitalizations in China: a retrospective survey[J]. Infect Dis Poverty, 2015, 4: 44. DOI:10.1186/s40249-015-0077-6 |
| [108] |
刘令初, 靳妍, 何寒青, 等. 2018-2019年台州市老年人接种流感疫苗的成本效益[J]. 中国疫苗和免疫, 2020, 26(5): 552-555. Liu LC, Jin Y, He HQ, et al. Benefit-cost ratio of influenza vaccination among elderly people of Taizhou city during the 2018-2019 season[J]. Chin J of Vaccines and Immunization, 2020, 26(5): 552-555. |
| [109] |
Yang J, Jit M, Zheng Y, et al. The impact of influenza on the health related quality of life in China: an EQ-5D survey[J]. BMC Infect Dis, 2017, 17(1): 686. DOI:10.1186/s12879-017-2801-2 |
| [110] |
Hollmann M, Garin O, Galante M, et al. Impact of influenza on health-related quality of life among confirmed (H1N1)2009 patients[J]. PLoS One, 2013, 8(3): e60477. DOI:10.1371/journal.pone.0060477 |
| [111] |
Bilcke J, Coenen S, Beutels P. Influenza-like-illness and clinically diagnosed flu: disease burden, costs and quality of life for patients seeking ambulatory care or no professional care at all[J]. PLoS One, 2014, 9(7): e102634. DOI:10.1371/journal.pone.0102634 |
| [112] |
Yoshino Y, Wakabayashi Y, Kitazawa T. The clinical effect of seasonal flu vaccination on health-related quality of life[J]. Int J Gen Med, 2021, 14: 2095-2099. DOI:10.2147/IJGM.S309920 |
| [113] |
Li S, Li L, Ai X, et al. A randomized, controlled, blinded study of the safety, immunogenicity and batch consistency of Aleph inactivated split influenza vaccine made in China in Chinese people[J]. Hum Vaccin Immunother, 2014, 10(3): 557-565. DOI:10.4161/hv.27329 |
| [114] |
Hu Y, Shao M, Hu Y, et al. Immunogenicity and safety of an inactivated quadrivalent influenza vaccine: a randomized, double-blind, controlled phase Ⅲ clinical trial in children aged 6-35 months in China[J]. Hum Vaccin Immunother, 2020, 16(7): 1691-1698. DOI:10.1080/21645515.2020.1721994 |
| [115] |
Zhu FC, Li YH, Guan XH, et al. Safety, tolerability, and immunogenicity of a recombinant adenovirus type-5 vectored COVID-19 vaccine: a dose-escalation, open-label, non-randomised, first-in-human trial[J]. Lancet, 2020, 395(10240): 1845-1854. DOI:10.1016/S0140-6736(20)31208-3 |
| [116] |
He XS, Holmes TH, Zhang C, et al. Cellular immune responses in children and adults receiving inactivated or live attenuated influenza vaccines[J]. J Virol, 2006, 80(23): 11756-11766. DOI:10.1128/JVI.01460-06 |
| [117] |
Mohn KG, Brokstad KA, Islam S, et al. Early induction of cross-reactive CD8+T-cell responses in tonsils after live-attenuated influenza vaccination in children[J]. J Infect Dis, 2020, 221(9): 1528-1537. DOI:10.1093/infdis/jiz583 |
| [118] |
Wen F, Guo J, Huang S. A meta-analysis identified genes responsible for distinct immune responses to trivalent inactivated and live attenuated influenza vaccines[J]. J Cell Physiol, 2019, 234(4): 5196-5202. DOI:10.1002/jcp.27327 |
| [119] |
Lindsey BB, Jagne YJ, Armitage EP, et al. Effect of a Russian-backbone live-attenuated influenza vaccine with an updated pandemic H1N1 strain on shedding and immunogenicity among children in The Gambia: an open-label, observational, phase 4 study[J]. Lancet Respir Med, 2019, 7(8): 665-676. DOI:10.1016/s2213-2600(19)30086-4 |
| [120] |
Coelingh K, Olajide IR, MacDonald P, et al. Efficacy and effectiveness of live attenuated influenza vaccine in school-age children[J]. Expert Rev Vaccines, 2015, 14(10): 1331-1346. DOI:10.1586/14760584.2015.1078732 |
| [121] |
刘书珍, 孟丽, 席佩佩, 等. 四价流感病毒裂解疫苗安全性和免疫原性评价[J]. 预防医学, 2020, 327(11): 1091-1095. Liu SZ, Meng L, Xi PP, et al. Safety and immunogenicity of a split-virion quadrivalent influenza vaccine[J]. Prev Med, 2020, 327(11): 17-21. DOI:10.19485/j.cnki.issn2096-5087.2020.11.003 |
| [122] |
孟子延, 张家友, 张哲罡, 等. 四价流感病毒灭活疫苗在18~64岁人群免疫原性和安全性的系统综述和Meta分析[J]. 中华流行病学杂志, 2018, 39(12): 1636-1641. Meng ZY, Zhang JY, Zhang ZG, et al. Immunogenicity of inacitivated quadrivalent influenza vaccine in adults aged 18-64 years: A systematic review and Meta-analysis[J]. Chin J Epidemiol, 2018, 39(12): 1636-1641. DOI:10.3760/cma.j.issn.0254-6450.2018.12.019 |
| [123] |
Wang Y, Zhang Y, Wu H, et al. Safety and immunogenicity of a quadrivalent inactivated subunit non-adjuvanted influenza vaccine: A randomized, double-blind, active-controlled phase 1 clinical trial[J]. Vaccine, 2021, 39(29): 3871-3878. DOI:10.1016/j.vaccine.2021.05.070 |
| [124] |
Zhang Y, Wang Y, Jia C, et al. Immunogenicity and safety of an egg culture-based quadrivalent inactivated non-adjuvanted subunit influenza vaccine in subjects ≥3 years: A randomized, multicenter, double-blind, active-controlled phase Ⅲ, non-inferiority trial[J]. Vaccine, 2022, 40(34): 4933-4941. DOI:10.1016/j.vaccine.2022.06.078 |
| [125] |
Minozzi S, Lytras T, Gianola S, et al. Comparative efficacy and safety of vaccines to prevent seasonal influenza: A systematic review and network meta-analysis[J]. E Clinical Medicine, 2022, 46: 101331. DOI:10.1016/j.eclinm.2022.101331 |
| [126] |
Osterholm MT, Kelley NS, Sommer A, et al. Efficacy and effectiveness of influenza vaccines: a systematic review and meta-analysis[J]. Lancet Infect Dis, 2012, 12(1): 36-44. DOI:10.1016/S1473-3099(11)70295-X |
| [127] |
Demicheli V, Jefferson T, Ferroni E, et al. Vaccines for preventing influenza in healthy adults[J]. Cochrane Database Syst Rev, 2018, 2: CD001269. DOI:10.1002/14651858.CD001269.pub6 |
| [128] |
Belongia EA, Simpson MD, King JP, et al. Variable influenza vaccine effectiveness by subtype: a systematic review and meta-analysis of test-negative design studies[J]. Lancet Infect Dis, 2016, 16(8): 942-951. DOI:10.1016/S1473-3099(16)00129-8 |
| [129] |
Ramsay LC, Buchan SA, Stirling RG, et al. The impact of repeated vaccination on influenza vaccine effectiveness: a systematic review and meta-analysis[J]. BMC Med, 2019, 17(1): 9. DOI:10.1186/s12916-018-1239-8 |
| [130] |
Huang C, Fu X, Zhou Y, et al. Comparison of the immunogenicity and safety of quadrivalent and tetravalent influenza vaccines in children and adolescents[J]. Vaccine, 2020, 38(6): 1332-1344. DOI:10.1016/j.vaccine.2019.11.071 |
| [131] |
Boddington NL, Pearson I, Whitaker H, et al. Effectiveness of influenza vaccination in preventing hospitalization due to Influenza in children: A systematic review and meta-analysis[J]. Clin Infect Dis, 2021, 73(9): 1722-1732. DOI:10.1093/cid/ciab270 |
| [132] |
Zhou S, Greene CM, Song Y, et al. Review of the status and challenges associated with increasing influenza vaccination coverage among pregnant women in China[J]. Hum Vaccin Immunother, 2020, 16(3): 602-611. DOI:10.1080/21645515.2019.1664230 |
| [133] |
Munoz FM, Patel SM, Jackson LA, et al. Safety and immunogenicity of three seasonal inactivated influenza vaccines among pregnant women and antibody persistence in their infants[J]. Vaccine, 2020, 38(33): 5355-5363. DOI:10.1016/j.vaccine.2020.05.059 |
| [134] |
Vesikari T, Virta M, Heinonen S, et al. Immunogenicity and safety of a quadrivalent inactivated influenza vaccine in pregnant women: a randomized, observer-blind trial[J]. Hum Vaccin Immunother, 2020, 16(3): 623-629. DOI:10.1080/21645515.2019.1667202 |
| [135] |
Nunes MC, Cutland CL, Dighero B, et al. Kinetics of hemagglutination-inhibiting antibodies following maternal influenza vaccination among mothers with and those without HIV infection and their infants[J]. J Infect Dis, 2015, 212(12): 1976-1987. DOI:10.1093/infdis/jiv339 |
| [136] |
Nakphook S, Patumanond J, Shrestha M, et al. Antibody responses induced by trivalent inactivated influenza vaccine among pregnant and non-pregnant women in Thailand: A matched cohort study[J]. PLoS One, 2021, 16(06): e0253028. DOI:10.1371/journal.pone.0253028 |
| [137] |
Madhi SA, Cutland CL, Kuwanda L, et al. Influenza vaccination of pregnant women and protection of their infants[J]. N Engl J Med, 2014, 371(10): 918-931. DOI:10.1056/NEJMoa1401480 |
| [138] |
Tapia MD, Sow SO, Tamboura B, et al. Maternal immunisation with trivalent inactivated influenza vaccine for prevention of influenza in infants in Mali: a prospective, active-controlled, observer-blind, randomised phase 4 trial[J]. Lancet Infect Dis, 2016, 16(9): 1026-1035. DOI:10.1016/s1473-3099(16)30054-8 |
| [139] |
Amin AB, Nunes MC, Tapia MD, et al. Immunogenicity of influenza vaccines administered to pregnant women in randomized clinical trials in Mali and South Africa[J]. Vaccine, 2020, 38(41): 6478-6483. DOI:10.1016/j.vaccine.2020.07.020 |
| [140] |
Steinhoff MC, Omer SB, Roy E, et al. Influenza immunization in pregnancy-antibody responses in mothers and infants[J]. N Engl J Med, 2010, 362(17): 1644-1646. DOI:10.1056/NEJMc0912599 |
| [141] |
Molgaard-Nielsen D, Fischer TK, Krause TG, et al. Effectiveness of maternal immunization with trivalent inactivated influenza vaccine in pregnant women and their infants[J]. J Intern Med, 2019, 286(4): 469-480. DOI:10.1111/joim.12947 |
| [142] |
Maltezou HC, Asimakopoulos G, Stavrou S, et al. Effectiveness of quadrivalent influenza vaccine in pregnant women and infants, 2018-2019[J]. Vaccine, 2020, 38(29): 4625-4631. DOI:10.1016/j.vaccine.2020.04.060 |
| [143] |
Omer SB, Clark DR, Madhi SA, et al. Efficacy, duration of protection, birth outcomes, and infant growth associated with influenza vaccination in pregnancy: a pooled analysis of three randomised controlled trials[J]. Lancet Respir Med, 2020, 8(6): 597-608. DOI:10.1016/S2213-2600(19)30479-5 |
| [144] |
Sullivan SG, Price OH, Regan AK. Burden, effectiveness and safety of influenza vaccines in elderly, paediatric and pregnant populations[J]. Ther Adv Vaccines Immunother, 2019, 7(7): 1-16. DOI:10.1177/2515135519826481 |
| [145] |
Thompson MG, Li DK, Shifflett P, et al. Effectiveness of seasonal trivalent influenza vaccine for preventing influenza virus illness among pregnant women: a population-based case-control study during the 2010-2011 and 2011-2012 influenza seasons[J]. Clin Infect Dis, 2014, 58(4): 449-457. DOI:10.1093/cid/cit750 |
| [146] |
Regan AK, Klerk N, Moore HC, et al. Effectiveness of seasonal trivalent influenza vaccination against hospital-attended acute respiratory infections in pregnant women: A retrospective cohort study[J]. Vaccine, 2016, 34(32): 3649-3656. DOI:10.1016/j.vaccine.2016.05.032 |
| [147] |
Nunes MC, Madhi SA. Influenza vaccination during pregnancy for prevention of influenza confirmed illness in the infants: A systematic review and meta-analysis[J]. Hum Vaccin Immunother, 2018, 14(3): 758-766. DOI:10.1080/21645515.2017.1345385 |
| [148] |
Cuningham W, Geard N, Fielding JE, et al. Optimal timing of influenza vaccine during pregnancy: A systematic review and meta-analysis[J]. Influenza Other Respir Viruses, 2019, 13(5): 438-452. DOI:10.1111/irv.12649 |
| [149] |
Zhong Z, Haltalli M, Holder B, et al. The impact of timing of maternal influenza immunization on infant antibody levels at birth[J]. Clin Exp Immunol, 2019, 195(2): 139-152. DOI:10.1111/cei.13234 |
| [150] |
Steinhoff MC, MacDonald N, Pfeifer D, et al. Influenza vaccine in pregnancy: policy and research strategies[J]. Lancet, 2014, 383(9929): 1611-1613. DOI:10.1016/S0140-6736(14)60583-3 |
| [151] |
Nolan T, Fortanier AC, Leav B, et al. Efficacy of a cell-culture-derived quadrivalent influenza vaccine in children[J]. N Engl J Med, 2021, 385(16): 1485-1495. DOI:10.1056/NEJMoa2024848 |
| [152] |
Esposito S, Nauta J, Lapini G, et al. Efficacy and safety of a quadrivalent influenza vaccine in children aged 6-35 months: A global, multiseasonal, controlled, randomized Phase Ⅲ study[J]. Vaccine, 2022, 40(18): 2626-2634. DOI:10.1016/j.vaccine.2022.02.088 |
| [153] |
Neuzil KM, Jackson LA, Nelson J, et al. Immunogenicity and reactogenicity of 1 versus 2 doses of trivalent inactivated influenza vaccine in vaccine-naive 5-8-year-old children[J]. J Infect Dis, 2006, 194(8): 1032-1039. DOI:10.1086/507309 |
| [154] |
Shinjoh M, Sugaya N, Furuichi M, et al. Effectiveness of inactivated influenza vaccine in children by vaccine dose, 2013-18[J]. Vaccine, 2019, 37(30): 4047-4054. DOI:10.1016/j.vaccine.2019.05.090 |
| [155] |
Chua H, Chiu SS, Chan ELY, et al. Effectiveness of partial and full influenza vaccination among children aged < 9 years in Hong Kong, 2011-2019[J]. J Infect Dis, 2019, 220(10): 1568-1576. DOI:10.1093/infdis/jiz361 |
| [156] |
骆淑英, 朱军礼, 吕梅斋, 等. 基于实验室检测结果病例-对照研究评价6~72月龄儿童流感疫苗效果[J]. 中华预防医学杂志, 2019, 53(6): 576-580. Luo SY, Zhu JL, Lyu MZ, et al. Evaluation of the influenza vaccine effectiveness among children aged 6 to 72 months based on the test-negative case control study design[J]. Chin J Prev Med, 2019, 53(6): 576-580. DOI:10.3760/cma.j.issn.0253-9624.2019.06.007 |
| [157] |
伊丽萍, 张婉青, 陈立凌, 等. 基于检测阴性设计2011-2021年儿童流感疫苗保护效果评价[J]. 中国公共卫生, 2022, 38(06): 689-693. Yi LP, Zhang WQ, Chen LL, et al. Influenza vaccine effectiveness among children, 2011-2021: A test-negative design-based evaluation[J]. Chin J Public Health, 2022, 38(06): 689-693. DOI:10.11847/zgggws1137211 |
| [158] |
Yang X, Zhao H, Li Z, et al. Influenza vaccine effectiveness in mainland China: A systematic review and meta-analysis[J]. Vaccines (Basel), 2021, 9(2): 79. DOI:10.3390/vaccines9020079 |
| [159] |
Chiu SS, Kwan MYW, Feng S, et al. Interim estimate of influenza vaccine effectiveness in hospitalised children, Hong Kong, 2017/18[J]. Euro Surveill, 2018, 23(8): 18-00062. DOI:10.2807/1560-7917.ES.2018.23.8.18-00062 |
| [160] |
Zhang Y, Cao Z, Costantino V, et al. Influenza illness averted by influenza vaccination among school year children in Beijing, 2013-2016[J]. Influenza Other Respir Viruses, 2018, 12(6): 687-694. DOI:10.1111/irv.12585 |
| [161] |
Wu S, Pan Y, Zhang X, et al. Influenza vaccine effectiveness in preventing laboratory-confirmed influenza in outpatient settings: A test-negative case-control study in Beijing, China, 2016/17 season[J]. Vaccine, 2018, 36(38): 5774-5780. DOI:10.1016/j.vaccine.2018.07.077 |
| [162] |
Zhang W, Gao J, Chen L, et al. Estimated influenza illnesses and hospitalizations averted by influenza vaccination among children aged 6-59 months in Suzhou, China, 2011/12 to 2015/16 influenza seasons[J]. Vaccine, 2020, 38(51): 8200-8205. DOI:10.1016/j.vaccine.2020.10.069 |
| [163] |
Pepin S, Samson SI, Alvarez FP, et al. Impact of a quadrivalent inactivated influenza vaccine on influenza-associated complications and health care use in children aged 6 to 35 months: Analysis of data from a phase Ⅲ trial in the Northern and Southern Hemispheres[J]. Vaccine, 2019, 37(13): 1885-1888. DOI:10.1016/j.vaccine.2019.01.059 |
| [164] |
Kalligeros M, Shehadeh F, Mylona EK, et al. Influenza vaccine effectiveness against influenza-associated hospitalization in children: A systematic review and meta-analysis[J]. Vaccine, 2020, 38(14): 2893-2903. DOI:10.1016/j.vaccine.2020.02.049 |
| [165] |
Chiu SS, Chua H, Kwan MYW, et al. Influenza vaccination effectiveness in preventing influenza hospitalization in children, Hong Kong, winter 2019/20[J]. Vaccine, 2020, 38(51): 8078-8081. DOI:10.1016/j.vaccine.2020.10.081 |
| [166] |
Tsang TK, Fang VJ, Ip DKM, et al. Indirect protection from vaccinating children against influenza in households[J]. Nat Commun, 2019, 10(1): 106. DOI:10.1038/s41467-018-08036-6 |
| [167] |
Younas M, Royer J, Rac H, et al. Association between influenza vaccination coverage and ambulatory antibiotic prescription rates in children in South Carolina[J]. Open Forum Infec Dise, 2019, 6 Suppl 2: S962. DOI:10.1093/ofid/ofz360.2411 |
| [168] |
Grohskopf LA, Alyanak E, Ferdinands JM, et al. Prevention and control of seasonal influenza with vaccines: Recommendations of the Advisory Committee on Immunization Practices, United States, 2021-22 influenza season[J]. MMWR Recomm Rep, 2021, 70(5): 1-28. DOI:10.15585/mmwr.rr7005a1 |
| [169] |
Hoft DF, Babusis E, Worku S, et al. Live and inactivated influenza vaccines induce similar humoral responses, but only live vaccines induce diverse T-cell responses in young children[J]. J Infect Dis, 2011, 204(6): 845-853. DOI:10.1093/infdis/jir436 |
| [170] |
陶焱炀, 金鹏飞, 朱凤才. 流感减毒活疫苗预防儿童季节性流感保护效果的Meta分析[J]. 中华流行病学杂志, 2020, 41(1): 103-110. Tao YY, Jin PF, Zhu FC. Meta-analysis on effectiveness of live attenuated influenza vaccine against seasonal influenza in children[J]. Chin J Epidemiol, 2020, 41(1): 103-110. DOI:10.3760/cma.j.issn.0254-6450.2020.01.019 |
| [171] |
Wang S, Zheng Y, Jin X, et al. Efficacy and safety of a live attenuated influenza vaccine in Chinese healthy children aged 3-17 years in one study center of a randomized, double-blind, placebo-controlled phase 3 clinical trial, 2016/17 season[J]. Vaccine, 2020, 38(38): 5979-5986. DOI:10.1016/j.vaccine.2020.07.019 |
| [172] |
Belshe RB, Mendelman PM, Treanor J, et al. The efficacy of live attenuated, cold-adapted, trivalent, intranasal influenzavirus vaccine in children[J]. N Engl J Med, 1998, 338(20): 1405-1412. DOI:10.1056/NEJM199805143382002 |
| [173] |
Block SL, Heikkinen T, Toback SL, et al. The efficacy of live attenuated influenza vaccine against influenza-associated acute otitis media in children[J]. Pediatr Infect Dis J, 2011, 30(3): 203-207. DOI:10.1097/INF.0b013e3181faac7c |
| [174] |
Duan W, Zhang L, Wu S, et al. Reduction of influenza A(H3N2)-associated symptoms by influenza vaccination in school aged-children during the 2014-2015 winter season dominated by mismatched H3N2 viruses[J]. Hum Vaccin Immunother, 2019, 15(5): 1031-1034. DOI:10.1080/21645515.2019.1575573 |
| [175] |
Pan Y, Wang Q, Yang P, et al. Influenza vaccination in preventing outbreaks in schools: A long-term ecological overview[J]. Vaccine, 2017, 35(51): 7133-7138. DOI:10.1016/j.vaccine.2017.10.096 |
| [176] |
Sun Y, Yang P, Wang Q, et al. Influenza vaccination and non-pharmaceutical measure effectiveness for preventing influenza outbreaks in schools: A surveillance-based evaluation in Beijing[J]. Vaccines (Basel), 2020, 8(4): 714. DOI:10.3390/vaccines8040714 |
| [177] |
Zhang L, van der Hoek W, Krafft T, et al. Influenza vaccine effectiveness estimates against influenza A(H3N2) and A(H1N1) pdm09 among children during school-based outbreaks in the 2016-2017 season in Beijing, China[J]. Hum Vaccin Immunother, 2020, 16(4): 816-822. DOI:10.1080/21645515.2019.1677438 |
| [178] |
Benjamin-Chung J, Arnold BF, Mishra K, et al. City-wide school-located influenza vaccination: A retrospective cohort study[J]. Vaccine, 2021, 39(42): 6302-6307. DOI:10.1016/j.vaccine.2021.08.099 |
| [179] |
Kim YM, Kang S, Lim JS, et al. Influenza vaccine effectiveness among elementary school students in Korea during the 2016-2017 seasons: a cross-sectional survey[J]. J Korean Med Sci, 2020, 35(5): e45. DOI:10.3346/jkms.2020.35.e45 |
| [180] |
Lau YL, Wong WHS, Hattangdi-Haridas SR, et al. Evaluating impact of school outreach vaccination programme in Hong Kong influenza season 2018-2019[J]. Hum Vaccin Immunother, 2020, 16(4): 823-826. DOI:10.1080/21645515.2019.1678357 |
| [181] |
陈达芹, 蒋亚文, 黄芳, 等. 深圳市学龄儿童接种流感疫苗对缺课预防效果的实证研究[J]. 中华流行病学杂志, 2021, 42(10): 1900-1906. Chen DQ, Jiang YW, Huang F, et al. Effectiveness of influenza vaccination for school-age children in preventing school absenteeism in Shenzhen: an empirical study[J]. Chin J Epidemiol, 2021, 42(10): 1900-1906. DOI:10.3760/cma.j.cn112338-20210723-00580 |
| [182] |
Demicheli V, Jefferson T, Di Pietrantonj C, et al. Vaccines for preventing influenza in the elderly[J]. Cochrane Database Syst Rev, 2018, 2: CD004876. DOI:10.1002/14651858.CD004876.pub4 |
| [183] |
Jackson ML, Chung JR, Jackson LA, et al. Influenza vaccine effectiveness in the United States during the 2015-2016 season[J]. N Engl J Med, 2017, 377(6): 534-543. DOI:10.1056/NEJMoa1700153 |
| [184] |
Flannery B, Chung JR, Thaker SN, et al. Interim estimates of 2016-17 seasonal influenza vaccine effectiveness-United States, February 2017[J]. MMWR Morb Mortal Wkly Rep, 2017, 66(6): 167-171. DOI:10.15585/mmwr.mm6606a3 |
| [185] |
Flannery B, Chung JR, Belongia EA, et al. Interim estimates of 2017-18 seasonal influenza vaccine effectiveness-United States, February 2018[J]. MMWR Morb Mortal Wkly Rep, 2018, 67(6): 180-185. DOI:10.15585/mmwr.mm6706a2 |
| [186] |
Dawood FS, Chung JR, Kim SS, et al. Interim estimates of 2019-20 seasonal influenza vaccine effectiveness-United States, February 2020[J]. MMWR Morb Mortal Wkly Rep, 2020, 69(7): 177-182. DOI:10.15585/mmwr.mm6907a1 |
| [187] |
Darvishian M, van den Heuvel ER, Bissielo A, et al. Effectiveness of seasonal influenza vaccination in community-dwelling elderly people: an individual participant data meta-analysis of test-negative design case-control studies[J]. Lancet Respir Med, 2017, 5(3): 200-211. DOI:10.1016/S2213-2600(17)30043-7 |
| [188] |
星一, 刘民. 流感灭活疫苗在中国应用效果的Meta分析[J]. 中华流行病学杂志, 2009, 30(4): 368-370. Xing Y, Liu M. Meta analysis on the effectiveness of inactivated influenza vaccine[J]. Chin J Epidemiol, 2009, 30(4): 368-370. DOI:10.3760/cma.j.issn.0254-6450.2009.04.015 |
| [189] |
Beyer WE, McElhaney J, Smith DJ, et al. Cochrane re-arranged: support for policies to vaccinate elderly people against influenza[J]. Vaccine, 2013, 31(50): 6030-6033. DOI:10.1016/j.vaccine.2013.09.063 |
| [190] |
Chung H, Buchan SA, Campigotto A, et al. Influenza vaccine effectiveness against all-cause mortality following laboratory-confirmed influenza in older adults, 2010-2011 to 2015-2016 seasons in Ontario, Canada[J]. Clin Infect Dis, 2021, 73(5): e1191-1199. DOI:10.1093/cid/ciaa1862 |
| [191] |
Rolfes MA, Flannery B, Chung JR, et al. Effects of influenza vaccination in the United States during the 2017-2018 influenza season[J]. Clin Infect Dis, 2019, 69(11): 1845-1853. DOI:10.1093/cid/ciz075 |
| [192] |
Chung JR, Rolfes MA, Flannery B, et al. Effects of influenza vaccination in the United States during the 2018-2019 influenza season[J]. Clin Infect Dis, 2020, 71(8): e368-376. DOI:10.1093/cid/ciz1244 |
| [193] |
Anderson ML, Dobkin C, Gorry D. The effect of influenza vaccination for the elderly on hospitalization and mortality: An observational study with a regression discontinuity design[J]. Ann Intern Med, 2020, 172(7): 445-452. DOI:10.7326/M19-3075 |
| [194] |
Gross PA, Hermogenes AW, Sacks HS, et al. The efficacy of influenza vaccine in elderly persons. A meta-analysis and review of the literature[J]. Ann Intern Med, 1995, 123(7): 518-527. DOI:10.7326/0003-4819-123-7-199510010-00008 |
| [195] |
Beyer WE, Nauta JJ, Palache AM, et al. Immunogenicity and safety of inactivated influenza vaccines in primed populations: a systematic literature review and meta-analysis[J]. Vaccine, 2011, 29(34): 5785-5792. DOI:10.1016/j.vaccine.2011.05.040 |
| [196] |
Govaert TM, Thijs CT, Masurel N, et al. The efficacy of influenza vaccination in elderly individuals. A randomized double-blind placebo-controlled trial[J]. JAMA, 1994, 272(21): 1661-1665. |
| [197] |
Praditsuwan R, Assantachai P, Wasi C, et al. The efficacy and effectiveness of influenza vaccination among Thai elderly persons living in the community[J]. J Med Assoc Thai, 2005, 88(2): 256-264. |
| [198] |
Chu K, Xu K, Tang R, et al. Immunogenicity and safety of an inactivated quadrivalent influenza vaccine: A randomized, double-blind, controlled phase Ⅲ study in healthy population aged ≥3 years[J]. Vaccine, 2020, 38(37): 5940-5946. DOI:10.1016/j.vaccine.2020.06.071 |
| [199] |
U. S. CDC. Licensure of a high-dose inactivated influenza vaccine for persons aged > or=65 years (Fluzone High-Dose) and guidance for use-United States, 2010[J]. MMWR Morb Mortal Wkly Rep, 2010, 59(16): 485-486. |
| [200] |
Couch RB, Winokur P, Brady R, et al. Safety and immunogenicity of a high dosage trivalent influenza vaccine among elderly subjects[J]. Vaccine, 2007, 25(44): 7656-7663. DOI:10.1016/j.vaccine.2007.08.042 |
| [201] |
Falsey AR, Treanor JJ, Tornieporth N, et al. Randomized, double-blind controlled phase 3 trial comparing the immunogenicity of high-dose and standard-dose influenza vaccine in adults 65 years of age and older[J]. J Infect Dis, 2009, 200(2): 172-180. DOI:10.1086/599790 |
| [202] |
Keitel WA, Atmar RL, Cate TR, et al. Safety of high doses of influenza vaccine and effect on antibody responses in elderly persons[J]. Arch Intern Med, 2006, 166(10): 1121-1127. DOI:10.1001/archinte.166.10.1121 |
| [203] |
Wilkinson K, Wei Y, Szwajcer A, et al. Efficacy and safety of high-dose influenza vaccine in elderly adults: A systematic review and meta-analysis[J]. Vaccine, 2017, 35(21): 2775-2780. DOI:10.1016/j.vaccine.2017.03.092 |
| [204] |
DiazGranados CA, Dunning AJ, Kimmel M, et al. Efficacy of high-dose versus standard-dose influenza vaccine in older adults[J]. N Engl J Med, 2014, 371(7): 635-645. DOI:10.1056/NEJMoa1315727 |
| [205] |
Izurieta HS, Thadani N, Shay DK, et al. Comparative effectiveness of high-dose versus standard-dose influenza vaccines in US residents aged 65 years and older from 2012 to 2013 using Medicare data: a retrospective cohort analysis[J]. Lancet Infect Dis, 2015, 15(3): 293-300. DOI:10.1016/S1473-3099(14)71087-4 |
| [206] |
Shay DK, Chillarige Y, Kelman J, et al. Comparative effectiveness of high-dose versus standard-dose influenza vaccines among US medicare beneficiaries in preventing postinfluenza deaths during 2012-2013 and 2013-2014[J]. J Infect Dis, 2017, 215(4): 510-517. DOI:10.1093/infdis/jiw641 |
| [207] |
Young-Xu Y, van Aalst R, Mahmud SM, et al. Relative vaccine effectiveness of high-dose versus standard-dose influenza vaccines among veterans health administration patients[J]. J Infect Dis, 2018, 217(11): 1718-1727. DOI:10.1093/infdis/jiy088 |
| [208] |
Doyle JD, Beacham L, Martin ET, et al. Relative and absolute effectiveness of high-dose and standard-dose influenza vaccine against influenza-related hospitalization among older adults-United States, 2015-2017[J]. Clin Infect Dis, 2021, 72(6): 995-1003. DOI:10.1093/cid/ciaa160 |
| [209] |
Izurieta HS, Chillarige Y, Kelman J, et al. Relative effectiveness of influenza vaccines among the United States elderly, 2018-2019[J]. J Infect Dis, 2020, 222(2): 278-287. DOI:10.1093/infdis/jiaa080 |
| [210] |
Ward BJ, Makarkov A, Seguin A, et al. Efficacy, immunogenicity, and safety of a plant-derived, quadrivalent, virus-like particle influenza vaccine in adults (18-64 years) and older adults (≥65 years): two multicentre, randomised phase 3 trials[J]. Lancet, 2020, 396(10261): 1491-1503. DOI:10.1016/S0140-6736(20)32014-6 |
| [211] |
黄远东, 赵晓平, 万涛, 等. 慢性阻塞性肺病人群流感疫苗接种的效果观察[J]. 海南医学, 2011, 22(4): 29-31. Huang YD, Zhao XP, Wan T, et al. Effects of influenza vaccination in chronic obstructive pulmonary disease[J]. Hai-nan Med J, 2011, 22(4): 29-31. DOI:10.3969/j.issn.1003-6350.2011.04.011 |
| [212] |
高忠翠, 李江涛, 展胜. 卡舒宁联合流感疫苗对老年性慢性支气管炎合并急性感染的防治效果[J]. 中国生物制品学杂志, 2011, 24(10): 1214-1216. Gao ZC, Li JT, Zhan S. Preventive and curative effects of Card Shu Ning Combined with Influenza Vaccine on senile chronic bronchitis complicated with acute infection[J]. Chin J Biol, 2011, 24(10): 1214-1216. DOI:10.13200/j.cjb.2011.10.99.gaozhc.030 |
| [213] |
Schwarze J, Openshaw P, Jha A, et al. Influenza burden, prevention, and treatment in asthma-A scoping review by the EAACI Influenza in asthma task force[J]. Allergy, 2018, 73(6): 1151-1181. DOI:10.1111/all.13333 |
| [214] |
Vasileiou E, Sheikh A, Butler C, et al. Effectiveness of influenza vaccines in asthma: A systematic review and meta-analysis[J]. Clin Infect Dis, 2017, 65(8): 1388-1395. DOI:10.1093/cid/cix524 |
| [215] |
Clar C, Oseni Z, Flowers N, et al. Influenza vaccines for preventing cardiovascular disease[J]. Cochrane Database Syst Rev, 2015(5): CD005050. DOI:10.1002/14651858.CD005050.pub3 |
| [216] |
Sribhutorn A, Phrommintikul A, Wongcharoen W, et al. Influenza vaccination in acute coronary syndromes patients in Thailand: the cost-effectiveness analysis of the prevention for cardiovascular events and pneumonia[J]. J Geriatr Cardiol, 2018, 15(6): 413-421. DOI:10.11909/j.issn.1671-5411.2018.06.008 |
| [217] |
Suh J, Kim B, Yang Y, et al. Cost effectiveness of influenza vaccination in patients with acute coronary syndrome in Korea[J]. Vaccine, 2017, 35(21): 2811-2817. DOI:10.1016/j.vaccine.2017.04.016 |
| [218] |
Behrouzi B, Bhatt DL, Cannon CP, et al. Association of influenza vaccination with cardiovascular risk: A meta-analysis[J]. JAMA Netw Open, 2022, 5(4): e228873. DOI:10.1001/jamanetworkopen.2022.8873 |
| [219] |
Modin D, Jørgensen ME, Gislason G, et al. Influenza vaccine in heart failure[J]. Circulation, 2019, 139(5): 575-586. DOI:10.1161/circulationaha.118.036788 |
| [220] |
Goeijenbier M, van Sloten TT, Slobbe L, et al. Benefits of flu vaccination for persons with diabetes mellitus: A review[J]. Vaccine, 2017, 35(38): 5095-5101. DOI:10.1016/j.vaccine.2017.07.095 |
| [221] |
Collins JP, Campbell AP, Openo K, et al. Clinical features and outcomes of immunocompromised children hospitalized with laboratory-confirmed influenza in the United States, 2011-2015[J]. J Pediatric Infect Dis Soc, 2019, 8(6): 539-549. DOI:10.1093/jpids/piy101 |
| [222] |
Caldera F, Mercer M, Samson SI, et al. Influenza vaccination in immunocompromised populations: Strategies to improve immunogenicity[J]. Vaccine, 2021, 39 Suppl 1: a15-23. DOI:10.1016/j.vaccine.2020.11.037 |
| [223] |
Ng AN, Lai CK. Effectiveness of seasonal influenza vaccination in healthcare workers: a systematic review[J]. J Hosp Infect, 2011, 79(4): 279-286. DOI:10.1016/j.jhin.2011.08.004 |
| [224] |
Kliner M, Keenan A, Sinclair D, et al. Influenza vaccination for healthcare workers in the UK: appraisal of systematic reviews and policy options[J]. BMJ Open, 2016, 6(9): e012149. DOI:10.1136/bmjopen-2016-012149 |
| [225] |
Imai C, Toizumi M, Hall L, et al. A systematic review and meta-analysis of the direct epidemiological and economic effects of seasonal influenza vaccination on healthcare workers[J]. PLoS One, 2018, 13(6): e0198685. DOI:10.1371/journal.pone.0198685 |
| [226] |
Amodio E, Restivo V, Firenze A, et al. Can influenza vaccination coverage among healthcare workers influence the risk of nosocomial influenza-like illness in hospitalized patients?[J]. J Hosp Infect, 2014, 86(3): 182-187. DOI:10.1016/j.jhin.2014.01.005 |
| [227] |
Su W, Wang H, Sun C, et al. The association between previous influenza vaccination and COVID-19 infection risk and severity: A systematic review and meta-analysis[J]. Am J Prev Med, 2022, 63(1): 121-130. DOI:10.1016/j.amepre.2022.02.008 |
| [228] |
Ting EEK, Sander B, Ungar WJ. Systematic review of the cost-effectiveness of influenza immunization programs[J]. Vaccine, 2017, 35(15): 1828-1843. DOI:10.1016/j.vaccine.2017.02.044 |
| [229] |
Taghioff SM, Slavin BR, Holton T, et al. Examining the potential benefits of the influenza vaccine against SARS-CoV-2: A retrospective cohort analysis of 74, 754 patients[J]. PLoS One, 2021, 16(8): e0255541. DOI:10.1371/journal.pone.0255541 |
| [230] |
Wilcox CR, Islam N, Dambha-Miller H. Association between influenza vaccination and hospitalisation or all-cause mortality in people with COVID-19: a retrospective cohort study[J]. BMJ Open Respir Res, 2021, 8(1): e000857. DOI:10.1136/bmjresp-2020-000857 |
| [231] |
Cate TR, Couch RB, Parker D, et al. Reactogenicity, immunogenicity, and antibody persistence in adults given inactivated influenza virus vaccines-1978[J]. Rev Infect Dis, 1983, 5(4): 737-747. DOI:10.1093/clinids/5.4.737 |
| [232] |
Ochiai H, Shibata M, Kamimura K, et al. Evaluation of the efficacy of split-product trivalent A(H1N1), A(H3N2), and B influenza vaccines: reactogenicity, immunogenicity and persistence of antibodies following two doses of vaccines[J]. Microbiol Immunol, 1986, 30(11): 1141-1149. DOI:10.1111/j.1348-0421.1986.tb03043.x |
| [233] |
Kunzel W, Glathe H, Engelmann H, et al. Kinetics of humoral antibody response to trivalent inactivated split influenza vaccine in subjects previously vaccinated or vaccinated for the first time[J]. Vaccine, 1996, 14(12): 1108-1110. DOI:10.1016/0264-410x(96)00061-8 |
| [234] |
Song JY, Cheong HJ, Hwang IS, et al. Long-term immunogenicity of influenza vaccine among the elderly: Risk factors for poor immune response and persistence[J]. Vaccine, 2010, 28(23): 3929-3935. DOI:10.1016/j.vaccine.2010.03.067 |
| [235] |
Davis CW, Jackson KJL, McCausland MM, et al. Influenza vaccine-induced human bone marrow plasma cells decline within a year after vaccination[J]. Science, 2020, 370(6513): 237-241. DOI:10.1126/science.aaz8432 |
| [236] |
Feng S, Chiu SS, Chan ELY, et al. Effectiveness of influenza vaccination on influenza-associated hospitalisations over time among children in Hong Kong: a test-negative case-control study[J]. Lancet Respir Med, 2018, 6(12): 925-934. DOI:10.1016/S2213-2600(18)30419-3 |
| [237] |
Liao Y, Jin Y, Zhang H, et al. Immunogenicity of a trivalent influenza vaccine and persistence of induced immunity in adults aged ≥60 years in Taizhou City, Zhejiang Province, China, during the 2018-2019 season[J]. Hum Vaccin Immunother, 2022, 18(5): 2071061. DOI:10.1080/21645515.2022.2071061 |
| [238] |
Martínez-Baz I, Navascués A, Casado I, et al. Simple models to include influenza vaccination history when evaluating the effect of influenza vaccination[J]. Euro Surveill, 2021, 26(32): 2001099. DOI:10.2807/1560-7917.ES.2021.26.32.2001099 |
| [239] |
de Lusignan S, Dos Santos G, Byford R, et al. Enhanced safety surveillance of seasonal quadrivalent influenza vaccines in English Primary Care: Interim analysis[J]. Adv Ther, 2018, 35(8): 1199-1214. DOI:10.1007/s12325-018-0747-4 |
| [240] |
Greenberg DP, Robertson CA, Landolfi VA, et al. Safety and immunogenicity of an inactivated quadrivalent influenza vaccine in children 6 months through 8 years of age[J]. Pediatr Infect Dis J, 2014, 33(6): 630-636. DOI:10.1097/INF.0000000000000254 |
| [241] |
Tsurudome Y, Kimachi K, Okada Y, et al. Immunogenicity and safety of an inactivated quadrivalent influenza vaccine in healthy adults: a phase Ⅱ, open-label, uncontrolled trial in Japan[J]. Microbiol Immunol, 2015, 59(10): 597-604. DOI:10.1111/1348-0421.12316 |
| [242] |
Tinoco JC, Pavia-Ruz N, Cruz-Valdez A, et al. Immunogenicity, reactogenicity, and safety of inactivated quadrivalent influenza vaccine candidate versus inactivated trivalent influenza vaccine in healthy adults aged ≥18 years: a phase Ⅲ, randomized trial[J]. Vaccine, 2014, 32(13): 1480-1487. DOI:10.1016/j.vaccine.2014.01.022 |
| [243] |
Statler VA, Albano FR, Airey J, et al. Immunogenicity and safety of a quadrivalent inactivated influenza vaccine in children 6-59 months of age: A phase 3, randomized, noninferiority study[J]. Vaccine, 2019, 37(2): 343-351. DOI:10.1016/j.vaccine.2018.07.036 |
| [244] |
van de Witte S, Nauta J, Montomoli E, et al. A Phase III randomised trial of the immunogenicity and safety of quadrivalent versus trivalent inactivated subunit influenza vaccine in adult and elderly subjects, assessing both anti-haemagglutinin and virus neutralisation antibody responses[J]. Vaccine, 2018, 36(40): 6030-6038. DOI:10.1016/j.vaccine.2018.04.043 |
| [245] |
Haber P, Moro PL, Lewis P, et al. Post-licensure surveillance of quadrivalent inactivated influenza (IIV4) vaccine in the United States, Vaccine Adverse Event Reporting System (VAERS), July 1, 2013-May 31, 2015[J]. Vaccine, 2016, 34(22): 2507-2512. DOI:10.1016/j.vaccine.2016.03.048 |
| [246] |
胡昱, 李倩, 陈雅萍, 等. 18岁以上人群接种四价流感病毒灭活疫苗免疫原性和安全性的Meta分析[J]. 国际流行病学传染病学杂志, 2017, 44(1): 47-52. Hu Y, Li Q, Chen YP, et al. Meta-analysis on immunogenicity and safety of inactivated quadrivalent influenza vaccine in adults aged above 18 years[J]. Inter J Epidemiol Infect Dis, 2017, 44(1): 47-52. DOI:10.3760/cma.j.issn.1673-4149.2017.01.010 |
| [247] |
Gandhi-Banga S, Chabanon AL, Eymin C, et al. Enhanced passive safety surveillance of three marketed influenza vaccines in the UK and the Republic of Ireland during the 2017/18 season[J]. Hum Vaccin Immunother, 2019, 15(9): 2154-2158. DOI:10.1080/21645515.2019.1581538 |
| [248] |
Pepin S, Dupuy M, Borja-Tabora CFC, et al. Efficacy, immunogenicity, and safety of a quadrivalent inactivated influenza vaccine in children aged 6-35 months: A multi-season randomised placebo-controlled trial in the Northern and Southern Hemispheres[J]. Vaccine, 2019, 37(13): 1876-1884. DOI:10.1016/j.vaccine.2018.11.074 |
| [249] |
武文娣, 李克莉, 许涤沙, 等. 中国2015-2018年3个流感季节流感疫苗疑似预防接种异常反应监测数据分析[J]. 中华预防医学杂志, 2019, 53(10): 987-992. Wu WD, Li KL, Xu DS, et al. Study on surveillance data of adverse events following immunization of seasonal influenza vaccine in China during 2015-2018 influenza season Data analysis of monitoring abnormal response of influenza vaccines in China from 2015 to 2018[J]. Chin J Prev Med, 2019, 53(10): 987-992. DOI:10.3760/cma.j.issn.0253-9624.2019.10.007 |
| [250] |
Febrile seizures: clinical practice guideline for the long-term management of the child with simple febrile seizures [J]. Pediatrics, 2008, 121(6): 1281-1286. DOI: 10.1542/peds.2008-0939.
|
| [251] |
Duffy J, Weintraub E, Hambidge SJ, et al. Febrile seizure risk after vaccination in children 6 to 23 months[J]. Pediatrics, 2016, 138(1): e20160320. DOI:10.1542/peds.2016-0320 |
| [252] |
Li R, Stewart B, McNeil MM, et al. Post licensure surveillance of influenza vaccines in the Vaccine Safety Datalink in the 2013-2014 and 2014-2015 seasons[J]. Pharmacoepidemiol Drug Saf, 2016, 25(8): 928-934. DOI:10.1002/pds.3996 |
| [253] |
Berry BB, Ehlert DA, Battiola RJ, et al. Influenza vaccination is safe and immunogenic when administered to hospitalized patients[J]. Vaccine, 2001, 19(25/26): 3493-3498. DOI:10.1016/s0264-410x(01)00068-8 |
| [254] |
Bansal A, Trieu MC, Mohn K GI, et al. Safety, immunogenicity, efficacy and effectiveness of inactivated influenza vaccines in healthy pregnant women and children under 5 years: An evidence-based clinical review[J]. Front Immunol, 2021, 12: 744774. DOI:10.3389/fimmu.2021.744774 |
| [255] |
Perego G, Vigezzi GP, Cocciolo G, et al. Safety and efficacy of spray intranasal live attenuated influenza vaccine: Systematic review and meta-analysis[J]. Vaccines (Basel), 2021, 9(9): 998. DOI:10.3390/vaccines9090998 |
| [256] |
Lewis KDC, Ortiz JR, Rahman MZ, et al. Immunogenicity and viral shedding of Russian-backbone, seasonal, trivalent, live, attenuated influenza vaccine in a phase Ⅱ, randomized, placebo-controlled trial among preschool-aged children in Urban Bangladesh[J]. Clin Infect Dis, 2019, 69(5): 777-785. DOI:10.1093/cid/ciy1003 |
| [257] |
Jackson D, Pitcher M, Hudson C, et al. Viral shedding in recipients of live attenuated influenza vaccine in the 2016-2017 and 2017-2018 influenza seasons in the United Kingdom[J]. Clin Infect Dis, 2020, 70(12): 2505-2513. DOI:10.1093/cid/ciz719 |
| [258] |
Nordin JD, Vazquez-Benitez G, Olsen A, et al. Safety of guidelines recommending live attenuated influenza vaccine for routine use in children and adolescents with asthma[J]. Vaccine, 2019, 37(30): 4055-4060. DOI:10.1016/j.vaccine.2019.05.081 |
| [259] |
Baxter R, Eaton A, Hansen J, et al. Safety of quadrivalent live attenuated influenza vaccine in subjects aged 2-49years[J]. Vaccine, 2017, 35(9): 1254-1258. DOI:10.1016/j.vaccine.2017.01.062 |
| [260] |
Caspard H, Steffey A, Mallory RM, et al. Evaluation of the safety of live attenuated influenza vaccine (LAIV) in children and adolescents with asthma and high-risk conditions: a population-based prospective cohort study conducted in England with the Clinical Practice Research Datalink[J]. BMJ Open, 2018, 8(12): e023118. DOI:10.1136/bmjopen-2018-023118 |
| [261] |
Turner PJ, Southern J, Andrews NJ, et al. Safety of live attenuated influenza vaccine in young people with egg allergy: multicentre prospective cohort study[J]. BMJ, 2015, 351: h6291. DOI:10.1136/bmj.h6291 |
| [262] |
何琛璐, 刘润武, 许钦, 等. 西宁市学龄儿童接种流感疫苗效果与效益评价[J]. 公共卫生与预防医学, 2021, 32(5): 97-100. He CL, Liu RW, Xu Q, et al. Evaluation of the effectiveness and benefit of influenza vaccination among school-age children in Xining, Qinghai[J]. J Pub Health Prev Med, 2021, 32(5): 97-100. DOI:10.3969/j.issn.1006-2483.2021.05.022 |
| [263] |
王岩, 迟阳, 王春平, 等. 潍坊市老年人流感疫苗免费接种效果及成本效益分析[J]. 中国农村卫生事业管理, 2020, 40(11): 795-798. Wang Y, Chi Y, Wang CP, et al. Cost-benefit analysis of free vaccination of influenza vaccine for the elderly in Weifang City[J]. Chin Rural Health Service Administration, 2020, 40(11): 795-798. DOI:10.3969/j.issn.1005-5916.2020.11.009 |
| [264] |
Zhu D, Lv M, Bai Y, et al. Cost-effectiveness analysis of quadrivalent seasonal influenza vaccines in Beijing: A modeling analysis[J]. Vaccine, 2022, 40(7): 994-1000. DOI:10.1016/j.vaccine.2022.01.006 |
| [265] |
吴晓亮, 叶兆嘉, 谢旭, 等. 基于马尔科夫模型的深圳市60岁及以上人群接种流感疫苗的成本效果分析[J]. 中华流行病学杂志, 2022, 43(7): 1140-1146. Wu XL, Ye ZJ, Xie X, et al. Based on a Markov model, cost-effectiveness analysis of influenza vaccination among people aged 60 years and older in Shenzhen[J]. Chin J Epidemiol, 2022, 43(7): 1140-1146. DOI:10.3760/cma.j.cn112338-20211221-01005 |
| [266] |
Ding H, Huang J, Ngai CH, et al. The cost-effectiveness of starting 23-valent pneumococcal polysaccharide vaccine and influenza vaccination at 50 vs. 65 years: A comparative modelling study[J]. Vaccine, 2022, 40(9): 1282-1288. DOI:10.1016/j.vaccine.2022.01.033 |
| [267] |
Wenzel NS, Atkins KE, van Leeuwen E, et al. Cost-effectiveness of live-attenuated influenza vaccination among school-age children[J]. Vaccine, 2021, 39(2): 447-456. DOI:10.1016/j.vaccine.2020.10.007 |
| [268] |
汪志国, 孙翔, 张岷, 等. 3~7岁儿童同时接种23价肺炎球菌多糖疫苗和流感病毒裂解疫苗的免疫原性及安全性研究[J]. 中华微生物学和免疫学杂志, 2019, 39(10): 758-762. Wang ZG, Sun X, Zhang M, et al. Immunogenicity and safety of co-immunization with 23-valent pneumococcal polysaccharide vaccine and influenza virus split vaccine for children aged 3-7 years[J]. Chin J Microbiol Immunol, 2019, 39(10): 758-762. DOI:10.3760/cma.j.issn.0254-5101.2019.10.006 |
| [269] |
Stockwell MS, Broder K, LaRussa P, et al. Risk of fever after pediatric trivalent inactivated influenza vaccine and 13-valent pneumococcal conjugate vaccine[J]. JAMA Pediatr, 2014, 168(3): 211-219. DOI:10.1001/jamapediatrics.2013.4469 |
| [270] |
Patterson JL, Carapetian SA, Hageman JR, et al. Febrile seizures[J]. Pediatr Ann, 2013, 42(12): 249-254. DOI:10.3928/00904481-20131122-09 |
| [271] |
Nolan T, Bernstein DI, Block SL, et al. Safety and immunogenicity of concurrent administration of live attenuated influenza vaccine with measles-mumps-rubella and varicella vaccines to infants 12 to 15 months of age[J]. Pediatrics, 2008, 121(3): 508-516. DOI:10.1542/peds.2007-1064 |
| [272] |
Frenck RW, Gurtman A, Rubino J, et al. Randomized, controlled trial of a 13-valent pneumococcal conjugate vaccine administered concomitantly with an influenza vaccine in healthy adults[J]. Clin Vaccine Immunol, 2012, 19(8): 1296-1303. DOI:10.1128/CVI.00176-12 |
| [273] |
Schwarz TF, Flamaing J, Rumke HC, et al. A randomized, double-blind trial to evaluate immunogenicity and safety of 13-valent pneumococcal conjugate vaccine given concomitantly with trivalent influenza vaccine in adults aged > /=65 years[J]. Vaccine, 2011, 29(32): 5195-5202. DOI:10.1016/j.vaccine.2011.05.031 |
| [274] |
McNeil SA, Noya F, Dionne M, et al. Comparison of the safety and immunogenicity of concomitant and sequential administration of an adult formulation tetanus and diphtheria toxoids adsorbed combined with acellular pertussis (Tdap) vaccine and trivalent inactivated influenza vaccine in adults[J]. Vaccine, 2007, 25(17): 3464-3474. DOI:10.1016/j.vaccine.2006.12.047 |
| [275] |
Kerzner B, Murray AV, Cheng E, et al. Safety and immunogenicity profile of the concomitant administration of ZOSTAVAX and inactivated influenza vaccine in adults aged 50 and older[J]. J Am Geriatr Soc, 2007, 55(10): 1499-1507. DOI:10.1111/j.1532-5415.2007.01397.x |
| [276] |
Levin MJ, Buchwald UK, Gardner J, et al. Immunogenicity and safety of zoster vaccine live administered with quadrivalent influenza virus vaccine[J]. Vaccine, 2018, 36(1): 179-185. DOI:10.1016/j.vaccine.2017.08.029 |
| [277] |
Nakashima K, Aoshima M, Ohfuji S, et al. Immunogenicity of simultaneous versus sequential administration of a 23-valent pneumococcal polysaccharide vaccine and a quadrivalent influenza vaccine in older individuals: A randomized, open-label, non-inferiority trial[J]. Hum Vaccin Immunother, 2018, 14(8): 1923-1930. DOI:10.1080/21645515.2018.1455476 |
| [278] |
Song JY, Cheong HJ, Tsai TF, et al. Immunogenicity and safety of concomitant MF59-adjuvanted influenza vaccine and 23-valent pneumococcal polysaccharide vaccine administration in older adults[J]. Vaccine, 2015, 33(36): 4647-4652. DOI:10.1016/j.vaccine.2015.05.003 |
| [279] |
WHO. Coadministration of seasonal inactivated influenza and COVID-19 vaccines-Interim guidance [EB/OL]. (2021-10-21)[2022-07-06]. https://www.who.int/publications/i/item/WHO-2019-nCoV-vaccines-SAGE_recommendation-coadministration-influenza-vaccines.
|
| [280] |
Lazarus R, Baos S, Cappel-Porter H, et al. Safety and immunogenicity of concomitant administration of COVID-19 vaccines (ChAdOx1 or BNT162b2) with seasonal influenza vaccines in adults in the UK (ComFluCOV): a multicentre, randomised, controlled, phase 4 trial[J]. Lancet, 2021, 398(10318): 2277-2287. DOI:10.1016/S0140-6736(21)02329-1 |
| [281] |
Toback S, Galiza E, Cosgrove C, et al. Safety, immunogenicity, and efficacy of a COVID-19 vaccine (NVX-CoV2373) co-administered with seasonal influenza vaccines: an exploratory substudy of a randomised, observer-blinded, placebo-controlled, phase 3 trial[J]. Lancet Respir Med, 2022, 10(2): 167-179. DOI:10.1016/S2213-2600(21)00409-4 |
| [282] |
Izikson R, Brune D, Bolduc JS, et al. Safety and immunogenicity of a high-dose quadrivalent influenza vaccine administered concomitantly with a third dose of the mRNA-1273 SARS-CoV-2 vaccine in adults aged ≥65 years: a phase 2, randomised, open-label study[J]. Lancet Respir Med, 2022, 10(4): 392-402. DOI:10.1016/S2213-2600(21)00557-9 |
| [283] |
Hause AM, Zhang B, Yue X, et al. Reactogenicity of Simultaneous COVID-19 mRNA Booster and Influenza Vaccination in the US[J]. JAMA Netw Open, 2022, 5(7): e2222241. DOI:10.1001/jamanetworkopen.2022.22241 |
| [284] |
Shenyu W, Xiaoqian D, Bo C, et al. Immunogenicity and safety of a SARS-CoV-2 inactivated vaccine (CoronaVac) co-administered with an inactivated quadrivalent influenza vaccine: A randomized, open-label, controlled study in healthy adults aged 18 to 59 years in China [J]. Vaccine, 2022, S0264-410X(22)00908-2: Advance online publication. DOI: 10.1016/j.vaccine.2022.07.021.
|
| [285] |
Chen H, Huang Z, Chang S, et al. Immunogenicity and safety of an inactivated SARS-CoV-2 vaccine (Sinopharm BBIBP-CorV) coadministered with quadrivalent split-virion inactivated influenza vaccine and 23-valent pneumococcal polysaccharide vaccine in China: A multicentre, non-inferiority, open-label, randomised, controlled, phase 4 trial[J]. Vaccine, 2022. DOI:10.1016/j.vaccine.2022.07.033 |
| [286] |
Launay O, Abitbol V, Krivine A, et al. Immunogenicity and safety of influenza vaccine in inflammatory bowel disease patients treated or not with immunomodulators and/or biologics: A two-year prospective study[J]. J Crohns Colitis, 2015, 9(12): 1096-1107. DOI:10.1093/ecco-jcc/jjv152 |
| [287] |
Huemer HP. Possible immunosuppressive effects of drug exposure and environmental and nutritional effects on infection and vaccination[J]. Mediators Inflamm, 2015, 2015, 349176. DOI:10.1155/2015/349176 |
| [288] |
Farkas K, Terhes G, Deak J, et al. The efficiency of influenza vaccines in patients with inflammatory bowel disease on immunosuppressive therapy[J]. Orv Hetil, 2012, 153(47): 1870-1874. DOI:10.1556/OH.2012.29484 |
| [289] |
Kroger A, Bahta L, Hunter P. General best practice guidelines for immunization. Best practices guidance of the Advisory Committee on Immunization Practices (ACIP) [EB/OL]. (2022-03-15)[2022-07-10]. https://www.cdc.gov/vaccines/hcp/acip-recs/general-recs/downloads/ general-recs.pdf.
|
| [290] |
庄文佳, 丛莉, 蔡兴雁, 等. 五种国内常用流感疫苗的分析比较[J]. 中外健康文摘, 2012, 9(27): 71-74. Zhuang WJ, Cong L, Cai XY, et al. Analysis and comparison of five common influenza vaccines in China[J]. World Health Digest, 2012, 9(27): 71-74. DOI:10.3969/j.issn.1672-5085.2012.27.055 |
| [291] |
Des Roches A, Paradis L, Gagnon R, et al. Egg-allergic patients can be safely vaccinated against influenza[J]. J Allergy Clin Immunol, 2012, 130(5): 1213-1216, e1211. DOI:10.1016/j.jaci.2012.07.046 |
| [292] |
Des Roches A, Samaan K, Graham F, et al. Safe vaccination of patients with egg allergy by using live attenuated influenza vaccine[J]. J Allergy Clin Immunol Pract, 2015, 3(1): 138-139. DOI:10.1016/j.jaip.2014.08.008 |
| [293] |
Turner PJ, Southern J, Andrews NJ, et al. Safety of live attenuated influenza vaccine in atopic children with egg allergy[J]. J Allergy Clin Immunol, 2015, 136(2): 376-381. DOI:10.1016/j.jaci.2014.12.1925 |
| [294] |
Ofori-Anyinam O, Leroux-Roels G, Drame M, et al. Immunogenicity and safety of an inactivated quadrivalent influenza vaccine co-administered with a 23-valent pneumococcal polysaccharide vaccine versus separate administration, in adults > /=50years of age: Results from a phase Ⅲ, randomized, non-inferiority trial[J]. Vaccine, 2017, 35(46): 6321-6328. DOI:10.1016/j.vaccine.2017.09.012 |
| [295] |
Chang YC, Chou YJ, Liu JY, et al. Additive benefits of pneumococcal and influenza vaccines among elderly persons aged 75 years or older in Taiwan—a representative population-based comparative study[J]. J Infect, 2012, 65(3): 231-218. DOI:10.1016/j.jinf.2012.04.014 |
| [296] |
Christenson B, Pauksen K, Sylvan SP. Effect of influenza and pneumococcal vaccines in elderly persons in years of low influenza activity[J]. Virol J, 2008, 5: 52. DOI:10.1186/1743-422X-5-52 |
| [297] |
Yin M, Huang L, Zhang Y, et al. Effectiveness and safety of dual influenza and pneumococcal vaccination versus separate administration or no vaccination in older adults: a meta-analysis[J]. Expert Rev Vaccines, 2018, 17(7): 653-663. DOI:10.1080/14760584.2018.1495077 |
| [298] |
Poscia A, Collamati A, Carfi A, et al. Influenza and pneumococcal vaccination in older adults living in nursing home: a survival analysis on the shelter study[J]. Eur J Public Health, 2017, 27(6): 1016-1020. DOI:10.1093/eurpub/ckx150 |
| [299] |
Li C, Gubbins PO, Chen GJ. Prior pneumococcal and influenza vaccinations and in-hospital outcomes for community-acquired pneumonia in elderly veterans[J]. J Hosp Med, 2015, 10(5): 287-293. DOI:10.1002/jhm.2328 |
 2022, Vol. 43
2022, Vol. 43