文章信息
- 李志强, 王盛书, 贡鑫然, 王彦丁, 吴迪, 杨美涛, 郭金鹏, 贾瑞忠, 刘淼, 何耀, 王勇.
- Li Zhiqiang, Wang Shengshu, Gong Xinran, Wang Yanding, Wu Di, Yang Meitao, Guo Jinpeng, Jia Ruizhong, Liu Miao, He Yao, Wang Yong
- 我国老年人轻度认知障碍与全因死亡关联的Meta分析
- Association between mild cognitive impairment and all-cause mortality in elderly population in China: a Meta analysis
- 中华流行病学杂志, 2022, 43(9): 1479-1484
- Chinese Journal of Epidemiology, 2022, 43(9): 1479-1484
- http://dx.doi.org/10.3760/cma.j.cn112338-20220207-00096
-
文章历史
收稿日期: 2022-02-07
2. 解放军疾病预防控制中心, 北京 100071;
3. 解放军总医院第二医学中心老年医学研究所, 衰老及相关疾病研究北京市重点实验室, 国家老年疾病临床医学研究中心, 北京 100853;
4. 解放军总医院研究生院, 北京 100853
2. Center for Disease Control and Prevention of Chinese People's Liberation Army, Beijing 100071, China;
3. Institute of Geriatrics, Second Medical Center, Beijing Key Laboratory of Aging and Geriatrics, National Clinical Research Center for Geriatric Disease, Chinese People's Liberation Army General Hospital & Chinese People's Liberation Army Medical Academy, Beijing 100853, China;
4. Graduate School, Chinese People's Liberation Army General Hospital, Beijing 100853, China
目前人口老龄化是我国面临的重大公共卫生问题。据2021年中国统计年鉴显示,截至2020年≥65岁老龄人口约有1.96亿,占总人口13.50%[1]。而到2050年这一数字将突破4亿。伴随老龄化速度的加快,衰老带来了诸多健康问题,其中轻度认知障碍(mild cognitive impairment,MCI)导致的老年人失能失智,给我国老年群体健康和晚期生活质量造成了严重挑战。一项关于全球认知障碍与老年人全因死亡关联的荟萃分析发现,伴随正常衰老过程中,患有MCI老年人全因死亡风险增加[2]。已有研究对老年人认知障碍与死亡风险的关系进行评估,研究结论尚不一致[3-12]。本研究收集国内MCI与全因死亡的前瞻性队列研究文献,采用Meta分析方法对其进行定量评估。
资料与方法1. 检索策略:检索中国知网、万方数据知识服务平台和PubMed、EMBASE中、英文数据库,收集MCI与全因死亡关联的队列研究,检索时限为自建库至2021年8月1日。根据数据库的特征进行主题词和自由词的联合检索。中文检索式:(认知障碍OR轻度认知障碍OR认知功能OR认知功能损伤OR认知功能下降OR神经认知障碍)AND(全因死亡OR全因死亡率OR死亡OR生存OR生存率);英文检索式:(mild cognitive impairment OR cognitive impairment OR MCI OR CI OR cognitive function OR cognitional functional disorder OR cognitive decline OR cognitive dysfunction OR neuropsychology OR neurocognitive disorders OR psychophysiology) AND (mortality OR all-cause mortality OR death OR survival) AND (cohort study OR longitudinal study OR follow-up)。不同数据库检索策略稍有不同。阅读文题和摘要后排除无关文献,阅读全文后根据纳入和排除标准进一步筛选出相关文章,并对入选文献中的参考文献进行手工检索。
2. 文献纳入与排除标准:纳入标准:①研究类型:前瞻性观察研究或基于人群的队列研究;②研究对象为≥60岁的老年人;③MCI筛查采用国际公认的筛查工具:简易智力状态检查量表(Mini-mental State Examination,MMSE);④结局指标:全因死亡;⑤提供危险比(hazard rate,HR)及其95%CI,或提供能计算上述值的基础数据。排除标准:①未调整混杂因素;②缺少或无法计算提取相关数据(综述、会议、摘要、无法获取全文等);③重复发表文献;④非中、英文文献;⑤无统计学检验;⑥低质量文献(NOS评分 < 6分)。
3. 文献筛选及数据提取:将检索出的文献导入EndNote 20文献管理软件去重后,由2名研究人员独立筛选文章的标题和摘要,明显不符合纳入标准的文献被排除。如果摘要包含的数据不足以说明是否满足纳入和排除标准,则阅读全文进行复筛以确定最终文献。如遇到分歧,可查阅原文或与第3名研究者进行商讨解决。如有需要,联系原始研究作者进一步获取信息。
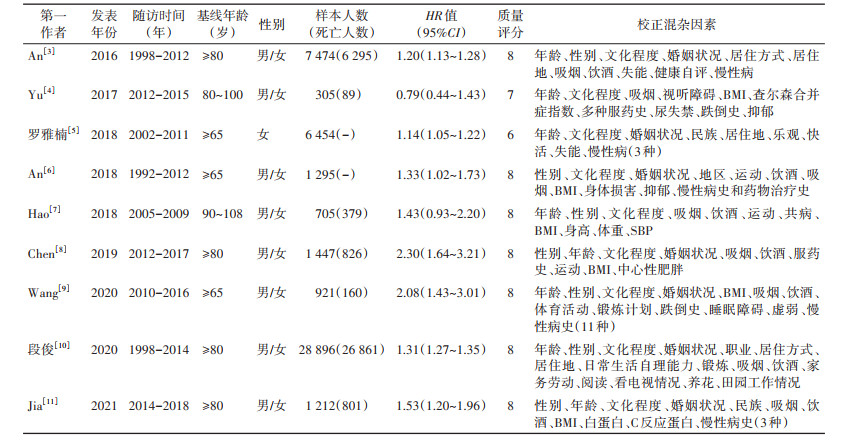
数据提取使用标准化的数据收集表格,每项研究提取的基本信息包括:第一作者、发表年份、数据来源地、随访时间、研究总样本量和死亡人数、纳入的年龄范围、性别、HR值及其95%CI,及所调整的潜在混杂因素,为避免痴呆对死亡的影响,认知障碍严重程度不同的文献,对HR值提取,是经校正混杂因素后的HR值及其95%CI。
4. 文献质量评价:2名研究员独立采用纽卡斯尔-渥太华量表[13](The New Castle Ottawa Scale,NOS)对纳入文献进行质量评估。质量评价表由8个项目组成,从对象选择性(参与者的招募和选择)、可比性(暴露组与非暴露组间的相似性和可比性)和结局(确定队列研究的兴趣结果)3个项目质量进行评估,总分9分。评价过程中如果有任何分歧,则通过协商或征求第三方意见。
5. 统计学分析:采用R 4.02软件进行统计学分析。荟萃分析的主要结果是全因死亡。用HR值及其95%CI的倒数逆方差的加权平均数估计MCI与全因死亡率之间的关系。统计学异质性采用I2和Q检验,若I2 < 50%或Q检验P > 0.1,则该研究异质性较小,采用固定效应模型分析;当I2≥50%且Q检验P≤0.1时,表明研究间存在异质性,此时采用随机效应模型分析,并绘制森林图。按照地域、随访时间、样本量、研究质量、发表时间和调整混杂因素数等进行亚组分析探讨潜在的异质性来源,使用敏感性分析检验结果稳定性,通过依次移除各研究,观察总体效应的变化,确保结果的稳定性,同时调查单个研究结果与荟萃分析结果的相关性,累积Meta分析评估单项研究对综合效应值的影响、潜在的发表偏倚及衡量研究对象何时能够达到足够的稳定性。使用漏斗图、Begg检验法和Egger回归法检验文献的发表偏倚。所有检验均为双侧检验,α=0.05。以P < 0.05为差异有统计学意义。
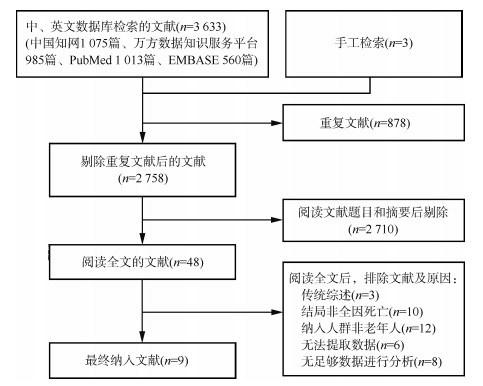
结果1. 纳入文献概况:文献检索的流程见图 1。经文献检索和筛选,共纳入9篇文献(7篇英文,2篇中文)。其中仅有1篇文献仅按照性别分层分析。研究时间为1992-2018年。9项研究,包含了48 709例参与者,其中有35 411例在随访期内死亡。本研究中,中国单一地区(省、市)研究4项;多个地区(省、市)研究5项。9项队列随访时间为3~20年,随访时间 > 10年研究有4项;根据NOS量表赋分,文献质量评分为6~9分,平均7.7分,9篇均≥6分,研究质量较高。5篇对年龄、性别协变量进行校正,9篇校正了吸烟因素。文献的基本特征及质量评价见表 1。
|
| 图 1 纳入文献筛选流程 |
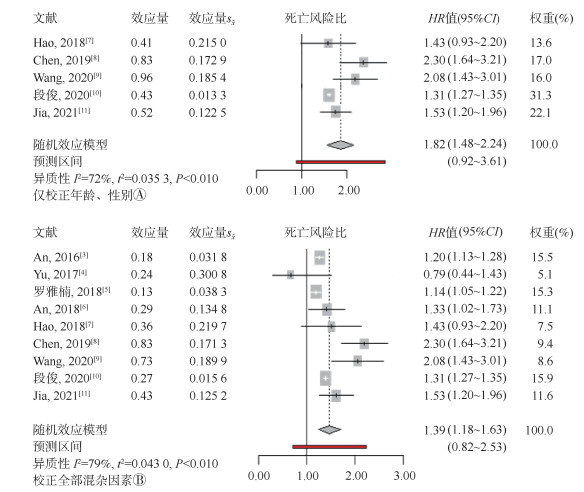
2. Meta分析:纳入的9篇文献研究中仅5篇提供了校正年龄、性别协变量后的效应值,合并后的结果表明,与认知功能正常者相比,MCI增加了全因死亡风险,二者之间关联有统计学意义(n=5;HR=1.82,95%CI:1.48~2.24;P < 0.05),图 2A;在对9篇独立研究完全校正混杂因素后的研究效应量合并后发现,MCI增加了全因死亡风险依然显著(n=9;HR=1.39,95%CI:1.18~1.63;P < 0.05)。图 2B结果显示,随着校正因素的增多,纳入研究间的异质性增强,且存在较高的异质性(I2=79%)。
|
| 图 2 老年人轻度认知障碍与全因死亡率关联的森林图 |
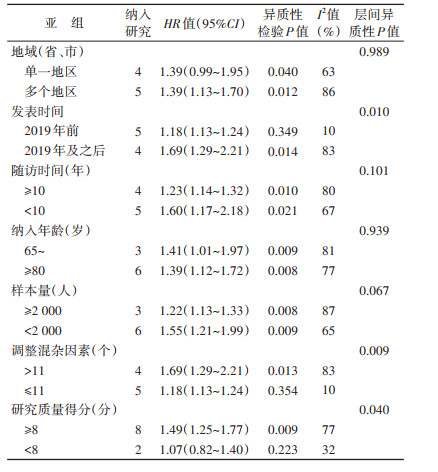
3. 亚组分析:为探索异质性的来源,本研究进行了分层亚组分析,结果表明,在2019年及之后发表、随访时间 < 10年、样本量 < 2 000人、调整混杂因素 > 11个以及研究质量得分≥8分的研究中MCI与全因死亡关联程度较高。同时层间异质性P值提示,研究发表时间、调整混杂因素数、文献质量是研究异质性的重要来源。见表 2。
4. 累积Meta分析:为探寻单项研究对综合效应值的影响、衡量研究对象何时达到足够的稳定性,采用按研究年代顺序和样本量大小排列,依次进行累积Meta分析,图 3A为随年代顺序累积的动态变化趋势,结果显示MCI的死亡预测价值可能在2018年(HR=1.17,95%CI:1.11~1.23,P < 0.001)前已经明确,之后结果趋于稳定。图 3B按照样本量大小进行的累积Meta分析,当累积的研究人群数到3 143人时首次出现差异有统计学意义(HR=1.46,95%CI:1.05~2.02,P < 0.001)。
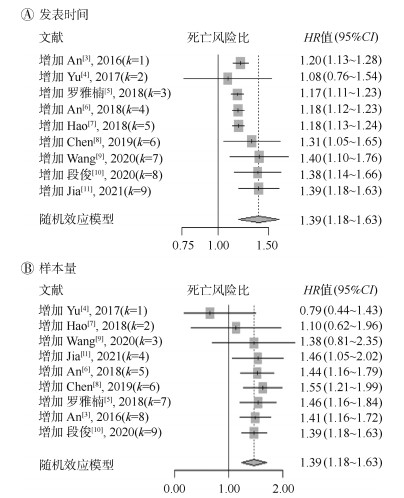
|
| 图 3 老年人轻度认知障碍与全因死亡累积的Meta分析 |
5. 敏感性分析和发表偏倚:敏感性分析中,采用逐一删除各项研究并重新合并效应量方法,分析单个研究对总体合并效应值的影响大小。影响性分析结果表明,与原始效应值作比较,总合并效应值并未发生明显改变(I2值变化较小),说明本研究结果稳定性较好。
本研究文献严格遵循纳入排除标准。为了增加结果的可靠性,应用漏斗图分析,结果显示研究左右分布较为均匀,尚未观察到发表偏倚,通过Egger和Begg检验均未显示发表偏倚(均P > 0.05)。经异质性检验发现Q=57.53,I2=82.6,P < 0.001,随机效应模型合并新的效应量HR=1.26,95%CI:1.02~1.54,差异依然有统计学意义,证明结果的稳定性。
讨论本研究纳入了9项关于MCI和全因死亡的前瞻性队列研究,考虑到年龄、性别在MCI与全因死亡的关联研究中是重要的混杂因素,在Meta分析时单独对校正年龄、性别协变量的效应值进行合并,发现MCI增加全因死亡风险,同时为了避免潜在的混杂因素影响,本研究纳入的9篇文献已调整年龄、性别、生活方式、常见非传染性慢性病等混杂因素,结果显示,基线MCI可以作为老年人中全死因死亡的预测因子。但对多种混杂因素校正效应值合并后发现结果的异质性明显增加,这表明混杂校正因素的不同是异质性的重要来源。
为进一步明确异质性的来源,本研究对7种影响因素进行了亚组分析。在地域亚组分析中,可以看出单一地域的异质性较小,可能与这4个省份经济医疗相对较好,具有同质性有关,而多个地域的广泛研究调查因涉及不同城乡地域,经济、教育文化、医疗水平等在多方面差异导致合并效应量存在较大的异质性,但单一地区的合并效应值HR值(95%CI)为1.39(0.99~1.95),置信区间宽于多个地域的研究水平,提示未来需要更进一步加强相关研究。在文献发表时间亚组中,2019年及以后发表研究的合并效应值远高于2019年前发表,但异质性更强,这可能和2019年及之后研究纳入更大样本量的人群研究有关。而在随访时间的亚组中我们发现,随访时间 < 10年相对随访≥10年的合并研究,MCI在增加全因死亡风险中关联更强,这可能与随访时间 > 10年纳入的人群大都是 > 80岁的高龄老人,由于该类人群的“健康生存效应”影响,作为一批可能早已患有认知障碍及更加坚强的幸存者老年群体代表,相比刚患有MCI病史并面临较高死亡风险的老年人,该群体已逐渐适应自身的认知功能水平。一项阿姆斯特丹阿尔茨海默病中心研究发现[14],在老年人年龄接近并达到90岁后,该类人群认知功能将保持相对稳定,对认知能力下降的不同风险因素具有弹性或抵抗力。与此同时通过纳入年龄范围发现,在≥80岁的人群的效应值低于≥65岁,但尚未发现明显的差异性(P > 0.05),这对未来加强高龄与低龄老人群体分层研究,针对性提出预防措施方案具有重要意义。本研究在样本量亚组中发现,小样本研究虽然随访时间往往不及大样本时间长,但却更趋向于报告一个较高的效应值,这与调整的混杂因素具有重要关联;调整混杂因素数亚组分析中,不同研究间调整混杂因素数是合并研究具有高异质性的重要原因。虽然NOS评分≥ 6分为高质量文献,本文纳入文献均可定义为高质量文献,但文献质量分层合并表明更高质量的文献结果,更能准确预测二者间的关联研究。
通过随年代和样本量大小的效应累积Meta分析,表明了阴性结果发表的重要性。当研究人群数量增加至3 143人,研究对象才能够达到足够的稳定性。Yu等[4]的研究对总体汇总效应值的影响表明通过增加样本量可以明确MCI与死亡存在相关性的结论。基于这样的结论也有助于促进我们在未来深入探索MCI与特异性原因死亡之间的关联,节约不必要的重复研究成本。与此同时,本研究还发现是文献[8]是导致本研究出现异质性的重要原因,通过对比文献,发现协变量是否调整慢性病及数目是研究间异质性较大的重要原因。
本研究结论与王宇等[2]研究结论一致,即经MMSE筛查的认知障碍是老年人全因死亡的重要预测指标。与该文相比,本研究纳入更多的中国人群的队列研究,同时我们发现在中国人群中MCI与全因死亡风险明显高于该研究,这可能与中国老年人文化程度普遍偏低有关,而文化程度是影响认知障碍的重要因素,其次,在对可能导致异质性的影响因素进行亚组分析,明确了异质性的来源,从而为进一步研究认知障碍与死亡的关联研究提供了更为翔实的参考依据。最后,本研究纳入文献的人群来自多个单一地域和多个地域的队列研究,研究对象的代表性较好,对结果的适用推广较好。
目前尚不清楚为什么表现出认知障碍的个体存活寿命更短,研究认为潜在机制如下:①认知障碍可能反映“终末衰退”,作为自身潜在慢性疾病增加和健康状况下降的标志[15]。由于获取医疗知识和综合健康信息所需的技能与认知功能直接相关,认知障碍患者可能难以识别疾病的症状,无法较早期接受诊断和治疗,并听从医生的建议,导致疾病恶化,寿命缩短。②系统的完整性[16],它假设良好的认知功能可能标志着更好的体质。更好的认知功能可能是一种“与生俱来”的生理特征,能够对常见的环境压力做出更强的反应。③虚弱假说[17],它指出认知障碍反映了由于与衰老相关的慢性疾病的累积导致多个生理系统的崩溃,导致器官衰竭和稳态系统衰竭,这些被认为是生命后期发生的近端特异性因素,是导致认知能力下降和随后死亡的关键因素[18]。
本研究存在局限性。首先,本研究仅考虑了基于单次测量认知功能水平对全因死亡的总体效应,可能会低估认知功能纵向变化对死亡的影响,同时纳入的研究随访时间存在一定的差异,可能导致一定的系统偏倚。其次,本研究合并的效应值存在较高的异质性,但通过亚组和累积Meta分析解释了异质性的重要来源。MCI与全因死亡相关风险存在诸多混杂因素,受到人口学特征和生活方式等因素的综合影响,都可能影响研究结果,导致解释异质性具有一定的局限性。但经过亚组和敏感性分析后,结局依然稳健,此外Egger和Begg检验均未显示发表偏倚的存在,提示结果可靠。
综上所述,中国老年人经MMSE评估为MCI可以作为增加全因死亡风险的独立预测指标。MCI作为痴呆防治的“机会之窗”,具有一定的可逆性,加强早期干预诊治,对延缓疾病转化及老年人的死亡风险都具有重要的意义。
利益冲突 所有作者声明无利益冲突
作者贡献声明 李志强:论文撰写与统计分析;王盛书、贡鑫然:统计分析;王彦丁、吴迪、杨美涛:文献检索与数据整理;郭金鹏、贾瑞忠:技术支持、论文指导;刘淼、何耀、王勇:研究方向指导、论文修改、经费支持
| [1] |
National Bureau of Statisties of China. China statistical yearbook 2021[EB/OL]. [2022-01-02]. http://www.stats.gov.cn/tjsj/ndsj/2021/indexeh.htm.
|
| [2] |
王宇, 巩秀珍, 翟鸿瑞, 等. 认知损伤与老年人全死因死亡率关系的Meta分析[J]. 青岛大学学报: 医学版, 2021, 57(4): 544-550. Wang Y, Gong XZ, Zhai HR, et al. Association between cognitive impairment and all-cause mortality rate in the elderly: a Meta-analysis[J]. J Qingdao Univ: Med Sci, 2021, 57(4): 544-550. DOI:10.11712/jms.2096-5532.2021.57.047 |
| [3] |
An RP, Liu GG. Cognitive impairment and mortality among the oldest-old Chinese[J]. Int J Geriatr Psychiatry, 2016, 31(12): 1345-1353. DOI:10.1002/gps.4442 |
| [4] |
Yu WC, Chou MY, Peng LN, et al. Synergistic effects of cognitive impairment on physical disability in all-cause mortality among men aged 80 years and over: Results from longitudinal older veterans study[J]. PLoS One, 2017, 12(7): e0181741. DOI:10.1371/journal.pone.0181741 |
| [5] |
罗雅楠, 金鑫, 王振杰, 等. 女性老年人认知障碍与死亡风险的相关性研究[J]. 中华疾病控制杂志, 2018, 22(7): 692-695. Luo YN, Jin X, Wang ZJ, et al. Study on the correlation between cognitive impairment and mortality risk in Chinese elderly women[J]. Chin J Dis Control Prev, 2018, 22(7): 692-695. DOI:10.16462/j.cnki.zhjbkz.2018.07.009 |
| [6] |
An J, Li HB, Tang Z, et al. Cognitive impairment and risk of all-cause and cardiovascular disease mortality over 20-year follow-up: results from the BLSA[J]. J Am Heart Assoc, 2018, 7(15): e008252. DOI:10.1161/JAHA.117.008252 |
| [7] |
Hao QK, Dong BR, Yang M, et al. Frailty and cognitive impairment in predicting mortality among oldest-old people[J]. Front Aging Neurosci, 2018, 10: 295. DOI:10.3389/fnagi.2018.00295 |
| [8] |
Chen C, Liu YC, Cao ZJ, et al. Combined associations of hs-CRP and cognitive function with all-cause mortality among oldest-old adults in Chinese longevity areas: a prospective cohort study[J]. Immun Ageing, 2019, 16: 30. DOI:10.1186/s12979-019-0170-y |
| [9] |
Wang MC, Li TC, Li CI, et al. Cognitive function and its transitions in predicting all-cause mortality among urban community-dwelling older adults[J]. BMC Psychiatry, 2020, 20(1): 203. DOI:10.1186/s12888-020-02618-9 |
| [10] |
段俊. 我国高龄老人认知功能受损和下降与全因死亡的关联分析[D]. 合肥: 安徽医科大学, 2020. DOI: 10.26921/d.cnki.ganyu.2020.000541. Duan J. Association between cognitive impairment and decline on the all-cause mortality among the oldest old in China[D]. Hefei: Anhui Medical University, 2020. DOI: 10.26921/d.cnki.ganyu.2020.000541. |
| [11] |
Jia WP, Han K, Wang SS, et al. Associations between anemia, cognitive impairment, and all-cause mortality in oldest-old adults: a prospective population-based cohort study[J]. Front Med (Lausanne), 2021, 8: 613426. DOI:10.3389/fmed.2021.613426 |
| [12] |
Lee WJ, Peng LN, Liang CK, et al. Cognitive frailty predicting all-cause mortality among community-living older adults in Taiwan: A 4-year nationwide population-based cohort study[J]. PLoS One, 2018, 13(7): e0200447. DOI:10.1371/journal.pone.0200447 |
| [13] |
Stang A. Critical evaluation of the Newcastle-Ottawa scale for the assessment of the quality of nonrandomized studies in Meta-analyses[J]. Eur J Epidemiol, 2010, 25(9): 603-605. DOI:10.1007/s10654-010-9491-z |
| [14] |
Beeri MS, Lin HM, Sano M, et al. Association of the Haptoglobin gene polymorphism with cognitive function and decline in elderly African American adults with Type 2 diabetes: findings from the action to control cardiovascular risk in diabetes-memory in diabetes (ACCORD-MIND) study[J]. JAMA Network Open, 2018, 1(7): e184458. DOI:10.1001/jamanetworkopen.2018.4458 |
| [15] |
Muniz-Terrera G, Matthews FE, Stephan B, et al. Are terminal decline and its potential indicators detectable in population studies of the oldest old?[J]. Int J Geriatr Psychiatry, 2011, 26(6): 584-592. DOI:10.1002/gps.2566 |
| [16] |
Deary IJ. Looking for 'system integrity' in cognitive epidemiology[J]. Gerontology, 2012, 58(6): 545-553. DOI:10.1159/000341157 |
| [17] |
Fried LP, Ferrucci L, Darer J, et al. Untangling the concepts of disability, frailty, and comorbidity: implications for improved targeting and care[J]. J Gerontol A Biol Sci Med Sci, 2004, 59(3): 255-263. DOI:10.1093/gerona/59.3.m255 |
| [18] |
Bäckman L, MacDonald SWS. Death and cognition: synthesis and outlook[J]. Eur Psychol, 2006, 11(3): 224-235. DOI:10.1027/1016-9040.11.3.224 |
 2022, Vol. 43
2022, Vol. 43