文章信息
- 阮晓楠, 徐芊, 吴抗, 侯珊珊, 王小楠, 周鑫, 李智韬, 柯居中, 刘晓琳, 陈晓丹, 刘庆平, 林涛, 付朝伟, 王娜.
- Ruan Xiaonan, Xu Qian, Wu Kang, Hou Shanshan, Wang Xiaonan, Zhou Xin, Li Zhitao, Ke Juzhong, Liu Xiaolin, Chen Xiaodan, Liu Qingping, Lin Tao, Fu Chaowei, Wang Na
- 社区轻中度慢性阻塞性肺疾病患者BMI与自我报告急性加重关联的前瞻性研究
- Association of BMI with acute exacerbation in mild to moderate chronic obstructive pulmonary disease patients in community: a prospective study
- 中华流行病学杂志, 2022, 43(9): 1441-1447
- Chinese Journal of Epidemiology, 2022, 43(9): 1441-1447
- http://dx.doi.org/10.3760/cma.j.cn112338-20211130-00938
-
文章历史
收稿日期: 2021-11-30
2. 复旦大学浦东预防医学研究院, 上海 200136;
3. 复旦大学公共卫生学院流行病学教研室, 上海 200032
2. Pudong Preventive Medicine Research Institute, Fudan University, Shanghai 200136, China;
3. Department of Epidemiology, School of Public Health, Fudan University, Shanghai 200032, China
肥胖是心血管疾病、糖尿病和癌症的危险因素[1-3]。然而,近些年来,越来越多的研究发现,在患有心血管疾病或癌症的患者中,BMI超过正常水平的患者,其预后相较于BMI正常的患者更好,不良事件发生率及死亡率更低[4-5]。这一发现被命名为“肥胖悖论”,并在心血管疾病[5]、MS[6]甚至是癌症[7]的患者中广泛地观察到这种现象。慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是一种常见的慢性呼吸系统疾病,是全球导致成年人死亡的第四大死因[8]。近年来研究发现,在COPD患者中也存在“肥胖悖论”[9],即:在COPD患者的死亡率与BMI存在显著负相关,相较于BMI正常(BMI < 25.0 kg/m2)的患者,超重或者肥胖患者(BMI≥25.0 kg/m2)往往具有更高的生存率[10]。然而,目前关于肥胖对COPD患者急性加重影响的证据却相对有限。COPD急性加重是COPD患者最为主要的不良事件,其发生会加速患者肺功能下降[11],最终严重影响患者的健康状况,甚至会导致患者死亡[12]。避免和推迟患者急性加重的发生成为COPD患者治疗和管理的首要目标。此外,中国COPD患者主要以轻度及中度为主,重度和极重度患者仅占极少数[13],而针对轻中度COPD患者急性加重的研究相对较少。因此,本研究旨在通过前瞻性队列研究设计,研究社区轻中度COPD患者中,BMI对患者急性加重发生风险的影响。
对象与方法1. 研究对象:来源于上海市浦东新区2014年起建立的COPD患者信息登记系统[14],该系统囊括了当地二、三级医院诊断的COPD患者。采用整群随机抽样方法,选取浦东新区8家社区,将其辖区内登记的COPD患者纳入研究,纳入标准:①≥40岁;②患有轻度[一秒用力呼气容量(forced expiratory volume in one second,FEV1)]/用力肺活量(forced vital capacity,FVC) < 0.7且FEV1占预计值百分比(forced expiratory volume in one second predicted,FEV1%)≥80%或中度(FEV1/FVC < 0.7且50%≤FEV1%预计值< 80%)COPD;③在浦东新区居住两年以上的常住人口。排除标准:①近一个月内,病情不稳定或处于严重状态,如发生COPD急性加重、心脑血管疾病的急性加重、或进行过外科手术、严重的骨骼肌肉疾病导致无法参与现场调查等;②伴有哮喘或慢性支气管炎的研究对象;③未能签署知情同意书;④未能完成肺功能检查或问卷调查。基于上述标准,基线调查共纳入328名符合标准的研究对象。本研究通过复旦大学公共卫生学院伦理委员会审查(批准文号:IRB#2016-07- 0597)。
2. 基线调查:采用前瞻性队列研究的方法,对上述研究对象在2018年5-7月集中展开基线调查。调查内容:①面对面问卷调查:内容涵盖患者的基本人口学特征,包括年龄、性别、婚姻状况、受教育年限(> 9年vs. ≤9年)、人均家庭月收入、职业有害性气体暴露情况、主动吸烟情况(每天1支以上持续超过6个月)、被动吸烟(非吸烟者每天接触烟草烟雾15 min以上)、30 min以上规律性身体活动(指能量消耗高于休息时的新陈代谢水平的身体运动,包括且不限于各种交通性、休闲性、职业性身体活动,如骑车出行、太极拳、广场舞或家中务农等,每周不到1次vs.每周≥1次)、自报共患慢性病史(高血压、2型糖尿病、其他心血管疾病)、COPD诊断及治疗情况等(通过患者自报常规服用COPD常见治疗药物及其自报使用频率获得)。②体格测量与BMI及其分级:分别使用机械式体重秤及红外身高测量仪采集身着轻便衣服下测量的体重(kg)以及净足身高(cm),数据精确到小数点后一位,测量两次求得均值,进而以体重(kg)除以身高(m)的平方计算BMI,将其二分类分级(< 25.0 kg/m2 vs. ≥25.0 kg/m2)及三分位数分级[T1(≤23.1 kg/m2)、T2(23.2~kg/m2)及T3(≥26.3 kg/m2)]。③肺功能检测及其分级:依据《肺功能检查指南(第二部分)——肺量计检查》《肺功能检查(第四部分)——支气管舒张试验》的要求,采用便携式肺功能仪进行肺功能测定。COPD的分级依据2021年版《慢性阻塞性肺疾病全球倡议(GOLD指南)》,分为轻度(FEV1/FVC < 0.7且FEV1%预计值≥80%)或中度(FEV1/FVC < 0.7且50%≤FEV1%预计值< 80%)。上述基线调查内容,均由经过统一培训的现场工作人员完成。
3. 随访调查:2018年12月、2019年6月、2019年12月分别开展3次家庭医生随访调查,其中,第一、三次为电话随访,第二次为面对面调查。随访调查内容涉及结局变量急性加重发生情况以及其他重要协变量:①患者自报急性加重发生情况,包括随访期间是否发生急性加重,以及急性加重发生的次数。本研究采用基于“症状描述”的急性加重定义,指患者出现呼吸困难、咳痰量突然上升或突然出现浓痰等相关呼吸道症状,且持续至少48 h,一次这样的经历被认定为发生了一次“基于症状”的急性加重[15],在问卷中,使用“您一年内是否发生过急性加重,急性加重是指突然出现气喘、气短、呼吸困难、咳嗽咳痰量上升或出现浓痰等相关呼吸道症状,且持续48小时以上”这一问题收集急性加重的发生情况,由家庭医生向患者解释相关症状的描述后,通过面访调查患者获得。②第二次随访调查时,再次组织研究对象集中调查,测量患者的身高、体重,要求同基线。
4. 统计学分析:研究对象的基本信息采用例数(百分比)或x±s的方式呈现。根据数据分布不同,分别选择t检验以及χ2检验比较不同变量之间的组间差异,使用配对t检验比较患者基线和随访的BMI差异。考虑到急性加重可多次发生,采用多元负二项回归分析BMI与自我报告急性加重发生风险之间的关联[16]。在分析中,BMI分别作为连续性变量(变化单位分别为1及1个标准差)[17]、二分类变量及三分位数分类变量被依次纳入模型,BMI作为连续变量纳入模型时,所得IRR(incidence rate ratio)值的解释为:BMI取值每升高1个单位所带来的风险倍数。为使得这一趋势的估计更为稳健,可评估BMI每变化1个标准差(本研究为3.57)的增加所带来的相应风险。对单因素分析中与急性加重有关的因素,以及《慢性阻塞性肺疾病诊治指南(2021年版)》中涉及的COPD急性加重相关因素纳入多因素分析,包括年龄、性别、收入状况、吸烟、规律性身体活动、高血压及COPD病程。运用限制性立方样条法,控制可能的混杂因素后,绘制BMI与急性加重之间的剂量-反应关系图,若总趋势P < 0.05且非线性P < 0.05,表示存在非线性剂量-反应关系。为检验结果的稳定性,仅将轻度COPD患者纳入以进行敏感度分析,此外,还对男女性进行分层分析,以探讨性别与BMI对急性加重可能的交互作用。其结果以IRR值及其95%CI表示,以P < 0.05或95%CI未包含1.00为分析结果有统计学意义。所有数据采用EpiData 3.1软件进行双份录入,并通过R 4.02软件进行数据分析。
结果1. COPD患者基本信息:在328名参与基线调查的轻中度COPD患者中,295人完成3次18个月的随访,随访率为89.9%。研究对象基线特征见表 1。本研究对象以轻度COPD患者为主(96.3%,284/295),约半数患者年龄 > 65岁,32.5%的患者曾有一年以上职业有害性粉尘接触。38.9%(56/144)的男性患者目前仍在吸烟,高血压(41.6%)是患者中最为常见的慢性疾病。第二次随访时COPD患者的BMI与基线差异无统计学意义(P=0.558),因此下文BMI均指基线BMI。
随访期间,约11.1%(33/295)的患者报告发生过急性加重,其中,大多数(63.6%,21/33)在随访期间仅发生过1次急性加重,36.4%(12/33)发生过2次及以上急性加重。
2. COPD患者不同急性加重发生情况之间的BMI比较:在随访期间发生过急性加重的COPD患者,其平均BMI显著低于未发生者(22.8 kg/m2 vs. 24.8 kg/m2,P=0.002)(表 2)。未发生过急性加重的COPD患者中,BMI处于超重及以上组的比例高于发生过急性加重患者,且差异有统计学意义(P=0.026)。
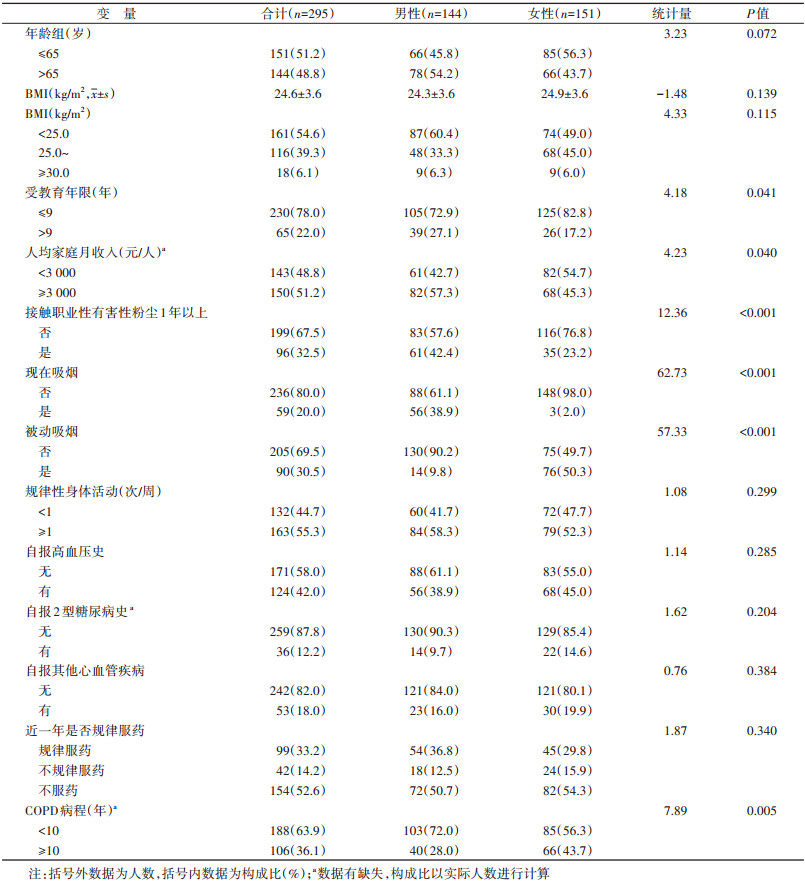
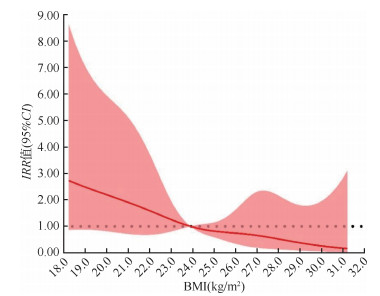
3. 急性加重发生风险与BMI之间的关联:单因素回归分析结果显示,较高的BMI(IRR=0.86,95%CI:0.76~0.95)及高收入水平(IRR=0.39,95%CI:0.18~0.81)与急性加重风险降低有关。校正可能的混杂因素后,多元负二项回归分析结果显示,轻中度COPD患者的基线BMI越高,其急性加重的发生风险越低(IRR=0.85,95%CI:0.73~0.98),处于超重或肥胖(BMI≥25.0)的患者,其急性加重的风险比正常组(BMI < 25.0)低(IRR=0.36,95%CI:0.13~0.91)。三分位数分组后,相比于BMI最低三分位数组(T1),中等BMI组(T2)COPD患者急性加重发生风险较低,且差异有统计学意义,但高BMI组并未发现明显保护作用。三分位数分组的趋势检验结果提示,趋势检验P=0.011,存在可能的剂量-反应关系(表 3)。限制性立方样条结果显示,BMI与急性加重风险间呈线性剂量-反应关系(总趋势P < 0.05,非线性P > 0.05)(图 1)。
|
| 图 1 社区轻中度慢性阻塞性肺疾病患者急性加重与BMI间的剂量-反应关系 |
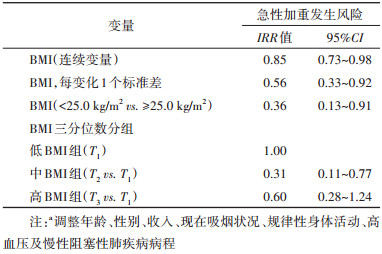
上述关联在仅纳入轻度COPD患者时依然存在。分层分析结果提示,男性COPD患者BMI对急性加重发生风险的影响相对不明显,仅在超重或肥胖组(BMI≥25.0 kg/m2)中起到显著的保护效果(BMI≥25.0 kg/m2,IRR=0.19,95%CI:0.03~0.87)。相比之下,女性COPD患者的急性加重发生风险随着BMI的增加而降低,且中度BMI组具有显著的保护效果,但BMI相关变量与性别之间无显著的交互作用[BMI:P=0.631;BMI(< 25.0 kg/m2 vs. ≥25.0 kg/m2):P=0.691;BMI(三分位数):P=0.578]。见表 4。
本研究结果显示,与基线BMI较低或正常的COPD患者相比,BMI水平较高者在18个月随访期间发生急性加重的风险更低,这种保护作用在中等BMI组更明显。这些结果与既往COPD有关肥胖悖论的研究相似[18]。
既往有研究显示,相比于一般人群,COPD患者肥胖比例更高[19]。这一比例在不同的研究中差异较大,介于14%~54%之间[20-23]。然而,本研究中仅6.1%的患者处于肥胖状态(BMI≥30.0 kg/m2),近四成患者超重,这一结果远低于既往的一些研究。可能的原因在于,一方面与研究对象COPD疾病严重程度构成有关,另一方面或与中国成年人整体肥胖比例相对较低有关。近来有研究发现,肥胖最常见于中度COPD患者[24],而本研究绝大多数患者为轻度COPD患者。此外,中国中老年人口的肥胖患病比例仅为2.8%~12.4%[25-27],本研究结果基本与之一致。
多因素分析结果显示,随着患者基线BMI的升高,其一年半内发生急性加重的风险随之降低。这一结果与既往发现的COPD患者中BMI对死亡率或生存率的影响一致,也被称作“肥胖悖论”[9-10]。某些研究中这种对急性加重发生的保护作用甚至出现于极高BMI组(BMI≥35 kg/m2)[28]。而本研究仅在中等BMI组(BMI:23.2~26.2 kg/m2)中发现较为明显的保护效果。这可能归因于本研究中较低的肥胖患病比例,即高BMI患者样本数量相对较少。另一方面,或许与肥胖悖论的“U”形曲线有关。有研究表明,BMI的影响可能是“U”形的,即两段(极低或极高)都会带来健康危害[29]。
尽管亚组分析结果提示,BMI对COPD急性加重的保护效果在男女性之间无交互作用,但仍有潜在的生理学机制支持这种可能存在的微弱差异。既往研究表明,臀股部位的脂肪与瘦素及脂联蛋白水平呈正相关,且与炎性细胞因子水平呈负相关,提示了臀股部位的脂肪在“肥胖悖论”可能起到的作用[30]。而周围性脂肪的分布在男女性之间存在显著差异。Paeratakul等[31]的研究结果表明,女性三头肌的皮褶厚度和上臂中部脂肪区高于男性,提示女性在相同BMI下,周围性脂肪分布(包括臀部或大腿周围脂肪)较男性更多。后续基于大样本的研究可对此开展进一步研究。
目前,有许多理论支持和解释COPD患者中存在的肥胖悖论。一些研究者注意到肥胖有助于减缓FEV1的下降[32],以及减少患者发生过度通气的情况[33]。另一种可能的解释是高BMI对肺弹性回缩能力起到一定的保护作用[34],而肺弹性回缩能力通常与COPD患者的肺功能以及疾病进展有关[35]。由于COPD急性加重通常与炎症作用有关[12],臀股部脂肪对炎症的积极作用也可能是肥胖对COPD急性加重保护作用的合理解释之一[30]。此外,也有观点认为,并非是肥胖具有保护作用,而是相比之下,低BMI带来的有害影响更大[36-37]。上述观点有待进一步研究证实。
本研究是一项国内较少的基于社区COPD患者,尤其轻中度患者开展的前瞻性队列研究,其随访间隔相对密集,避免了相关的信息遗漏。但本研究仍存在以下不足或局限:①本研究未进行其他身体成分测量,如去脂BMI指数和/或肌肉含量,这些指数相比于BMI可能提供更多的信息;②对轻度或中度COPD患者而言,18个月的随访时间可能仍相对较短,无法观察到更多的急性加重发生;③急性加重信息收集来源于患者自报,可能存在的漏报和误报会低估急性加重的发生率;④本研究患者临床诊治信息存在回忆偏倚或未接受COPD治疗,而无法得出可靠分析结果。
综上所述,本研究对社区轻中度COPD患者的前瞻性队列研究发现,急性加重的风险会随着BMI的升高而下降,但本研究并未发现极高BMI对急性加重发生风险存在显著影响。
利益冲突 所有作者声明无利益冲突
作者贡献声明 阮晓楠:研究设计、研究指导、论文修改、经费支持;徐芊:统计学分析、数据整理、论文撰写及修改;吴抗:现场调查、数据收集、数据整理;侯珊珊:统计学分析,数据整理;王小楠、周鑫、李智韬、柯居中、刘晓琳、陈晓丹、刘庆平、林涛:现场调查;付朝伟、王娜:研究设计、研究指导、论文修改
| [1] |
Lavie CJ, de Schutter A, Parto P, et al. Obesity and prevalence of cardiovascular diseases and prognosis—the obesity paradox updated[J]. Prog Cardiovasc Dis, 2016, 58(5): 537-547. DOI:10.1016/j.pcad.2016.01.008 |
| [2] |
Lavie CJ, Sharma A, Alpert MA, et al. Update on obesity and obesity paradox in heart failure[J]. Prog Cardiovasc Dis, 2016, 58(4): 393-400. DOI:10.1016/j.pcad.2015.12.003 |
| [3] |
Chan DSM, Vieira AR, Aune D, et al. Body mass index and survival in women with breast cancer-systematic literature review and meta-analysis of 82 follow-up studies[J]. Ann Oncol, 2014, 25(10): 1901-1914. DOI:10.1093/annonc/mdu042 |
| [4] |
Konishi T, Fujiogi M, Michihata N, et al. Impact of body mass index on outcomes after breast cancer surgery: nationwide inpatient database study in Japan[J]. Clin Breast Cancer, 2020, 20(6): e663-674. DOI:10.1016/j.clbc.2020.05.002 |
| [5] |
刘雪娇, 王炳源, 任永成, 等. 高血压人群中体质指数与全死因死亡风险的队列研究[J]. 中华流行病学杂志, 2018, 39(7): 914-919. Liu XJ, Wang BY, Ren YC, et al. A cohort study on body mass index and risk of all-cause mortality among hypertensive population[J]. Chin J Epidemiol, 2018, 39(7): 914-919. DOI:10.3760/cma.j.issn.0254-6450.2018.07.010 |
| [6] |
Tobias DK, Pan A, Jackson CL, 等. 体质指数与成人2型糖尿病的病死率[J]. 蔡梦茵, 译. 中华糖尿病杂志, 2014, 6(5): 355-356. Tobias DK, Pan A, Jackson CL, et al. Body-mass index and mortality among adults with incident type 2 diabetes[J]. Cai MY, trans. Chin J Diabetes Mellitus, 2014, 6(5): 355-356. |
| [7] |
Tsang NM, Pai PC, Chuang CC, et al. Overweight and obesity predict better overall survival rates in cancer patients with distant metastases[J]. Cancer Med, 2016, 5(4): 665-675. DOI:10.1002/cam4.634 |
| [8] |
Asia Pacific COPD Roundtable Group. Global Initiative for Chronic Obstructive Lung Disease strategy for the diagnosis, management and prevention of chronic obstructive pulmonary disease: an Asia-Pacific perspective[J]. Respirology, 2005, 10(1): 9-17. DOI:10.1111/j.1440-1843.2005.00692.x |
| [9] |
黄翔, 吴华容, 陈文震. 慢性阻塞性肺疾病患者的"肥胖悖论"[C]//中华医学会急诊医学分会第17次全国急诊医学学术年会论文集. 西宁: 中华医学会, 2014: 1. Huang X, Wu HR, Chen WZ. Obesity paradox in patients with chronic obstructive pulmonary disease[C]//Proceedings of 17th annual congress of the Chinese society for emergency medicine. Xining: Chinese Medical Association, 2014: 1. |
| [10] |
Ji ZC, de Miguel-Díez J, Castro-Riera CR, et al. Differences in the outcome of patients with COPD according to body mass index[J]. J Clin Med, 2020, 9(3): 710. DOI:10.3390/jcm9030710 |
| [11] |
Fletcher C, Peto R. The natural history of chronic airflow obstruction[J]. Br Med J, 1977, 1(6077): 1645-1648. DOI:10.1136/bmj.1.6077.1645 |
| [12] |
Ko FW, Chan KP, Hui DS, et al. Acute exacerbation of COPD[J]. Respirology, 2016, 21(7): 1152-1165. DOI:10.1111/resp.12780 |
| [13] |
Fang LW, Gao P, Bao HL, et al. Chronic obstructive pulmonary disease in China: a nationwide prevalence study[J]. Lancet Respir Med, 2018, 6(6): 421-430. DOI:10.1016/S2213-2600(18)30103-6 |
| [14] |
Xiao T, Qiu H, Chen Y, et al. Prevalence of anxiety and depression symptoms and their associated factors in mild COPD patients from community settings, Shanghai, China: a cross-sectional study[J]. BMC Psychiatry, 2018, 18(1): 89. DOI:10.1186/s12888-018-1671-5 |
| [15] |
Shorofsky M, Bourbeau J, Kimoff J, et al. Impaired sleep quality in COPD is associated with exacerbations: the CanCOLD cohort study[J]. Chest, 2019, 156(5): 852-863. DOI:10.1016/j.chest.2019.04.132 |
| [16] |
Keene ON, Calverley PMA, Jones PW, et al. Statistical analysis of exacerbation rates in COPD: TRISTAN and ISOLDE revisited[J]. Eur Respir J, 2008, 32(1): 17-24. DOI:10.1183/09031936.00161507 |
| [17] |
Mody P, Joshi PH, Khera A, et al. Beyond coronary calcification, family history, and C-reactive protein: cholesterol efflux capacity and cardiovascular risk prediction[J]. J Am Coll Cardiol, 2016, 67(21): 2480-2487. DOI:10.1016/j.jacc.2016.03.538 |
| [18] |
Spelta F, Pasini AMF, Cazzoletti L, et al. Body weight and mortality in COPD: focus on the obesity paradox[J]. Eat Weight Disord, 2018, 23(1): 15-22. DOI:10.1007/s40519-017-0456-z |
| [19] |
McDonald VM, Wood LG, Holland AE, et al. Obesity in COPD: to treat or not to treat?[J]. Expert Rev Respir Med, 2017, 11(2): 81-83. DOI:10.1080/17476348.2017.1267570 |
| [20] |
Eisner MD, Blanc PD, Sidney S, et al. Body composition and functional limitation in COPD[J]. Respir Res, 2007, 8(1): 7. DOI:10.1186/1465-9921-8-7 |
| [21] |
de Oca MM, Tálamo C, Perez-Padilla R, et al. Chronic obstructive pulmonary disease and body mass index in five Latin America cities: the PLATINO study[J]. Respir Med, 2008, 102(5): 642-650. DOI:10.1016/j.rmed.2007.12.025 |
| [22] |
Vanfleteren LEGW, Spruit MA, Groenen M, et al. Clusters of comorbidities based on validated objective measurements and systemic inflammation in patients with chronic obstructive pulmonary disease[J]. Am J Respir Crit Care Med, 2013, 187(7): 728-735. DOI:10.1164/rccm.201209-1665OC |
| [23] |
Hallin R, Gudmundsson G, Ulrik CS, et al. Nutritional status and long-term mortality in hospitalised patients with chronic obstructive pulmonary disease (COPD)[J]. Respir Med, 2007, 101(9): 1954-1960. DOI:10.1016/j.rmed.2007.04.009 |
| [24] |
Zhu J, Zhao ZL, Wu B, et al. Effect of body mass index on lung function in chinese patients with chronic obstructive pulmonary disease: a multicenter cross-sectional study[J]. Int J Chron Obstruct Pulmon Dis, 2020, 15: 2477-2486. DOI:10.2147/COPD.S265676 |
| [25] |
Reynolds K, Gu DF, Whelton PK, et al. Prevalence and risk factors of overweight and obesity in China[J]. Obesity (Silver Spring), 2007, 15(1): 10-18. DOI:10.1038/oby.2007.527 |
| [26] |
张梅, 姜勇, 李镒冲, 等. 2010年我国≥60岁老年人超重/肥胖流行特征[J]. 中华流行病学杂志, 2014, 35(4): 365-369. Zhang M, Jiang Y, Li YC, et al. Prevalence of overweight and obesity among Chinese elderly aged 60 and above in 2010[J]. Chin J Epidemiol, 2014, 35(4): 365-369. DOI:10.3760/cma.j.issn.0254-6450.2014.04.005 |
| [27] |
王义艳, 何耀, 姜斌, 等. 2001-2010年北京城市社区老年人群体重变迁及其危险因素变化的研究[J]. 中华流行病学杂志, 2014, 35(4): 359-364. Wang YY, He Y, Jiang B, et al. Study on the secular changes of BMI, prevalence rates of overweight, obesity and related factors in an urban elderly population, Beijing from 2001 to 2010[J]. Chin J Epidemiol, 2014, 35(4): 359-364. DOI:10.3760/cma.j.issn.0254-6450.2014.04.004 |
| [28] |
Smulders L, van der Aalst A, Neuhaus EDET, et al. Decreased risk of COPD exacerbations in obese patients[J]. COPD: J Chronic Obstructive Pulmonary Dis, 2020, 17(5): 485-491. DOI:10.1080/15412555.2020.1799963 |
| [29] |
Divo MJ, Cabrera C, Casanova C, et al. Comorbidity distribution, clinical expression and survival in COPD patients with different body mass index[J]. Chronic Obstr Pulm Dis, 2014, 1(2): 229-238. DOI:10.15326/jcopdf.1.2.2014.0117 |
| [30] |
Manolopoulos KN, Karpe F, Frayn KN. Gluteofemoral body fat as a determinant of metabolic health[J]. Int J Obes (Lond), 2010, 34(6): 949-959. DOI:10.1038/ijo.2009.286 |
| [31] |
Paeratakul S, Adair LS, Zhai F, et al. Sex difference in measures of body fatness and the possible difference in the effect of dietary fat on body fatness in men and women[J]. Eur J Clin Nutr, 1999, 53(11): 865-871. DOI:10.1038/sj.ejcn.1600867 |
| [32] |
Sun YL, Milne S, Jaw JE, et al. BMI is associated with FEV1 decline in chronic obstructive pulmonary disease: a meta-analysis of clinical trials[J]. Respir Res, 2019, 20(1): 236. DOI:10.1186/s12931-019-1209-5 |
| [33] |
Sava F, Laviolette L, Bernard S, et al. The impact of obesity on walking and cycling performance and response to pulmonary rehabilitation in COPD[J]. BMC Pulm Med, 2010, 10: 55. DOI:10.1186/1471-2466-10-55 |
| [34] |
Pellegrino R, Gobbi A, Antonelli A, et al. Ventilation heterogeneity in obesity[J]. J Appl Physiol (1985), 2014, 116(9): 1175-1181. DOI:10.1152/japplphysiol.01339.2013 |
| [35] |
O'donnell DE, Laveneziana P. The clinical importance of dynamic lung hyperinflation in COPD[J]. COPD: J Chronic Obstructive Pulmonary Dis, 2006, 3(4): 219-232. DOI:10.1080/15412550600977478 |
| [36] |
Yang RL, Cheung MC, Pedroso FE, et al. Obesity and weight loss at presentation of lung cancer are associated with opposite effects on survival[J]. J Surg Res, 2011, 170(1): e75-83. DOI:10.1016/j.jss.2011.04.061 |
| [37] |
Win T, Ritchie AJ, Wells FC, et al. The incidence and impact of low body mass index on patients with operable lung cancer[J]. Clin Nutr, 2007, 26(4): 440-443. DOI:10.1016/j.clnu.2007.01.009 |
 2022, Vol. 43
2022, Vol. 43