文章信息
- 周业胜, 罗柳红, 林玫, 陈宏利, 黄精华, 朱秋映, 陈欢欢, 沈智勇, 李剑军, 冯毅, 李丹, 廖玲洁, 邢辉, 邵一鸣, 阮玉华, 蓝光华.
- Zhou Yesheng, Luo Liuhong, Lin Mei, Chen Hongli, Huang Jinghua, Zhu Qiuying, Chen Huanhuan, Shen Zhiyong, Li Jianjun, Feng Yi, Li Dan, Liao Lingjie, Xing Hui, Shao Yiming, Ruan Yuhua, Lan Guanghua
- 广西壮族自治区2004-2019年初始抗病毒治疗儿童HIV感染者死亡和脱失情况分析
- Factors associated with death and attrition in HIV-infected children under initial antiretroviral therapy in Guangxi Zhuang Autonomous Region, 2004 - 2019
- 中华流行病学杂志, 2022, 43(9): 1430-1435
- Chinese Journal of Epidemiology, 2022, 43(9): 1430-1435
- http://dx.doi.org/10.3760/cma.j.cn112338-20220112-00027
-
文章历史
收稿日期: 2022-01-12
2. 广西壮族自治区疾病预防控制中心, 广西重大传染病防控与生物安全应急响应重点实验室, 南宁 530028
2. Guangxi Key Laboratory for Major Infectious Diseases Prevention and Control and Biosafety Emergency Response, Guangxi Zhuang Autonomous Region Center for Disease Control and Prevention, Nanning 530028, China
儿童感染HIV后与成年人相比,免疫损伤严重,机会感染率高,疾病进展快且病死率也较高。抗病毒治疗(ART)可有效降低HIV感染者病毒载量,提高CD4+T淋巴细胞(CD4)计数,延缓艾滋病发病、减少机会性感染和降低死亡风险并改善生活质量[1-3]。ART脱失者病毒载量和耐药率均高,并且与未ART组的二代传播风险差异无统计学意义[4-5]。目前,我国开展较大样本量的ART儿童HIV感染者的死亡情况及其影响因素的研究很少,脱失情况未见相关研究报道。广西壮族自治区(广西)是我国艾滋病流行重点地区之一[6],也是全国较早开展儿童ART的地区之一,孕妇及儿童HIV感染者基数较大[7]。本研究分析广西2004-2019年初始ART儿童HIV感染者的死亡和脱失情况及其影响因素,为进一步提高ART效果提供参考依据。
对象与方法1. 研究对象:来自我国艾滋病综合防治信息系统ART数据库。纳入标准:①2004-2019年广西初始ART儿童HIV感染者,年龄 < 15岁;②ART时间≥1年。排除标准:基线和随访信息缺失。
2. 研究方法:采用回顾性队列研究。研究变量包括年龄、性别、感染途径、基线WHO临床分期、基线CD4计数、基线年龄别体重Z评分、基线血红蛋白、基线肺结核、初始ART方案、最近ART方案和初始ART时间。研究起点为儿童HIV感染者开始ART日期,随访终点为2021年5月31日。随访期间根据随访状态分为在治、失访、死亡、转出、停药和转为成年人治疗,脱失包括停药和失访。通过ART编号将儿童ART数据库与疫情库关联,用以判定儿童HIV感染者是否死亡或脱失,以儿童ART数据库中最近1次停药或失访作为脱失的定义。儿童ART方案包括AZT+3TC+EFV/NVP(含AZT)、D4T+3TC+NVP/EFV(含D4T)、TDF+3TC+NVP/EFV(含TDF)、ABC+3TC+NVP/EFV(含ABC)和LPV/r+3TC+AZT/D4T/TDF/ABC(含LPV/r)。
3. 统计学分析:本研究将死亡作为初始ART儿童HIV感染者结局事件时,在治、失访、转出、停药及转为成年人治疗作为结尾删失;将脱失作为另一个结局事件时,在治、死亡、转出、及转为成年人治疗作为结尾删失。生存时间的计算为开始ART时间至结局事件的时间。删失数据生存时间的计算为开始ART时间至删失事件的时间。采用SAS 9.4软件对数据进行整理和分析,用Cox比例风险回归模型分别对研究对象的死亡和脱失进行单因素和多因素分析,将单因素分析中有统计学意义的自变量进行多因素分析,P < 0.05为差异有统计学意义,双侧检验。
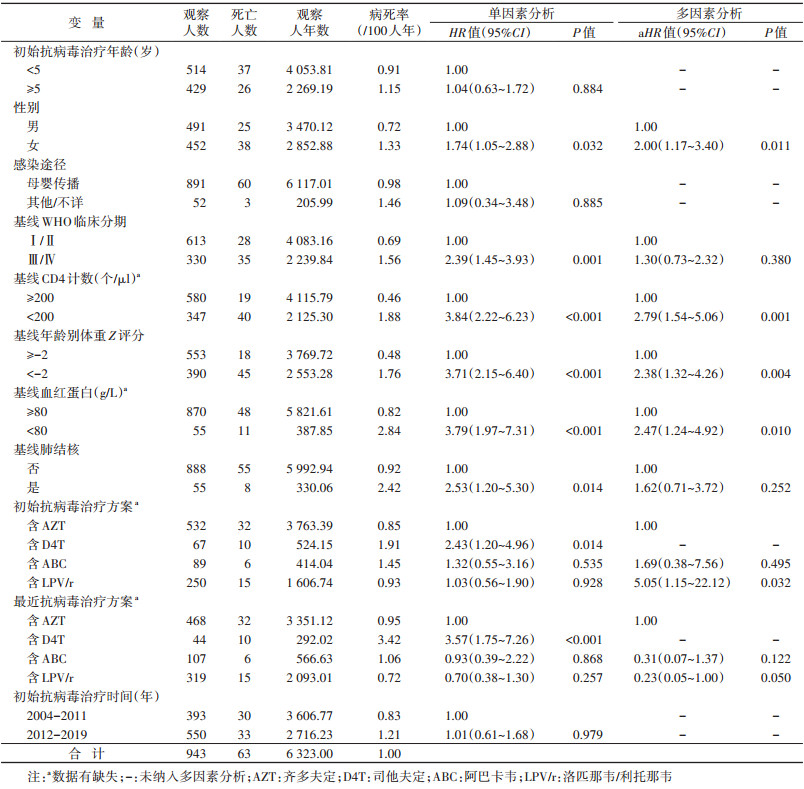
结果1. 基线情况:2004-2019年广西初始ART儿童HIV感染者共945例,排除HIV确证日期缺失者2例,研究最终纳入943例。研究对象HIV确证年龄为(4.36±3.13)岁,初始ART年龄为(5.27±3.37)岁,男性占52.1%(491/943),母婴传播占94.5%(891/943),基线WHO临床分期为Ⅰ/Ⅱ期占65.0%(613/943),基线CD4计数≥200个/μl占61.5%(580/943),基线年龄别体重Z评分≥-2占58.6%(553/943),基线血红蛋白≥80 g/L占92.3%(870/943),基线肺结核占5.8%(55/943)。初始ART方案含AZT的占56.4%(532/943),治疗后最近治疗方案含AZT的占49.6%(468/943),2012-2019年初始ART的占58.3%(550/943)。见表 1。
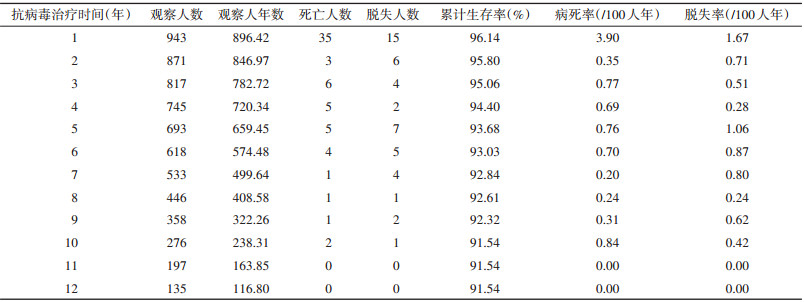
2. 死亡情况:截至2021年5月31日,研究对象共随访6 323.00人年,在治603例(4 232.21人年),死亡63例(130.97人年);ART数据库里脱失而疫情库里死亡的有8例,失访19例(62.82人年),停药30例(112.71人年),转出17例(66.19人年),转为成年人治疗211例(1 718.11人年)。研究对象总体病死率为1.00/100人年,初始治疗后第1~5年的病死率分别是3.90/100人年、0.35/100人年、0.77/100人年、0.69/100人年和0.76/100人年。初始治疗后第1、2、5和10年的累计生存率分别为96.14%、95.80%、93.68%和91.54%。见表 2。多因素Cox比例风险回归分析结果显示,女性(aHR=2.00,95%CI:1.17~3.40)、基线CD4计数 < 200个/μl(aHR=2.79,95%CI:1.54~5.06)、基线年龄别体重Z评分 < -2(aHR=2.38,95%CI:1.32~4.26)、基线血红蛋白 < 80 g/L(aHR=2.47,95%CI:1.24~4.92)和初始ART方案含LPV/r(aHR=5.05,95%CI:1.15~22.12)是儿童HIV感染者死亡的关联性因素。见表 1。
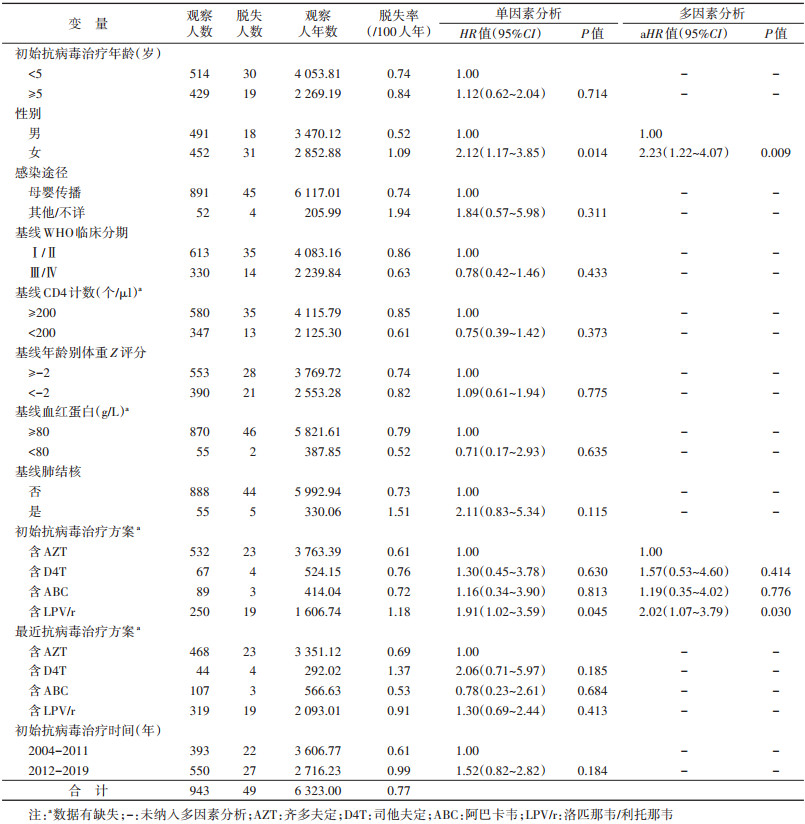
3. 脱失情况:研究对象总体脱失率为0.77/100人年,初始治疗后第1~5年的脱失率分别是1.67/100人年、0.71/100人年、0.51/100人年、0.28/100人年和1.06/100人年。见表 2。多因素Cox比例风险回归分析结果显示,相比于男性、初始ART方案含AZT,女性(aHR=2.23,95%CI:1.22~4.07)和初始ART方案含LPV/r(aHR=2.02,95%CI:1.07~3.79)是儿童HIV感染者脱失的关联性因素。见表 3。
本研究通过较大样本量和较长随访时间的回顾性队列研究,分析广西2004-2019年初始ART儿童HIV感染者死亡和脱失情况,对提高其ART效果具有一定的科学指导作用。本研究发现,2004-2019年我国广西初始ART儿童HIV感染者总体死亡率为1.00/100人年。津巴布韦2013-2014年、尼日利亚2003-2019年和泰国2008-2013年接受ART儿童HIV感染者的死亡率分别为2.86/100人年、1.82/100人年和2.10/100人年[8-10]。欧洲等中、高收入国家为期17年和荷兰为期16年的ART儿童HIV感染者回顾性队列研究的总体死亡率分别为0.45/100人年和0.30/100人年[11-12]。我国2005-2010年和云南省2005-2015年ART儿童HIV感染者的死亡率分别为2.31/100人年和0.83/100人年[13-14]。我国早期的ART儿童HIV感染者死亡率较高,本研究的总体死亡率高于中、高收入国家,低于低收入国家。本研究对象在初始ART后第1、2、5和10年的累计生存率高于印度及我国河南省[15-16],但低于欧洲等中、高收入国家[11]。本研究对象的死亡主要发生在初始ART后第1年(占55.6%),与国内外多项研究结果相似[11, 16]。应减少初始ART后第1年ART儿童的死亡风险。
本研究发现,接受ART的女童HIV感染者的死亡风险是男童的2倍,这与Kariminia等[17]研究结果相似。尽管有研究报道,接受ART的女童HIV感染者较容易发生病毒抑制失败、免疫学失败和获得性耐药相关突变[18-19],但印度和我国云南省、河南省等地区的相关研究均未见死亡率与性别有关[14-16]。本研究基线CD4计数低和基线年龄别体重Z评分低及基线血红蛋白低与儿童HIV感染者死亡有关联,这与其他研究结果相似[11, 13-14]。说明早发现、早治疗、加强营养评价和提供营养支持及纠正贫血的重要性。本研究的多因素分析结果未发现基线肺结核与死亡的统计学关联,说明HIV合并肺结核患儿治疗效果良好。
本研究对象的总体脱失率为0.77/100人年,目前未见国内相关研究报道。本研究对象的脱失率低于尼日利亚(8.94/100人年)[9]和埃塞俄比亚(4.50/100人年)[20],也低于泰国(2.90/100人年)[10]和缅甸(1.43/100人年)[21]等东南亚国家。本研究还发现ART女童HIV感染者更容易发生脱失,这与Kariminia等[17]研究结果基本一致,但是,性别与ART儿童HIV感染者脱失关系尚需进一步研究。初始ART后第1年脱失率最高,与既往研究结果相似[9, 20],说明初始ART后第1年是ART关键时期。
本研究还发现,含LPV/r初始治疗方案的死亡率和脱失率均高于其他方案。虽然蛋白酶抑制剂的抗病毒效果良好,但该方案在ART早期容易引起胃肠道不良反应等副反应[22-23],导致服药依从性差。在开展ART医护人员培训、宣传教育时应包括补充这些知识。
本研究对象的母婴传播占94.5%,HIV确证年龄(4.36±3.13)岁较大,初始ART年龄(5.27±3.37)岁,存在获得HIV确证和ART延迟问题,应针对性加强措施解决影响HIV感染者生存质量的问题。
本研究存在不足。少数自变量存在少量的数据缺失,可能对研究结果影响较小。
综上所述,广西儿童HIV感染者ART效果较好,但初始ART后第1年病死率和脱失率较高。需针对死亡和脱失的影响因素,加强医护人员培训和儿童HIV感染者及其父母宣传教育以提高ART效果。
利益冲突 所有作者声明无利益冲突
作者贡献声明 周业胜、罗柳红、林玫:数据分析、论文撰写;陈宏利、黄精华、朱秋映、陈欢欢:数据整理和统计学分析;沈智勇、李剑军、冯毅、李丹、廖玲洁、邢辉、邵一鸣、阮玉华、蓝光华:研究指导、论文修改、经费支持
| [1] |
尹浩, 马烨, 杨萱, 等. 我国14岁及以下HIV感染儿童生存分析[J]. 中华流行病学杂志, 2020, 41(6): 850-855. Yin H, Ma Y, Yang X, et al. Survival analysis on HIV-infected children aged 14 years old and younger in China[J]. Chin J Epidemiol, 2020, 41(6): 850-855. DOI:10.3760/cma.j.cn112338-20191129-00844 |
| [2] |
周信娟, 朱秋映, 阮玉华, 等. 广西儿童HIV/AIDS病人抗病毒治疗的免疫学效果及对其生长发育的影响[J]. 中国艾滋病性病, 2018, 24(2): 125-128. Zhou XJ, Zhu QY, Ruan YH, et al. Analysis of immunological effect and influence on growth and development of antiretroviral therapy for children with HIV/AIDS in Guangxi[J]. Chin J AIDS STD, 2018, 24(2): 125-128. DOI:10.13419/j.cnki.aids.2018.02.05 |
| [3] |
李景越. 2011-2019年河南省南阳市112例儿童艾滋病抗病毒治疗效果分析[J]. 疾病监测, 2020, 35(9): 815-818. Li JY. Effects of antiviral therapy in 112 child AIDS cases in Nanyang, Henan[J]. Dis Surveill, 2020, 35(9): 815-818. DOI:10.3784/j.issn.1003-9961.2020.09.010 |
| [4] |
Kang RH, Li JJ, Chen HH, et al. Using longitudinal genetic-network study to understand HIV treatment- as-prevention[J]. AIDS, 2021, 35(6): 947-955. DOI:10.1097/QAD.0000000000002812 |
| [5] |
刘磊, 左中宝, 廖玲洁, 等. 中国部分地区HIV抗病毒治疗停药患者的耐药研究[J]. 热带医学杂志, 2018, 18(12): 1613-1618, 1634. Liu L, Zuo ZB, Liao LJ, et al. The drug resistance in HIV/AIDS patients who had stopped ART in 2016[J]. J Trop Med, 2018, 18(12): 1613-1618, 1634. DOI:10.3969/j.issn.1672-3619.2018.12.018 |
| [6] |
Chen HH, Luo LH, Pan SW, et al. HIV Epidemiology and prevention in southwestern China: trends from 1996-2017[J]. Curr HIV Res, 2019, 17(2): 85-93. DOI:10.2174/1570162X17666190703163838 |
| [7] |
姜金茹, 周玉博, 李宏田, 等. 2016年中国孕产妇艾滋病病毒感染空间分布特征[J]. 中华医学杂志, 2018, 98(41): 3360-3364. Jiang JR, Zhou YB, Li HT, et al. HIV epidemic among pregnant women in China, 2016: trend and spatial analysis[J]. Natl Med J China, 2018, 98(41): 3360-3364. DOI:10.3760/cma.j.issn.0376-2491.2018.41.014 |
| [8] |
McHugh G, Simms V, Dauya E, et al. Clinical outcomes in children and adolescents initiating antiretroviral therapy in decentralized healthcare settings in Zimbabwe[J]. J Int AIDS Soc, 2017, 20(1): 21843. DOI:10.7448/IAS.20.1.21843 |
| [9] |
Onubogu CU, Ugochukwu EF. A 17 year experience of attrition from care among HIV infected children in Nnewi South-East Nigeria[J]. BMC Infect Dis, 2021, 21(1): 409. DOI:10.1186/s12879-021-06099-3 |
| [10] |
Teeraananchai S, Kerr SJ, Puthanakit T, et al. Attrition and mortality of children receiving antiretroviral treatment through the universal coverage health program in Thailand[J]. J Pediatr, 2017, 188: 210-216.e1. DOI:10.1016/j.jpeds.2017.05.035 |
| [11] |
The European Pregnancy and Paediatric HIV Cohort Collaboration, Judd A, Chappell E, et al. Long-term trends in mortality and AIDS-defining events after combination ART initiation among children and adolescents with perinatal HIV infection in 17 middle- and high-income countries in Europe and Thailand: a cohort study[J]. PLoS Med, 2018, 15(1): e1002491. DOI:10.1371/journal.pmed.1002491 |
| [12] |
Cohen S, Smit C, van Rossum AMC, et al. Long-term response to combination antiretroviral therapy in HIV-infected children in the Netherlands registered from 1996 to 2012[J]. AIDS, 2013, 27(16): 2567-2575. DOI:10.1097/01.aids.0000432451.75980.1b |
| [13] |
Zhao Y, Li CM, Sun X, et al. Mortality and treatment outcomes of China's National Pediatric antiretroviral therapy program[J]. Clin Infect Dis, 2013, 56(5): 735-744. DOI:10.1093/cid/cis941 |
| [14] |
杨壁珲, 张米, 舒远路, 等. 云南省接受抗病毒治疗的艾滋病患儿10年死亡风险及其预测因素分析[J]. 中华传染病杂志, 2019, 37(1): 28-31. Yang BH, Zhang M, Shu YL, et al. Risks and predictors of mortality among human immunodeficiency virus-infected children receiving highly active antiretroviral therapy in Yunnan Province[J]. Chin J Infect Dis, 2019, 37(1): 28-31. DOI:10.3760/cma.j.issn.1000-6680.2019.01.005 |
| [15] |
Acharya S, Palkar A, Sayed AP, et al. Retrospective cohort analysis of survival of children living with HIV/AIDS in Mumbai, India[J]. BMJ Open, 2021, 11(9): e050534. DOI:10.1136/bmjopen-2021-050534 |
| [16] |
孙定勇, 杨文杰, 马彦民, 等. 2003–2014年河南省14岁及以下艾滋病抗病毒治疗患者生存分析[J]. 中华预防医学杂志, 2015, 49(8): 700-704. Sun DY, Yang WJ, Ma YM, et al. Survival analysis of the AIDS patients under 14 years of age and receiving antiretroviral treatment in Henan province from 2003 to 2014[J]. Chin J Prev Med, 2015, 49(8): 700-704. DOI:10.3760/cma.j.issn.0253-9624.2015.08.007 |
| [17] |
Kariminia A, Law M, Davies MA, et al. Mortality and losses to follow-up among adolescents living with HIV in the IeDEA global cohort collaboration[J]. J Int AIDS Soc, 2018, 21(12): e25215. DOI:10.1002/jia2.25215 |
| [18] |
Fenta DA, Wube TB, Nuru MM. Long-term immunological and virological outcomes in children receiving highly active antiretroviral therapy at hawassa university college of medicine and health sciences, southern Ethiopia[J]. J Immunol Res, 2021, 2021, 2498025. DOI:10.1155/2021/2498025 |
| [19] |
Muri L, Gamell A, Ntamatungiro AJ, et al. Development of HIV drug resistance and therapeutic failure in children and adolescents in rural Tanzania: an emerging public health concern[J]. AIDS, 2017, 31(1): 61-70. DOI:10.1097/QAD.0000000000001273 |
| [20] |
Hibstie YT, Kibret GD, Talie A, et al. Nearly one in every six HIV-infected children lost from ART follow-up at Debre Markos Referral Hospital, Northwest Ethiopia: a 14-year retrospective follow-up study[J]. PLoS One, 2020, 15(9): e0239013. DOI:10.1371/journal.pone.0239013 |
| [21] |
Nyunt KKK, Han WW, Satyanarayana S, et al. Factors associated with death and loss to follow-up in children on antiretroviral care in Mingalardon Specialist Hospital, Myanmar, 2006-2016[J]. PLoS One, 2018, 13(4): e0195435. DOI:10.1371/journal.pone.0195435 |
| [22] |
Pasipanodya B, Kuwengwa R, Prust ML, et al. Assessing the adoption of lopinavir/ritonavir oral pellets for HIV-positive children in Zimbabwe[J]. J Int AIDS Soc, 2018, 21(12): e25214. DOI:10.1002/jia2.25214 |
| [23] |
Kang RH, Luo LH, Chen HH, et al. Treatment outcomes of initial differential antiretroviral regimens among HIV patients in Southwest China: comparison from an observational cohort study[J]. BMJ Open, 2019, 9(3): e025666. DOI:10.1136/bmjopen-2018-025666 |
 2022, Vol. 43
2022, Vol. 43