文章信息
- 牛丹丹, 汤后林, 陈方方, 肖体呈, 陈晨, 刘宏, 吕繁.
- Niu Dandan, Tang Houlin, Chen Fangfang, Xiao Ticheng, Chen Chen, Liu Hong, Lyu Fan
- 多状态马尔科夫模型分析四川省泸州市2010-2021年抗病毒治疗HIV感染者的疾病转归及其影响因素
- Multi-state Markov model analysis of disease outcomes and influencing factors in HIV infected individuals receiving antiretroviral therapy in Luzhou of Sichuan province, 2010-2021
- 中华流行病学杂志, 2022, 43(9): 1394-1400
- Chinese Journal of Epidemiology, 2022, 43(9): 1394-1400
- http://dx.doi.org/10.3760/cma.j.cn112338-20220401-00251
-
文章历史
收稿日期: 2022-04-01
2. 泸州市疾病预防控制中心,泸州 646000
2. Luzhou Prefectural Center for Disease Control and Prevention, Luzhou 646000, China
艾滋病作为一种严重威胁人类健康的传染病,其流行给社会带来巨大挑战[1]。为清晰认识该疾病的进展规律,帮助分析其传播特征和流行现状,学者们开始尝试通过数学模型进行HIV感染者疾病转归的探索[2-3]。1989年Longini等[4]率先使用多状态马尔科夫模型开展艾滋病自然病程研究,将疾病进程划分为5个阶段:①已感染且抗体阴性;②抗体阳性且无症状;③艾滋病前期;④艾滋病临床阶段;⑤死亡,估算出潜伏期和不同感染阶段间的转移概率。随着抗病毒治疗(ART)药物的广泛使用,艾滋病由一种致死性疾病变成可防可控的慢性传染病[5],国外学者陆续对ART的HIV感染者(感染者)疾病进展规律开展研究,例如2019年Wang等[6]通过构建多状态马尔科夫模型对ART感染者CD4+T淋巴细胞(CD4)计数变化规律进行分析,发现种族、地区和传播途径等影响ART感染者疾病转归,对ART感染者相关防控具有重要指导意义。我国2016年对所有HIV感染者均建议实施ART[7],全国范围的ART覆盖率也由2005年的9.8%上升至2020年的92.9%[8],然而,国内尚未针对ART感染者的疾病转归及其影响因素开展相关研究。本研究构建连续时间离散状态的多状态马尔科夫模型分析2010-2021年四川省泸州市ART感染者的疾病转归及其影响因素,为制定艾滋病防控策略及卫生资源的合理分配提供参考依据。
资料与方法1. 资料来源:我国艾滋病综合防治信息系统。2010-2021年四川省泸州市ART感染者作为研究对象进行回顾性队列分析,启动ART时年龄≥15岁。观测指标包括:①社会人口学信息:年龄、性别、婚姻状况和文化程度;②CD4计数随访信息:随访次数、检测时间和检测结果;③其他信息:死亡时间、诊断年份、ART年份和病毒载量。排除标准:①仅有1次CD4计数随访记录;②CD4计数随访信息缺失。
2. 相关定义:
(1)病毒学失败[9]:ART感染者启动ART的48周后血浆HIV RNA持续 > 200拷贝数/ml;或出现病毒学反弹:在达到病毒学完全抑制后又出现HIV RNA≥200拷贝数/ml的情况。
(2)转移强度[Prs(t)][10]:状态间转移的瞬时风险,即在时刻t处于状态r的个体,在极短时间δt后转移到状态s的可能性,公式:Prs(t)= 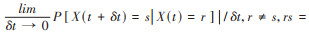
(3)转移概率[Prs(t0,t)][10]:时刻t0处于状态r的个体,在未来某个时刻t0+t处于状态s的可能性,公式:
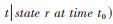
3. 研究内容:构建连续时间离散状态的可逆多状态马尔科夫模型,对四川省泸州市2010-2021年ART感染者的疾病转归及其影响因素进行统计学分析,疾病状态划分为5个:①S1:CD4计数 > 500个/μl;②S2:CD4计数350~500个/μl;③S3:CD4计数200~349个/μl;④S4:CD4计数≤199个/μl;⑤S5:死亡。其中状态S1~S4均为暂态,S5为吸收态,即病程不能从死亡转移至其他状态。见图 1。根据文献将年龄、性别、文化程度、婚姻状况、基线CD4计数水平、诊断年份、ART年份和病毒学失败情况作为研究变量纳入模型,分析ART感染者疾病转归的影响因素。
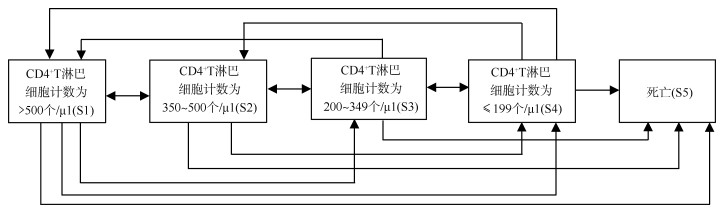
|
| 图 1 抗病毒治疗HIV感染者疾病转归模式图 |
4. 统计学分析:采用SPSS 21.0软件进行数据整理和分析,非正态分布的计量资料采用M(Q1,Q3)表示;计数资料采用频数和构成比表示,组间比较采用χ2检验;使用R 4.1.2软件的msm软件包进行多状态马尔科夫模型构建、转移强度和转移概率估计[11],模型主要采用Quasi-Newton迭代法进行转移强度和转移概率的最大似然估计,影响因素分析时对分类变量设置哑变量,各变量对状态间转移强度的影响采用HR值(95%CI)表示。双侧检验,检验水准α=0.05。
结果1. 基本情况:2010-2021年四川省泸州市共有7 542例ART感染者纳入研究,随访时间M(Q1,Q3)为2.4(1.5,4.6)年。ART感染者年龄M(Q1,Q3)为53.4(41.2,64.5)岁,≥45岁感染者占68.3%(5 154/7 542);基线CD4计数水平 > 500个/μl者占8.8%(667/7 542);ART感染者的诊断年份和ART年份在2016-2021年分别占76.7%(5 787/7 542)和77.2%(5 824/7 542)。见表 1。
2. ART感染者的疾病转归情况:
(1)随访期疾病状态转移频数(表 2):1 108次从CD4计数 > 500个/μl转移至350~500个/μl,1 352次从CD4计数为350~500个/μl转移至200~349个/μl,1 119次从CD4计数为200~349个/μl转移至≤199个/μl,357次从CD4计数≤199个/μl转移至死亡,以此类推。
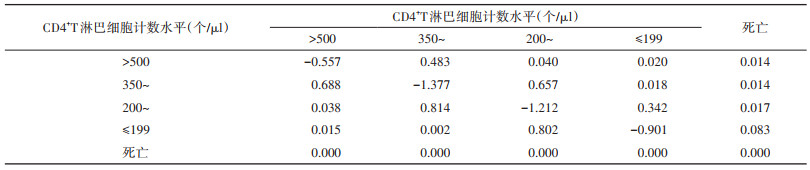
(2)随访期疾病状态间转移强度(表 3):CD4计数水平从200~349个/μl至350~500个/μl的转移强度较大(0.814),其次是从≤199个/μl转移至200~349个/μl(0.802)和从350~500个/μl转移至 > 500个/μl(0.688)。CD4计数水平从≤199个/μl转移至200~349个/μl的转移强度约是从≤199个/μl转移至死亡的9.7倍(0.802/0.083);CD4计数水平从200~349个/μl转移至350~500个/μl的转移强度约是从200~349个/μl转移至≤199个/μl的2.4倍(0.814/0.342);CD4计数水平从350~500个/μl转移至 > 500个/μl的转移强度(0.688)高于从350~500个/μl转移至200~349个/μl的转移强度(0.657),即CD4计数水平从≤199个/μl转移至200~349个/μl、从200~349个/μl转移至350~500个/μl和从350~500个/μl转移至 > 500个/μl的瞬时风险较高。
(3)随访期疾病状态间转移概率:ART感染者和疾病状态定义为可逆性转移,故可以停留在原状态、向上一疾病状态转移或者向下一疾病状态转移,按照1、3、5、7、9和12年的6个时间节点比较ART感染者各疾病状态转移概率(图 2)。随访期间,CD4计数水平从 > 500个/μl转移至350~500个/μl和从350~500个/μl转移至 > 500个/μl的转移概率先升高后降低,在第3年达到峰值;CD4计数水平从350~500个/μl转移至200~349个/μl、从200~349个/μl转移至350~500个/μl、从200~349个/μl转移至≤199个/μl和从≤199个/μl转移至200~349个/μl的转移概率逐渐降低,从CD4计数水平≤199个/μl转移至死亡的转移概率逐渐升高。

|
| 注:S1~S5分别代表CD4+T淋巴细胞计数 > 500、350~、200~、≤199个/μl和死亡 图 2 2010-2021年四川省泸州市抗病毒治疗HIV感染者不同随访时间疾病状态间转移概率 |
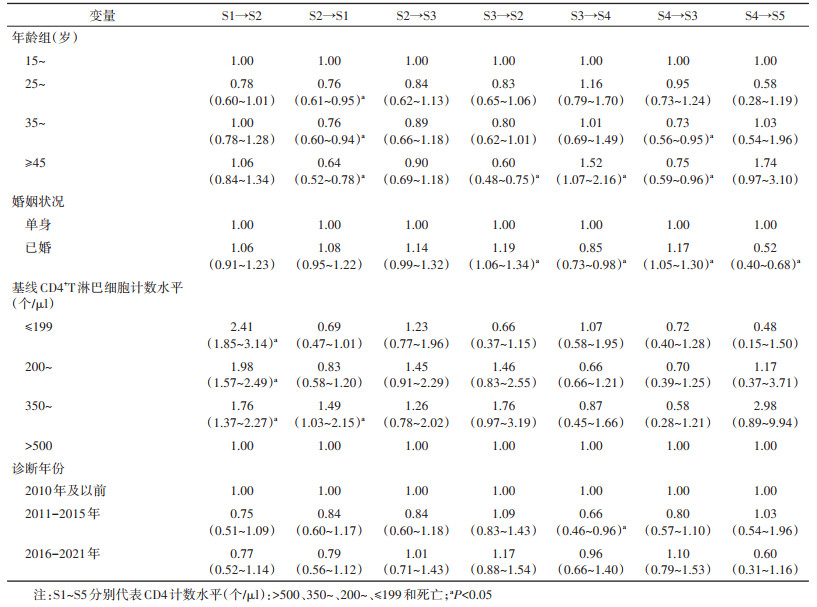
3. ART感染者疾病转归的影响因素分析:剔除婚姻状况信息不详者3例,对7 539例ART感染者的疾病转归进行影响因素分析,纳入变量包括年龄、性别、婚姻状况、文化程度、基线CD4计数水平、诊断年份、ART年份和病毒学失败情况。单因素分析结果显示,所有变量均对ART感染者疾病转归有影响。将所有变量纳入多因素分析结果显示,年龄、婚姻状况、基线CD4计数水平和诊断年份对ART感染者疾病转归有影响(表 4),表 4仅展示相邻的疾病状态转移。其他变量固定不变,与15~24岁者相比,≥45岁ART感染者S2→S1、S3→S2和S4→S3的转移强度均较低,S3→S4的转移强度较高;与单身者相比,已婚者S3→S2和S4→S3的转移强度较高,S3→S4和S4→S5的转移强度较低;基线CD4计数≤199个/μl、200~349个/μl和350~500个/μl者S1→S2的转移强度均高于基线CD4计数 > 500个/μl者;2011-2015年被诊断者S3→S4的转移强度低于2010年及以前被诊断者。
多状态马尔科夫模型对具有多状态多阶段发展特点的艾滋病具有很强的适用性[12-13],目前已广泛应用于艾滋病疾病进展规律[14]、疫情估计和预测[15]及卫生经济学评价[16]等众多领域,积极发挥其在艾滋病研究领域的独特优势,有利于艾滋病防控策略的制定和卫生资源的合理分配。ART有效改善了HIV感染者的生存状况,研究ART感染者的疾病转归有利于个体水平ART效果评估并指导临床决策[17]。本研究通过构建多状态马尔科夫模型分析ART感染者疾病转归情况,估算了不同疾病状态转移强度和转移概率,揭示了其疾病进展情况,并通过对影响因素的探索为艾滋病防控决策提供参考依据。
对ART感染者疾病状态转移强度的估算结果显示CD4计数水平从≤199个/μl转移至200~349个/μl、从200~349个/μl转移至350~500个/μl和从350~500个/μl转移至 > 500个/μl的瞬时风险较高,即ART感染者更倾向于向上一疾病状态发生转移,提示ART有利于感染者发生免疫重建。转移概率估算结果显示,随着时间的推移,ART感染者CD4计数水平从≤199个/μl至死亡的转移概率逐渐升高,表明CD4计数≤199个/μl时疾病进展加快,死亡概率增加,该发现与其他研究结果一致[18],提示做好CD4计数长期连续监测的重要性,当CD4计数出现明显下降时,应及时分析原因并做出调整以避免死亡发生[19]。
ART感染者疾病转归的影响因素分析提示年龄、婚姻状况、基线CD4计数水平和诊断年份均是其影响因素。与较低年龄组(15~24岁)相比,较高年龄组(≥45岁)ART感染者向上一疾病状态转移风险较低,向下一疾病状态转移风险较高,提示较高年龄组ART感染者疾病进展较快,该结论与其他研究结果一致[20];已婚ART感染者向上一疾病状态转移风险高于单身者,提示已婚者较有利于发生免疫重建,这与Andualem和Ayele[21]研究结果不同;基线CD4计数≤500个/μl的ART感染者向下一疾病状态转移风险高于 > 500个/μl者,提示较低基线CD4计数加快疾病进程,与其他研究结果一致[17],我国2016年将治疗标准调整为所有HIV感染者一经诊断均推荐接受ART[7],该策略有利于HIV感染者在基线CD4计数水平较高的早期被治疗,从而延缓疾病进程;2011-2015年被诊断的ART感染者向下一疾病状态转移风险低于2010年及以前被诊断者,提示2010年及以前被诊断者疾病进展风险更高,考虑由于2010年及以前该地区CD4计数水平检测力度不足、ART药物疗效有限或防控策略不够优化等原因所致。另外,Wang等[6]、Andualem和Ayele[21]、Zingoni等[22]在研究中发现,男性和女性均可能增加ART感染者疾病进展的风险,Dessie等[23]研究发现,文化程度是HIV感染者疾病进展的影响因素,Nosyk等[19]研究发现,2004年以前的ART感染者疾病进展风险是2004年及以后者的1.2~1.5倍,Shoko等[24]研究发现南非地区ART感染者无论CD4计数水平高低,一旦发生病毒学失败,其死亡率将会增加,以上发现均与本研究结果不同,考虑可能由于研究地区或者样本量大小差异所致,国内对ART感染者疾病转归的研究较少,影响因素如治疗时长[22]、耐药性等的研究仍有待加强。
本研究构建的多状态马尔科夫模型与以往研究多以感染状态为划分标准不同,采用CD4计数水平描述ART感染者的疾病转归,除病毒载量以外,CD4计数水平也是重要的ART效果评价指标,对了解机体免疫力水平变化规律至关重要,我国对ART感染者CD4计数水平长期连续的随访监测保证了数据的准确性。
本研究存在局限性。首先,对于多状态马尔科夫模型的构建较为简单,未考虑ART感染者疾病进程中可能出现的ART中断或耐药等更为复杂的情形,而这些因素或许影响疾病进程,因此更加完善的模型有待进一步研究;其次,对ART感染者疾病转归影响因素的研究仅是初步的探讨,鉴于样本量有限并缺乏详细的ART方案、耐药性或ART中断等个案信息,影响因素的研究可能略有欠缺,未来研究中可以考虑更全面的ART信息,从而详细了解ART感染者疾病转归的相关影响因素。
利益冲突 所有作者声明无利益冲突
作者贡献声明 牛丹丹:研究设计、数据整理、数据分析、论文撰写;汤后林、陈方方:研究设计、论文修改;肖体呈、陈晨、刘宏:数据整理;吕繁:研究设计、研究指导、经费支持
| [1] |
Wu ZY, Chen JF, Scott SR, et al. History of the HIV epidemic in China[J]. Curr HIV/AIDS Rep, 2019, 16(6): 458-466. DOI:10.1007/s11904-019-00471-4 |
| [2] |
Aalen OO, Farewell VT, de Angelis D, et al. A Markov model for HIV disease progression including the effect of HIV diagnosis and treatment: application to AIDS prediction in England and Wales[J]. Stat Med, 1997, 16(19): 2191-2210. DOI:10.1002/(sici)1097-0258(19971015)16:19<2191:aid-sim645>3.0.co;2-5 |
| [3] |
Asena TF, Goshu AT. Comparison of sojourn time distributions in modeling HIV/AIDS disease progression[J]. Biom Lett, 2017, 54(2): 155-174. DOI:10.1515/bile-2017-0009 |
| [4] |
Longini IM, Clark Jr WS, Haber M, et al. The stages of HIV infection: waiting times and infection transmission probabilities[M]//Castillo-Chavez C. Mathematical and statistical approaches to AIDS epidemiology. Berlin: Springer, 1990: 111-137. DOI: 10.1007/978-3-642-93454-4_5.
|
| [5] |
Papa F, Felici G, Franzetti M, et al. Impact of ART-induced viral suppression on the HIV epidemic in Italy[J]. Math Med Biol, 2020, 37(2): 183-211. DOI:10.1093/imammb/dqz010 |
| [6] |
Wang LW, Krebs E, Min JE, et al. Combined estimation of disease progression and retention on antiretroviral therapy among treated individuals with HIV in the USA: a modelling study[J]. Lancet HIV, 2019, 6(8): e531-539. DOI:10.1016/S2352-3018(19)30148-1 |
| [7] |
Cao W, Hsieh E, Li TS. Optimizing treatment for adults with HIV/AIDS in China: successes over two decades and remaining challenges[J]. Curr HIV/AIDS Rep, 2020, 17(1): 26-34. DOI:10.1007/s11904-019-00478-x |
| [8] |
吴尊友. 我国实现艾滋病防治策略三个90%的进展与挑战[J]. 中华疾病控制杂志, 2016, 20(12): 1187-1189. Wu ZY. The progress and challenges of promoting HIV/AIDS 90-90-90 strategies in China[J]. Chin J Dis Control Prev, 2016, 20(12): 1187-1189. DOI:10.16462/j.cnki.zhjbkz.2016.12.001 |
| [9] |
中华医学会感染病学分会艾滋病丙型肝炎学组, 中国疾病预防控制中心. 中国艾滋病诊疗指南(2018年版)[J]. 中华内科杂志, 2018, 57(12): 867-884. AIDS and Hepatitis C Professional Group, Society of Infectious Diseases, Chinese Medical Association, China Center for Disease Control and Prevention. Chinese guidelines for diagnosis and treatment of HIV/AIDS (2018)[J]. Chin J Int Med, 2018, 57(12): 867-884. DOI:10.3760/cma.j.issn.0578-1426.2018.12.002 |
| [10] |
石舒原, 赵厚宇, 刘志科, 等. 多状态马尔科夫模型估计2型糖尿病患者慢性并发症累积数量的转移概率及影响因素研究[J]. 中华流行病学杂志, 2021, 42(7): 1274-1279. Shi SY, Zhao HY, Liu ZK, et al. Application of multi-state Markov model in studying transition of number of chronic complications and influencing factors in type 2 diabetes mellitus patients[J]. Chin J Epidemiol, 2021, 42(7): 1274-1279. DOI:10.3760/cma.j.cn112338-20210128-00075 |
| [11] |
Jackson CH. Multi-state models for panel data: The msm Package for R[J]. J Stat Softw, 2011, 38(8): 1-28. DOI:10.18637/jss.v038.i08 |
| [12] |
唐林, 孙坤, 陈方方, 等. 艾滋病疫情估计与预测方法研究进展[J]. 中华流行病学杂志, 2019, 40(6): 731-738. Tang L, Sun K, Chen FF, et al. Progress on estimation and projection of HIV epidemics[J]. Chin J Epidemiol, 2019, 40(6): 731-738. DOI:10.3760/cma.j.issn.0254-6450.2019.06.024 |
| [13] |
刘世安, 李晓松, 苏茜, 等. Markov模型对具有波动性特征传染病发病趋势短期预测的初步探讨[J]. 现代预防医学, 2010, 37(10): 1815-1817, 1820. Liu SA, Li XS, Su X, et al. Study on the Markov model on short-term prediction for the trends of infectious diseases with volatility characteristics by[J]. Mod Prev Med, 2010, 37(10): 1815-1817, 1820. |
| [14] |
Shoko C, Chikobvu D. Time-homogeneous Markov process for HIV/AIDS progression under a combination treatment therapy: cohort study, South Africa[J]. Theor Biol Med Model, 2018, 15(1): 3. DOI:10.1186/s12976-017-0075-4 |
| [15] |
Sun XD, Yang WM, Tang SY, et al. Declining trend in HIV new infections in Guangxi, China: insights from linking reported HIV/AIDS cases with CD4-at-diagnosis data[J]. BMC Public Health, 2020, 20(1): 919. DOI:10.1186/s12889-020-09021-9 |
| [16] |
DelaCruz JJ, Brennan-Ing M, Kakolyris A, et al. The cost effectiveness of mental health treatment in the lifetime of older adults with HIV in New York City: a Markov approach[J]. Pharmacoecon Open, 2021, 5(2): 221-236. DOI:10.1007/s41669-020-00238-3 |
| [17] |
Ross JM, Ying R, Celum CL, et al. Modeling HIV disease progression and transmission at population-level: The potential impact of modifying disease progression in HIV treatment programs[J]. Epidemics, 2018, 23: 34-41. DOI:10.1016/j.epidem.2017.12.001 |
| [18] |
Binquet C, Le Teuff G, Abrahamovicz M, et al. Markov modelling of HIV infection evolution in the HAART era[J]. Epidemiol Infect, 2009, 137(9): 1272-1282. DOI:10.1017/S0950268808001775 |
| [19] |
Nosyk B, Min J, Lima VD, et al. HIV-1 disease progression during highly active antiretroviral therapy: an application using population-level data in British Columbia: 1996-2011[J]. J Acquir Immune Defic Syndr, 2013, 63(5): 653-659. DOI:10.1097/QAI.0b013e3182976891 |
| [20] |
Wang LW, Min JE, Zang X, et al. Characterizing human immunodeficiency virus antiretroviral therapy interruption and resulting disease progression using population-level data in British Columbia, 1996-2015[J]. Clin Infect Dis, 2017, 65(9): 1496-1503. DOI:10.1093/cid/cix570 |
| [21] |
Andualem BD, Ayele BT. Progression of HIV disease among patients on ART in Ethiopia: application of longitudinal count models[J]. Front Public Health, 2020, 7: 415. DOI:10.3389/fpubh.2019.00415 |
| [22] |
Zingoni ZM, Chirwa TF, Todd J, et al. HIV disease progression among antiretroviral therapy patients in Zimbabwe: a multistate Markov model[J]. Front Public Health, 2019, 7: 326. DOI:10.3389/fpubh.2019.00326 |
| [23] |
Dessie ZG, Zewotir T, Mwambi H, et al. Modelling of viral load dynamics and CD4 cell count progression in an antiretroviral naive cohort: using a joint linear mixed and multistate Markov model[J]. BMC Infect Dis, 2020, 20: 246. DOI:10.1186/s12879-020-04972-1 |
| [24] |
Shoko C, Chikobvu D, Bessong PO. A Markov model for the effects of virological failure on HIV/AIDS progression in tuberculosis co-infected patients receiving antiretroviral therapy in a rural clinic in northern South Africa[J]. S Afr Med J, 2020, 110(4): 313-319. DOI:10.7196/SAMJ.2020.v110i4.13934 |
 2022, Vol. 43
2022, Vol. 43