文章信息
- 朱蕴卿, 樊俊宁, 余灿清, 吕筠, 郭彧, 裴培, 夏庆梅, 杜怀东, 陈怡平, 陈君石, 陈铮鸣, 李立明, 代表中国慢性病前瞻性研究项目协作组.
- Zhu Yunqing, Fan Junning, Yu Canqing, Lyu Jun, Guo Yu, Pei Pei, Xia Qingmei, Du Huaidong, Chen Yiping, Chen Junshi, Chen Zhengming, Li Liming, for the China Kadoorie Biobank Collaborative Group
- 我国30~79岁成年人中睡眠状况与衰弱的相关性研究
- Correlation between sleep status and frailty in adults aged 30-79 years in China
- 中华流行病学杂志, 2022, 43(9): 1349-1356
- Chinese Journal of Epidemiology, 2022, 43(9): 1349-1356
- http://dx.doi.org/10.3760/cma.j.cn112338-20220110-00018
-
文章历史
收稿日期: 2022-01-10
2. 北京大学公众健康与重大疫情防控战略研究中心,北京 100191;
3. 中国医学科学院阜外医院,北京 100037;
4. 中国医学科学院,北京 100730;
5. 英国牛津大学医学研究委员会人口健康研究组,牛津OX3 7LF;
6. 英国牛津大学临床与流行病学研究中心纳菲尔德人群健康系,牛津OX3 7LF;
7. 国家食品安全风险评估中心,北京 100022
2. Peking University Center for Public Health and Epidemic Preparedness & Response, Beijing 100191, China;
3. Fuwai Hospital, Chinese Academy of Medical Sciences, National Center for Cardiovascular Diseases, Beijing 100037, China;
4. Chinese Academy of Medical Sciences, Beijing 100730, China;
5. Medical Research Council Population Health Research Unit at the University of Oxford, Oxford OX3 7LF, UK;
6. Clinical Trial Service Unit and Epidemiological Studies Unit, Nuffield Department of Population Health, University of Oxford, Oxford OX3 7LF, UK;
7. China National Center for Food Safety Risk Assessment, Beijing 100022, China
随着生活节奏加快,睡眠问题在中年群体中愈发严重,且比老年人更可能因睡眠不佳而产生应激反应,造成机体损伤[1]。衰弱(frailty)反映了机体受到有害刺激时,造成损伤或疾病的可能性高低,可分为衰弱前期(prefrail)和衰弱期[2]。不只是老年群体,在身体机能较差的年轻群体中亦存在衰弱问题[3]。现有国内外证据大多为 > 60岁人群,研究的睡眠行为也仅聚焦在睡眠时长与失眠,且研究结论不一致:部分研究发现睡眠时长与衰弱呈U形关系[4],但亦有研究仅能发现睡眠时长较长、较短或失眠的危害[5-6]。来自国内的研究仅考虑衰弱期一种状态,未考虑到衰弱前期与衰弱期的差异[7]。此外,目前尚缺乏探讨打鼾及各项睡眠问题的累加效应。同时,超重肥胖已成为困扰国人的健康问题,且与睡眠时长过短[8-9]、打鼾等睡眠习惯相关[10]。因此,有必要在中老年人群中探讨超重肥胖对睡眠与衰弱关系的效应修饰作用。本研究旨在利用中国慢性病前瞻性研究(China Kadoorie Biobank,CKB)项目的基线调查数据,分析30~79岁成年人中各项睡眠问题与衰弱前期及衰弱期的相关性,并进一步探讨超重肥胖对二者关系的效应修饰作用。
对象与方法1. 研究对象:CKB项目于2004-2008年展开基线调查,覆盖我国5个城市(青岛市、哈尔滨市、海口市、苏州市和柳州市)和5个农村(四川省、甘肃省、河南省、浙江省和湖南省),共招募512 726名30~79岁的研究对象完成基线调查。CKB项目获得英国牛津大学和中国CDC伦理委员会审查批准,所有研究对象签署知情同意书[11-12]。本研究剔除2名衰弱指数(frailty index,FI)构成条目有缺失者后,最终纳入512 724名研究对象。
2. 研究内容:
(1)数据收集:基线调查中,以面对面的电子调查问卷的形式,在经过统一培训的调查员的指导下,收集了研究对象的社会人口学特征(性别、年龄、地区、最高文化程度)、疾病史(脑卒中、恶性肿瘤等)、症状(便秘、身体持续疼痛等)、生活方式特征(吸烟、饮酒、体力活动水平)和睡眠状况。其中,文化程度包括未正规上过学、小学、初中、高中/中专/技校、大专、大学及以上;吸烟状况包括从来不吸、偶尔吸、曾经吸(不含因病戒烟)、当前吸烟(含因病戒烟);饮酒状况包括从不或几乎不饮酒、曾经每周饮酒、当前偶尔饮酒、当前偶尔饮酒但曾经每周饮酒、当前每月饮酒、当前每周饮酒;根据从事不同种体力活动(工作、交通、休闲、家务)的累积时间(h/d)及其对应的代谢当量(metabolic equivalent,MET)相乘加和,得到研究对象每天的体力活动水平(MET-h/d)[13]。所有体格检查项目(身高、体重、腰围、臀围、血压、心率、第1秒用力肺活量、最大肺活量等)由经过统一培训的调查员按照标准化操作手册进行测量。并根据体重(kg)除以身高(m)的平方计算得到BMI(kg/m2),根据腰围(mm)除以臀围(mm)计算得到腰臀比(waist-to-hip ratio,WHR)。并根据《中国成人超重和肥胖症预防控制指南》[14],以BMI(kg/m2)进行体重分组:< 18.5为低体重,18.5~23.9为正常体重,24.0~27.9为超重,≥28.0为肥胖;以腰围(cm)判断中心性肥胖:男性腰围≥85,女性腰围≥80为中心性肥胖。
(2)睡眠状况:根据调查员面对面询问获得研究对象近一个月的睡眠状况,包括睡眠时长、早醒、入睡困难、日间功能障碍、服用安眠药、打鼾。本研究中考虑的睡眠因素包括:①睡眠时长(为通常情况下平均每日睡眠时长,包括午休,以小时为单位)≤6 h/d或≥9 h/d:根据美国国家睡眠委员会的建议,对于中老年群体而言睡眠时长7~8 h/d为正常睡眠[15],据此本研究以≤6 h/d为睡眠时长较短,≥9 h/d为睡眠时长较长。②失眠障碍:根据《精神障碍诊断与统计手册(第五版)》,以近一个月内每周≥3 d满足以下2种情况之一认为是失眠障碍:a)早醒或入睡困难且存在日间功能障碍;b)服用安眠药[16]。③打鼾(为通常情况下睡眠中的打鼾习惯):以自报经常或有时有打鼾习惯的研究对象为打鼾者,以自报不打鼾或不知道是否打鼾者为不打鼾。④不健康睡眠评分:根据上述3个指标,将睡眠时长较短或较长、失眠障碍、打鼾3个因素构建不健康睡眠评分,每个表型计1分,最终得分为0~3分,评分越高表明睡眠问题越严重。
(3)FI:既往研究基于CKB项目,筛选出28种疾病或缺陷指标来构建适合中国人群的FI,其中包括14个疾病指标(脑卒中、恶性肿瘤等)、10个症状或体征(便秘、睡眠问题等)、4个体检测量指标(BMI、WHR等),每个变量被赋予0~1之间的数值,数值越大表示疾病或缺陷越严重[17]。本研究中主要研究睡眠状况,因此从构建FI的变量中删除,以剩余的27个变量构建FI[18]。然后将FI分为非衰弱(FI≤0.10)、衰弱前期(0.10 < FI < 0.25)、衰弱(FI≥0.25)3种衰弱状态[19-20]。
3. 统计学分析:本研究根据衰弱状态将研究对象分为非衰弱、衰弱前期、衰弱期3组,采用logistic回归(分类变量)及线性回归(连续变量),在调整性别、年龄、项目地区后,以构成比(分类变量)和x±s(连续变量)描述研究对象的社会人口学特征、生活方式特征、超重问题与睡眠状况。并拟合限制性立方样条模型(restrict cubic spline,RCS),选择睡眠时长(h/d)的百分位数(10%:6,25%:7,50%:8,75%:8,90%:9)共4个节点,以8 h/d为参照组,在调整性别、年龄、地区后,描述FI与睡眠时长的非线性关系。在分析睡眠状况各因素与衰弱状态的相关性中,以衰弱状态为因变量,采用多分类logistic回归调整性别、年龄、项目地区、最高文化程度,吸烟状况,饮酒状况,估计OR值(95%CI),并检验相关性的线性趋势。在按照肥胖指标进行分层分析及交互分析中,以正常组为对照,根据引入的肥胖与睡眠交互项显著性,评价不同肥胖状态者对睡眠各因素与衰弱状态关系的效应修饰作用。
本研究使用Stata 16.0软件进行统计学分析,并使用SAS 9.4软件拟合RCS曲线,所有分析使用双侧检验,以P < 0.05为差异有统计学意义;以Bonferroni矫正后的P < 0.007作为交互项显著的判断标准。
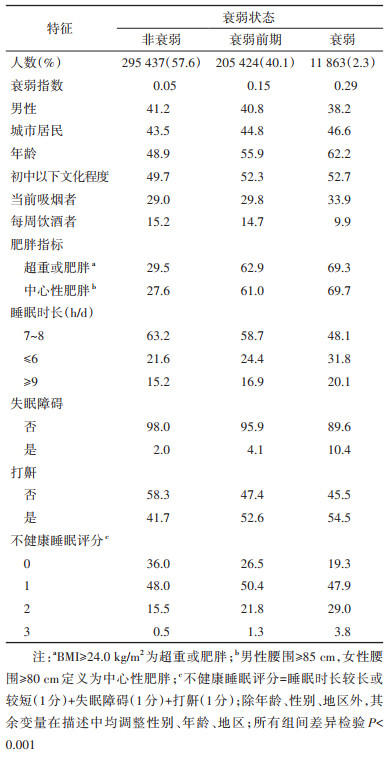
结果1. 基本情况:512 724名研究对象中,41.0%为男性,44.1%为城市居民,年龄(52.0±10.7)岁。研究对象的FI呈现正偏态分布,均值为0.097(四分位数:0.056,0.130),其中有11 863人(2.3%)处于衰弱状态,205 424人(40.1%)处于衰弱前期状态。随着衰弱状态加重,男性占比更低,城市居民占比升高,年龄逐渐增大。在调整性别、年龄、地区后,衰弱者中每周饮酒者占比降低,中学以下文化程度者、当前吸烟者、超重或肥胖者、中心性肥胖者占比增高(P < 0.001)。
在调整性别、年龄和地区后,衰弱组中每日睡眠时长不足7 h/d(31.8%)、超过8 h/d(20.1%)的比例均最高,失眠障碍的比例最高(10.4%),打鼾的比例最高(54.5%),不健康睡眠评分为3分的比例最高(3.8%),在不同衰弱状态间睡眠特征的分布均存在显著差异(P < 0.001)(表 1)。样条曲线显示,FI与睡眠时长呈U形关系,最低点在7~8 h/d之间,即睡眠时长≤6 h/d时,随着睡眠时长减少,FI升高,睡眠时长≥9 h/d时,随着睡眠时长增加,FI升高(图 1)。
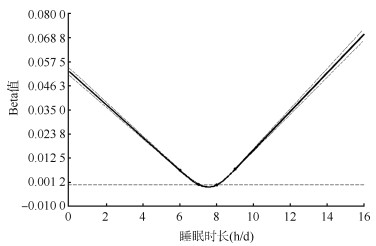
|
| 注:限制性立方样条模型中以睡眠时长(h/d):6、7、8、9为节点;模型调整性别、年龄、地区;实线表示回归系数Beta值,虚线表示回归系数的95%CI 图 1 我国成年人中衰弱指数与睡眠时长的非线性关系 |
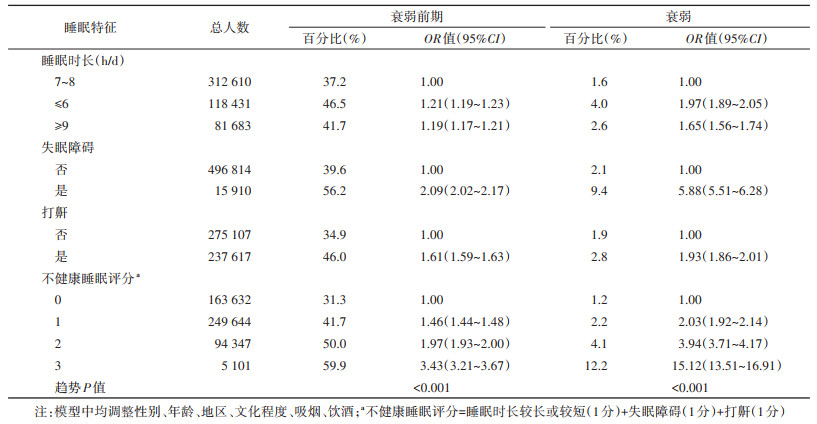
2. 睡眠状况与衰弱状态的相关性分析:经多因素调整后,各项睡眠问题(睡眠时长≤6 h/d、≥9 h/d,失眠障碍,打鼾),均与衰弱前期或衰弱期呈正相关。睡眠时长较短(≤6 h/d)、睡眠时长较长(≥9 h/d)、失眠障碍、打鼾与衰弱前期的OR值(95%CI)分别为1.21(1.19~1.23)、1.19(1.17~1.21)、2.09(2.02~2.17)、1.61(1.59~1.63)。综合不同睡眠行为,不健康睡眠评分越高,其与衰弱前期、衰弱期的相关性越高(趋势P < 0.001),评分为3分与衰弱前期、衰弱期的OR值(95%CI)分别为3.43(3.21~3.67)、15.12(13.51~16.91)(表 2)。
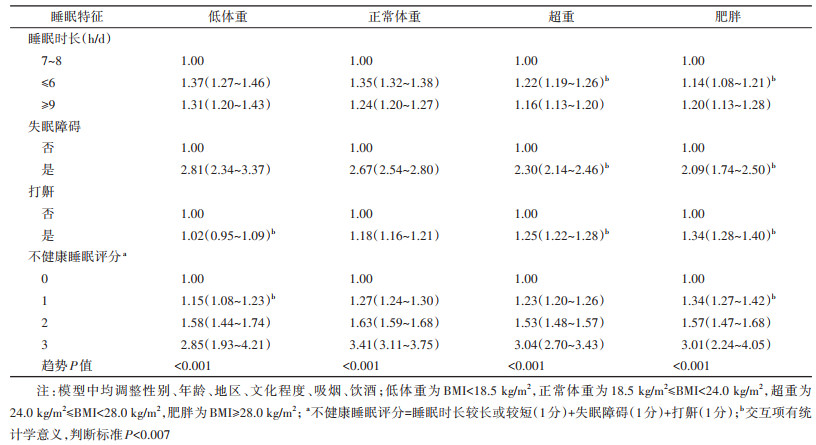
3. 不同肥胖水平下睡眠特征与衰弱状态的关系:经多因素调整后,在体重正常组中,与正常睡眠者(7~8 h/d)相比,睡眠时长较短(≤6 h/d)者处于衰弱前期、衰弱期的相关性,失眠者处于衰弱前期的相关性,均高于超重/肥胖组对应的相关性。譬如在体重正常组中,睡眠时长较短与衰弱期的OR值为2.39(95%CI:2.20~2.60),而在超重组仅为1.99(95%CI:1.85~2.14,交互P < 0.007),肥胖组仅为1.88(95%CI:1.71~2.06,交互P < 0.007)。而睡眠时长较长(≥9 h/d)者衰弱或衰弱前期的相关性,在体重分层的不同组间无显著差异(交互P值均 > 0.007)。在体重正常组中,与非打鼾者相比,打鼾者与衰弱期的正相关性,随着低体重(OR=0.94,95%CI:0.81~1.08)、正常体重(OR=1.23,95%CI:1.14~1.33)、超重(OR=1.47,95%CI:1.37~1.57)、肥胖(OR=1.67,95%CI:1.52~1.83),这一连续谱而逐渐提高(交互P值均 < 0.007),打鼾与衰弱前期的相关性变化趋势与之类似。除不健康睡眠评分为1分时处于衰弱前期的相关性在正常体重(OR=1.27,95%CI:1.24~1.30)、低体重(OR=1.15,95%CI:1.08~1.23)、肥胖组间(OR=1.34,95%CI:1.27~1.42),差异有统计学意义(交互P < 0.007),在其他评分下的相关性组间差异均无统计学意义(交互P < 0.007)(表 3,4)。
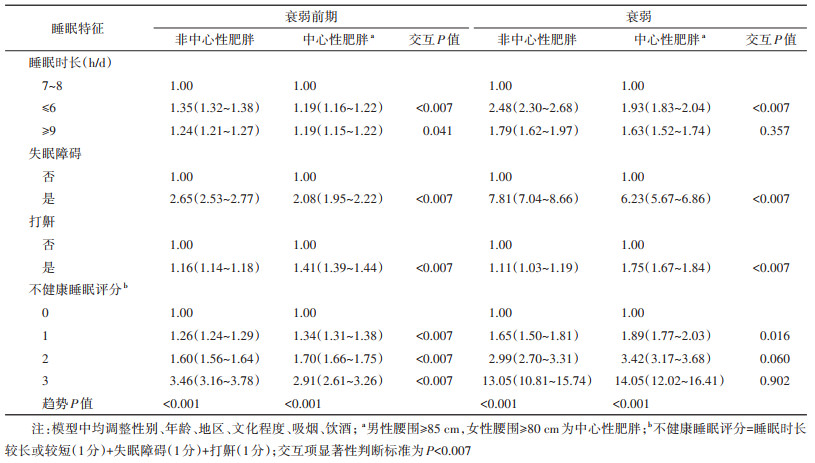
在按中心性肥胖分层时,睡眠时长较长、较短、失眠障碍、打鼾的相关性大小关系与超重肥胖分层类似。特别地,不健康睡眠评分为1、2、3分时处于衰弱前期的相关性组间差异有统计学意义(交互P值均 < 0.007)(表 5)。
本研究基于CKB项目数据,分析了睡眠状况与衰弱状态的相关性,并探讨肥胖对二者相关性的效应修饰作用。结果表明,睡眠时长过长或过短、失眠障碍及打鼾与衰弱正相关,存在的睡眠问题种类越多(不健康睡眠评分越高),与衰弱的相关性越强。分层分析结果表明肥胖对睡眠与衰弱的关系具有效应修饰作用:在体重正常者中,睡眠时长短及有失眠障碍与衰弱的相关性更强;而在超重肥胖者中,打鼾与衰弱的相关性更强。
本研究发现,睡眠时长与衰弱之间呈现U形关系:7~8 h/d睡眠时长组的FI最低,与国内外既往研究结果一致[4, 7]。针对睡眠时长较长者处于衰弱的比例提高,国外在60岁以上老年人中的前瞻性研究(RR=1.69,95%CI:1.10~2.58)、横断面研究(OR=2.86,95%CI:1.09~7.50)中均证明睡眠时长较长与衰弱的正相关[6, 21]。对此,有学者以双向关联解释,一方面,睡眠时间的延长是疾病恶化的症状,往往出现在衰弱程度不断演进但尚未被界定为衰弱的人中;另一方面,睡眠时间较长导致促炎因子的释放,譬如C反应蛋白、白细胞介素6的释放,与机体衰弱状态密切相关[22-23]。然而国内基于50岁以上人群的横断面研究并未发现睡眠时间较长的危害作用(OR=1.11,95%CI:0.92~1.33),推测与样本量较少有关[7]。
针对睡眠时长较短与衰弱的正相关,不同研究选择的睡眠时长节点不一,国外在以≤6 h/d为节点的横断面研究中并未发现相关性(OR=1.41,95%CI:0.97~2.04)[21],但以≤5 h/d为节点的前瞻性研究可以发现与衰弱的正相关(RR=1.80,95%CI:1.04~3.11)[6],国内在以 < 6 h/d为节点的横断面研究中亦可发现与衰弱的正相关(OR=1.60,95%CI:1.27~2.01)[7]。对此亦可通过双向关联解释,一方面,睡眠时长较短与瘦素(leptin)水平减少、胃饥饿素(ghrelin)水平增加有关,进而导致食欲增加,造成肥胖、糖尿病等与衰弱密切相关的疾病或缺陷[24],同时睡眠时间不足将导致生长激素的分泌不足,促进肌蛋白水解,更易发生衰弱;另一方面,处于衰弱状态的人,患抑郁、存在关节疼痛的可能性升高,进而可能影响睡眠[7]。
本研究及国外前瞻性研究(OR=2.11,95%CI:1.41~3.16)均发现,失眠障碍与衰弱之间存在正相关[25]。失眠障碍是更为极端的睡眠不足,亦可通过双向关联解释[25]。除此之外,国外横断面研究表明,不同的失眠症状与衰弱的相关性是不同的,入睡困难(sleep-onset insomnia)与衰弱存在正相关(OR=1.73,95%CI:1.09~2.76),而早醒或夜间惊醒(sleep-maintenance insomnia)与衰弱无显著相关(OR=1.25,95%CI:0.80~1.98)[26]。由此说明,相比于早醒,入睡困难可能是表征衰弱的更敏感的指标。该结果亦提示未来研究应探究各项失眠症状与衰弱的关系。
本研究亦发现打鼾与衰弱的正相关。国外研究表明,打鼾与女性骨折风险增高有关,后者是衡量衰弱的指标之一[27]。打鼾作为睡眠呼吸暂停(obstructive sleep apnea,OSA)最为常见的症状,国外研究表明OSA与老年人衰弱密切相关,OSA表现为在睡眠期间呼吸反复中断,出现低氧血症,促进了交感神经兴奋,造成氧化应激反应,进而激活炎症因子反应影响身体机能,造成衰弱。另一方面,存在OSA的患者因睡眠期间呼吸中断扰乱了快速眼动睡眠的第三阶段,从而导致睡眠的碎片化,通过失眠造成衰弱[25]。
此外,本研究发现随着存在的睡眠问题种类数增多,处于衰弱的比例增高。学者以匹斯堡睡眠量表构建评分,综合与睡眠相关的条目(睡眠时长、入睡困难、睡眠质量、使用睡眠药物等)评价个体睡眠质量,结果亦发现睡眠质量差(匹斯堡睡眠质量指数 > 5)与衰弱正相关(OR=1.78,95%CI:1.19~2.66),表明各项睡眠问题与衰弱之间存在累加效应[28]。
本研究发现肥胖对睡眠与衰弱之间的相关性具有效应修饰作用。由此说明,在体重正常者中通过保障充足的睡眠时长、干预失眠障碍来预防衰弱,比在超重肥胖者中进行干预更加有效;而在超重肥胖者中,干预打鼾问题来预防衰弱的效果,可能比在体重正常者中更有效。
本研究的优势为首次在中国30~79岁的大型队列中,探究睡眠问题与衰弱的相关性,因此本研究结论具有推广意义。其次,本研究关注到睡眠时长较长或较短、失眠障碍、打鼾等睡眠问题,本研究不仅考虑了衰弱状态,更对衰弱前期进行探讨。此外,本研究按是否超重肥胖进行分层分析,有助于精准防控,具有公共卫生学意义。但本研究具有局限性。首先,本研究设计为横断面研究,仅能探讨两者的相关性,对于因果关联的探索则有待前瞻性研究证据予以证实。其次,本研究通过研究对象自报来调查睡眠问题,无法避免信息偏倚。尽管如此,本研究已通过统一培训的调查员收集数据来提高数据质量。
综上,本研究证实了睡眠时长与衰弱之间存在的U形关系,发现了失眠障碍、打鼾均与衰弱比例升高有关,以及睡眠问题对衰弱的累加效应,同时首次发现了超重/肥胖对睡眠问题与衰弱关系的效应修饰作用。由此为通过睡眠干预以预防衰弱的精准防控提供科学依据,针对体重正常人群,通过保障充足的睡眠时长、干预失眠障碍来预防衰弱的效果可能更明显;而在超重肥胖人群中,通过干预打鼾问题来预防衰弱的效果可能更明显。
利益冲突 所有作者声明无利益冲突
作者贡献声明 朱蕴卿:分析/解释数据、论文撰写、统计分析;樊俊宁:统计分析;余灿清、吕筠:分析方案确定、结果解释、获取研究经费;郭彧、裴培、夏庆梅、杜怀东、陈怡平:实施研究、采集数据;陈君石、陈铮鸣、李立明:项目设计和方案制定
志谢 感谢所有参加中国慢性病前瞻性研究项目的队列成员和各项目地区的现场调查队调查员。感谢项目管理委员会、国家项目办公室、牛津协作中心和10个项目地区办公室的工作人员
| [1] |
Zitting KM, Münch MY, Cain SW, et al. Young adults are more vulnerable to chronic sleep deficiency and recurrent circadian disruption than older adults[J]. Sci Rep, 2018, 8(1): 11052. DOI:10.1038/s41598-018-29358-x |
| [2] |
陈璐, 樊俊宁, 孙点剑一, 等. 生物学年龄评价方法进展[J]. 中华流行病学杂志, 2021, 42(9): 1683-1688. Chen L, Fan JN, Sun DJY, et al. Progress in research of measurements of biological age[J]. Chin J Epidemiol, 2021, 42(9): 1683-1688. DOI:10.3760/cma.j.cn112338-20201210-01396 |
| [3] |
Williams AM, Krull KR, Howell CR, et al. Physiologic frailty and neurocognitive decline among young-adult childhood cancer survivors: a prospective study from the St Jude lifetime cohort[J]. J Clin Oncol, 2021, 39(31): 3485-3495. DOI:10.1200/JCO.21.00194 |
| [4] |
Nakakubo S, Makizako H, Doi T, et al. Long and short sleep duration and physical frailty in community-dwelling older adults[J]. J Nutr Health Aging, 2018, 22(9): 1066-1071. DOI:10.1007/s12603-018-1116-3 |
| [5] |
Nemoto Y, Sato S, Kitabatake Y, et al. Bidirectional relationship between insomnia and frailty in older adults: A 2-year longitudinal study[J]. Arch Gerontol Geriatr, 2021, 97: 104519. DOI:10.1016/j.archger.2021.104519 |
| [6] |
Moreno-Tamayo K, Manrique-Espinoza B, Morales-Carmona E, et al. Sleep duration and incident frailty: The Rural Frailty Study[J]. BMC Geriatr, 2021, 21(1): 368. DOI:10.1186/s12877-021-02272-0 |
| [7] |
郭雁飞, 阮晔, 肖义泽, 等. 50岁及以上人群睡眠时间与衰弱的关联研究[J]. 中华流行病学杂志, 2019, 40(10): 1252-1256. Guo YF, Ruan Y, Xiao YZ, et al. Association between frailty and sleep duration among people aged 50 years and over[J]. Chin J Epidemiol, 2019, 40(10): 1252-1256. DOI:10.3760/cma.j.issn.0254-6450.2019.10.015 |
| [8] |
Doo H, Chun H, Doo M. Associations of daily sleep duration and dietary macronutrient consumption with obesity and dyslipidemia in Koreans: A cross-sectional study[J]. Medicine (Baltimore), 2016, 95(45): e5360. DOI:10.1097/MD.0000000000005360 |
| [9] |
Sperry SD, Scully ID, Gramzow RH, et al. Sleep duration and waist circumference in adults: a meta-analysis[J]. Sleep, 2015, 38(8): 1269-1276. DOI:10.5665/sleep.4906 |
| [10] |
Knuiman M, James A, Divitini M, et al. Longitudinal study of risk factors for habitual snoring in a general adult population: the Busselton Health Study[J]. Chest, 2006, 130(6): 1779-1783. DOI:10.1378/chest.130.6.1779 |
| [11] |
Chen ZM, Lee L, Chen JS, et al. Cohort profile: the Kadoorie Study of Chronic Disease in China (KSCDC)[J]. Int J Epidemiol, 2005, 34(6): 1243-1249. DOI:10.1093/ije/dyi174 |
| [12] |
李立明, 吕筠, 郭彧, 等. 中国慢性病前瞻性研究: 研究方法和调查对象的基线特征[J]. 中华流行病学杂志, 2012, 33(3): 249-255. Li LM, Lu J, Guo Y, et al. The China Kadoorie Biobank: related methodology and baseline characteristics of the participants[J]. Chin J Epidemiol, 2012, 33(3): 249-255. DOI:10.3760/cma.j.issn.0254-6450.2012.03.001 |
| [13] |
On Behalf of the China Kadoorie Biobank Collaborative Group. Physical activity and sedentary leisure time and their associations with BMI, waist circumference, and percentage body fat in 0.5 million adults: the China Kadoorie Biobank study[J]. Am J Clin Nutr, 2013, 97(3): 487-496. DOI:10.3945/ajcn.112.046854 |
| [14] |
陈春明, 孔灵芝. 中国成人超重和肥胖症预防控制指南[M]. 北京: 人民卫生出版社, 2006. Chen CM, Kong LZ. Guidelines for prevention and control of overweight and obesity among Chinese adults[M]. Beijing: People's Health Publishing House, 2006. |
| [15] |
Hirshkowitz M, Whiton K, Albert SM, et al. National Sleep Foundation's sleep time duration recommendations: methodology and results summary[J]. Sleep Health, 2015, 1(1): 40-43. DOI:10.1016/j.sleh.2014.12.010 |
| [16] |
Harper C. Diagnosing the diagnostic and statistical manual of mental disorders[M]. London: Karnac Books, 2014.
|
| [17] |
Fan JN, Yu CQ, Guo Y, et al. Frailty index and all-cause and cause-specific mortality in Chinese adults: a prospective cohort study[J]. Lancet Public Health, 2020, 5(12): e650-660. DOI:10.1016/S2468-2667(20)30113-4 |
| [18] |
樊俊宁, 孙至佳, 余灿清, 等. Fried表型和衰弱指数与死亡风险关联的比较分析[J]. 中华流行病学杂志, 2021, 42(7): 1179-1187. Fan JN, Sun ZJ, Yu CQ, et al. Comparison of Fried phenotype and frailty index and their associations with risk of mortality[J]. Chin J Epidemiol, 2021, 42(7): 1179-1187. DOI:10.3760/cma.j.cn112338-20210310-00192 |
| [19] |
Shi GP, Ma T, Zhu YS, et al. Frailty phenotype, frailty index and risk of mortality in Chinese elderly population-Rugao longevity and ageing study[J]. Arch Gerontol Geriatr, 2019, 80: 115-119. DOI:10.1016/j.archger.2018.11.001 |
| [20] |
Hoogendijk EO, Afilalo J, Ensrud KE, et al. Frailty: implications for clinical practice and public health[J]. Lancet (London, England), 2019, 394(10206): 1365-1375. DOI:10.1016/S0140-6736(19)31786-6 |
| [21] |
Baniak LM, Yang K, Choi J, et al. Long sleep duration is associated with increased frailty risk in older community-dwelling adults[J]. J Aging Health, 2020, 32(1): 42-51. DOI:10.1177/0898264318803470 |
| [22] |
Jike M, Itani O, Watanabe N, et al. Long sleep duration and health outcomes: A systematic review, meta-analysis and meta-regression[J]. Sleep Med Rev, 2018, 39: 25-36. DOI:10.1016/j.smrv.2017.06.011 |
| [23] |
Patel SR, Zhu XB, Storfer-Isser A, et al. Sleep duration and biomarkers of inflammation[J]. Sleep, 2009, 32(2): 200-204. DOI:10.1093/sleep/32.2.200 |
| [24] |
Taheri S, Lin L, Austin D, et al. Short sleep duration is associated with reduced leptin, elevated ghrelin, and increased body mass index[J]. PLoS Med, 2004, 1(3): e62. DOI:10.1371/journal.pmed.0010062 |
| [25] |
Moreno-Tamayo K, Manrique-Espinoza B, Guerrero-Zúñiga S, et al. Sex differences in the association between risk of obstructive sleep apnea, insomnia, and frailty in older adults[J]. Nat Sci Sleep, 2021, 13: 1461-1472. DOI:10.2147/NSS.S320192 |
| [26] |
Tang JYM, Luo H, Tse M, et al. The relationship between insomnia symptoms and frailty in community-dwelling older persons: a path analysis[J]. Sleep Med, 2021, 84: 237-243. DOI:10.1016/j.sleep.2021.05.039 |
| [27] |
Choi SB, Lyu IS, Lee W, et al. Increased fragility fracture risk in Korean women who snore: a 10-year population-based prospective cohort study[J]. BMC Musculoskelet Disord, 2017, 18(1): 236. DOI:10.1186/s12891-017-1587-0 |
| [28] |
Sun XH, Ma T, Yao S, et al. Associations of sleep quality and sleep duration with frailty and pre-frailty in an elderly population Rugao longevity and ageing study[J]. BMC Geriatr, 2020, 20(1): 9. DOI:10.1186/s12877-019-1407-5 |
 2022, Vol. 43
2022, Vol. 43