文章信息
- 杨金华, 费兴林, 李其龙, 徐增豪, 高垲, 白浩, 李佳昱, 唐梦龄, 王建炳, 金明娟, 陈坤.
- Yang Jinhua, Fei Xinglin, Li Qilong, Xu Zenghao, Gao Kai, Bai Hao, Li Jiayu, Tang Mengling, Wang Jianbing, Jin Mingjuan, Chen Kun
- 起始年龄对结直肠癌高危人群进展期病变检出的影响研究
- Influence of age on advanced neoplasia detection in colorectal cancer screening in population at high risk
- 中华流行病学杂志, 2022, 43(8): 1282-1287
- Chinese Journal of Epidemiology, 2022, 43(8): 1282-1287
- http://dx.doi.org/10.3760/cma.j.cn112338-20211220-01002
-
文章历史
收稿日期: 2021-12-20
2. 浙江大学公共卫生学院流行病与卫生统计学系, 杭州 310058;
3. 浙江大学医学院附属第二医院肿瘤研究所恶性肿瘤预警与干预教育部重点实验室, 杭州 310000
2. Department of Epidemiology and Biostatistics, Zhejiang University School of Public Health, Hangzhou 310058, China;
3. Key Laboratory of Cancer Prevention and Intervention, Ministry of Education, Cancer Institute, Second Affiliated Hospital, Zhejiang University School of Medicine, Hangzhou 310000, China
随着社会经济的不断发展,居民饮食结构及生活习惯的明显改变,中国人结直肠癌发病和死亡显著增加。根据国际癌症中心的最新分析数据显示,2020年,我国结直肠癌发病率和死亡率分别位居常见恶性肿瘤的第3位和第5位[1],已成为严重危害公众健康的重大疾病。既往研究表明,筛查是降低结直肠癌发病和死亡的有效方法[2-4]。因此,世界范围内已有许多国家和地区推广以人群为基础的结直肠癌筛查实践。目前,欧洲地区、加拿大和亚太地区对普通人群的推荐结直肠癌筛查起始年龄为50岁[5-7]。但随着其发病和患病的快速增长和年轻化,将结直肠癌筛查起始年龄提前引起广泛关注。美国预防服务工作组依据模型模拟结果已建议将筛查起始年龄提前至45岁[8]。在我国,虽已有多个学术团体/协会发布了结直肠癌筛查与早诊早治专家指南/意见/专家共识,但对普通人群的筛查起始年龄未能达成一致[9-11]。因此,本研究对结直肠癌高危人群进展期病变检出率的年龄变化趋势进行了描述,并进一步计算和比较了分别以50、45和40岁为筛查起始年龄的进展期病变检出率和需镜检人数差异,为我国人群结直肠癌筛查起始年龄的确定提供现实证据。
对象与方法1. 研究对象:来源于浙江省嘉善县结直肠癌早诊早治筛查项目。该项目自2007年起采用原卫生部疾控局、癌症早诊早治专家委员会推荐的《癌症早诊早治项目技术方案》中的结直肠癌优化序贯筛查方案[12]。首先,从户籍登记系统中获取当地40~74岁无高血压、心脏病、出血性倾向、精神类疾病和妊娠的居民进行粪便隐血试验(iFOBT)和结直肠癌危险因素数量化评估问卷(HRFQ)联合初筛。对象若符合以下标准中的任何一项或以上为初筛阳性,即结直肠癌高危人群:间隔1周进行2次iFOBT测定,任何一次阳性;具备以下HRFQ标准中一项或以上:①一级亲属结直肠癌史;②本人任何恶性肿瘤病史;③本人肠道息肉史;④具有慢性便秘、慢性腹泻、黏液血便、不良生活事件史、慢性阑尾炎或阑尾切除史、慢性胆道疾病史或胆囊切除史两项或以上。被初筛出的高危人群随后受邀进行肠镜检查。
2007年1月至2016年6月,嘉善县第一轮需筛查目标人群211 859例,实际完成初筛160 813例,初筛阳性人群28 710例;2016年7月至2020年12月,第二轮需筛查目标人群187 833例,实际完成初筛134 980例,初筛阳性人群32 960例。研究分别剔除第一轮和第二轮筛查中年龄、性别和/或初筛结果缺失者1 580例和1 755例,最终分别纳入27 130例和31 205例应接受肠镜检查的对象。
2. 现场初筛与肠镜检查:研究对象年龄、性别等社会人口学特征以及iFOBT检测、HRFQ相关信息收集由统一培训的乡镇卫生院医师完成。肠镜检查由嘉善县肿瘤防治所经验丰富的胃肠科医师根据标准操作步骤进行,进入深度需达回盲部,对检查过程中所见病变取活检标本,进一步由两位高年资主治医师及以上的病理科医师独立阅片和诊断。同时,对首次肠镜检查肠道准备不足者,1个月内充分准备后再行检查。
3. 结直肠进展期病变及指标定义:结直肠进展期病变包括癌和进展期腺瘤两类,为研究主要结局事件。结直肠癌指浸润达黏膜下层的恶性癌组织;进展期腺瘤指腺瘤伴中重度异型增生(或高级别上皮内瘤变)、或腺瘤直径≥10 mm、或绒毛结构≥20%的腺瘤(一般指绒毛状腺瘤或混合性腺瘤)。进展期病变检出率指被诊断为相应结直肠进展期病变的患者数占所有完成肠镜检查有病理学诊断结果者的率。需镜检人数定义为每检出1例相应结直肠进展期病变患者需要镜检的人数。
4. 统计学方法:采用频数(百分比)描述研究对象的基本特征分布,并采用χ2拟合优度检验比较基本特征的分布差异。采用基于广义加性模型的样条分析拟合结直肠进展期病变检出率的年龄变化趋势和筛查轮次差异。进一步计算分别以50、45和40岁为筛查起始年龄的结直肠进展期病变检出率和需镜检人数,并采用χ2拟合优度检验比较筛查起始年龄为50岁与45岁或40岁的检出率差异。数据分析采用R 4.0.3软件,双侧检验,以P < 0.05为差异有统计学意义。
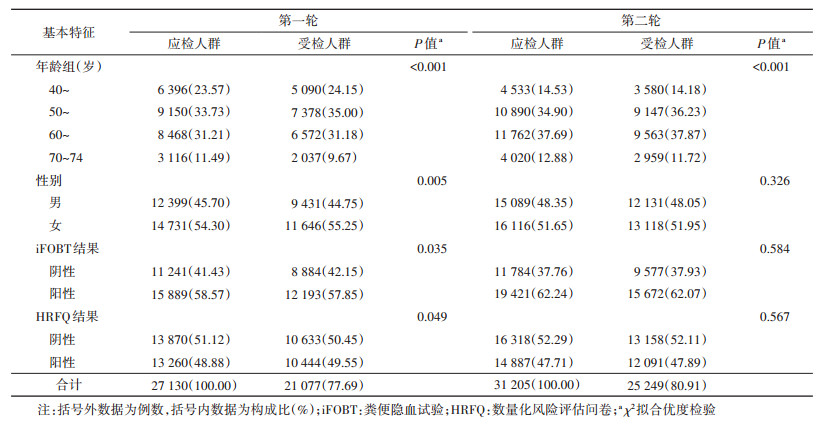
结果1. 基本特征:第一轮27 130例应检对象中50~59岁占比最高(33.73%),男、女性分别有12 399例(45.70%)和14 731例(54.30%),实际有21 077例(77.69%)接受了肠镜检查。χ2拟合优度检验表明,实际受检人群和应检人群间的年龄、性别、iFOBT和HRFQ结果分布差异均有统计学意义(P < 0.05)。第二轮31 205例应检对象中60~69岁占比最高(37.69%),男、女性分别有15 089例(48.35%)和16 116例(51.65%),实际有25 249例(80.91%)接受了肠镜检查。除年龄分布在实际受检人群与应检人群间分布差异有统计学意义外(P < 0.05),性别、iFOBT和HRFQ结果分布差异均无统计学意义。见表 1。
2. 结直肠进展期病变检出率与年龄的关系:第一轮检出进展期病变1 097例(52.05‰),包括进展期腺瘤920例(43.65‰)和结直肠癌177例(8.40‰)。第二轮检出进展期病变1 151例(45.59‰),包括进展期腺瘤995例(39.41‰)和结直肠癌156例(6.18‰)。基于广义加性模型的样条分析表明,两轮筛查中的进展期病变、进展期腺瘤和结直肠癌检出率均随年龄增长而增加(趋势检验P < 0.05),且第一轮的各类检出率均显著高于第二轮的相应检出率(P < 0.05)(图 1)。

|
| 图 1 结直肠进展期病变(癌和进展期腺瘤)检出率的年龄变化趋势 |
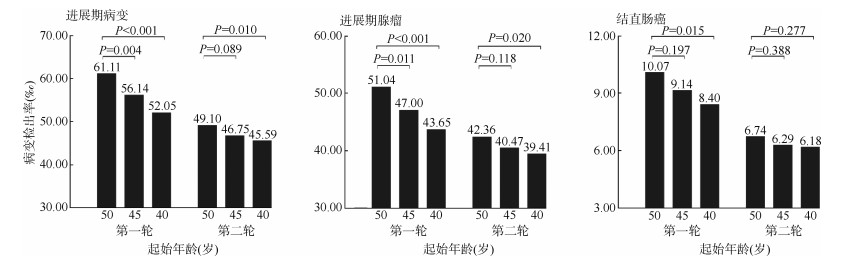
3. 起始年龄对结直肠进展期病变(癌和进展期腺瘤)检出率的影响:分别以50、45和40岁为筛查起始年龄的结直肠进展期病变检出率见图 2。前述3种起始年龄的进展期病变检出率在第一轮中依次为61.11‰、56.14‰和52.05‰,而在第二轮依次为49.10‰、46.75‰和45.59‰,均随起始年龄提前而降低。χ2拟合优度检验表明,进展期病变仅在第二轮筛查的50岁和45岁间差异无统计学意义,其他比较差异均有统计学意义(P < 0.05)。进一步区分为进展期腺瘤和结直肠癌后,进展期腺瘤的差异比较结果与进展期病变一致。而结直肠癌检出率仅在第一轮中的50岁和40岁间差异有统计学意义(P < 0.05)。
|
| 图 2 不同筛查起始年龄的结直肠进展期病变(癌和进展期腺瘤)检出率比较 |
4. 起始年龄对需镜检人数的影响:不同筛查起始年龄检出单位结直肠进展期病变(癌和进展期腺瘤)的需镜检人数结果见表 2。第一轮中,起始年龄分别为50、45和40岁时每检出1例进展期病变分别需镜检17、18和20例;第二轮中分别需镜检21、22和22例。检出单位进展期病变的需镜检人数均随筛查起始年龄提前而增加,且相同筛查起始年龄下,第一轮检出单位进展期病变的需镜检人数均低于第二轮。对于进展期腺瘤和结直肠癌的单位病变需镜检人数分析与进展期病变相近,同样随起始年龄提前而增大。
本研究利用2007-2020年浙江省嘉善县结直肠癌早诊早治筛查项目的常规数据,在第一轮27 130例和第二轮31 205例应接受肠镜检查的对象中,分别有21 077例(77.69%)和25 249例(80.91%)接受了肠镜检查,分别检出结直肠进展期病变1 097例(52.05‰)和1 151例(45.59‰),发现结直肠进展期病变检出率均随年龄增长而增加,且第一轮的结直肠进展期病变检出率显著高于第二轮。对50、45和40岁3种不同筛查起始年龄的结直肠进展期病变检出率和相应的需镜检人数进行的比较分析发现,筛查起始年龄提前可使进展期病变检出率减小,相应的需镜检人数增加。
肠镜受检率是评价结直肠癌筛查项目的关键指标,本研究两轮结直肠癌筛查的肠镜受检率与既往欧洲地区结直肠癌筛查项目报道相近(66.0%~98.9%)[13],但显著高于我国既往报道(14.0%~18.9%)[14-16]。基于较高的肠镜受检率,本研究能较真实地描述我国结直肠癌筛查项目的检出收益。同时,进展期病变检出率是反映筛查检出收益的重要指标。本研究两轮筛查的进展期病变检出率显著低于西方人群报道,略高于我国既往人群报道。如Toes-Zoutendijk等[17]基于荷兰结直肠癌筛查项目,报道55~75岁人群中不同iFOBT阳性截断值的进展期病变检出率在42.1%~49.1%。而Chen等[14]利用2012-2015年中国城市癌症早诊早治项目,对于182 927例对象的肠镜筛查结果展开的描述发现进展期病变检出率为3.32%。造成差异的主要原因可能有应用人群结直肠癌及癌前病变患病水平、高危人群筛选标准、肠镜设备与检查实施人员的主客观差异等。另外,研究发现结直肠进展期病变检出率随年龄增长而增加,该趋势与既往文献报道一致[14, 18-19]。
目前,已有多个研究组发布的结直肠癌筛查指南均将50岁作为一般人群的起始筛查年龄[5-7]。但由于结直肠癌发病和患病的快速增长和年轻化,世界各国陆续开始关注人群结直肠癌筛查起始年龄提前问题。美国癌症协会[20]和预防服务工作组[8]基于监测数据提示美国 < 50岁人群的结直肠癌发病率增速显著高于≥50岁人群,发布的最新指南中基于多种数学模型模拟结果,发现筛查年龄提前至45岁能显著减少结直肠癌发病和死亡,明显增加人群终生健康收益。在我国,国家消化系统疾病临床医学研究中心考虑到我国人口基数巨大及人均肠镜资源相对匮乏[21],推荐从50岁开始筛查[9];中国抗癌协会大肠癌专业委员会建议普通人群从40岁开始参加筛查[10];国家癌症中心建议采用风险分层法,高风险人群从40岁起、中低风险人群从50岁起接受筛查[11]。然而上述文件制定时所参考的科学证据大多源自国外人群,我国自然人群的现实收益证据仍较匮乏。李晓等[22]利用青岛市2014-2019年结直肠癌早诊早治的数据发现≥50、≥45和≥40岁人群的进展期病变检出率分别为5.10%(110/2 157)、4.72%(120/2 543)和4.46%(122/2 735)。但由于肠镜检查数量较少(2 735例)及肠镜受检率较低(25.85%),其检出率估计可能存在选择偏倚。本研究第一轮筛查分别以50、45和40岁为起始年龄的结直肠进展期病变检出率分别为61.11‰、56.14‰和52.05‰,而第二轮筛查分别为49.10‰、46.75‰和45.59‰,筛查起始年龄提前,结直肠进展期病变检出率下降,但差值较小。相应地,第一轮筛查的进展期病变需镜检人数分别为17、18和20例,第二轮分别为21、22和22例,变化也相对有限。从进展期病变检出数和肠镜消耗分析,筛查起始年龄分别为50岁和40岁时,两轮筛查差异的肠镜消耗数分别为5 090例(占所有受检对象24.15%)和3 580例(占所有受检对象14.18%),差异的进展期病变检出数分别为120例(占所有检出10.94%)和87例(占所有检出7.56%)。
本研究的主要优势是首次基于我国自然人群,利用大样本的现场数据比较了不同筛查起始年龄对结直肠进展期病变检出收益的影响;理想的肠镜受检率为较为真实地反映高危人群的肠镜检出收益提供了保障。同时,研究仍存在不足之处。首先,研究对象均来自浙江省嘉善县结直肠癌筛查项目,为单中心研究,结果代表性相对有限;其次,本研究基于已实施的结直肠癌筛查项目横断面数据,比较了不同筛查起始年龄的结直肠进展期病变检出和需镜检人数,证据参考价值相对受限。未来可进一步尝试多中心研究;采用前瞻性队列研究设计思路,进一步比较不同筛查起始年龄人群的结直肠癌发病和死亡差异,评价其长期效果。
综上所述,本研究发现结直肠癌筛查的检出收益随起始年龄提前而下降,而相应的需镜检人数增加,但实际数值差异有限。未来可进一步就我国人群结直肠癌筛查的依从性、长期生物学效果、卫生经济学效果等开展研究,为我国结直肠癌筛查指南的进一步精细化提供现实证据。
利益冲突 所有作者声明无利益冲突
作者贡献声明 杨金华:实施研究、数据整理、统计学分析、结果解释、论文撰写;费兴林、李其龙、徐增豪、高垲、白浩、李佳昱:实施研究、采集数据;唐梦龄、王建炳:研究指导、论文修改;金明娟、陈坤:项目设计、对文章的知识性内容作批评性审阅、经费支持
| [1] |
Ferlay J, Ervik M, Lam F, et al. Global cancer observatory: cancer today[EB/OL]. [2021-08-02]. https://gco.iarc.fr/today/home.
|
| [2] |
Atkin WA, Wooldrage K, Parkin DM, et al. Long term effects of once-only flexible sigmoidoscopy screening after 17 years of follow-up: The UK flexible sigmoidoscopy screening randomised controlled trial[J]. Lancet, 2017, 389(10076): 1299-1311. DOI:10.1016/S0140-6736(17)30396-3 |
| [3] |
Nishihara R, Wu KN, Lochhead P, et al. Long-term colorectal-cancer incidence and mortality after lower endoscopy[J]. N Engl J Med, 2013, 369(12): 1095-1105. DOI:10.1056/NEJMoa1301969 |
| [4] |
Zauber AG, Winawer SJ, O'Brien MJ, et al. Colonoscopic polypectomy and long-term prevention of colorectal- cancer deaths[J]. N Engl J Med, 2012, 366(8): 687-696. DOI:10.1056/NEJMoa1100370 |
| [5] |
von Karsa L, Patnick J, Segnan N, et al. European guidelines for quality assurance in colorectal cancer screening and diagnosis: Overview and introduction to the full supplement publication[J]. Endoscopy, 2013, 45(1): 51-59. DOI:10.1055/s-0032-1325997 |
| [6] |
Canadian Task Force on Preventive Health Care. Colorectal cancer screening. Recommendation statement from the Canadian Task Force on Preventive Health Care[J]. CMAJ, 2001, 165(2): 206-208. |
| [7] |
Sung JJ, Ng SC, Chan FKL, et al. An updated Asia Pacific Consensus Recommendations on colorectal cancer screening[J]. Gut, 2015, 64(1): 121-132. DOI:10.1136/gutjnl-2013-306503 |
| [8] |
Davidson KW, Barry MJ, Mangione CM, et al. Screening for colorectal cancer: US Preventive Services Task Force recommendation statement[J]. JAMA, 2021, 325(19): 1965-1977. DOI:10.1001/jama.2021.6238 |
| [9] |
国家消化系统疾病临床医学研究中心(上海), 国家消化道早癌防治中心联盟, 中华医学会消化内镜学分会, 等. 中国早期结直肠癌筛查流程专家共识意见(2019, 上海)[J]. 中华内科杂志, 2019, 58(10): 736-744. National Clinical Research Center for Digestive Diseases (Shanghai), Prevention & Treatment Center Alliance (GECA), Association of Digestive Endoscopy, Chinese Society of Medicine, et al. Chinese consensus of early colorectal cancer screening (2019, Shanghai)[J]. Chin J Intern Med, 2019, 58(10): 736-744. DOI:10.3760/cma.j.issn.0578-1426.2019.10.004 |
| [10] |
中国抗癌协会大肠癌专业委员会中国结直肠肿瘤早诊筛查策略制订专家组. 中国结直肠肿瘤早诊筛查策略专家共识[J]. 中华胃肠外科杂志, 2018, 21(10): 1081-1086. China Colorectal Cancer Early Diagnosis and Screening Strategy Development Expert Group, Large Intestinal Carcinoma Specialty Committee, Chinese Anti-Cancer association. Expert consensus on early diagnosis and screening strategies for colorectal tumors in China[J]. Chin J Gastrointest Surg, 2018, 21(10): 1081-1086. DOI:10.3760/cma.j.issn.1671-0274.2018.10.001 |
| [11] |
国家癌症中心中国结直肠癌筛查与早诊早治指南制定专家组. 中国结直肠癌筛查与早诊早治指南(2020, 北京)[J]. 中国肿瘤, 2021, 30(1): 1-28. National Cancer Center, China, Expert Group of the Development of China Guideline for the Screening, Early Detection and Early Treatment of Colorectal Cancer. China guideline for the screening, early detection and early treatment of colorectal cancer (2020, Beijing)[J]. China Cancer, 2021, 30(1): 1-28. DOI:10.11735/j.issn.1004-0242.2021.01.A001 |
| [12] |
卫生部疾病预防控制局, 癌症早诊早治项目专家委员会. 癌症早诊早治项目技术方案[M]. 北京: 人民卫生出版社, 2011: 150-189. Cancer Early Diagnosis and Treatment Project Expert Committee, Ministry of Health Disease Control and Prevention Bureau. Technical proposal of cancer early diagnosis and early treatment project[M]. Beijing: People's Medical Publishing House, 2011: 150-189. |
| [13] |
Navarro M, Nicolas A, Ferrandez A, et al. Colorectal cancer population screening programs worldwide in 2016: An update[J]. World J Gastroenterol, 2017, 23(20): 3632-3642. DOI:10.3748/wjg.v23.i20.3632 |
| [14] |
Chen HD, Li N, Ren JS, et al. Participation and yield of a population-based colorectal cancer screening programme in China[J]. Gut, 2019, 68(8): 1450-1457. DOI:10.1136/gutjnl-2018-317124 |
| [15] |
Zhang JG, Xu HF, Zheng LY, et al. Determinants of participation and detection rate of colorectal cancer from a population-based screening program in China[J]. Front Oncol, 2020, 10: 1173. DOI:10.3389/fonc.2020.01173 |
| [16] |
Lin GZ, Feng ZQ, Liu HZ, et al. Mass screening for colorectal cancer in a population of two million older adults in Guangzhou, China[J]. Sci Rep, 2019, 9(1): 10424. DOI:10.1038/s41598-019-46670-2 |
| [17] |
Toes-Zoutendijk E, van Leerdam ME, Dekker E, et al. Real-time monitoring of results during first year of Dutch colorectal cancer screening program and optimization by altering fecal immunochemical test cut-off levels[J]. Gastroenterology, 2017, 152(4): 767-775.e2. DOI:10.1053/j.gastro.2016.11.022 |
| [18] |
贺宇彤, 任萌, 胡建军, 等. 2018-2019年度河北省城市结直肠癌筛查结果分析[J]. 肿瘤防治研究, 2020, 47(9): 688-693. He YT, Ren M, Hu JJ, et al. Screening results of colorectal cancer in urban area of Hebei province, 2018-2019[J]. Cancer Res Prev Treat, 2020, 47(9): 688-693. DOI:10.3971/j.issn.1000-8578.2020.20.0218 |
| [19] |
周海, 张旋, 沈正海, 等. 2014-2017年昆明城市人群结直肠癌筛查结果分析[J]. 中华胃肠外科杂志, 2019, 22(11): 1058-1063. Zhou H, Zhang X, Shen ZH, et al. Screening of colorectal cancer in Kunming urban residents from 2014 to 2017[J]. Chin J Gastrointest Surg, 2019, 22(11): 1058-1063. DOI:10.3760/cma.j.issn.1671-0274.2019.11.009 |
| [20] |
Wolf AMD, Fontham ETH, Church TR, et al. Colorectal cancer screening for average-risk adults: 2018 guideline update from the American Cancer Society[J]. CA Cancer J Clin, 2018, 68(4): 250-281. DOI:10.3322/caac.21457 |
| [21] |
王洛伟, 辛磊, 林寒, 等. 中国消化内镜技术发展现状[J]. 中华消化内镜杂志, 2015, 32(8): 501-515. Wang LW, Xin L, Lin H, et al. The development status of digestive endoscopy in China[J]. Chin J Dig Endosc, 2015, 32(8): 501-515. DOI:10.3760/cma.j.issn.1007-5232.2015.08.001 |
| [22] |
李晓, 马恒敏, 马学真, 等. 2014-2019年山东省青岛市城市居民结直肠癌早诊早治项目筛查结果分析[J]. 中国肿瘤, 2021, 30(5): 340-345. Li X, Ma HM, Ma XZ, et al. Screening results of early diagnosis and treatment of colorectal cancer among urban residents in Qingdao City from 2014 to 2019[J]. China Cancer, 2021, 30(5): 340-345. DOI:10.11735/j.issn.1004-0242.2021.05.A004 |
 2022, Vol. 43
2022, Vol. 43