文章信息
- 吴晓亮, 叶兆嘉, 谢旭, 黄芳, 孔东锋, 冯铁建, 张顺祥, 蒋亚文.
- Wu Xiaoliang, Ye Zhaojia, Xie Xu, Huang Fang, Kong Dongfeng, Feng Tiejian, Zhang Shunxiang, Jiang Yawen
- 基于马尔科夫模型的深圳市60岁及以上人群接种流感疫苗的成本效果分析
- Based on a Markov model, cost-effectiveness analysis of influenza vaccination among people aged 60 years and older in Shenzhen
- 中华流行病学杂志, 2022, 43(7): 1140-1146
- Chinese Journal of Epidemiology, 2022, 43(7): 1140-1146
- http://dx.doi.org/10.3760/cma.j.cn112338-20211221-01005
-
文章历史
收稿日期: 2021-12-21
2. 中山大学公共卫生学院(深圳), 深圳 518107
2. School of Public Health, Sun Yat-sen University (Shenzhen), Shenzhen 518107, China
流行性感冒(流感)是由流感病毒引起的可严重危害人群健康的一种急性呼吸道传染病,是全球关注的重要公共卫生问题。据WHO的最新估计,全球每年多达65万人死于由季节性流感引起的呼吸系统疾病[1]。2019年一项研究显示,我国每年平均发生88 100例流感相关超额呼吸系统死亡,其中80%发生在≥60岁人群中,其超额死亡率(38.5/10万)显著高于 < 60岁人群(1.5/10万)[2]。调查显示,流感相关的门诊和住院治疗的平均总费用分别为155美元和1 511美元;≥60岁流感住院患者的平均住院费用(2 735美元),远高于 < 60岁住院患者(1 417~1 621美元)[3]。由于流感流行毒株可能逐年变化,疫苗接种后的有效保护期约为6~8个月,因此,每年接种流感疫苗是预防流感的方法之一。2019年中国CDC推荐≥60岁老年人为流感疫苗优先接种对象之一。巴西和澳大利亚等国家已将流感和肺炎链球菌疫苗纳入国家免疫规划[4]。流感疫苗尚未纳入我国的国家免疫规划,多数地区实行自愿自费接种,人群疫苗接种率较低[5]。为提高接种率,部分地区通过政府财政补助对老年人、学龄儿童等特定人群实施流感疫苗免费接种政策,或将疫苗纳入医疗和社会保险的支付范围[6]。深圳市于2016年10月开始实施≥60岁常住人群流感疫苗免费接种政策,并纳入市政府民生项目进行考核。流感疫苗接种的成本效果分析可为卫生行政部门制定流感综合防控策略提供卫生经济学证据,但国内的相关研究较少。为此,本研究以深圳市≥60岁常住人群为研究对象,应用马尔科夫状态转换模型,评估老年人接种流感疫苗的成本效果,为政府制定和实施免疫规划政策提供卫生经济学依据。
资料与方法1. 马尔科夫状态转换模型结构(图 1):通过健康状态、门诊和住院流感、残疾和死亡等状态来模拟老年人不同接种策略的进展过程。模型中所有的对象都从健康状态开始模拟。在流感季,所有个体都可能感染流感病毒,感染后根据疾病严重程度有3种行为:不就诊而自行治疗、门诊就诊、住院治疗,其中住院治疗的患者因病情恶化可能会发展成侵袭性肺炎球菌病(IPD)。IPD是流感常见的并发症,是指肺炎链球菌侵入与外环境无直接相通的、原本无菌的部位和组织引起的感染,主要包括脑膜炎、菌血症和菌血症性肺炎[7]。由于肺炎链球菌的侵入性感染,IPD患者有致残的风险。流感患者经治疗后可回归到健康状态,也可能因流感或其他原因而死亡。模型假设队列人数为100 000人,循环周期为1周,以深圳市≥60岁人群的平均年龄70岁作为初始年龄[8],时间跨度为5年。

|
| 注:侵袭性肺炎球菌病为过渡状态 图 1 马尔科夫状态转换模型结构图 |
2. 接种策略和疫苗接种率:疫苗接种策略有两种:每年的第40周接种1次流感疫苗和不接种疫苗。根据深圳市中老年人疫苗接种记录的数据,流感疫苗的接种率定为30%。
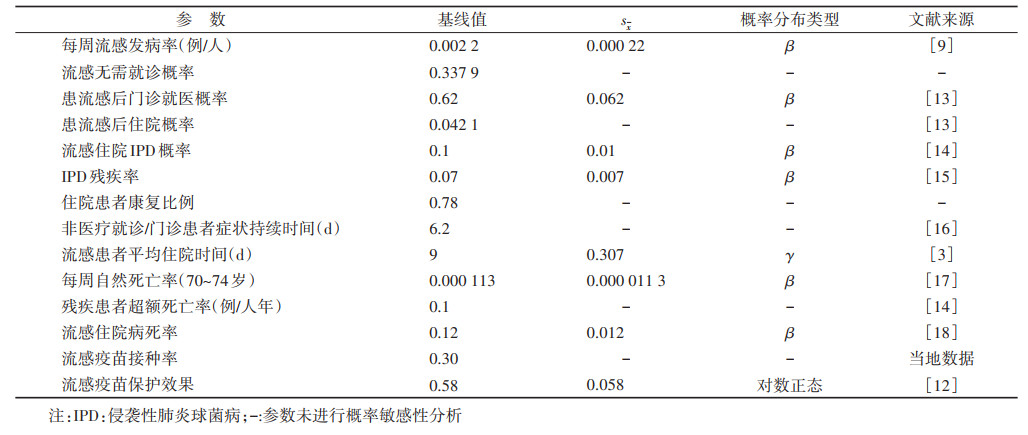
(1)流行病学数据:根据一项评估季节性流感罹患率的荟萃分析结果,未接种疫苗者的流感年罹患率为10.7%(95%CI:4.5%~23.2%)[9]。由于本研究中的马尔科夫状态转换模型以周为周期,因此需要将年发病率转化为相应的周发病率。使用指数递减(declining exponential approximation of life expectancy,DEALE)的方法实现该转换[10],公式:Pweek = 1 - e(-(-(1/52) × LN(1 - Pyear))),经计算每周流感的发病率为0.002 2。此外,为反映流感发病的季节性特征,本研究假定流感的发病率β(t)呈正弦变化[11]。具体而言,利用公式β(t) = β1 × [1 + αcos(2πt)] 来模拟流感发病的季节性变化,其中β1为流感的基线发病率,α为季节性振幅(本研究设定为1),t为模拟周期(周)。接种疫苗者的流感发病率=未接种者发病率×(1-疫苗效果×疫苗接种率)。老年人接种流感疫苗的保护效果为58%(95%CI:34%~73%)[12]。因目前文献尚缺乏我国相关的数据,门诊和住院流感患者的比例取自美国的一项回顾性研究[13]。无需就诊流感患者的比例为100%减去门诊和住院流感患者比例。流感无需就医患者的症状持续时间和门诊患者症状持续时间相同。根据文献,流感住院患者发生IPD的风险为10%,IPD患者发生残疾的概率为7%[14-16]。据我国的一项回顾性调查报道,流感患者平均住院时间为9 d[3]。流感住院患者康复率根据模型周期占平均住院时间的比例估计所得,约为0.78。
年龄别自然死亡率数据从WHO公布的中国寿命表中获得[17],70~74岁年龄组的自然死亡率为0.029,利用DEALE方法转化为相应的周自然死亡概率(0.000 113)。残疾患者的超额死亡率[14]和住院流感患者的病死率[18]数据均从已发表的文献中获得。见表 1。
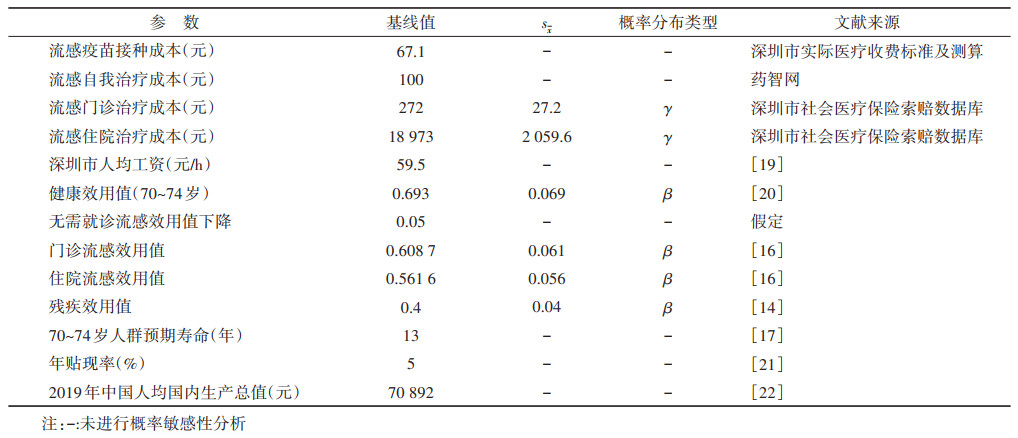
(2)成本和健康效用数据:评估疫苗接种策略的成本效果,成本包括直接成本和间接成本。直接成本包括疫苗接种成本和流感相关医疗成本,间接成本包括看护人员损失的生产力成本。流感疫苗成本根据深圳市实际医疗收费标准的每支25元,肌内注射是流感疫苗的常规注射途径,注射成本为每支25元,还包括其他成本17.1元(如疫苗损耗、宣传、培训等)。流感无需就诊患者多采用非处方药(OTC)进行治疗,按常见的OTC感冒药、退热药的价格估算其治疗成本约为100元。流感门诊(272元)和住院治疗成本(24 394元)通过分析深圳市社会医疗保险支付数据库所得。见表 2。
间接成本采用人力资本法来衡量。≥60岁为我国法定退休年龄,故间接成本仅考虑照顾残疾患者所需的看护人员生产力成本。根据残疾者每天需要看护的时间(假定为2 h)和深圳市平均每小时工资水平来计算。2019年深圳市城镇非私营单位就业人员年平均工资为125 612元[19],平均工作时间假定为每月22 d,每天8 h,则平均工资为59.5元/h。
使用质量调整生命年(QALYs)作为健康收益指标,该指标综合评估患者在干预措施下的生存质量和生存数量,由各马尔科夫状态的健康效用值与个体处于该状态下的时间相乘所得。模型中特定年龄健康效用值取自Sun等[20]使用欧洲五维健康量表(EQ-5D)计算的中国一般人群不同年龄的健康效用分数。本研究假定无需就诊流感患者效用值下降0.05。流感门诊和住院患者的健康效用数据取自一项回顾性研究[16],该研究同样采用EQ-5D调查并计算中国流感患者不同疾病状态的效用分数。由于目前中国缺乏IPD所致残疾的效用权重,故其效用值取自国外已发表的文献[14]。此外,本研究还考虑了死亡损失的QALYs,根据寿命表中的特定年龄预期寿命和特定年龄效用值计算所得。根据《中国药物经济学评价指南(2019版)》的建议[21],对模型中的成本和健康收益按照5%的年贴现率进行贴现(每周贴现率=e(ln (1 + 5%/52))-1=0.001)。
3. 成本效果分析和敏感性分析:采用增量成本效果比(incremental cost-effectiveness ratio,ICER)作为成本效果评价指标,该指标表示与未接种疫苗组相比,接种疫苗组平均多获得1个QALYs需要多投入的成本,计算公式为ICER = 

为评估参数不确定性对基线结果的影响,进行单因素和概率敏感性分析。在单因素敏感性分析中,一个参数用不同的值进行测试,而其他参数保持不变。除贴现率采用3%和8%进行分析外,其他参数都在其95%CI或基线值的±20%的变化范围内进行分析,结果以旋风图呈现。采用蒙特卡罗模拟进行概率敏感性分析以评估参数整体不确定性对模型结果的影响。根据模型参数的平均值和标准误,同时从每个参数的适当分布函数中进行采样,其中成本和住院时间数据采用Gamma分布,效用值和转移概率数据采用Beta分布,疫苗效果采用对数正态分布。对模型进行了1 000次模拟,并重新计算两种接种策略的成本和QALYs。概率敏感性分析的结果以成本效果平面散点图和成本效果可接受曲线表示。采用Excel 2019和TreeAge Pro 2019软件进行分析。
结果1. 基线分析:
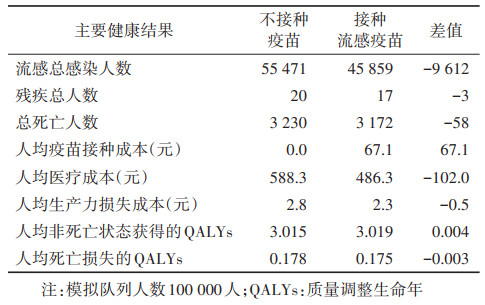
(1)主要健康产出结果:通过模型模拟,在研究期限5年内,与不接种疫苗相比,每年接种流感疫苗共避免9 612人感染流感,3人残疾和58人死亡;人均疫苗接种成本为67.1元,人均节约流感相关医疗成本102.0元和生产力损失成本0.5元。见表 3。
(2)成本效果分析结果:在研究期限5年内,与不接种疫苗相比,每年接种流感疫苗人均节约总成本35元并且多获得0.007个QALYs,人均获得的NMB为529元,为绝对优势策略。
2. 敏感性分析:
(1)单因素敏感性分析:模型关键参数在单因素敏感性分析的取值范围内所得的NMB均 > 0(图 2),表明接种流感疫苗是具有成本效果的,基线结果具有稳健性。在其他因素保持不变的情况下,每周流感发生率和疫苗保护效果是影响基线结果最重要的2个因素。当每周流感发病率和疫苗保护效果取95%CI下限值时,流感疫苗接种策略是具有成本效果的,ICER值分别为8 879.3元/QALY和1 388.4元/QALYs;当每周流感发病率和疫苗保护效果取95%CI上限值时,接种流感疫苗是成本节约的,人均获得的净货币效益分别为1 307元和638元。
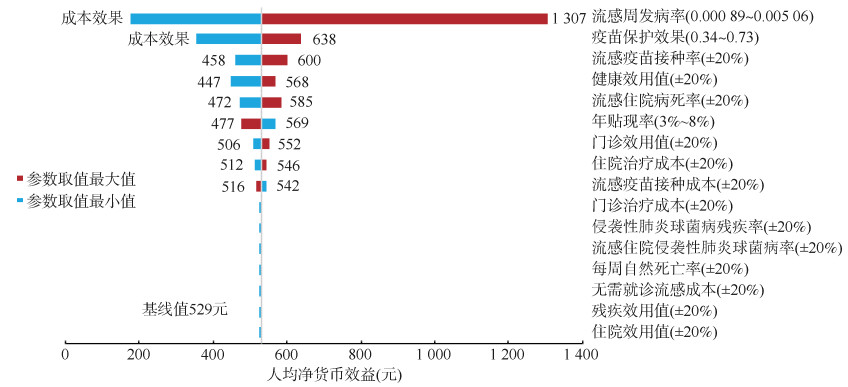
|
| 图 2 单因素敏感性分析旋风图 |
(2)概率敏感性分析:对模型进行1 000次蒙特卡罗模拟,在以一倍2019年我国人均GDP(70 892元)为WTP阈值的情况下,接种流感疫苗与不接种疫苗相比,所有的散点均落在阈值线以下(图 3),表明成本效果分析结果是稳健的。人均节约成本37.2元(95%CI:36.0~38.3),人均多获得0.007 0个QALYs(95%CI:0.006 9~0.007 1)。成本效果可接受曲线显示了在不同WTP阈值下,干预策略具有成本效果的概率。当WTP阈值为70 892元/QALY时,流感疫苗接种策略具有成本效果的概率为100%(图 4)。
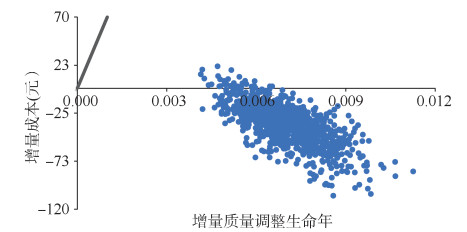
|
| 图 3 成本效果平面散点图 |
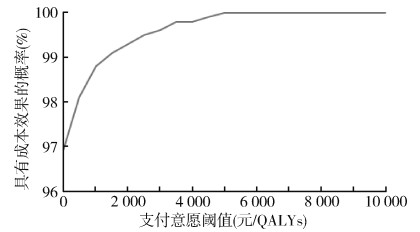
|
| 注:QALYs:质量调整生命年 图 4 成本效果可接受曲线 |
本研究应用马尔科夫状态转换模型从社会角度评估深圳市≥60岁人群接种流感疫苗的成本效果。与不接种疫苗相比,接种流感疫苗可降低人群流感相关的健康和经济负担,属于绝对优势策略。当模型关键参数在合理范围内变化时,人均获得的净货币效益均 > 0,表明成本效果分析结果是稳健的。概率敏感性分析的结果显示,当以2019年中国人均GDP为支付意愿阈值时,接种流感疫苗具有成本效果的概率为100%。本研究分析结果与既往研究结果一致[18, 23],进一步证实了老年人接种流感疫苗具有良好的健康和经济效益。
从单因素敏感性分析的结果来看,流感发病率和流感疫苗保护效果是影响模型结果的主要因素。本研究发现,NMB与流感发病率和流感疫苗保护效果之间存在正相关关系,表明随着流感发病率和流感疫苗保护效果的逐渐升高,接种流感疫苗可获得的净货币效益更多,即更具成本效果,该结果与其他地区的研究结果一致。如果在流感季节开始前,人人都接种了流感疫苗,但流感发生率很低,免疫成本可能被浪费。另一方面,当流感发生率高且流感疫苗的保护效果较高时,能避免大量的流感病例发生,从而减轻流感经济负担和QALYs损失,收获好的社会经济利益。
目前中国居民的流感疫苗接种率相对较低。据Zhou等[5]报道,2011-2012流感季,我国9个城市 > 60岁居民的流感疫苗接种率仅为4.3%。实施免费接种政策或将疫苗接种纳入医疗或社会保险的报销范围是提高疫苗接种率、预防流感的有效方法。在发达国家,特别是实施流感疫苗免费接种政策的国家,流感疫苗的接种率相对较高。澳大利亚自1999年起向老年人提供免费的流感疫苗接种后,2001年流感疫苗的接种率达78%[24]。我国目前仅北京市、广东省深圳市、新疆维吾尔自治区克拉玛依市和河南省新乡市等地区为老年人提供免费的流感疫苗,广东省珠海市和浙江省宁波市则将流感疫苗接种纳入医疗或社会保险的支付范畴[6],这些地方性措施显著提高了当地的疫苗接种率。北京市自2007年实施流感疫苗免费接种政策后,2012年老年人流感疫苗的接种率约为39%,较之前明显提高[25]。由于卫生资源的有限性,特别是对中、低收入发展中国家而言,如何实施流感疫苗的接种策略、提高接种率,迫切需要进行广泛而全面的卫生经济学评价,以确保公共资源的投入带来良好的社会经济效益。深圳市老年人流感疫苗免费接种政策收到良好的经济效益。按本研究结果分析,一个老年人口规模100万的城市,如果按30%的接种率实施≥60岁人群流感疫苗免费接种,每年可为政府和社会减少流感相关的医疗成本及生产力损失成本近1 050万元,带来近1.59亿元的净货币效益。该研究结果将为其他地区公共卫生决策者提供经济学决策依据。
本研究存在局限性。一是深圳市流感免费项目实施过程中无严重不良反应报告。为了简化模型,本研究未考虑疫苗接种的不良反应,可能就造成成本的过小估计。据文献报道[26],老年人接种流感疫苗是安全的。常见的不良反应为一过性的局部反应,如注射部位疼痛、红斑、肿胀等,全身性不良反应极少发生。二是由于数据的可及性,IPD致残率、残疾效用值等数据从国外文献中提取。由于自然和社会环境不同,这些数据不能很好地代表中国居民的实际情况,但从单因素敏感性分析的结果来看,在目前的WTP阈值下,这些数据的不确定性对基线结果没有显著影响。当相应的数据可获得时,将进一步开展研究,为决策者提供更为准确的信息。另外,本研究没有考虑疫苗接种的群体免疫效果。随着人群接种率提升,减少了传染源,对未接种疫苗人群能产生保护作用。因此,深圳市流感疫苗免费接种的实际健康收益可能大于本研究结果。最后,本研究采用静态模型进行分析,假定流感的基线感染率是固定值,虽然考虑了流感发病的季节性特征,未能反映流感的动态传染过程。虽然,WHO免疫规划经济学评价指南的建议[27],老年人的流感疫苗接种计划采用静态模型进行评价是合适的。进一步的卫生经济学评价将使用动态传播模型[28],把感染率作为人群中感染者数量的函数来建模,并考虑群体免疫的影响以期得到更准确的结果。
综上所述,与不接种疫苗相比,≥60岁人群接种流感疫苗是一项成本节约的疾病预防策略。流感发病率和流感疫苗保护效果是影响成本效果分析结果的主要因素。
利益冲突 所有作者声明无利益冲突
作者贡献声明 吴晓亮:论文撰写;叶兆嘉:数据收集及项目总体协调;谢旭、黄芳:协调数据收集;孔东锋:数据收集;冯铁建:项目指导;张顺祥、蒋亚文:数据统计分析
| [1] |
WHO. Up to 650 000 people die of respiratory diseases linked to seasonal flu each year[EB/OL]. (2017-12-13)[2021-12-01]. https://www.who.int/news/item/13-12-2017-up-to-650-000-people-die-of-respiratory-diseases-linked-to-seasonal-flu-each-year.
|
| [2] |
Li L, Liu YN, Wu P, et al. Influenza-associated excess respiratory mortality in China, 2010-15: a population- based study[J]. The Lancet Public Health, 2019, 4(9): e473-481. DOI:10.1016/s2468-2667(19)30163-x |
| [3] |
Yang J, Jit M, Leung KS, et al. The economic burden of influenza-associated outpatient visits and hospitalizations in China: a retrospective survey[J]. Infect Dis Poverty, 2015, 4: 44. DOI:10.1186/s40249-015-0077-6 |
| [4] |
National Health Service. The NHS vaccination schedule[EB/OL]. (2019-07-30)[2021-12-01]. http://www.nhs.uk/Conditions/vaccinations/Pages/vaccination-schedule-age-checklist.aspx.
|
| [5] |
Zhou L, Su QR, Xu Z, et al. Seasonal influenza vaccination coverage rate of target groups in selected cities and provinces in China by season (2009/10 to 2011/12)[J]. PLoS One, 2013, 8(9): e73724. DOI:10.1371/journal.pone.0073724 |
| [6] |
Yang J, Atkins KE, Feng LZ, et al. Seasonal influenza vaccination in China: Landscape of diverse regional reimbursement policy, and budget impact analysis[J]. Vaccine, 2016, 34(47): 5724-5735. DOI:10.1016/j.vaccine.2016.10.013 |
| [7] |
中华预防医学会. 肺炎链球菌性疾病相关疫苗应用技术指南(2012版)[J]. 中华流行病学杂志, 2012, 33(11): 1101-1110. Chinese Preventive Medicine Association. Technical guideline on application of pneumococcal vaccine in China (2012)[J]. Chin J Epidemiol, 2012, 33(11): 1101-1110. DOI:10.3760/cma.j.issn.0254-6450.2012.11.001 |
| [8] |
国家统计局. 2019中国统计年鉴[M]. 北京: 中国统计出版社, 2019. National Health Commission of the People's Republic of China. 2019 Chinese health statistics yearbook[M]. Beijing: China Statistics Press, 2019. |
| [9] |
Somes MP, Turner RM, Dwyer LJ, et al. Estimating the annual attack rate of seasonal influenza among unvaccinated individuals: A systematic review and meta-analysis[J]. Vaccine, 2018, 36(23): 3199-3207. DOI:10.1016/j.vaccine.2018.04.063 |
| [10] |
Beck JR, Pauker SG, Gottlieb JE, et al. A convenient approximation of life expectancy (the "DEALE"): Ⅱ. Use in medical decision-making[J]. Am J Med, 1982, 73(6): 889-897. DOI:10.1016/0002-9343(82)90787-2 |
| [11] |
Dushoff J, Plotkin JB, Levin SA, et al. Dynamical resonance can account for seasonality of influenza epidemics[J]. Proc Natl Acad Sci USA, 2004, 101(48): 16915-16916. DOI:10.1073/pnas.0407293101 |
| [12] |
Demicheli V, Jefferson T, Ferroni E, et al. Vaccines for preventing influenza in healthy adults[J]. Cochrane Database Syst Rev, 2018, 2. DOI:10.1002/14651858.CD001269.pub6 |
| [13] |
Molinari NAM, Ortega-Sanchez IR, Messonnier ML, et al. The annual impact of seasonal influenza in the US: measuring disease burden and costs[J]. Vaccine, 2007, 25(27): 5086-5096. DOI:10.1016/j.vaccine.2007.03.046 |
| [14] |
Yang J, Jit M, Zheng YM, et al. The impact of influenza on the health related quality of life in China: an EQ-5D survey[J]. BMC Infect Dis, 2017, 17(1): 686. DOI:10.1186/s12879-017-2801-2 |
| [15] |
Smith KJ, Lee BY, Nowalk MP, et al. Cost-effectiveness of dual influenza and pneumococcal vaccination in 50-year-olds[J]. Vaccine, 2010, 28(48): 7620-7625. DOI:10.1016/j.vaccine.2010.09.053 |
| [16] |
Caldwell R, Roberts CS, An ZJ, et al. The health and economic impact of vaccination with 7-valent pneumococcal vaccine (PCV7) during an annual influenza epidemic and influenza pandemic in China[J]. BMC Infect Dis, 2015, 15: 284. DOI:10.1186/s12879-015-1021-x |
| [17] |
World Health Organization. Life tables by country, China[EB/OL]. (2020-12-06)[2021-12-01]. http://apps.who.int/gho/data/?theme=main&vid=60340.
|
| [18] |
Jiang MH, Li PC, Wang WH, et al. Cost-effectiveness of quadrivalent versus trivalent influenza vaccine for elderly population in China[J]. Vaccine, 2020, 38(5): 1057-1064. DOI:10.1016/j.vaccine.2019.11.045 |
| [19] |
深圳市统计局. 2019年深圳市城镇单位就业人员年平均工资数据公报[EB/OL]. (2020-06-29)[2021-12-01]. http://tjj.sz.gov.cn/zwgk/zfxxgkml/qt/tzgg/content/post_7829822.html.
|
| [20] |
Sun S, Chen JY, Johannesson M, et al. Population health status in China: EQ-5D results, by age, sex and socio-economic status, from the National Health Services Survey 2008[J]. Qual Life Res, 2011, 20(3): 309-320. DOI:10.1007/s11136-010-9762-x |
| [21] |
Writing group of Chinese Pharmacoeconomic evaluations. China guidelines for pharmacoeconomic evaluations 2019[Z]. Beijing, China: Chinese Pharmaceutical Association, 2019.
|
| [22] |
National bureau of statistics[EB/OL]. (2020-11-30)[2021-12-01]. http://data.stats.gov.cn/easyquery.htm?cn=C01.
|
| [23] |
Choi EJ, Park JH, Chun BC. Cost effectiveness of trivalent and quadrivalent influenza vaccines in 50- to 64-year-old adults in Korea[J]. Vaccine, 2020, 38(32): 5002-5008. DOI:10.1016/j.vaccine.2020.05.065 |
| [24] |
Horby PW, Williams A, Burgess MA, et al. Prevalence and determinants of influenza vaccination in Australians aged 40 years and over-a national survey[J]. Aust N Z J Public Health, 2005, 29(1): 35-37. DOI:10.1111/j.1467-842x.2005.tb00745.x |
| [25] |
Lv M, Fang RF, Wu J, et al. The free vaccination policy of influenza in Beijing, China: The vaccine coverage and its associated factors[J]. Vaccine, 2016, 34(18): 2135-2140. DOI:10.1016/j.vaccine.2016.02.032 |
| [26] |
Govaert TM, Dinant GJ, Aretz K, et al. Adverse reactions to influenza vaccine in elderly people: randomised double blind placebo controlled trial[J]. BMJ, 1993, 307(6910): 988-990. DOI:10.1136/bmj.307.6910.988 |
| [27] |
Walker DG, Hutubessy R, Beutels P. WHO Guide for standardisation of economic evaluations of immunization programmes[J]. Vaccine, 2010, 28(11): 2356-2359. DOI:10.1016/j.vaccine.2009.06.035 |
| [28] |
Edmunds WJ, Medley GF, Nokes DJ. Evaluating the cost-effectiveness of vaccination programmes: a dynamic perspective[J]. Stat Med, 1999, 18(23): 3263-3282. DOI:10.1002/(sici)1097-0258(19991215)18:23<3263::aid-sim315>3.0.co;2-3 |
 2022, Vol. 43
2022, Vol. 43