文章信息
- 汪涵, 张艺倩, 余灿清, 郭彧, 裴培, 陈君石, 陈铮鸣, 吕筠, 李立明, 代表中国慢性病前瞻性研究项目协作组.
- Wang Han, Zhang Yiqian, Yu Canqing, Guo Yu, Pei Pei, Chen Junshi, Chen Zhengming, Lyu Jun, Li Liming, for the China Kadoorie Biobank Collaborative Group
- 中国成年人睡眠状况与肾结石风险的前瞻性队列研究
- Associations between sleep status and risk for kidney stones in Chinese adults: a prospective cohort study
- 中华流行病学杂志, 2022, 43(7): 1002-1009
- Chinese Journal of Epidemiology, 2022, 43(7): 1002-1009
- http://dx.doi.org/10.3760/cma.j.cn112338-20210930-00760
-
文章历史
收稿日期: 2021-09-30
2. 北京大学公众健康与重大疫情防控战略研究中心, 北京 100191;
3. 中国医学科学院阜外医院, 国家心血管病中心, 北京 100037;
4. 中国医学科学院, 北京 100730;
5. 国家食品安全风险评估中心, 北京 100022;
6. 英国牛津大学临床与流行病学研究中心纳菲尔德人群健康系, 英国 OX3 7LF;
7. 北京大学分子心血管学教育部重点实验室, 北京 100191
2. Peking University Center for Public Health and Epidemic Preparedness & Response, Beijing 100191, China;
3. Fuwai Hospital, Chinese Academy of Medical Sciences, National Center for Cardiovascular Diseases, Beijing 100037, China;
4. Chinese Academy of Medical Sciences, Beijing 100730, China;
5. China National Center for Food Safety Risk Assessment, Beijing 100022, China;
6. Clinical Trial Service Unit and Epidemiological Studies Unit, Nuffield Department of Population Health, University of Oxford, Oxford OX3 7LF, UK;
7. Key Laboratory of Molecular Cardiovascular Sciences (Peking University), Ministry of Education, Beijing 100191, China
肾结石是尿液中矿物质过度饱和而形成的结晶体,通常位于肾盏和肾盂,可游离或附着于肾乳头,是泌尿系统的常见疾病之一[1]。肾结石通常呈急性发作,症状包括腰背疼痛、血尿、恶心、呕吐等;可导致尿路感染、急性肾功能损伤、输尿管狭窄等不良结局,严重损害机体健康[2]。过去几十年,全球肾结石的发病率呈现快速增长趋势[3]。例如,美国明尼苏达州成年人的肾结石发病率(/10万人年)从1984年的95增长到2012年的254[4];德国人群从1979年的120增长为2000年的720[5];日本人群则从1965年的54增长为2005年的114[6]。当前,亚洲、欧洲及南美洲地区人群的肾结石患病率分别为1%~19%、5%~10%和4%[7]。在首次发病后的5年内,肾结石的复发率高达30%[8]。肾结石的高发病率、高复发率与不可预测性给个人、卫生系统和社会造成了较大的负担[9]。
睡眠是影响健康的重要生活方式之一。既往研究表明,睡眠状况与冠心病、卒中、糖尿病、慢性肾病、恶性肿瘤、抑郁症等多种疾病相关[10-14]。睡眠状况是否也会影响肾结石风险,相关研究仍非常有限。仅有一项研究报告了打鼾与肾结石风险之间的关联,其他睡眠因素(如失眠、白天嗜睡、午休、睡眠时间等)对肾结石风险的影响尚无研究[15]。本研究基于中国慢性病前瞻性研究(China Kadoorie Biobank,CKB)50余万人的长期随访数据,分析中国成年人睡眠状况与肾结石风险之间的关联。
对象与方法1. 研究对象:2004-2008年,CKB项目在全国5个城市和5个农村地区招募研究对象并完成基线调查。项目的详细介绍参见文献[16-18]。可开展分析的研究对象共512 725名。本研究剔除基线自报患有慢性肾病(n=7 575)、恶性肿瘤(n=2 578)、自报睡眠时间为极端值(≤2或≥13 h/d,n=968)、BMI缺失(n=2)的研究对象,共纳入501 701人。
2. 睡眠状况评价:通过调查员当面询问获得以下5个方面。
(1)失眠症状:询问过去1个月内是否出现以下情况:①入睡困难:每周有≥3 d需要半小时以上方可入睡(包括半夜醒来后);②过早醒来:每周有≥3 d早上很早醒来,并难以重新入睡;③使用安眠药:每周有≥1 d需要服用安眠药(西药或中药)以帮助睡眠。任何一项回答为“是”即定义为有失眠症状。
(2)白天嗜睡:询问过去1个月内,是否每周有≥3 d因睡眠不佳,白天在工作、吃饭或和别人交谈时难于保持清醒。
(3)午休:询问是否有午休的习惯(一年四季均有、只在夏天有、没有)。
(4)打鼾:询问睡觉时是否有打鼾的习惯(经常有、有时有、没有/不知道)。
(5)睡眠时间:询问通常情况下,平均每天睡几个小时(包括午休)。CKB项目在基线调查后1~2周内随机抽取约3.1%的研究对象,对问卷中部分核心问题进行质量控制调查。共调查15 728人,两次调查中自报睡眠时间的Spearman相关系数为0.63。
参考既往相关研究[19],本研究根据3个睡眠因素(失眠症状、白天嗜睡情况、睡眠时间)构建睡眠评分。将无失眠症状、无白天嗜睡、睡眠时间≥7 h/d,分别赋值为1,不满足则赋值为0。3个睡眠因素得分相加即为睡眠评分。睡眠评分的取值范围为0~3分,分值越高表明睡眠质量越高。
3. 协变量评价:基线调查时由经过统一培训的调查员询问获得:①社会人口学信息:年龄、性别、文化程度、职业、家庭年收入;②生活方式:吸烟状况,体力活动,饮茶、饮酒状况,红肉、乳制品、新鲜蔬菜、新鲜水果的摄入状况,维生素片、钙铁锌片的服用情况;③个人健康状况:高血压、糖尿病、冠心病、卒中/小卒中、胆结石/胆囊炎的基线患病状况,利尿剂的服用情况。身高(m)、体重(kg)、腰围(cm)均使用经统一校正的工具测量。BMI=体重(kg)/身高(m)2。
4. 结局评价:CKB项目通过多种途径获取研究对象随访期间的发病与死亡信息,包括全民医保数据库、常规疾病与死亡监测系统及主动的定向监测。疾病编码采用国际疾病分类第10版(ICD-10)。本研究的结局事件包括随访期间首次记录的肾与输尿管结石(N20)、未特指肾绞痛(N23)。
5. 统计学分析:描述不同睡眠评分组人群的基线特征,连续变量采用一般线性回归模型,分类变量采用logistic回归模型,报告调整年龄、性别和地区后的均数或构成比。
人年计算自基线调查完成后开始,直到出现研究的结局、死亡、失访或2017年12月31日为止。采用Cox比例风险回归模型分析睡眠状况与肾结石风险之间的关联,以年龄为时间尺度,按年龄(5岁一组)和项目地区(10个地区)联合分层,估计风险比(HR)及95%CI。模型分步调整已知或可能的混杂因素。模型1调整性别(男、女)。模型2进一步调整文化程度(未正规上学、小学、初中、高中、大专、大学及以上),职业(农林牧渔劳动者、工人、行政及管理人员、专业技术人员、销售及服务工作人员、离退休、家务、私营业主、待业/下岗、其他),家庭年收入(< 2 500、2 500~、5 000~、10 000~、20 000~、≥35 000元),吸烟(从不/偶尔吸、非因病戒烟、当前吸烟或因病戒烟前1~14、15~24、≥25支/d),体力活动水平(MET-h/d),饮茶(从不饮茶、非每日饮茶、每日饮茶1~2、3~4、5~6、≥7杯),饮酒(从不饮酒、非每日饮酒、每日饮酒 < 30.0、30.0~、60.0~、≥90.0 g纯乙醇),红肉、乳制品、新鲜蔬菜、新鲜水果的摄入状况(根据类别中点值赋值:不吃/极少吃=0、每月吃数次=0.5、每周有1~3 d吃=2、每周有4~6 d吃=5、每天都吃=7;按连续变量调整),过去1年内持续服用维生素片、钙铁锌片(是、否)。模型3进一步调整BMI(kg/m2)、腰围(cm)、高血压、糖尿病的基线患病状况(是、否)。
为检验结果的稳健性,本研究进行了敏感性分析:①剔除基线调查后两年内发生肾结石的研究对象;②剔除随访期内发生未特指肾绞痛(N23)的研究对象;③额外调整冠心病、卒中/小卒中、胆结石/胆囊炎的基线患病状况,利尿剂的使用情况。
本研究根据不同的基线特征进行亚组分析,交互检验采用似然比检验,比较有、无交互项模型的差异是否有统计学意义。采用Stata 15.0软件进行数据分析,所有检验均为双侧检验,以P < 0.05为差异有统计学意义。
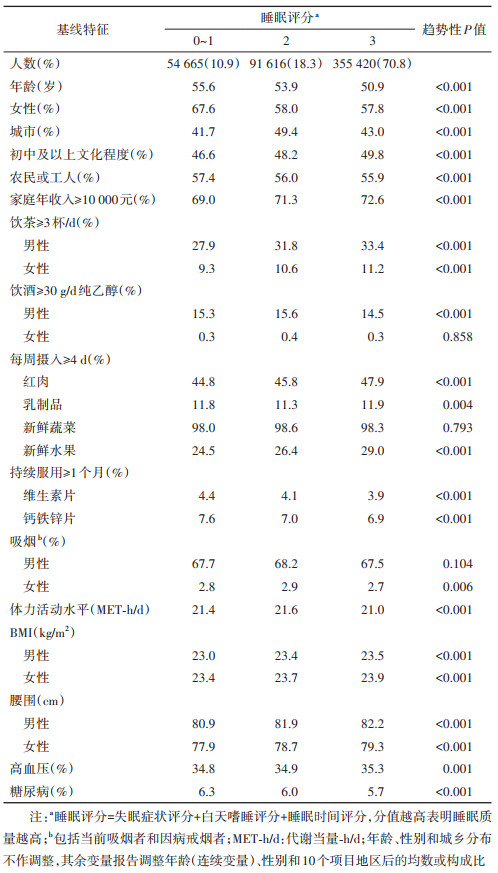
结果1. 基线特征:纳入分析的501 701名研究对象的基线年龄为(52.0±10.7)岁,女性占58.9%,城市居民占44.0%。各睡眠评分组的基线特征见表 1。与睡眠评分为0~1分(睡眠质量较低)者相比,睡眠评分越高,年龄越小,男性比例越高,每天饮茶≥3杯、每周摄入红肉及新鲜水果≥4 d的比例越高,BMI越高,腰围越大。
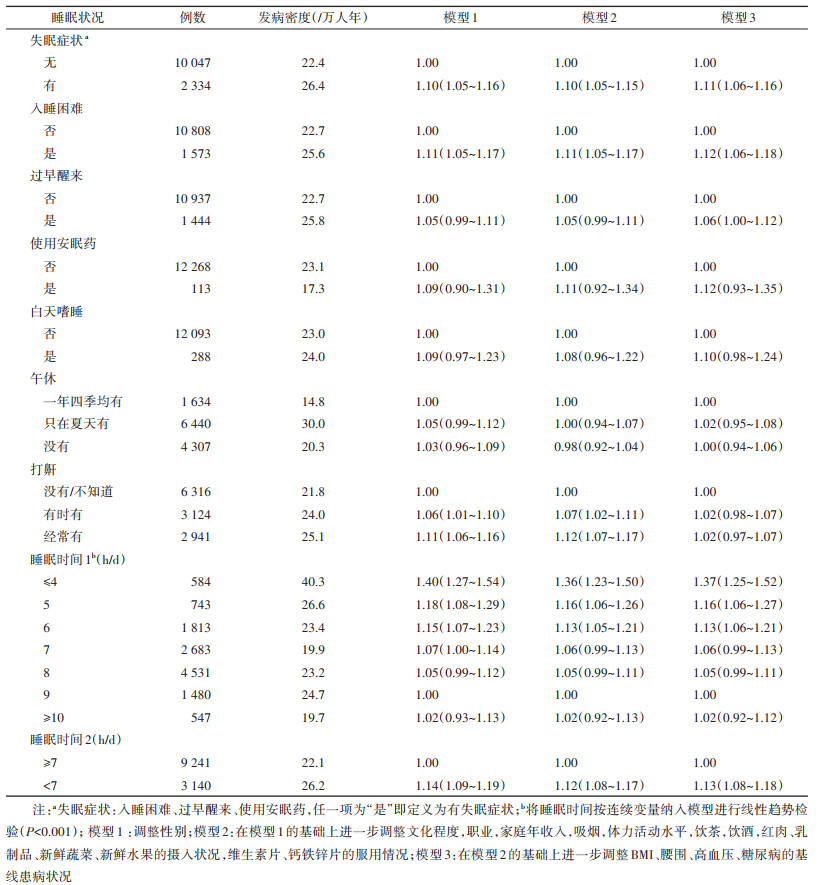
2. 睡眠状况与肾结石风险的关联:纳入分析的研究对象随访(10.7±2.2)年,累计随访5 376 879人年。随访期间,首次记录的肾结石病例共12 381例。调整潜在混杂因素后,与无失眠症状者相比,有失眠症状者的肾结石风险增加11%(HR=1.11,95%CI:1.06~1.16)(表 2)。其中,入睡困难、过早醒来对应的HR值(95%CI)分别为1.12(1.06~1.18)、1.06(1.00~1.12),使用安眠药与肾结石风险无统计学显著的关联。白天嗜睡、午休、打鼾与肾结石风险均不存在统计学显著的关联。
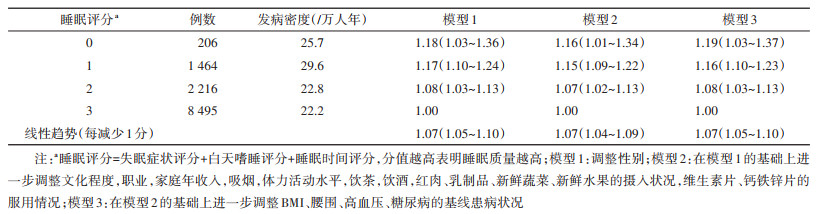
对于睡眠时间,与每天睡9 h者相比,睡眠时间为≤4、5、6、7、8、≥10 h/d者对应的HR值(95%CI)分别为1.37(1.25~1.52)、1.16(1.06~1.27)、1.13(1.06~1.21)、1.06(0.99~1.13)、1.05(0.99~1.11)、1.02(0.92~1.12)(趋势P < 0.001)。与睡眠时间≥7 h/d者相比,睡眠时间 < 7 h/d者的肾结石风险增加13%(HR=1.13,95%CI:1.08~1.18)(表 2)。调整潜在混杂因素后,与睡眠评分为3分(睡眠质量最高)者相比,睡眠评分为2、1、0分者对应的HR值(95%CI)分别为1.08(1.03~1.13)、1.16(1.10~1.23)、1.19(1.03~1.37)(表 3)。睡眠评分每减少1分,肾结石风险的HR值增加7%(HR=1.07,95%CI:1.05~1.10)。敏感性分析未明显改变上述各关联分析的结果(结果未展示)。
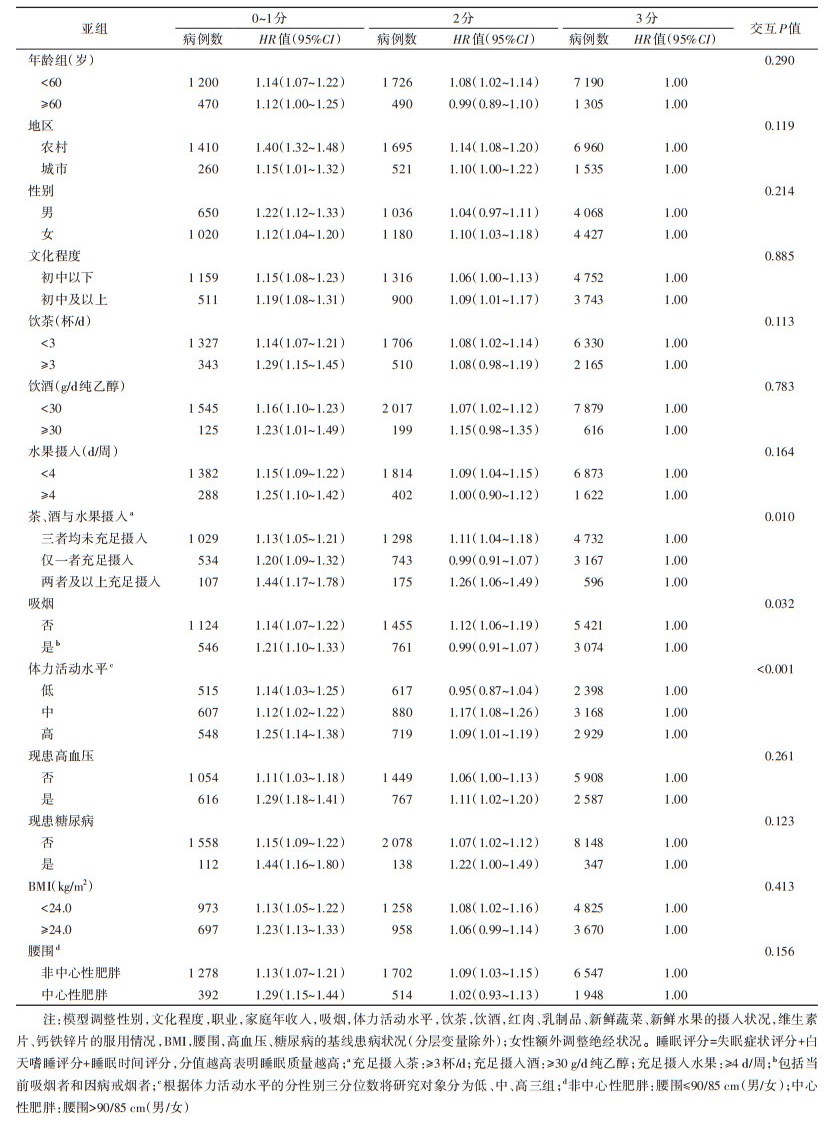
3. 亚组分析:睡眠评分与肾结石风险的关联在不同茶、酒与水果摄入状况、吸烟状况、体力活动水平人群中不完全一致(交互P=0.010、0.032和 < 0.001)(表 4)。低睡眠评分(0~1分)与肾结石风险的关联效应值在充足摄入茶、酒或水果、吸烟、高体力活动水平的人群中更高。按其他基线特征进行亚组分析时,未发现有统计学意义的交互作用(均交互P > 0.05)。
本研究利用大规模的中国人群前瞻性队列数据,分析了睡眠状况与肾结石风险之间的关联。结果显示,肾结石风险在有失眠症状或睡眠时间短的研究对象中增加。与睡眠质量最高(睡眠评分为3分)者相比,睡眠质量最低(睡眠评分为0分)者的肾结石风险增加19%。
一项来自中国台湾地区的研究纳入39 124人,平均随访5.6年,发现打鼾者的肾结石发生风险增加(HR=1.35,95%CI:1.23~1.48);研究者指出,打鼾导致组织间歇性缺氧、诱发氧化应激,机体产生胰岛素抵抗,从而使尿酸增加、尿柠檬酸盐降低,促进肾结石形成[15]。该项研究仅在模型中调整了年龄、性别和既往疾病史,未对膳食、体力活动、BMI、腰围等生活方式相关的协变量进行调整,难以确定目前的结果是否受混杂偏倚影响。本研究未发现打鼾与肾结石风险之间存在统计学显著性关联。既往研究表明失眠症状、白天嗜睡情况、午休习惯与多种疾病的发生风险有关,包括心脑血管疾病、糖尿病、恶性肿瘤、慢性肾病等[10-13];但尚无研究报告其与肾结石风险之间的关联。本研究中,入睡困难和过早醒来两个失眠症状与肾结石风险存在正向关联;午休习惯与肾结石风险不存在统计学显著性关联。由于当前人群中自报使用安眠药和白天嗜睡的人数较少,不排除相关分析的统计学效力不足。很多研究发现睡眠时间过短或过长均会对健康产生不良影响,如导致死亡、心血管疾病、2型糖尿病、认知障碍、跌倒等风险升高[20]。本研究发现,肾结石风险增加主要出现在睡眠时间 < 7 h/d者中。
既往有研究通过构建睡眠评分来综合反映个体的睡眠质量,进而评价睡眠质量与不同疾病结局的关联。例如,一项在中国台湾地区人群中开展的研究纳入194 039人,平均随访5.6年,根据失眠状况、睡眠时间构建睡眠评分,发现与睡眠评分 > 6分(睡眠质量最高)者相比,睡眠评分为4~6分和 < 4分者的慢性肾病风险分别增加7%和61%[12]。另一项来自英国生物银行(United Kingdom Biobank)的研究纳入385 292人,平均随访8.5年,基于作息习惯(总是早睡早起、经常早睡早起、经常晚睡晚起、总是晚睡晚起)、睡眠时间、失眠症状、打鼾情况、白天嗜睡情况生成睡眠评分,发现与睡眠评分为0~1分(睡眠质量最低)者相比,睡眠评分为5分者的心血管疾病、冠心病和卒中对应的HR值(95%CI)分别为0.65(0.52~0.81)、0.66(0.56~0.78)和0.66(0.58~0.75)[19]。本研究采取类似的方法构建睡眠评分,分析结果显示,睡眠质量越高,肾结石风险越低。
失眠、睡眠时间不足可增强机体交感神经活动,导致肾脏功能进行性损害[21-22],可能增加肾结石的风险。有研究发现,睡眠障碍患者外周循环中包括C-反应蛋白、白介素-6、肿瘤坏死因子-α、瘦蛋白、脂联素在内的炎症介质增加[23]。同时,在结石患者的尿液和血清中检测到炎症蛋白升高、抗氧化物(α-胡萝卜素、β-胡萝卜素、β-隐黄质)降低[24-25]。上述结果提示炎症反应可能是睡眠障碍导致肾结石形成的重要阶段。
本研究发现,低睡眠评分与肾结石风险的关联效应值在充足摄入茶、酒或水果或高体力活动水平的人群中更高。既往基于CKB项目的研究发现,摄入茶、酒或水果较为充足的人群中肾结石风险降低[26]。而增加的体力活动会使个体增加液体摄入量,甚至超过运动中流失的量,经常锻炼者的体内总液体量会缓慢增加,尿钠排泄减少,交感神经张力降低,肾结石风险进而降低[27]。相比之下,对于液体摄入不足或体力活动水平不高的个体,肾结石基线风险较高,由低睡眠质量导致的额外增加的风险可能就不那么明显。本研究结果还显示,在吸烟者中低睡眠评分与肾结石的关联效应值更高;吸烟能显著提高血浆中抗利尿激素水平,增加肾脏氧化应激损伤,因此与低睡眠质量有可能产生协同作用[28]。
本研究的优势:前瞻性的研究设计;样本量大,平均随访时间长,累积病例数较多,可对睡眠时间进行详细的分组以探究关联趋势;基线调查从多个角度了解睡眠状况,有机会分析多种睡眠因素对肾结石风险的影响;模型中尽可能调整了已知或可能的混杂因素,并根据基线特征进行了充分的亚组分析。本研究也存在局限性。首先,本研究的结局主要通过医保住院事件确定,会遗漏无症状或轻症的肾结石病例;不过,关注有症状、较严重的肾结石病例,不考虑仅能通过超声检查发现的肾结石病例,可能更具有公共卫生学意义。其次,本研究在基线调查时未询问研究对象的肾结石患病情况,难以确定随访期间记录的肾结石病例是否为首次发生;然而,本研究在数据分析前剔除了自报患有慢性肾病的个体,一定程度上可排除部分有症状的肾结石患者。第三,本研究的睡眠状况由研究对象自报,而不是客观测量;但采用多导睡眠监测仪等设备收集睡眠数据并不适用于大型人群队列研究,也有研究表明自报睡眠数据与客观测量数据之间的相关性良好[29]。最后,本研究的睡眠信息仅在基线调查时收集,未考虑睡眠状况随时间的变化情况。
本研究利用CKB项目50余万人的随访数据发现,有失眠症状或睡眠时间短的个体发生肾结石的风险增加。各方面的研究证据均提示睡眠对健康的重要性,因此倡导改善睡眠质量也应作为普及健康生活的一部分。
利益冲突 所有作者声明无利益冲突
作者贡献声明 汪涵、张艺倩:分析数据、撰写文章;余灿清、郭彧、裴培、吕筠:采集/解释数据、修改文章;李立明、陈铮鸣、陈君石:项目管理、经费支持
志谢 感谢所有参加中国慢性病前瞻性研究项目的队列成员和各项目地区的现场调查队调查员;感谢项目管理委员会、国家项目办公室、牛津协作中心和10个项目地区办公室的工作人员
| [1] |
Khan SR, Pearle MS, Robertson WG, et al. Kidney stones[J]. Nat Rev Dis Primers, 2016, 2: 16008. DOI:10.1038/nrdp.2016.8 |
| [2] |
Corbo J, Wang J. Kidney and ureteral stones[J]. Emerg Med Clin North Am, 2019, 37(4): 637-648. DOI:10.1016/j.emc.2019.07.004 |
| [3] |
Sorokin I, Mamoulakis C, Miyazawa K, et al. Epidemiology of stone disease across the world[J]. World J Urol, 2017, 35(9): 1301-1320. DOI:10.1007/s00345-017-2008-6 |
| [4] |
Kittanamongkolchai W, Vaughan LE, Enders FT, et al. The changing incidence and presentation of urinary stones over 3 decades[J]. Mayo Clin Proc, 2018, 93(3): 291-299. DOI:10.1016/j.mayocp.2017.11.018 |
| [5] |
Hesse A, Brändle E, Wilbert D, et al. Study on the prevalence and incidence of urolithiasis in Germany comparing the years 1979 vs. 2000[J]. Eur Urol, 2003, 44(6): 709-713. DOI:10.1016/s0302-2838(03)00415-9 |
| [6] |
Yasui T, Iguchi M, Suzuki S, et al. Prevalence and epidemiological characteristics of urolithiasis in Japan: national trends between 1965 and 2005[J]. Urology, 2008, 71(2): 209-213. DOI:10.1016/j.urology.2007.09.034 |
| [7] |
Thongprayoon C, Krambeck AE, Rule AD. Determining the true burden of kidney stone disease[J]. Nat Rev Nephrol, 2020, 16(12): 736-746. DOI:10.1038/s41581-020-0320-7 |
| [8] |
Rule AD, Lieske JC, Pais VM Jr. Management of kidney stones in 2020[J]. JAMA, 2020, 323(19): 1961-1962. DOI:10.1001/jama.2020.0662 |
| [9] |
Morgan MSC, Pearle MS. Medical management of renal stones[J]. BMJ, 2016, 352: i52. DOI:10.1136/bmj.i52 |
| [10] |
Sofi F, Cesari F, Casini A, et al. Insomnia and risk of cardiovascular disease: a meta-analysis[J]. Eur J Prev Cardiol, 2014, 21(1): 57-64. DOI:10.1177/2047487312460020 |
| [11] |
Guo VY, Cao B, Wong CKH, et al. The association between daytime napping and risk of diabetes: a systematic review and meta-analysis of observational studies[J]. Sleep Med, 2017, 37: 105-112. DOI:10.1016/j.sleep.2017.01.018 |
| [12] |
Bo YC, Yeoh EK, Guo C, et al. Sleep and the risk of chronic kidney disease: a cohort study[J]. J Clin Sleep Med, 2019, 15(3): 393-400. DOI:10.5664/jcsm.7660 |
| [13] |
Christensen AS, Clark A, Salo P, et al. Symptoms of sleep disordered breathing and risk of cancer: a prospective cohort study[J]. Sleep, 2013, 36(10): 1429-1435. DOI:10.5665/sleep.3030 |
| [14] |
Zhai L, Zhang H, Zhang DF. Sleep duration and depression among adults: a meta-analysis of prospective studies[J]. Depress Anxiety, 2015, 32(9): 664-670. DOI:10.1002/da.22386 |
| [15] |
Tsai SH, Stoller ML, Sherer BA, et al. Risk of nephrolithiasis in patients with sleep apnea: a population-based cohort study[J]. J Clin Sleep Med, 2018, 14(5): 767-773. DOI:10.5664/jcsm.7102 |
| [16] |
Chen ZM, Lee L, Chen JS, et al. Cohort profile: the kadoorie study of chronic disease in China (KSCDC)[J]. Int J Epidemiol, 2005, 34(6): 1243-1249. DOI:10.1093/ije/dyi174 |
| [17] |
Chen ZM, Chen JS, Collins R, et al. China Kadoorie Biobank of 0.5 million people: survey methods, baseline characteristics and long-term follow-up[J]. Int J Epidemiol, 2011, 40(6): 1652-1666. DOI:10.1093/ije/dyr120 |
| [18] |
李立明, 吕筠, 郭彧, 等. 中国慢性病前瞻性研究: 研究方法和调查对象的基线特征[J]. 中华流行病学杂志, 2012, 33(3): 249-255. Li LM, Lv J, Guo Y, et al. The China Kadoorie Biobank: related methodology and baseline characteristics of the participants[J]. Chin J Epidemiol, 2012, 33(3): 249-255. DOI:10.3760/cma.j.issn.0254-6450.2012.03.001 |
| [19] |
Fan MY, Sun DJY, Zhou T, et al. Sleep patterns, genetic susceptibility, and incident cardiovascular disease: a prospective study of 385 292 UK biobank participants[J]. Eur Heart J, 2020, 41(11): 1182-1189. DOI:10.1093/eurheartj/ehz849 |
| [20] |
Chaput JP, Dutil C, Featherstone R, et al. Sleep duration and health in adults: an overview of systematic reviews[J]. Appl Physiol Nutr Metab, 2020, 45(10 Suppl 2): S218-231. DOI:10.1139/apnm-2020-0034 |
| [21] |
Castro-Diehl C, Diez Roux AV, Redline S, et al. Sleep duration and quality in relation to autonomic nervous system measures: the multi-ethnic study of atherosclerosis (MESA)[J]. Sleep, 2016, 39(11): 1927-1940. DOI:10.5665/sleep.6218 |
| [22] |
Hering D, Esler MD, Schlaich MP. Chronic kidney disease: role of sympathetic nervous system activation and potential benefits of renal denervation[J]. EuroIntervention, 2013, 9(Suppl R): R127-135. DOI:10.4244/eijv9sra22 |
| [23] |
Fernandez-Mendoza J, Baker JH, Vgontzas AN, et al. Insomnia symptoms with objective short sleep duration are associated with systemic inflammation in adolescents[J]. Brain Behav Immun, 2017, 61: 110-116. DOI:10.1016/j.bbi.2016.12.026 |
| [24] |
Canales BK, Anderson L, Higgins L, et al. Proteome of human calcium kidney stones[J]. Urology, 2010, 76(4): 1017.e13-1017.e20. DOI:10.1016/j.urology.2010.05.005 |
| [25] |
Holoch PA, Tracy CR. Antioxidants and self-reported history of kidney stones: the National Health and Nutrition Examination Survey[J]. J Endourol, 2011, 25(12): 1903-1908. DOI:10.1089/end.2011.0130 |
| [26] |
Wang H, Fan JN, Yu CQ, et al. Consumption of tea, alcohol, and fruits and risk of kidney stones: a prospective cohort study in 0.5 million Chinese adults[J]. Nutrients, 2021, 13(4): 1119. DOI:10.3390/nu13041119 |
| [27] |
Sorensen MD, Chi T, Shara NM, et al. Activity, energy intake, obesity, and the risk of incident kidney stones in postmenopausal women: a report from the Women's Health Initiative[J]. J Am Soc Nephrol, 2014, 25(2): 362-369. DOI:10.1681/asn.2013050548 |
| [28] |
Liu CC, Huang SP, Wu WJ, et al. The impact of cigarette smoking, alcohol drinking and betel quid chewing on the risk of calcium urolithiasis[J]. Ann Epidemiol, 2009, 19(8): 539-545. DOI:10.1016/j.annepidem.2009.02.006 |
| [29] |
Lauderdale DS, Knutson KL, Yan LL, et al. Self-reported and measured sleep duration: how similar are they?[J]. Epidemiology, 2008, 19(6): 838-845. DOI:10.1097/EDE.0b013e318187a7b0 |
 2022, Vol. 43
2022, Vol. 43