文章信息
- 闫梅英, 阚飙.
- Yan Meiying, Kan Biao
- 建设部门协同机制和监测网络应对沙门菌感染疫情
- Establishment of multi-sector collaborative mechanism and surveillance network for Salmonella infection outbreak response and control
- 中华流行病学杂志, 2022, 43(7): 996-1001
- Chinese Journal of Epidemiology, 2022, 43(7): 996-1001
- http://dx.doi.org/10.3760/cma.j.cn112338-20220523-00449
-
文章历史
收稿日期: 2022-05-23
非伤寒沙门菌导致的沙门菌病,是广受关注的食品安全问题。目前已发现的沙门菌属有2 500余种血清型,引起人类感染的主要为沙门菌肠炎亚种,其中鼠伤寒沙门菌和肠炎沙门菌引发的感染最为常见。全球每年大约有1.5亿沙门菌病病例,其中5.9万人死亡[1]。沙门菌可从动物、动物饲料、食品加工生产到餐桌的整个食物链中检出,因此,沙门菌(Salmonella)也是食品安全重要指示菌。另外,沙门菌易携带耐药基因,耐药沙门菌感染及其导致的耐药扩散也是当前重点关注的健康问题。
2022年3月27日,英国卫生部门向WHO报告了感染单相鼠伤寒沙门菌序列型(ST)34型的聚集性病例,调查发现此次聚集性疫情与比利时生产的巧克力有关,产品已销往包括中国在内的至少113个国家和地区。截至4月25日,陆续有11个国家报告了151例疑似与食用相关巧克力产品有关的鼠伤寒沙门菌病例,引起国际媒体广泛关注[2-5]。由污染食品导致的沙门菌感染暴发在多国及世界范围内并不少见,但此次疫情中涉及的食品在全世界范围内销售,是造成在短时间内多个国家出现感染病例的主要原因。另外,本次疫情中的病原—单相鼠伤寒沙门菌为近年来各国沙门菌感染血清型中占比逐渐升高的主要型别之一,此次疫情也是该血清型首次引起跨国病例暴发,再次提出对沙门菌感染监测的需求。
一、此次巧克力产品相关鼠伤寒沙门菌疫情概况及风险分析2022年3月27日,英国卫生部门向WHO通报发现多例鼠伤寒沙门菌(S. Typhimurium)聚集性病例,后续血清分型及多位点序列分型确定为单相鼠伤寒沙门菌ST34型。感染源追溯到2021年12月和2022年1月意大利费列罗集团(Ferrero Corporate)在比利时阿尔隆(Arlon)的工厂生产的Kinder(国内译为健达)巧克力系列产品(包括Kinder Surprise、Kinder Mini Eggs、Kinder Surprise Maxi 100 g和Kinder Schoko-Bons)。在阿尔隆工厂酪乳罐中发现了与病例相匹配的单相鼠伤寒沙门菌(S.1,4,[5],12:i:-),并确定为本次疫情的污染来源[5-6]。彼时,这些巧克力产品已销往包括中国在内的至少113个国家和地区。截至2022年4月25日,报告的151例病例分布在英国(65例)、比利时(26例)、法国(25例)、爱尔兰(15例)、德国(10例)、瑞典(4例)、荷兰(2例)、卢森堡、挪威、西班牙和美国(各1例)。报告病例以10岁以下儿童为主,占89%(134例),女性占66%(99例)。21例病例症状相对较重,其中12例(57%)出现血性腹泻,9例(43%)住院。无相关的死亡病例报告[5-6]。另外,根据英国卫生部门的报告,此次引起暴发的菌株对青霉素类、氨基糖苷类(链霉素、壮观霉素、卡那霉素和庆大霉素)、苯酚类、磺胺类、甲氧苄啶、四环素类6种抗生素具有耐药性,但对喹诺酮类药物、头孢菌素类药物未见耐药。测序发现,引起暴发的菌株的基因组,在EnteroBase基因组数据库中核心基因组多位点序列分型(cgMLST)为HC5_296366[6]。
本起疫情症状较重病例住院率高,儿童和老年人感染出现严重并发症的风险较大。但病例是否感染该类菌株需要使用基因或基因组测序进行ST型判断,并进行cgMLST比对,而相关技术并非所有国家或实验室均能常规使用,因此部分病例可能未被发现。国际食品安全官方网站已于2022年4月10日发出警报,在全球范围内召回相关巧克力产品。因此,WHO认为在污染产品被全面召回之前,评估本起疫情在受影响区域以及全球范围内传播的风险为中等[5]。
中国海关总署于2022年4月15日发布消费提示,提醒消费者暂停食用费列罗集团比利时阿尔隆工厂生产的4类巧克力产品。当前我国疾控机构尚未接到明确因食用健达巧克力引起沙门菌感染的病例报告,随着监测进展,不排除未来发现病例的可能。
二、单相鼠伤寒沙门菌感染的全球分布概况单相鼠伤寒沙门菌是鼠伤寒沙门菌的一个变种,20世纪90年代以前一直被归为鼠伤寒沙门菌,所以报道很少。单相鼠伤寒沙门菌在亚洲地区于1993年首次报道分离于泰国;在欧洲地区,1997年首次报道分离于西班牙。近20年来,单相鼠伤寒沙门菌在全球多个国家的多种样本中被发现,包括动物(鸡、牛、猪、甲鱼等)、食品(禽肉、猪肉、香肠等)以及人类的粪便、血液中,并成为动物和人类感染的主要血清型之一[7-9]。在欧洲地区,2014-2016年单相鼠伤寒沙门菌感染占年报告人类沙门菌病病例总数的8%,为报告沙门菌血清型的第三位[10],德国发现2008年的人源鼠伤寒沙门菌中42.2%为单相鼠伤寒沙门菌[11],法国研究报道2005-2010年食品和动物产品中单相鼠伤寒沙门菌的分离率升高了10倍[12]。美国自2001年来单相鼠伤寒沙门菌已成为引起人类沙门菌病的5种主要血清型之一,沙门菌感染的总发病率增加了33%,但单相鼠伤寒沙门菌菌株的感染却增加了5倍以上[13]。
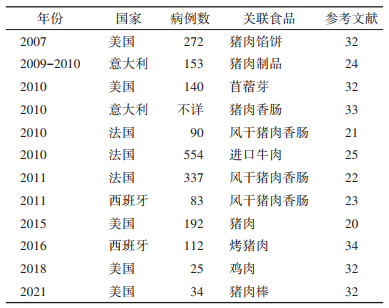
目前由该菌导致的疾病暴发仍在不断增加。猪、牛和禽类中单相鼠伤寒沙门菌携带率较高,人类单相鼠伤寒沙门菌感染多与猪肉及其制品有关[14-19]。自2010年以来,报道的较大规模单相鼠伤寒沙门菌感染暴发案例至少10起,主要发生在欧洲地区及美国,主要由污染的猪肉制品引起,如2015年美国猪肉污染单相鼠伤寒沙门菌引起了一起192例病例的暴发[20];2010-2011年在西班牙和法国由猪肉香肠引起了3起单相鼠伤寒沙门菌感染暴发(病例超过500例)[21-23]。2007-2021年美国跨州的单相鼠伤寒沙门菌感染暴发共5起,累计659例病例(117例住院、1例死亡),主要由污染肉制品(猪肉涉及3起、鸡肉1起、苜蓿芽1起)引起(表 1)。另外,在美国、法国、意大利还发现由宠物、牛肉及水污染引起的单相鼠伤寒沙门菌感染暴发[24-26]。由污染巧克力引起的沙门菌感染暴发案例亦见报道,但主要涉及几种少见血清型,如S. Oranienburg、S.Nima、S.Napoli、S.Eastbourne等[27-31],未见由巧克力引起的单相鼠伤寒沙门菌感染暴发。
单相鼠伤寒沙门菌在流行过程中获得了多重耐药(multidrug resistance),主要为ST19型和ST34型两个流行克隆群[35],其中ST34型为优势克隆群,分布于欧洲地区及美国,主要表现为染色体携带的氨苄西林-链霉素-复方新诺明-四环素(ASSuT)的耐药[15-17, 36-38],另外发现单相鼠伤寒沙门菌对粘菌素也存在耐药[39]。
三、我国沙门菌监测及单相鼠伤寒沙门菌感染概况我国沙门菌病未列入单病种报告,在法定报告传染病中,沙门菌感染引起的沙门菌病属于丙类传染病中“其他感染性腹泻”报告病例范畴,“其他感染性腹泻”中大多无病原检测结果,因此我国传染病疫情报告系统中缺乏规范和完整的沙门菌感染的病原学报告。食源性疾病监测系统中虽然将沙门菌纳入其监测的主要食源性致病菌之一,但尚未建立与疾控机构、临床机构之间的信息交流共享平台,食品中有关巧克力的常规检测仅涉及有害化学物质的检测,不进行微生物检测。沙门菌病实验室监测多来自零散开展的专项监测,覆盖面不足,缺乏系统性。但开展的一些监测分析已显示了单相鼠伤寒沙门菌的感染问题。广东省报道发现自2009年以来,单相鼠伤寒沙门菌为广东省引起人类沙门菌病的第四位血清型[40],多分离自6岁以下儿童及婴幼儿,与鼠伤寒沙门菌类似,但不同于肠炎沙门菌(多分离自成年人和1~6岁幼童)。单相鼠伤寒沙门菌也是2011-2016年中国零售肉类和肉类生产中第五大流行血清型[41]。综合2011年以来主要来自广东、江苏、上海等地的4 514株单相鼠伤寒沙门菌(92%为人源)的耐药情况[42],发现单相鼠伤寒沙门菌对四环素、氨苄青霉素、磺胺异恶唑和链霉素的耐药率较高(> 75%);对萘啶酸、阿莫西林-克拉维酸和氯霉素的耐药率高,在50%~75%;对甲氧苄啶-磺胺甲恶唑、卡那霉素、甲氧苄啶和庆大霉素耐药率在25%~50%;虽然对环丙沙星、头孢噻肟、头孢曲松、头孢吡肟、头孢他啶和粘菌素的耐药率较低(< 25%),但当其在临床应用时需要谨慎选择,要依据药敏结果选择敏感药物,防止用药不当引起治疗失败及耐药克隆扩散的风险。此外,单相鼠伤寒沙门菌多重耐药率高达86%,并以ASSuT耐药谱为主(另2种主要耐药谱为氨苄西林-氯霉素-链霉素-复方新诺明-四环素耐药和氨苄西林-氯霉素-复方新诺明-庆大霉素-链霉素-四环素耐药)。有限资料显示我国单相鼠伤寒沙门菌主要为ST34型,且猪是其主要储存宿主[43]。单相鼠伤寒沙门菌感染暴发在我国少见,多为点源性暴发[44],暴发判定及分子分型主要依赖PFGE分子分型技术[45-46],尚未采用基因组聚类分析,至今未见巧克力相关的单相鼠伤寒沙门菌感染暴发。
2017年,我国启动了国家致病菌识别网,在全国疾控系统开展病原菌实验室监测。目前国家致病菌识别网中共收集自2011-2022年沙门菌菌株信息超过5.5万株,其中单相鼠伤寒沙门菌有四千余株,在所收集沙门菌菌株中血清型排序第三位(前两位分别是肠炎沙门菌和鼠伤寒沙门菌,占32%),绝大多数分离自人类,尚未发现类似本起跨国疫情的巧克力相关来源菌株。其中702株单相鼠伤寒沙门菌完成全基因组测序,有691株鉴定为ST34型(占98.4%),提示ST34型也是我国单相鼠伤寒沙门菌的优势序列型,未发现与这次巧克力暴发株基因组一致的菌株。完成耐药性检测的单相鼠伤寒沙门菌结果显示,ST34型单相鼠伤寒沙门菌耐药严重,一些菌株耐药水平高于鼠伤寒和肠炎2种血清型,主要是对临床常用药物包括氨苄西林、头孢曲松、头孢吡肟、环丙沙星以及一些基础药物如复方新诺明、四环素、链霉素、庆大霉素、卡那霉素的耐药,可能会造成病例治疗困难或治愈延迟。因此,近期临床对于该单相鼠伤寒沙门菌感染或分离到疑似鼠伤寒沙门菌感染的病例,应尽快进行菌株药敏实验,根据药敏结果及时调整用药选择,防止耐药克隆株增殖。
四、我国沙门菌等食源性疾病监测与应对能力提升的需求沙门菌感染属于常见病、多发病,但社会经济发展并不能导致该病以及其他食源性疾病流行的快速减弱,在一些条件下反而可能引发暴发和快速传播。社会组织管理系统不断完善,信息化程度不断提高,传染病及其病原监测分析技术不断创新,也为提升这些常见疾病的监测、预警和控制能力提供了基础。
1. 构建和运行多部门多系统协同的监测与应对网络:人群中沙门菌感染主要来自于养殖动物、食品供应链,也包括生活环境污染甚至宠物等,因此,需要农业兽医、食品供应、环境监测、海关检疫、医疗机构、食品安全监测监督机构与疾控机构的密切联合监测。多系统、多环节的网络监测和信息沟通是预防与控制沙门菌扩散、流行的必要条件和策略,以应对包括沙门菌在内的、具有引起跨地域传播或全球流行能力或潜力的病原,特别是人畜共患病病原、食品安全相关病原等。需要实时关注国际上沙门菌及其他食源性病原体感染所致疾病暴发的疫情信息,尤其在出现跨国传播时,需要及时搜索疫情进展、发布预警,并且需要多部门联合,开展对输入相关食品以及可能导致国内病例的监测与发现,并及时采取相应防控行动。其中,需要强化从食品供应到人群全链条相关因素和环节中的风险因子监测,建立多点触发疫情预警机制,搭建监测实体网络和信息网络。
2. 加强公共卫生与临床医疗机构的协作,及时发现病例和疫情:提高临床医生特别是肠道门诊医生的腹泻病诊疗意识,及时采样开展病原学检测和报告。需要建立腹泻病监测的流行病学基线,通过流行病学监测分析、舆情监测等多种方法发现相关病例的异常出现或增多,及时开展流行病学调查。建立临床医疗与公共卫生工作的有效连通,不仅仅在新发突发传染病的监测与应对层面上、也需要在常见病多发病的诊断和公共卫生防控上联合开展工作,形成“病例就诊-病原诊断-疫情分析-防控应用”的工作模式,以便及时发现感染、传播并采取应对措施。
3. 升级病原学监测技术,加强以基因组测序为基础的实验室监测网络的运行,建立网络信息共享分析和监测预警系统:围绕沙门菌来源、传播和感染各相关环节,建立运行跨部门的沙门菌监测实验室网络,加强沙门菌污染和感染的分子检测、菌株分离与分析工作,实时开展血清型鉴定、基因组测序比对分析,使实验室沙门菌检测技术从传统的“血清型+分子指纹图谱分型”,升级为“血清型+全基因组测序”,建立以基因组测序为基础的实验室监测网络,以早期发现序列一致及高度相似的菌株聚集簇,发现新的变异型和多耐药菌株及其引起的扩散,及时发布监测协查信息,并开展流行病学调查,实现暴发或聚集性病例的精准溯源、精准识别。本次ST34型单相鼠伤寒沙门菌感染暴发的全球追溯,即以基因组测序为基础、以菌株特异基因型为依据进行菌株和感染病例的识别、溯源,基因组学监测正成为沙门菌病乃至其他食源性疾病监测的主要手段。另外,需要建立病原菌生物特征及其基因组监测信息的跨部门沟通平台,实现病原菌基本信息、基因组信息、流行病学信息在农业兽医、食品安全监测、医疗和疾病控制机构间的共享分析;在国际上,也有必要建立全球网络实验室共享交流机制,推进全球化监测和联合防控。
沙门菌所致疾病是常见病之一,但是不断出现新的遗传型别,以及多耐药甚至广泛耐药菌株引起疾病暴发和流行,甚至导致全球扩散。单相鼠伤寒沙门菌变异型、尤其近期出现的ST34型感染的暴发,是病原新亚型所致的食源性疾病、人兽共患病发生和传播的又一个实例。就本起疫情而言,需要实时跟进WHO和各国公布相关信息进展和全球疫情情况,加强各部门间信息沟通,掌握我国相关产品进口及销售情况,动态开展风险评估、疫情研判,并加强食品安全监管、食品微生物监测及公众宣教。鉴于沙门菌在动物、食品中广泛存在,持续引发健康威胁,因此,尽管是常见病、多发病,从健康保障、食品安全等目的出发,仍需加强对沙门菌病尤其高致病、高耐药菌群的防控,建立多部门联合、技术能力升级的监测预警网络,实施覆盖病原出现和传播的全链条、多系统的联合监测和信息共享机制与体系,及时监测、应对常见沙门菌感染暴发,及时发现新流行亚型、新耐药克隆株扩散。并密切结合当前的信息化发展及大数据技术,全面提升包括沙门菌病在内的食源性疾病监测、预警和处置能力。
利益冲突 所有作者声明无利益冲突
志谢 感谢崔志刚、周海健、杜小莉、卢昕、李臻鹏在国家致病菌识别网数据分析中提供的信息
| [1] |
WHO. WHO estimates of the global burden of foodborne diseases: foodborne diseases burden epidemiology reference group 2007-2015[R]. Geneva, Switzerland: WHO, 2015.
|
| [2] |
和讯新闻. 污染沙门氏菌巧克力部分已销往中国!全球警报: 多国暴发鼠伤寒沙门氏菌疫情, 与比利时生产的巧克力有关[EB/OL]. (2022-04-29)[2022-05-23]. http://news.hexun.com/2022-04-29/205845509.html.
|
| [3] |
新浪财经. 多国暴发巧克力相关沙门氏菌疫情, 部分产品已销往中国[EB/OL]. (2022-04-29)[2022-05-23]. https://finance.sina.cn/2022-04-29/detail-imcwipii7095299.d.html.
|
| [4] |
财经头条. 欧美多国暴发巧克力相关沙门氏菌疫情[EB/OL]. (2022-04-29)[2022-05-23]. https://cj.sina.com.cn/articles/view/1496814565/593793e50200195nl.
|
| [5] |
World Health Organization. Multi-country outbreak of Salmonella Typhimurium linked to chocolate products- Europe and the United States of America[EB/OL]. (2022- 04-26)[2022-05-23]. https://www.who.int/emergencies/disease-outbreak-news/item/2022-DON369.
|
| [6] |
Larkin L, de La Gandara MP, Hoban A, et al. Investigation of an international outbreak ofmultidrug-resistant monophasic Salmonella Typhimurium associated with chocolate products, EU/EEA and United Kingdom, February to April 2022[J]. Euro Surveill, 2022, 27(15): 2200314. DOI:10.2807/1560-7917.ES.2022.27.15.2200314 |
| [7] |
European Food Safety Authority (EFSA). Scientific opinion on monitoring and assessment of the public health risk of "Salmonella Typhimurium-like" strains[J]. EFSA J, 2010, 8(10): 1826. DOI:10.2903/j.efsa.2010.1826 |
| [8] |
Hopkins KL, Kirchner M, Guerra B, et al. Multiresistant Salmonella enterica serovar 4, [5], 12: i: - in Europe: a new pandemic strain?[J]. Euro Surveill, 2010, 15(22): 19580. |
| [9] |
Elnekave E, Hong S, Mather AE, et al. Salmonella enterica serotype 4, [5], 12: i: - in swine in the United States Midwest: An emerging multidrug-resistant clade[J]. Clin Infect Dis, 2018, 66(6): 877-885. DOI:10.1093/cid/cix909 |
| [10] |
European Food Safety Authority, European Centre for Disease Prevention and Control. The European Union summary report on trends and sources of zoonoses, zoonotic agents and food-borne outbreaks in 2016[J]. EFSA J, 2017, 15(12): e05077. DOI:10.2903/j.efsa.2017.5077 |
| [11] |
Trüpschuch S, Laverde Gomez JA, Ediberidze I, et al. Characterisation of multidrug-resistant Salmonella Typhimurium 4, [5], 12: i: - DT193 strains carrying a novel genomic island adjacent to the thrW tRNA locus[J]. Int J Med Microbiol, 2010, 300(5): 279-288. DOI:10.1016/j.ijmm.2010.02.001 |
| [12] |
Bugarel M, Vignaud ML, Moury F, et al. Molecular identification in monophasic and nonmotile variants of Salmonella enterica serovar Typhimurium[J]. Microbiologyopen, 2012, 1(4): 481-489. DOI:10.1002/mbo3.39 |
| [13] |
Centers for Disease Control and Prevention. National Salmonella surveillance 2016 annual summaries[EB/OL]. [2019-09-12]. https://www.cdc.gov/nationalsurveillance/salmonella-surveillance.html.
|
| [14] |
de La Torre E, Zapata D, Tello M, et al. Several Salmonella enterica subsp. enterica serotype 4, 5, 12: i: - phage types isolated from swine samples originate from serotype typhimurium DT U302[J]. J Clin Microbiol, 2003, 41(6): 2395-2400. DOI:10.1128/JCM.41.6.2395-2400.2003 |
| [15] |
Mossong J, Marques P, Ragimbeau C, et al. Outbreaks of monophasic Salmonella enterica serovar 4, [5], 12: i: - in Luxembourg, 2006[J]. Euro Surveill, 2007, 12(6): 4601-4610. DOI:10.2807/esm.12.06.00719-en |
| [16] |
Hauser E, Tietze E, Helmuth R, et al. Pork contaminated with Salmonella enterica serovar 4, [5], 12: i: -, an emerging health risk for humans[J]. Appl Environ Microbiol, 2010, 76(14): 4601-4610. DOI:10.1128/AEM.02991-09 |
| [17] |
Lucarelli C, Dionisi AM, Filetici E, et al. Nucleotide sequence of the chromosomal region conferring multidrug resistance (R-type ASSuT) in Salmonella Typhimurium and monophasic Salmonella Typhimurium strains[J]. J Antimicrob Chemother, 2012, 67(1): 111-114. DOI:10.1093/jac/dkr391 |
| [18] |
Lucarelli C, Dionisi AM, Torpdahl M, et al. Evidence for a second genomic island conferring multidrug resistance in a clonal group of strains of Salmonella enterica serovar Typhimurium and its monophasic variant circulating in Italy, Denmark, and the United Kingdom[J]. J Clin Microbiol, 2010, 48(6): 2103-2109. DOI:10.1128/JCM.01371-09 |
| [19] |
Mourão J, Machado J, Novais C, et al. Characterization of the emerging clinically-relevant multidrug-resistant Salmonella enterica serotype 4, [5], 12: i: - (monophasic variant of S. Typhimurium) clones[J]. Eur J Clin Microbiol Infect Dis, 2014, 33(12): 2249-2257. DOI:10.1007/s10096-014-2180-1 |
| [20] |
Kawakami VM, Bottichio L, Angelo K, et al. Notes from the field: Outbreak of multidrug-resistant Salmonella infections linked to pork-Washington, 2015[J]. MMWR Morb Mortal Wkly Rep, 2016, 65(14): 379-381. DOI:10.15585/mmwr.mm6514a4 |
| [21] |
Bone A, Noel H, Le Hello S, et al. Nationwide outbreak of Salmonella enterica serotype 4, 12: i: - infections in France, linked to dried pork sausage, March-May 2010[J]. Euro Surveill, 2010, 15(24): 19592. |
| [22] |
Gossner CM, van Cauteren D, Le Hello S, et al. Nationwide outbreak of Salmonella enterica serotype 4, [5], 12: i: - infection associated with consumption of dried pork sausage, France, November to December 2011[J]. Euro Surveill, 2012, 17(40): 20071. DOI:10.2807/ese.17.05.20071-en |
| [23] |
Arnedo-Pena A, Sabater-Vidal S, Herrera-León S, et al. An outbreak of monophasic and biphasic Salmonella Typhimurium, and Salmonella Derby associated with the consumption of dried pork sausage in Castellon (Spain)[J]. Enferm Infect Microbiol Clin, 2016, 34(9): 544-550. DOI:10.1016/j.eimc.2015.11.016 |
| [24] |
Cartwright EJ, Nguyen T, Melluso C, et al. A multistate investigation of antibiotic-resistant Salmonella enterica serotype Ⅰ 4, [5], 12: i: - infections as part of an international outbreak associated with frozen feeder rodents[J]. Zoon Public Health, 2016, 63(1): 62-71. DOI:10.1111/zph.12205 |
| [25] |
Raguenaud ME, Le Hello S, Salah S, et al. Epidemiological and microbiological investigation of a large outbreak of monophasic Salmonella Typhimurium 4, 5, 12: i: - in schools associated with imported beef in Poitiers, France, October 2010[J]. Euro Surveill, 2012, 17(40): 20289. |
| [26] |
Cito F, Baldinelli F, Calistri P, et al. Outbreak of unusual Salmonella enterica serovar Typhimurium monophasic variant 1, 4[5], 12: i: -, Italy, June 2013 to September 2014[J]. Euro Surveill, 2016, 21(15): 30194. DOI:10.2807/1560-7917.ES.2016.21.15.30194 |
| [27] |
Werber D, Dreesman J, Feil F, et al. International outbreak of Salmonella Oranienburg due to German chocolate[J]. BMC Infect Dis, 2005, 5(1): 7. DOI:10.1186/1471-2334-5-7 |
| [28] |
Rao M, Tamber S. Microbiological analysis of frozenprofiteroles and mini chocolate eclairs implicated in a nationalsalmonellosis outbreak[J]. Food Microbiol, 2021, 100: 103871. DOI:10.1016/j.fm.2021.103871 |
| [29] |
Hockin JC, D'Aoust JY, Bowering D, et al. An international outbreak of Salmonella Nima from imported chocolate[J]. J Food Prot, 1989, 52(1): 51-54. DOI:10.4315/0362-028X-52.1.51 |
| [30] |
Gill ON, Bartlett CLR, Sockett PN, et al. Outbreak of Salmonella napoli infection caused by contaminated chocolate bars[J]. Lancet, 1983, 321(8324): 574-577. DOI:10.1016/S0140-6736(83)92822-2 |
| [31] |
Craven PC, Baine WB, Mackel DC, et al. International outbreak of Salmonella Eastbourne infection traced to contaminated chocolate[J]. Lancet, 1975, 305(7910): 788-792. DOI:10.1016/S0140-6736(75)92446-0 |
| [32] |
Centers for Disease Control and Prevention. Salmonella multistate outbreaks[EB/OL]. (2022-05-05) [2022-05-23]. https://www.cdc.gov/foodsafety/outbreaks/multistate-outbreaks/outbreaks-list.html.
|
| [33] |
Andreoli G, Merla C, Valle CD, et al. Foodborne salmonellosis in Italy: Characterization of Salmonella enterica serovar Typhimurium and monophasic variant 4, [5], 12: i: - isolated from salami and human patients[J]. J Food Prot, 2017, 80(4): 632-639. DOI:10.4315/0362-028X.JFP-16-331 |
| [34] |
de Frutos M, López-Urrutia L, Berbel C, et al. Monophasic Salmonella Typhimurium outbreakdue to the consumption of roast pork meat[J]. Rev Esp Quimioter, 2018, 31(2): 156-159. |
| [35] |
Cadel-Six S, Cherchame E, Douarre PE, et al. The spatiotemporal dynamics and microevolution events that favored the success of the highlyclonal multidrug- resistant monophasic Salmonella Typhimurium circulating in Europe[J]. Front Microbiol, 2021, 12: 651124. DOI:10.3389/fmicb.2021.651124 |
| [36] |
Majtan V, Majtanova L, Majtan J. Phenotypic and molecular characterization of human Salmonella enterica serovar 4, [5], 12: i: - isolates in Slovakia[J]. Curr Microbiol, 2011, 63(5): 491-495. DOI:10.1007/s00284-011-0010-6 |
| [37] |
Gallati C, Stephan R, Hachler H, et al. Characterization of Salmonella enterica subsp. enterica serovar 4, [5], 12: i: - clones isolated from human and other sources in Switzerland between 2007 and 2011[J]. Foodborne Pathog Dis, 2013, 10(6): 549-554. DOI:10.1089/fpd.2012.1407 |
| [38] |
García P, Hopkins KL, García V, et al. Diversity of plasmids encoding virulence and resistance functions in Salmonella enterica subsp. enterica serovar Typhimurium monophasic variant 4, [5], 12: i: - strains circulating in Europe[J]. PLoS One, 2014, 9(2): e89635. DOI:10.1371/journal.pone.0089635 |
| [39] |
Portes AB, Rodrigues G, Leitão MP, et al. Global distribution of plasmid-mediated colistin resistance mcrgene in Salmonella: A systematic review[J]. J Appl Microbiol, 2022, 132(2): 872-889. DOI:10.1111/jam.15282 |
| [40] |
Deng XL, Ran L, Wu SY, et al. Laboratory-based surveillance of non-typhoidal Salmonella infections in Guangdong province, China[J]. Foodborne Pathog Dis, 2012, 9(4): 305-312. DOI:10.1089/fpd.2011.1008 |
| [41] |
Yang XJ, Wu QP, Zhang JM, et al. Prevalence, bacterial load, and antimicrobial resistance of Salmonella serovars isolated from retail meat and meat products in China[J]. Front Microbiol, 2019, 10: 2121. DOI:10.3389/fmicb.2019.02121 |
| [42] |
Qin XJ, Yang MZ, Cai H, et al. Antibiotic resistance of Salmonella Typhimurium monophasic variant1, 4, [5], 12: i: -in China: a systematic review and meta-analysis[J]. Antibiotics (Basel), 2022, 11(4): 532. DOI:10.3390/antibiotics11040532 |
| [43] |
Xie XL, Wang ZY, Zhang K, et al. Pig as a reservoir of CRISPR type TST4 Salmonella enterica serovar Typhimurium monophasic variant during 2009-2017 in China[J]. Emerg Microbes Infect, 2020, 9(1): 1-4. DOI:10.1080/22221751.2019.1699450 |
| [44] |
张勇, 梁秀川, 赵士程, 等. 一起鼠伤寒沙门菌单相变异株引起食源性疾病暴发的检测分析[J]. 预防医学情报杂志, 2021, 37(6): 809-812. Zhang Y, Liang XC, Zhao SC, et al. A food-borne Disease outbreak caused by monophasic variant of Salmonella Typhimurium[J]. J Prev Med Inf, 2021, 37(6): 809-812. |
| [45] |
曾献莹, 吕素玲, 瞿聪, 等. 广西鼠伤寒沙门菌1, 4, [5], 12: i: -耐药性及分子分型特征研究[J]. 中国食品卫生杂志, 2021, 33(5): 558-565. Zeng XY, Lv SL, Qu C, et al. The drug resistance and molecular characteristics of Salmonella Typhimurium 1, 4, [5], 12: i: - in Guangxi[J]. J Food Hyg, 2021, 33(5): 558-565. DOI:10.13590/j.cjfh.2021.05.007 |
| [46] |
仇绮琳, 郑悦康, 刘绮明, 等. 广东省中山市2018-2019年沙门菌血清型分布、耐药性及分子分型[J]. 中国热带医学, 2021, 21(8): 758-763. Qiu QL, Zheng YK, Liu QM, et al. Serotype distribution, drug resistance and molecular typing of Salmonella in Zhongshan, Guangdong, 2018-2019[J]. China Trop Med, 2021, 21(8): 758-763. DOI:10.13604/j.cnki.46-1064/r.2021.08.09 |
 2022, Vol. 43
2022, Vol. 43