文章信息
- 陈秋兰, 朱曼桐, 陈宁, 杨栋, 殷文武, 牟笛, 李昱, 张彦平, 再那吾东·玉山.
- Chen Qiulan, Zhu Mantong, Chen Ning, Yang Dong, Yin Wenwu, Mu Di, Li Yu, Zhang Yanping, Zainawudong·Yushan
- 2011-2021年全国发热伴血小板减少综合征流行特征分析
- Epidemiological characteristics of severe fever with thtrombocytopenia syndrome in China, 2011-2021
- 中华流行病学杂志, 2022, 43(6): 852-859
- Chinese Journal of Epidemiology, 2022, 43(6): 852-859
- http://dx.doi.org/10.3760/cma.j.cn112338-20220325-00228
-
文章历史
收稿日期: 2022-03-25
2. 广西医科大学公共卫生学院, 南宁 530000;
3. 长沙市疾病预防控制中心, 长沙 410000;
4. 中国疾病预防控制中心, 北京 102206
2. School of Public Health, Guangxi Medical University, Nanning 530000, China;
3. Changsha Center for Disease Control and Prevention, Changsha 410000, China;
4. Chinese Center for Disease Control and Prevention, Beijing 102206, China
2006年以来我国河南、湖北、安徽、江苏等中、东部省份农村地区相继发现并报告了一种以发热和血小板减少为主要特征的疾病,伴有白细胞减少及多脏器功能障碍,病例出血倾向明显,出现多例死亡病例,2009年我国卫生行政部门根据疾病特征暂以发热伴血小板减少综合征(SFTS)命名该病[1]。2009年我国学者在河南省和湖北省的大部分病例中分离出一种布尼亚病毒科的新病毒,学界将该病毒命名为发热伴血小板减少综合征布尼亚病毒(SFTSV)[1-2]。SFTSV的传播途径主要为蜱虫叮咬传播[3],也可通过接触病例血液、体液、血性分泌物或排泄物感染[4]。2010年10月,原卫生部印发《发热伴血小板减少综合征防治指南(2010年版)》[5],规定按照法定乙类传染病要求报告该病以加强监测。为揭示近年来我国SFTS的流行特征,指导各地有针对性地开展防控工作,本研究针对2011-2021年SFTS病例监测数据开展流行病学特征分析。
资料与方法1. 资料来源:源自中国疾病预防控制信息系统传染病报告信息管理系统,按照发病日期导出2011-2021年传染病报告卡中的SFTS临床诊断病例和确诊病例。人口资料来自国家统计局的常住人口数据。
2. 分析方法:采用Excel 2019和SPSS 20.0软件对数据进行描述与分析,根据发病时间整理全国2011-2021年疫情数据,分南方和北方绘制每年逐月发病数分布图,对季节性的流行特征进行分析。根据年发病率,应用ArcGIS 10.2软件将全国各地级市SFTS发病率与行政区划地图空间关联,分级渲染,按地级市级尺度绘制发病率空间分布图。率的趋势变化用平均年度变化百分比(AAPC)进行分析,采用线性模型回归系数(β)计算AAPC,AAPC=(eβ-1)×100%。用Cochran-Armitage趋势检验分别验证男性和女性2011-2021年累计发病率、病死率随年龄变化趋势,不同组别的发病率和病死率差异采用Pearson χ2检验,检验水准α=0.05。
3.计算公式及相关定义:年均发病率(/10万)=



1. 全国发病及死亡情况:2011-2021年,全国共报告SFTS病例18 902例,其中确诊病例为12 953例(68.5%)。2011年全国SFTS发病率为0.041/10万,2021年上升为0.188/10万;年均发病率为0.125/10万。2011年全国SFTS病死率为10.58%,2021年下降为5.07%;年均病死率为5.11%(966/18 902)。发病率自2011年开始逐年上升,2016年为发病高峰(AAPC=38.68%,P < 0.001),2017-2019年疫情出现回落(AAPC=-10.69%,P=0.163),近年来又出现逐年增长趋势(AAPC=19.36%,P=0.250);2011-2021年发病率整体呈上升趋势(AAPC=14.80%,P=0.001)。病死率以2011年最高,而后呈现明显的下降趋势,2016年病死率降至最低达2.65%(AAPC=-22.20%,P=0.007),之后又开始上升,至2018年达到6.17%(AAPC=52.65%,P=0.034),在2018-2021年呈缓慢下降趋势(AAPC=-6.20%,P=0.087);2011-2021年,病死率整体呈平稳趋势(AAPC=-5.45%,P=0.126)。见图 1。
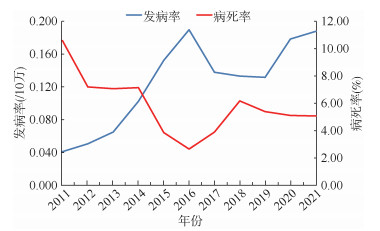
|
| 图 1 2011-2021年全国发热伴血小板减少综合征发病率和病死率 |
2. 重点省份发病及死亡情况:2011-2021年,全国除海南、西藏、青海、宁夏4个省(自治区)无病例报告外,其他27个省(直辖市、自治区)均有SFTS病例报告,病例主要集中在山东(5 648例)、河南(4 989例)、安徽(3 458例)、湖北(2 463例)、辽宁(1 017例)、浙江(630例)、江苏(551例)7个省,报告发病数占全国的99.23%(18 756/18 902)。此7个省2011-2021年累计报告发病率:山东(5.726/10万)、安徽(5.643/10万)、河南(5.237/10万)、湖北(4.225/10万)、辽宁(2.329/10万)、浙江(1.114/10万)、江苏(0.687/10万),其中山东省、安徽省、湖北省、辽宁省的发病率呈逐年波动上升趋势(AAPC分别为17.59%、26.62%、12.41%、19.01%),变化趋势均有统计学意义(P < 0.001);河南省的发病率2015年达到高峰后呈下降趋势(AAPC=-15.72%,P=0.059),浙江省、江苏省的发病率则历年处于相对较低水平。见图 2。

|
| 图 2 2011-2021年全国发热伴血小板减少综合征发病人数前7位省份的发病率分布 |
全国共11个省报告SFTS死亡病例。其中山东(555例)、安徽(129例)、湖北(88例)、浙江(71例)、河南(65例)、江苏(29例)、辽宁(25例),7个省报告死亡数占全国的99.59%(962/966)。年均病死率前7位的省为浙江(11.27%)、山东(9.83%)、江苏(5.26%)、安徽(3.73%)、湖北(3.57%)、辽宁(2.46%)和河南(1.30%),各省病死率差异有统计学意义(χ2=496.13,P < 0.001)。其中,浙江省的发病率虽然相对较低,但其病死率历年处于较高水平;山东省的发病率较高,其病死率历年也处于较高水平;河南省的病死率历年维持在较低水平,江苏省(AAPC=-6.57%,P=0.421)、安徽省(AAPC=-10.33%,P=0.080)、湖北省(AAPC=-26.29%,P=0.005)、辽宁省(AAPC=-21.73%,P=0.006)的病死率均呈下降趋势,其中湖北省和辽宁省的变化趋势有统计学意义。见图 3。
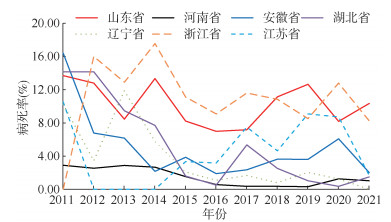
|
| 图 3 2011-2021年全国发热伴血小板减少综合征发病人数前7位省份的病死率分布 |
3. 季节性特征分析:全年均有SFTS病例报告,发病时间主要集中在4-10月,报告病例数占全年的96.63%(18 265/18 902)。南、北方发病均具有明显的季节性,发病数4月逐渐增多,且均多在5-6月达到发病高峰,在不同年份中北方季节性发病数峰值均高于南方,而南方多在10月出现第二次发病小高峰,11月后快速下降,12月至次年2月进入静息期。见图 4。死亡病例季节性特征与发病数基本一致,全国死亡病例报告主要集中在4-10月,报告病例数占全年的97.00%(937/966)。南、北方死亡数4月开始逐渐增多,南方在5-6月达到高峰,而北方则多在6-7月达到高峰。见图 5。
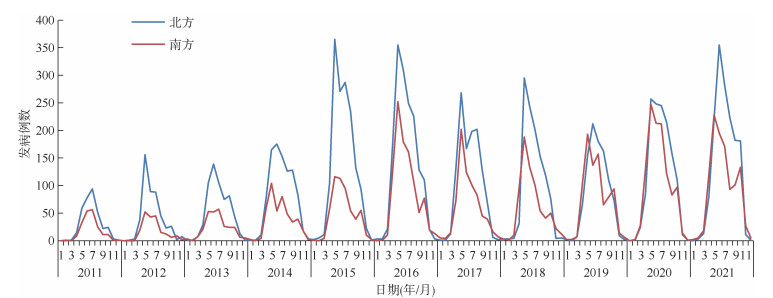
|
| 图 4 2011-2021年中国南、北方发热伴血小板减少综合征发病季节性分布 |
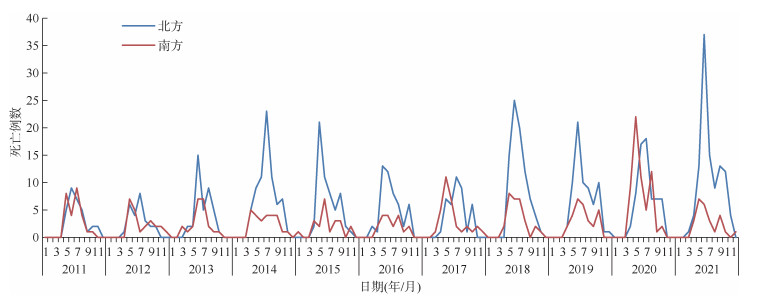
|
| 图 5 2011-2021年中国南、北方发热伴血小板减少综合征死亡季节性分布 |
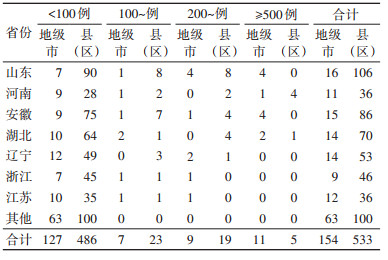
4. 地区分布:2011-2021年全国共计154个地级市报告SFTS病例,其中累计报告病例数最多的是河南省信阳市(4 771例),其次是山东省烟台市(1 343例)、湖北省黄冈市(1 295例)、山东省威海市(1 056例)、安徽省滁州市(834例)、安徽省六安市(798例)、山东省济南市(792例),此7个地级市报告病例数占全国的57.61%。全国共有11个地级市累计报告发病数≥500例,报告发病总数占全国的70.28%(13 285/18 902);9个地级市累计报告发病数范围为200~499例,报告发病总数占全国的15.94%(3 013/18 902);7个地级市累计报告发病数范围为100~199例,报告发病总数占全国的5.32%(1 005/18 902);其他127个地级市累计报告发病数 < 100例,报告发病总数占全国的7.34%(1 388/18 902)。见表 1。
11年间全国533个县(区)有SFTS病例分布,累计报告病例数位居前3位的县(区)全部来自河南省信阳市,分别是商城县(1 373例)、光山县(1 148例)和浉河区(756例),其次是湖北省黄冈市麻城市(661例)、河南省信阳市平桥区(573例)。此5个县(区)报告发病总数占全国的23.87%。全国19个县(区)累计报告发病数范围为200~499例,报告发病总数占全国的26.83%(5 071/18 902);23个县(区)累计报告发病数范围为100~199例,报告发病总数占全国的17.45%(3 299/18 902);其他486个县(区)累计报告发病数 < 100例,报告发病总数占全国的27.33%(5 165/18 902),即全国共47个县(区)累计报告发病数≥100例,报告发病总数占全国的72.67%(13 737/18 902)。见表 1。
2011年共51个地级市报告SFTS病例,发病率超过1.000/10万的有3个,分别是河南省信阳市(2.194/10万)、湖北省随州市(1.249/10万)和山东省烟台市(1.162/10万)。2014年新疆维吾尔自治区首次报告病例。2016年全国增至76个地级市报告病例,发病率超过1.000/10万的地级市高达15个,发病率最高的是河南省信阳市(16.000/10万),其次是湖北省随州市(5.797/10万)和山东省威海市(4.385/10万)。2021年高达88个地级市报告病例,发病率超过1.000/10万的有15个,发病率最高的是山东省威海市(7.604/10万),其次是河南省信阳市(6.605/10万)和安徽省滁州市(5.092/10万)。
整体而言,我国SFTS报告地区由2011年13个省51个地级市108县(区),上升到2021年的19个省88个地级市277县(区),2011-2021年全国疫情呈现报告发病率总体升高、存在明显空间聚集性、地域不断扩散的趋势,从中部向东北、西部和南方扩散。见图 6。

|
| 图 6 2011-2021年全国以地级市为尺度的发热伴血小板减少综合征发病率分布 |
5. 人群分布:SFTS病例的职业主要为农民,占85.82%(16 221/18 902),其次为家务及待业,占6.99%(1 322/18 902);死亡病例的职业也主要为农民,占84.58%(817/966),其次为家务及待业,占7.97%(77/966)。发病年龄主要集中在50~74岁,占69.46%(13 129/18 902)。
全国报告SFTS病例的男女性别比为0.89∶1(8 905∶9 997),累计报告发病率女性(1.491/10万)略高于男性(1.266/10万),差异有统计学意义(χ2=126.57,P < 0.001)。从历年累计发病率来看,男性和女性均以70~74岁年龄组为发病高峰,≥75岁年龄组的发病率有所下降,但仍处于较高水平,< 40岁(χ2=27.79,P < 0.001)及≥75岁(χ2=47.73,P < 0.001)年龄组中,男性均高于女性;40~74岁年龄组中,女性则高于男性(χ2=158.15,P < 0.001),且女性在50~54岁年龄组中出现发病小高峰。男性和女性发病率均呈随着年龄增加而上升趋势,其中男性发病率由0~4岁年龄组的0.040/10万增加到≥80岁的4.480/10万(χ2=13 185.21,P < 0.001),女性发病率由0~4岁年龄组的0.038/10万增加到≥80岁的3.318/10万(χ2=12 939.83,P < 0.001)。见图 7。

|
| 图 7 2011-2021年全国发热伴血小板减少综合征不同年龄性别累计发病率分布 |
SFTS死亡病例的男女性别比为1.11∶1(508∶458),累计报告病死率男性(5.70%)略高于女性(4.58%),差异有统计学意义(χ2=12.25,P < 0.001)。从历年累计病死率来看,60~64岁(6.25% vs. 4.12%,χ2=6.61,P=0.010)及70~74岁(8.15% vs. 6.09%,χ2=4.26,P=0.039)年龄组中,男性均高于女性,其余年龄组男性和女性差异无统计学意义(P > 0.05)。男性 < 30岁(0/258)、女性 < 35岁(0/251)年龄组病死率均为0。死亡病例主要集中在≥60岁年龄组,占79.71%(770/966)。男性和女性病死率均呈随着年龄增加而上升趋势,其中男性病死率由30~34岁年龄组的0.70%增加到≥80岁的11.58%(χ2=115.70,P < 0.001),女性病死率由35~39岁年龄组的1.56%增加到≥80岁的8.98%(χ2=103.42,P < 0.001)。见图 8。
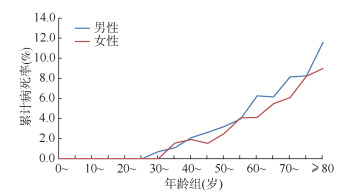
|
| 图 8 2011-2021年全国发热伴血小板减少综合征不同年龄性别累计病死率分布 |
本研究针对2011-2021年全国SFTS监测数据分析发现,全国SFTS年发病率总体呈上升趋势;病死率较高,总体呈下降趋势,不同省份病死率差异较大,山东省和浙江省病死率较高,河南省病死率较低。我国SFTS发病、死亡具有明显的季节性特征,南、北方均夏、秋季高发,北方发病峰值更高,南方死亡高峰期早于北方。我国SFTS发病具有高度空间聚集性,集中于河南、山东、湖北、安徽、江苏、浙江和辽宁7个省的部分地级市和县(区),地域呈不断扩散趋势,与Miao等[6]的研究结果相似。病例职业主要为农民,发病和死亡年龄集中于中老年人群,女性发病率略高于男性,男性病死率则高于女性,与既往研究发现基本一致[7];男性和女性的发病率和病死率随年龄增长均呈上升趋势。
2011-2021年全国报告SFTS病例逐年出现增长和扩散趋势,可能有两个方面的原因。首先,SFTSV的主要传播媒介是蜱,SFTSV的自然宿主较多[8]、牛羊等家畜感染率高,接触家畜血液亦可能导致人类感染[9],蜱及其宿主动物的自然扩散和迁移促使新疫区不断形成。SFTSV可能通过人类、小型哺乳动物、蜱或鸟类传播到更多地区[10],通过自然感染模式[11],即动物宿主污染环境,环境暴露造成更多动物宿主感染,进而人接触动物宿主受感染。现代物流和交通导致宿主被动迁移加速,全球气候不断变暖亦是新疫区成因之一[12]。其次,该病于我国发现初期病死率高达30%[1],我国政府高度重视,下发防治指南、要求按照法定乙类传染病进行监测报告,并加强高发区医疗卫生机构培训,各地尤其高发区SFTS诊断和报告能力快速提升。
发病诊断间隔长是SFTS病死的危险因素[13-14]。近11年我国SFTS病死率呈现逐年下降的趋势,可能由于各地尤其高发区加强群众健康教育和基层医疗卫生机构诊治能力建设,病例诊治及时性提高。此外,随着治疗经验积累和临床研究进展及成果应用,我国SFTS救治水平逐步提高[13-14]。例如河南省信阳市定点医院及早(在病例病毒载量 < 1×106拷贝/ml时)使用利巴韦林抗病毒药治疗SFTS住院病例,使病死率从6.25%下降至1.16%[13]。不同地区报告病死率差异较大,与不同地区的病例诊治及时性、救治水平,以及病例随访制度完善程度不同相关[13-15]。部分地区建立了SFTS定点医院,群众对该病防范意识强,被蜱叮咬发病后及时诊治,病死风险降低。由于风俗和经济能力制约,部分病例病重后放弃治疗返回家中,如果随访缺失、未统计在家中死亡病例则导致报告病死率低于真实情况[15]。
SFTS为自然疫源性疾病,蜱是其主要传播媒介,带病毒蜱叮咬吸血是其主要传播方式[16]。因此该病发病存在明显季节性,南、北方均夏、秋季高发,可能与蜱的季节消长和人类活动有关。多地生物媒介监测显示蜱的优势种类为长角血蜱,其活动具有明显的季节性,春季开始活动并延续到秋季[17-18]。蜱主要栖息于植被丰富的山区丘陵或林场,生长繁殖受到植被、温度、湿度和光照等气候因素的影响,较高的温度和湿度有利于促进雌蜱产卵及幼蜱、若蜱的生长发育[19],这些因素的季节性变化导致了蜱密度的自然消长。人类耕种、割草、狩猎、采摘茶叶、放牧和旅行等户外活动亦多在夏、秋季进行。北方地区山东省、河南省SFTS报告发病数位居全国前两位,北方发病峰值高可能也与此两省高发区人口密度大、从事果园、茶园种植等野外作业的人员多,且当地长角血蜱具有较高的SFTSV携带率[20],以及监测力度大和病例发现能力强有关[12]。南方死亡高峰期早于北方1~2个月,这可能与南、北方气候的差异以及不同的空间地理位置有关[6]。我国SFTS高发的山东、河南、安徽、湖北等省的高发县(区),以山地、丘陵地势为主,植被覆盖茂盛,为蜱的生长繁殖提供了良好的自然条件,山地、丘陵地区经常从事农业劳动接触草丛等环境,被蜱叮咬的机会较多,蜱病毒携带率较高[17-18, 20],SFTSV暴露、感染风险高,因此发病率高发病人数多。
SFTS病例中农民占比最高,中老年人群高发,女性发病率略高于男性,其原因可能与暴露机会差异有关。农村地区是蜱活动的最主要场所,留守的多为中老年人群,从事人工为主的农业生产活动,长期暴露在自然环境中,在田间劳动时接触蜱的概率相对较高有关。一些高发地区如河南省有种植茶业相关产业,从事采茶活动的女性农民较多,其采摘、除草等劳作过程中极易被蜱叮咬造成感染[18]。发病率随年龄增长呈上升趋势,可能是由于中老年人群基础性疾病罹患率高,机体免疫力较差,感染后多易发病并且症状较重而较容易被发现,从而更容易被诊断报告[7, 21-22]。
SFTS是一个不断扩大的全球公共卫生威胁,该病在日本、韩国等国家的发病率增加并有较高的死亡率[23]。有研究显示,估计有8.3%的SFTS病例在我国高流行地区未被确诊[24],可能是因为这些病例缺乏典型的疾病临床特征;对我国健康人群SFTSV血清的流行病学调查结果显示,河南、湖北、浙江、陕西、安徽、山东等省流行区血清阳性率较高,平均值范围为3.9%~6.9%,江苏省较低(0.7%)[25],非流行区健康人群也有较高的SFTSV血清阳性率(采茶人群9.4% vs.非采茶人群2.5%)[26],提示多数SFTSV感染以亚临床感染或轻症病例存在以及可能广泛存在的感染风险。因此,应加强对此病的监测,并加强流行病学研究和病例随访管理,进一步摸清其疾病谱和疾病负担。截至目前,SFTS仍无有效的疫苗,亦无特异性药物治疗[27],因此切断传播途径,减少暴露机会,加强病例管理、避免人际传播,是目前较为有效的防控措施[28-29]。鉴于SFTS在我国具有高度的空间聚集性,但发病呈上升和扩散态势、病死率高的特征,应根据不同地区的流行水平做好分类指导。低发地区做好病例监测、蜱虫叮咬健康教育和防控技术储备,在高发地区要倾斜防控资源,通过爱国卫生运动、环境综合治理控制媒介密度;开展公众健康教育,宣传蜱防治知识,户外或野外活动时做好个人防护,蜱虫叮咬发病后及时就医;开展基层医护人员技术培训,建立重症识别和转诊机制,提高诊断和医疗救治能力,降低病死率。
利益冲突 所有作者声明无利益冲突
作者贡献声明 陈秋兰:研究设计、论文撰写、论文修改;朱曼桐、陈宁:查阅文献、数据整理、统计学分析、绘制图表;杨栋:数据收集、数据整理;殷文武、牟笛、李昱:查阅文献、修改论文;张彦平:研究指导、论文指导;再那吾东·玉山:研究设计、获取研究经费、研究指导、论文修改
| [1] |
Yu XJ, Liang MF, Zhang SY, et al. Fever with thrombocytopenia associated with a novel Bunyavirus in China[J]. N Engl J Med, 2011, 364(16): 1523-1532. DOI:10.1056/NEJMoa1010095 |
| [2] |
Xu BL, Liu LC, Huang XY, et al. Metagenomic analysis of fever, thrombocytopenia and leukopenia syndrome (FTLS) in Henan Province, China: discovery of a new Bunyavirus[J]. PLoS Pathog, 2011, 7(11): e1002369. DOI:10.1371/journal.ppat.1002369 |
| [3] |
Luo LM, Zhao L, Wen HL, et al. Haemaphysalis longicornis ticks as reservoir and vector of severe fever with thrombocytopenia syndrome virus in China[J]. Emerg Infect Dis, 2015, 21(10): 1770-1776. DOI:10.3201/eid2110.150126 |
| [4] |
Fang XY, Hu JL, Peng ZH, et al. Epidemiological and clinical characteristics of severe fever with thrombocytopenia syndrome bunyavirus human-to-human transmission[J]. PLoS Negl Trop Dis, 2021, 15(4): e0009037. DOI:10.1371/journal.pntd.0009037 |
| [5] |
中华人民共和国卫生部办公厅. 关于印发《发热伴血小板减少综合征防治指南(2010年版)》的通知[EB/OL]. (2010-10-08)[2021-11-10]. http://www.gov.cn/gzdt/2010-10/09/content_1718261.htm.
|
| [6] |
Miao D, Liu MJ, Wang YX, et al. Epidemiology and ecology of severe fever with thrombocytopenia syndrome in China, 2010-2018[J]. Clin Infect Dis, 2021, 73(11): e3851-3858. DOI:10.1093/cid/ciaa1561 |
| [7] |
Huang XX, Li JD, Li AQ, et al. Epidemiological characteristics of severe fever with thrombocytopenia syndrome from 2010 to 2019 in Mainland China[J]. Int J Environ Res Public Health, 2021, 18(6): 3092. DOI:10.3390/ijerph18063092 |
| [8] |
Tian HY, Yu PB, Chowell G, et al. Severe fever with thrombocytopenia syndrome virus in humans, domesticated animals, ticks, and mosquitoes, Shaanxi province, China[J]. Am J Trop Med Hyg, 2017, 96(6): 1346-1349. DOI:10.4269/ajtmh.16-0333 |
| [9] |
Choi SJ, Park SW, Bae IG, et al. Severe fever with thrombocytopenia syndrome in South Korea, 2013-2015[J]. PLoS Negl Trop Dis, 2016, 10(12): e0005264. DOI:10.1371/journal.pntd.0005264 |
| [10] |
Fu YF, Li SB, Zhang Z, et al. Phylogeographic analysis of severe fever with thrombocytopenia syndrome virus from Zhoushan Islands, China: implication for transmission across the ocean[J]. Sci Rep, 2016, 6: 19563. DOI:10.1038/srep19563 |
| [11] |
Xing XS, Guan XH, Liu L, et al. Natural transmission model for severe fever with thrombocytopenia syndrome Bunyavirus in villages of Hubei province, China[J]. Medicine (Baltimore), 2016, 95(4): e2533. DOI:10.1097/MD.0000000000002533 |
| [12] |
姜晓林, 张晓梅, 逄博, 等. 山东省发热伴血小板减少综合征时空流行特征分析[J]. 中国人兽共患病学报, 2020, 36(9): 740-745. Jiang XL, Zhang XM, Pang B, et al. Temporal-spatial Analysis of severe fever with thrombocytopenia syndrome (SFTS) in Shandong Province, China[J]. Chin J Zoon, 2020, 36(9): 740-745. DOI:10.3969/j.issn.1002-2694.2020.00.112 |
| [13] |
Li H, Lu QB, Xing B, et al. Epidemiological and clinical features of laboratory-diagnosed severe fever with thrombocytopenia syndrome in China, 2011-17: a prospective observational study[J]. Lancet Infect Dis, 2018, 18(10): 1127-1137. DOI:10.1016/S1473-3099(18)30293-7 |
| [14] |
Cui N, Bao XL, Yang ZD, et al. Clinical progression and predictors of death in patients with severe fever with thrombocytopenia syndrome in China[J]. J Clin Virol, 2014, 59(1): 12-17. DOI:10.1016/j.jcv.2013.10.024 |
| [15] |
Yu XJ. Risk factors for death in severe fever with thrombocytopenia syndrome[J]. Lancet Infect Dis, 2018, 18(10): 1056-1057. DOI:10.1016/S1473-3099(18)30312-8 |
| [16] |
王建跃, 邬辉, 仝振东, 等. 发热伴血小板减少综合征流行病学研究进展[J]. 中华流行病学杂志, 2016, 37(2): 294-298. Wang JY, Wu H, Tong ZD, et al. A review on the epidemiologic features of severe fever with thrombocytopenia syndrome[J]. Chin J Epidemiol, 2016, 37(2): 294-298. DOI:10.3760/cma.j.issn.0254-6450.2016.02.029 |
| [17] |
熊进峰, 占建波, 谭梁飞, 等. 黄冈市蜱及宿主动物携带发热伴血小板减少综合征病毒情况调查[J]. 中国媒介生物学及控制杂志, 2016, 27(5): 504-505. Xiong JF, Zhan JB, Tan LF, et al. Survey on ticks and host animals of severe fever with thrombocytopenia syndrome virus in Huanggang, Hubei province[J]. Chin J Vector Biol Control, 2016, 27(5): 504-505. DOI:10.11853/j.issn.1003.8280.2016.05.023 |
| [18] |
马婷, 龚震宇, 张严峻, 等. 浙江省发热伴血小板减少综合征布尼亚病毒的宿主媒介调查[J]. 中国媒介生物学及控制杂志, 2015, 26(4): 353-356. Ma T, Gong ZY, Zhang YJ, et al. Survey of vectors and hosts of severe fever with thrombocytopenia syndrome virus in Zhejiang province, China[J]. Chin J Vector Biol Control, 2015, 26(4): 353-356. DOI:10.11853/j.issn.1003.4692.2015.04.006 |
| [19] |
李朝品. 医学蜱螨学[M]. 北京: 人民军医出版社, 2006. Li CP. Medical acarology[M]. Beijing: People's Military Medical Press, 2006. |
| [20] |
王黎源, 杨振东, 孙毅, 等. 长角血蜱携带发热伴血小板减少综合征病毒调查及基因特征分析[J]. 中国病原生物学杂志, 2014, 9(7): 629-632. Wang LY, Yang ZD, Sun Y, et al. Survey and genetic analysis of severe fever with thrombocytopenia syndrome virus from Haemaphysalis longicornis[J]. J Path Biol, 2014, 9(7): 629-632. DOI:10.13350/j.cjpb.140713 |
| [21] |
徐慧宁, 张宇, 于杰, 等. 老年新型布尼亚病毒致发热伴血小板减少综合征5例[J]. 中国老年学杂志, 2012, 32(18): 4076-4077. Xu HN, Zhang Y, Yu J, et al. Severe fever with thrombocytopenia syndrome caused by novel Bunyavirus in the elderly: a report of 5 cases[J]. Chin J Gerontol, 2012, 32(18): 4076-4077. DOI:10.3969/j.issn.1005-9202.2012.18.119 |
| [22] |
Gai ZT, Zhang Y, Liang MF, et al. Clinical progress and risk factors for death in severe fever with thrombocytopenia syndrome patients[J]. J Infect Dis, 2012, 206(7): 1095-1102. DOI:10.1093/infdis/jis472 |
| [23] |
Sun JM, Lu L, Wu HX, et al. The changing epidemiological characteristics of severe fever with thrombocytopenia syndrome in China, 2011-2016[J]. Sci Rep, 2017, 7(1): 9236. DOI:10.1038/s41598-017-08042-6 |
| [24] |
Huang XX, Wang SW, Wang XJ, et al. Estimation of the incidence of severe fever with thrombocytopenia syndrome in high endemic areas in China: an inpatient-based retrospective study[J]. BMC Infect Dis, 2018, 18(1): 66. DOI:10.1186/s12879-018-2970-7 |
| [25] |
Du YH, Cheng NN, Li Y, et al. Seroprevalance of antibodies specific for severe fever with thrombocytopenia syndrome virus and the discovery of asymptomatic infections in Henan Province, China[J]. PLoS Negl Trop Dis, 2019, 13(11): e0007242. DOI:10.1371/journal.pntd.0007242 |
| [26] |
Huang XX, Zhang ZX, Jin GH, et al. Presence of antibodies against severe fever with thrombocytopenia syndrome virus in non-endemic areas of China[J]. Jpn J Infect Dis, 2017, 70(3): 248-251. DOI:10.7883/yoken.JJID.2016.214 |
| [27] |
Wang YL, Deng BC, Zhang J, et al. Person-to-person asymptomatic infection of severe fever with thrombocytopenia syndrome virus through blood contact[J]. Intern Med, 2014, 53(8): 903-906. DOI:10.2169/internalmedicine.53.1164 |
| [28] |
陈冲, 田地, 陈志海. 发热伴血小板减少综合征的研究进展[J]. 中国医药, 2019, 14(5): 790-794. Chen C, Tian D, Chen ZH. Research progress of severe fever with thrombocytopenia syndrome[J]. China Medicine, 2019, 14(5): 790-794. DOI:10.3760/j.issn.1673-4777.2019.05.037 |
| [29] |
雷晓颖, 张笑爽, 于学杰. 发热伴血小板减少综合征布尼亚病毒研究进展[J]. 中国公共卫生, 2014, 30(7): 967-971. Lei XY, Zhang XS, Yu XJ. Advances in severe fever with thrombocytopenia syndrome Bunyavirus[J]. Chin J Public Health, 2014, 30(7): 967-971. DOI:10.11847/zgggws2014-30-07-38 |
 2022, Vol. 43
2022, Vol. 43