文章信息
- 王婷, 王丹丹, 陈文鑫, 晋聪, 李雁笛, 扆琳珠, 丰淑英, 汪波, 冯永亮, 王素萍.
- Wang Ting, Wang Dandan, Chen Wenxin, Jin Cong, Li Yandi, Yi Linzhu, Feng Shuying, Wang Bo, Feng Yongliang, Wang Suping
- HBsAg阳性母亲C基因型HBV DNA CpG岛分布特点和宫内传播的关系
- Distributive characteristics of HBV DNA CpG islands in HBsAg positive mothers and its relationship with intrauterine transmission
- 中华流行病学杂志, 2022, 43(5): 728-733
- Chinese Journal of Epidemiology, 2022, 43(5): 728-733
- http://dx.doi.org/10.3760/cma.j.cn112338-20211010-00779
-
文章历史
收稿日期: 2021-10-10
2. 太原市第三人民医院妇产科,太原 030001
2. Department of Obstetrics and Gynaecology, the Third People Hospital of Taiyuan City, Taiyuan 030001, China
我国是HBV感染中流行区,疾病负担较为严重[1-2]。HBV宫内传播是我国HBV感染的重要传播途径[3-5],且HBV宫内传播是目前人群中慢性乙肝感染者积累的重要原因之一[6],研究HBV宫内传播的发生机制十分必要。HBV具有高度的变异性,根据其基因组间核酸序列差异性可将其分为多个基因型,在我国以C基因型较为多见[7-8]。HBV C基因型有两个常见的传统CpG岛,即CpG岛Ⅱ、CpG岛Ⅲ。HBV DNA CpG岛分布在HBV基因组的开放阅读框(S基因、C基因、P基因以及X基因)及顺式作用元件(启动子、增强子等)上:CpG岛Ⅱ与增强子I、X基因启动子区(Xp区)以及X基因区部分重叠,CpG岛Ⅲ在P基因区的起始位点附近[9-10]。这些HBV基因组结构都与HBV在体内的复制密切相关,而HBsAg阳性母亲体内HBV高复制水平又是宫内传播发生的重要危险因素[11-12],由此推测CpG岛在HBV基因组结构上的分布可能与HBV宫内传播有关,其可能会通过影响HBV DNA碱基对的排列顺序而影响HBV在宿主体内的复制、转录和表达,从而进一步影响HBV宫内传播。本研究以HBV C基因型的HBsAg阳性母亲作为研究对象,探讨母亲携带的HBV DNA CpG岛分布特点及与HBV宫内传播的关系,从而为HBV宫内传播机制研究提出新视角,为降低HBV宫内传播提供新思路。
对象与方法1. 研究对象:连续收集2011年6月至2013年7月山西省太原市第三人民医院妇产科的HBsAg阳性母亲及其新生儿399对。通过面对面问卷调查及电子病历收集母亲的一般人口学资料、本次妊娠情况和新生儿的分娩、出生情况等资料;采集母亲分娩前24 h内肘静脉血及新生儿出生后24 h内乙肝疫苗/乙肝免疫球蛋白注射前股静脉血各3 ml,分装血清于-80 ℃冰箱保存备检。本研究经山西医科大学伦理委员会批准,所有研究对象均签署知情同意书。
2. HBV宫内传播判定标准:新生儿出生后24 h内且主/被动免疫前,股静脉血HBsAg和/或HBV DNA阳性者判定为HBV宫内传播[13-14]。
3. 母亲及新生儿HBV血清学标志物及血清HBV DNA检测:采用电化学发光法(ECLIA,试剂购自德国罗氏诊断有限公司)检测HBV血清学标志物(HBsAg、抗-HBs、HBeAg、抗-HBe、抗-HBc),采用荧光定量PCR(试剂购自中山大学达安基因股份有限公司)检测血清HBV DNA载量。
4. 母亲携带的HBV DNA的提取和扩增:使用德国Qiagen公司生产的QIAamp DNA提取试剂盒,严格按照使用说明书操作提取血清HBV DNA。使用梯度PCR仪(德国EPPENDORF公司)进行DNA扩增,DNA分单、双链进行扩增,扩增HBV单链(1 442 bp)用HBV-DF/DR引物(DF:5'-GTC TGC GGC GTT TTA TC-3',DR:5'-AAG TTG CAT GGT GCT GGT GA-3');扩增HBV双链(2 410 bp)用HBV-SF/SR引物(SF:5'-TCA CCT CTG CCT AAT CAT CTC ATG-3',SR:5'-GCA AAG CCC AAA AGA CCC ACA AT-3')。PCR为50 μl反应体系,包括3 μl HBV DNA模板,10 μl 5×TransStart® FastPfu Buffer,4 μl dNTPs,1 μl TransStart® FastPfu DNA聚合酶,30 μl超纯水(ddH2O)及上、下游引物各1 μl[引物由生工生物工程(上海)股份有限公司设计、合成]。PCR扩增条件:94 ℃变性5 min;94 ℃ 30 s,55 ℃ 30 s,68 ℃单链80 s/双链110 s,35个循环;68 ℃延伸10 min。
5. 母亲携带的HBV DNA测序及基因型确定:将上述PCR产物经凝胶电泳分离回收,将HBV DNA片段连接到pEASY-Blunt Zero Cloning载体,转入Trans1-T1噬菌体抗性化学感受态细胞(北京TransGen生物技术有限公司)进行培养,培养液送生工生物工程(上海)股份有限公司进行测序。所得HBV序列经编辑(DNAStar软件包)、拼接(SeqMan软件)、位置调整(Mega 6.0软件包)后采用邻接(Neighbor-joining)法构建系统进化树(Kimura双参数,1 000次验证)。通过与NCBI下载的标准序列比对进行基因分型,详见课题组前期研究[13-14]。
6. 母亲携带的HBV DNA CpG岛分布预测:利用“MethPrimer”网站(http://www.urogene.org/methprimer/)对母亲携带的HBV DNA CpG岛的分布进行预测。进入网站后,点击“Go to MethPrimer(plus CpG Island Prediction)”界面,输入已经测序确定的母亲携带的HBV DNA序列,调整CpG岛预测所需参数为默认参数(默认参数:片段长度≥100 bp;GC含量≥50.0%;检测到的CpG岛与预期的CpG岛的比值≥0.6),汇总CpG岛的类型、位置及长度等。
7. 统计学分析:用EpiData 3.1软件建库并进行数据录入,采用SAS 9.4软件进行数据分析。非正态分布的计量资料用M(Q1,Q3)进行统计描述,计数资料用例数、构成比(%)进行统计描述;计量/计数资料组间比较用Wilcoxon秩和检验/χ2检验。以P < 0.05为差异有统计学意义。
结果1. 母亲携带的HBV基因型:共收集399对HBsAg阳性母亲及其新生儿,其中54例新生儿发生HBV宫内传播。发生宫内传播者中,22例母亲外周血HBV DNA载量满足克隆测序要求(HBV DNA≥106 IU/ml);未发生HBV宫内传播者中,91例母亲外周血HBV DNA载量满足克隆测序要求,以随机种子方法选择22例作为对照。
对44例HBsAg阳性母亲的HBV DNA进行扩增克隆测序,HBV基因型分析结果显示:44例样本中39例(88.64%,39/44)为C基因型(均为C2亚型),余2例为B基因型,3例为B/C基因混合型。选择HBV C基因型的39例HBsAg阳性母亲作为研究对象进一步进行HBV DNA CpG岛分布预测,其中宫内传播组19例,未发生宫内传播的对照组20例。
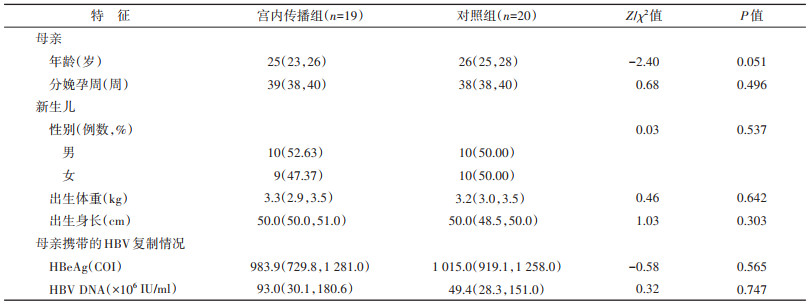
2. HBV C基因型的HBsAg阳性母亲及新生儿的一般情况:39例HBsAg阳性母亲年龄在20~35岁,均为汉族,分娩孕周为37~41周;新生儿出生体重和身长范围分别为2.5~4.3 kg和45~52 cm。比较HBV宫内传播组与对照组母亲及新生儿的一般人口学特征和母亲携带的HBV复制情况,结果显示母亲的年龄、分娩孕周和血清HBeAg、HBV DNA以及新生儿的性别、出生身长和出生体重在两组间的差异无统计学意义(P>0.05)。见表 1。
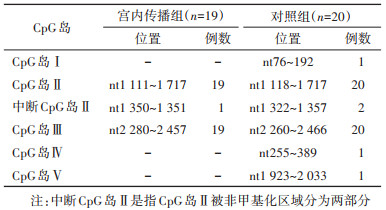
3. C基因型HBV DNA CpG岛分布与宫内传播的关系:HBV DNA CpG岛分布预测结果显示,39例C基因型中共检出5个CpG岛,包括传统CpG岛Ⅰ、Ⅱ、Ⅲ以及新型CpG岛Ⅳ和Ⅴ,且均含CpG岛Ⅱ和岛Ⅲ。HBV宫内传播组仅含CpG岛Ⅱ和岛Ⅲ;对照组均含CpG岛Ⅱ和岛Ⅲ,且有CpG岛Ⅰ、岛Ⅳ和岛Ⅴ各1例。另外,HBV宫内传播组(1例)和对照组(2例)的岛Ⅱ为“中断CpG岛Ⅱ”(中断CpG岛Ⅱ是指CpG岛Ⅱ被非甲基化区域分为两部分)。HBV宫内传播组的HBV DNA CpG岛有2种类型,而对照组共有5种类型,15.00%(3/20)同时还含有CpG岛Ⅰ、岛Ⅳ或岛Ⅴ。见表 2。
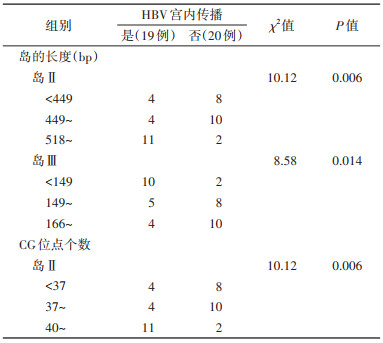
4. C基因型HBV DNA CpG岛Ⅱ、岛Ⅲ与HBV宫内传播的关系:HBV宫内传播组和对照组母亲的HBV DNA均含有CpG岛Ⅱ和岛Ⅲ,进一步研究HBV DNA CpG岛Ⅱ、岛Ⅲ与HBV宫内传播的关系。比较两组母亲携带的HBV DNA CpG岛Ⅱ、岛Ⅲ的长度及其CpG位点(CG位点)个数,结果显示,HBV宫内传播组的CpG岛Ⅱ长度及其CG位点个数大于对照组(P < 0.05);CpG岛Ⅲ长度小于对照组(P < 0.05),但CpG岛Ⅲ CG位点个数在两组间的差异无统计学意义(P > 0.05)。见表 3。将CpG岛长度和CG位点个数以三分位数为界分析其分布差异,结果显示,HBV宫内传播组和对照组CpG岛Ⅱ长度及CG位点个数和岛Ⅲ长度分布明显不同(P < 0.05),在HBV宫内传播组中有11例母亲的HBV DNA CpG岛Ⅱ长度≥518 bp,且CG位点个数≥40个,而18例对照组的CpG岛Ⅱ长度 < 518 bp,且CG位点个数 < 40个;在宫内传播组中有10例母亲(10/19)的HBV DNA CpG岛Ⅲ长度 < 149 bp,明显多于对照组(2/20)。见表 4。
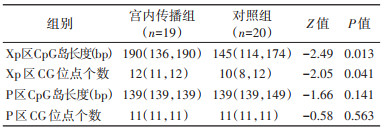
5. HBV DNA Xp区和P基因区(P区)的CpG岛分布与HBV宫内传播的关系:测序及CpG岛预测结果表明,39例母亲的HBV DNA CpG岛Ⅱ位置跨越nt1 111~1 717,与部分Xp区(nt1 170~1 359)重叠,CpG岛Ⅲ位置跨越nt2 260~2 466,与部分P区(nt2 307~3 125,nt1~1 620)重叠。进一步分析HBV Xp区和P区的CpG岛分布与HBV宫内传播的关系,结果显示,HBV宫内传播组HBV Xp区(有较多RNA聚合酶Ⅱ结合位点的区域)CpG岛长度大于对照组(P=0.013)。在HBV宫内传播组的19例母亲中有12例母亲携带的HBV DNA CpG岛Ⅱ完全覆盖了Xp区,远多于对照组(5/20)。见图 1。同时,HBV宫内传播组HBV DNA Xp区CG位点个数高于对照组(P=0.041),提示HBV Xp区的CpG岛Ⅱ与HBV宫内传播有关;而P区CpG岛的长度及其CG位点个数在两组之间接近(P>0.05)。见表 5。

|
| 图 1 HBV宫内传播组和对照组母亲携带的HBV DNA CpG岛覆盖Xp区情况 |
HBV宫内传播无法完全得到有效控制是人群中HBV感染者积累的重要原因[6],了解HBV宫内传播发生的机制对于减轻由HBV引起的相关疾病负担具有重要意义。有研究表明CpG岛的分布与下游基因的表达有关[15],而HBV DNA CpG岛在HBV基因组结构上的分布有所不同[8-9],可能会通过影响母亲携带的HBV在体内的复制而导致宫内传播的发生,相关研究未见报道。本研究发现,C基因型HBsAg母亲携带的HBV DNA CpG岛的分布与HBV宫内传播发生有关,可能为HBV宫内传播机制研究提供新的思路。
HBV是一种因缺乏聚合酶校正功能而具有高度变异性的病毒,根据基因组序列异质性将其分为不同的基因型[16],在我国以C基因型较为多见[7-8]。本研究同样显示大部分的HBsAg阳性母亲的HBV基因型为C基因型(88.64%,39/44),B基因型及B/C基因混合型(11.36%,5/44)较少。
CpG岛是HBV基因组中富含CG双核苷酸的序列,目前普遍认为HBV DNA中有3个传统类型的CpG岛:Ⅰ、Ⅱ和Ⅲ,以及3个新发现的CpG岛:Ⅳ、Ⅴ和Ⅵ。本研究中39例HBV C基因型HBsAg阳性母亲携带的HBV DNA均含有CpG岛Ⅱ和岛Ⅲ,其他岛仅在个别研究对象中出现,这与已有研究结果相似[9, 15]。本研究中HBV宫内传播组的母亲携带的HBV DNA仅含有传统CpG岛Ⅱ和岛Ⅲ,对照组含有传统CpG岛Ⅰ及新的CpG岛Ⅳ及岛Ⅴ。HBV宫内传播组的HBV DNA CpG岛的类型较对照组少,提示发生HBV宫内传播的HBV DNA CpG岛类型的分布可能比较保守。本研究还发现部分岛Ⅱ出现“中断”现象,其发生机制和临床意义目前尚不清楚,Hou等[15]在岛Ⅱ的“中断”区域,检测到了与HBV基因结构和功能异常有关的突变现象,而本研究中仅发现3例,待扩大样本量继续研究。本研究结果还显示对照组有新型CpG岛Ⅳ和岛Ⅴ,新型岛Ⅳ的位置在岛Ⅰ和岛Ⅱ之间,新型岛Ⅴ位于岛Ⅱ和岛Ⅲ之间,新型CpG岛可能是DNA甲基化的潜在区域[17-18],关于新型岛的生物学意义还有待进一步探讨。
本研究中HBV宫内传播组母亲携带的HBV DNA CpG岛Ⅱ长度、CG位点个数和Xp区的CpG岛Ⅱ长度、CG位点个数均明显高于对照组(P < 0.05),提示HBV DNA CpG岛Ⅱ长度和CG位点个数与HBV宫内传播有关。一方面,HBV DNA CpG岛Ⅱ与HBV的部分增强子(Enh I)、Xp区以及部分X基因区重叠。Enh I/X基因启动子能与多种核内转录因子相结合,增强启动子的转录水平从而上调前基因组RNA(pgRNA)的表达,而X基因编码的HBx蛋白具有广泛的转录激活功能。Enh I/X基因启动子及X基因的正确表达均有利于维持HBV在体内的高水平复制[19-20]。另一方面,有研究表明CpG岛的存在与基因调控区相关[21],也有研究显示,CpG岛较长的启动子具有更多的RNA聚合酶Ⅱ结合位点[22-23]。在HBV DNA中,CpG岛Ⅱ覆盖部分Xp区(nt1 170~1 359),启动子区的CpG岛越长,其RNA聚合酶Ⅱ结合位点越多,由于HBV DNA在复制过程中缺乏病毒聚合酶的校对功能,大量的RNA聚合酶Ⅱ的结合位点能够有效校对HBV聚合酶蛋白,减少在复制的DNA链中出现随机的碱基错误合并,避免HBV基因的结构和功能异常,有助于HBV在体内的复制。在本研究中,HBV宫内传播组母亲的HBV DNA载量也相对较高,而母亲体内高病毒载量又是HBV宫内传播发生重要的危险因素,支持了CpG岛Ⅱ的长度及CG位点个数与HBV宫内传播的关系。
本次研究显示,与CpG岛Ⅱ相反,CpG岛Ⅲ短,发生HBV宫内传播可能性高。HBV DNA CpG岛Ⅲ位于部分P区上,但进一步分析HBV DNA CpG岛Ⅲ长度及CG位点个数在P区的分布,发现在两组之间并无差异,出现这种差异的原因还有待进一步探讨。
本研究存在局限性。由于目前测序技术的高载量要求和测序结果的稳定问题,本研究只选择了HBV DNA高载量的母亲及新生儿作为研究对象,无法评估不同HBV DNA水平下HBV DNA CpG岛分布与HBV宫内传播的相关性,因此研究结论需要增加研究样本量进一步深入阐释。
综上所述,HBsAg阳性母亲C基因型HBV DNA CpG岛分布可能与HBV宫内传播有关,HBV DNA CpG岛类型分布保守、CpG岛Ⅱ长度长和CG位点个数多可能会增加HBV宫内传播的发生风险。
利益冲突 所有作者声明无利益冲突
作者贡献声明 王婷、王丹丹:实验操作、数据处理、论文撰写;陈文鑫、晋聪、李雁笛、扆琳珠:采集、整理数据;丰淑英、汪波:采集数据、支持性贡献;冯永亮、王素萍:研究指导、论文修改、经费支持
| [1] |
World Health Organization. Global Hepatitis Report, 2017[EB/OL]. (2017-04-19). https://www.who.int/publications/i/item/global-hepatitis-report-2017.
|
| [2] |
Liu J, Liang WN, Jing WZ, et al. Countdown to 2030:eliminating hepatitis B disease, China[J]. Bull World Health Organ, 2019, 97(3): 230-238. DOI:10.2471/blt.18.219469 |
| [3] |
Xu YY, Liu HH, Wang Y, et al. The next step in controlling HBV in China[J]. BMJ, 2013, 347: f4503. DOI:10.1136/bmj.f4503 |
| [4] |
Thio CL, Guo N, Xie C, et al. Global elimination of mother-to-child transmission of hepatitis B: revisiting the current strategy[J]. Lancet Infect Dis, 2015, 15(8): 981-985. DOI:10.1016/s1473-3099(15)00158-9 |
| [5] |
张磊, 邵中军. HBV宫内传播研究在乙型肝炎防控工作中发挥着重要的作用[J]. 中华流行病学杂志, 2019, 40(9): 1055-1058. Zhang L, Shao ZJ. Important role of study on intrauterine transmission of HBV in prevention and control of hepatitis B[J]. Chin J Epidemiol, 2019, 40(9): 1055-1058. DOI:10.3760/cma.j.issn.0254-6450.2019.09.007 |
| [6] |
王贵强, 王福生, 庄辉, 等. 慢性乙型肝炎防治指南(2019年版)[J]. 肝脏, 2019, 24(12): 1335-1356. Wang GQ, Wang FS, Zhuang H, et al. Guidelines for the Prevention and Treatment of Chronic Hepatitis B (2019 version)[J]. Chin Hepatol, 2019, 24(12): 1335-1356. DOI:10.14000/j.cnki.issn.1008-1704.2019.12.001 |
| [7] |
Zeng G, Wang Z, Wen S, et al. Geographic distribution, virologic and clinical characteristics of hepatitis B virus genotypes in China[J]. J Viral Hepat, 2005, 12(6): 609-617. DOI:10.1111/j.1365-2893.2005.00657.x |
| [8] |
伍宵, 魏少峰, 徐楠, 等. 中国慢性HBV感染者基因型分布及其临床意义Meta分析[J]. 实用肝脏病杂志, 2017, 20(3): 271-275. Wu X, Wei SF, Xu N, et al. Meta-analysis on distribution of hepatitis B virus genotypes and related clinical outcomes in China[J]. J Pract Hepatol, 2017, 20(3): 271-275. DOI:10.3969/j.issn.1672-5069.2017.03.005 |
| [9] |
Zhang YM, Li CX, Zhang YJ, et al. Comparative analysis of CpG islands among HBV genotypes[J]. PLoS One, 2013, 8(2): e56711. DOI:10.1371/journal.pone.0056711 |
| [10] |
Zhong CY, Hou ZW, Huang JH, et al. Mutations and CpG islands among hepatitis B virus genotypes in Europe[J]. BMC Bioinformatics, 2015, 16(1): 38. DOI:10.1186/s12859-015-0481-8 |
| [11] |
Shih YF, Liu CJ. Mother-to-infant transmission of hepatitis B virus: challenges and perspectives[J]. Hepatol Int, 2017, 11(6): 481-484. DOI:10.1007/s12072-017-9831-0 |
| [12] |
Peng SX, Wan ZH, Liu TT, et al. Incidence and risk factors of intrauterine transmission among pregnant women with chronic hepatitis B virus infection[J]. J Clin Gastroenterol, 2019, 53(1): 51-57. DOI:10.1097/mcg.0000000000001001 |
| [13] |
武佳欣, 杨志清, 张睿君, 等. HBsAg阳性母亲携带的HBV核心启动子突变与宫内传播的关系[J]. 中华流行病学杂志, 2020, 41(6): 902-907. Wu JX, Yang ZQ, Zhang RJ, et al. Relationship between mutations of HBV basal core promoter region in HBsAg-positive mothers and intrauterine transmission[J]. Chin J Epidemiol, 2020, 41(6): 902-907. DOI:10.3760/cma.j.cn112338-20200224-00163 |
| [14] |
赵甜静, 杨志清, 李雁笛, 等. C基因型HBV变异与宫内传播的关系[J]. 中华流行病学杂志, 2021, 42(4): 716-722. Zhao TJ, Yang ZQ, Li YD, et al. Relationship between C genotype HBV mutation and intrauterine transmission[J]. Chin J Epidemiol, 2021, 42(4): 716-722. DOI:10.3760/cma.j.cn112338-20200915-01163 |
| [15] |
Hou ZW, Huang JH, Zhong CY, et al. CpG islands of hepatitis B virus genome isolated from Chinese patients[J]. Gene, 2015, 561(2): 261-267. DOI:10.1016/j.gene.2015.02.036 |
| [16] |
Chen L, Shi Y, Yang WR, et al. Differences in CpG island distribution between subgenotypes of the Hepatitis B Virus genotype[J]. Med Sci Monit, 2018, 24: 6781-6794. DOI:10.12659/msm.910049 |
| [17] |
凌青霞, 陈明泉, 施光峰. DNA甲基化修饰在乙肝病毒持续感染相关肝病中的研究现状[J]. 肝脏, 2014, 19(5): 362-364. Ling QX, Chen MQ, Shi GF. Research status of DNA methylation modification in hepatitis B virus persistent infection-associated liver disease[J]. Chin Hepatol, 2014, 19(5): 362-364. DOI:10.14000/j.cnki.issn.1008-1704.2014.05.010 |
| [18] |
Vivekanandan P, Thomas D, Torbenson M. Hepatitis B viral DNA is methylated in liver tissues[J]. J Viral Hepat, 2008, 15(2): 103-107. DOI:10.1111/j.1365-2893.2007.00905.x |
| [19] |
Bock CT, Malek NP, Tillmann HL, et al. The enhancerⅠ core region contributes to the replication level of hepatitis B virus in vivo and in vitro[J]. J Virol, 2000, 74(5): 2193-2202. DOI:10.1128/jvi.74.5.2193-2202.2000 |
| [20] |
郑丹华, 王小众. 乙型肝炎病毒X蛋白的研究进展[J]. 中国病原生物学杂志, 2018, 13(10): 1158-1161. Zheng DH, Wang XZ. Advances in the study of the hepatitis B virus X protein[J]. J Parasit Biol, 2018, 13(10): 1158-1161. DOI:10.13350/j.cjpb.181023 |
| [21] |
Kim TH, Barrera LO, Zheng M, et al. A high-resolution map of active promoters in the human genome[J]. Nature, 2005, 436(7052): 876-880. DOI:10.1038/nature03877 |
| [22] |
Elango N, Yi SV. Functional relevance of CpG island length for regulation of gene expression[J]. Genetics, 2011, 187(4): 1077-1083. DOI:10.1534/genetics.110.126094 |
| [23] |
Thompson AJ, Colledge D, Rodgers S, et al. Stimulation of the interleukin-1 receptor and Toll-like receptor 2 inhibits hepatitis B virus replication in hepatoma cell lines in vitro[J]. Antivir Ther, 2009, 14(6): 797-808. DOI:10.3851/imp1294 |
 2022, Vol. 43
2022, Vol. 43