文章信息
- 徐传海, 袁满琼, 方亚.
- Xu Chuanhai, Yuan Manqiong, Fang Ya
- 我国老年人认知衰弱转移规律及其影响因素研究
- Transition rules of cognitive frailty and influencing factors in the elderly in China
- 中华流行病学杂志, 2022, 43(5): 722-727
- Chinese Journal of Epidemiology, 2022, 43(5): 722-727
- http://dx.doi.org/10.3760/cma.j.cn112338-20211013-00792
-
文章历史
收稿日期: 2021-10-13
认知障碍与躯体衰弱是两种常见的老年综合征,会增加不良健康结局的发生风险,如住院、跌倒、死亡等[1-2]。两者联系紧密,且常常共存于老年个体中。研究显示,躯体衰弱会显著增加认知障碍的发生风险[3],反之亦然[4]。以往研究通常将认知障碍与躯体衰弱作为两种独立的状态,近年来,大量关于两者之间相互关联的证据引发“认知衰弱”一词的出现。2013年国际衰老与营养协会及国际老年病学协会首次将认知衰弱定义为一种异质性综合征,是指在排除阿尔茨海默病或其他类型痴呆后,个体同时存在躯体衰弱和认知障碍[5]。认知衰弱会导致残疾、痴呆、死亡等风险增加,相比于单一的认知障碍或躯体衰弱状态,其作为预测因素能够提高老年人不良健康结局发生预测的有效性[6]。
目前我国关于认知衰弱的研究多集中于患病率、影响因素及其对不良健康结局的分析[7-8],忽略了认知衰弱具有的可逆性特征[5]。因此,本研究探讨我国老年人认知衰弱转移规律及其影响因素,为了解认知衰弱发生发展以及制定早期干预措施提供科学依据。
资料与方法1. 资料来源:采用中国健康与养老追踪调查(China Health and Retirement Longitudinal Study,CHARLS)2011-2015年数据。该数据由北京大学国家发展研究院发布,于2011年在全国范围开展基线调查,覆盖28个省(直辖市、自治区)150个县(区)450个村(社区)约1万户家庭中的17 705名≥45岁人群[9],每隔两年进行1次随访调查。本研究以≥60岁老年人作为研究对象,以2011年调查数据为基线,2013、2015年数据为两期随访资料,筛除关键变量缺失、死亡和失访人群,最终纳入3 470名老年人。
2. 个体健康状态划分:
(1)认知障碍:认知功能采用认知状态电话访谈(TICS-10)、10个词语回忆和图形绘制进行评估。其中,TICS-10包括日期(能否正确回答年、月、日、季节、星期)和100连续减7(能否正确计算结果),受试者每正确回答一项计1分,共10分;词语回忆包括10个单词的即时回忆和延迟回忆(每正确回忆一个词语计1分,取两次回忆平均分),共10分;图形绘制(能否完成两个重叠五边形图形的模仿绘制),共1分。总分21分,得分越高,认知功能越高。若受试者总分低于年龄调整x-s,为认知障碍[10]。
(2)躯体衰弱:躯体衰弱判定采用国内外广泛使用的Fried表型[1],包含5项指标:非自主性体重减轻、握力下降、步速减慢、体力活动水平降低和自报疲劳。各项指标界值的选取参考Wu等[11]的研究:①非自主性体重下降:受访者身体BMI≤18.5 kg/m2;②握力下降:握力值低于经性别和BMI调整后的界值;③步速减慢:步速低于经性别和身高调整后的界值;④体力活动水平降低:受访者自报通常一周内连续步行时间少于10 min;⑤自报疲劳:使用抑郁量表(CESD-10)中“我觉得做任何事都很费劲”“我觉得我无法继续我的生活”两个条目进行测量,研究对象对任一条目作出“有时或者有一半时间(3~4 d)”或“大多数的时间(5~7 d)”的回答。研究对象每符合上述1项计1分,不符合计0分,总分0~5分。得分1~2分,为躯体衰弱前期;3~5分,为躯体衰弱。本研究将躯体衰弱前期与躯体衰弱合并,作为躯体衰弱状态[12]。
(3)认知衰弱:若研究对象同时存在认知障碍和躯体衰弱状态且自报未患有阿尔茨海默病、帕金森病等疾病,为认知衰弱[5, 7]。
(4)健壮-认知正常:若研究对象不存在躯体衰弱状态和认知障碍,认定其为健壮-认知正常状态[5]。
3. 多状态Markov模型:假定认知衰弱进程中,从现有状态转移到下一状态仅取决于当前状态,而与过去的状态无关,即具有Markov的“无后效性”特征。考虑到认知衰弱的发生发展过程具有时间连续性和状态可数性的特点,本研究采用时间连续、状态离散的多状态Markov模型进行分析。将健康状态分为健壮-认知正常、认知障碍、躯体衰弱和认知衰弱4种,由于健壮-认知正常至认知衰弱之间的转移需先经过一个中间状态(即认知障碍、躯体衰弱),认知障碍、躯体衰弱之间的转移需先逆转至健壮-认知正常,而转移强度表示瞬时的转换,因此本研究假定反对角线的转移强度为0,对角线的转移强度等于该行其余转移强度之和的相反数,具体方法参照文献[13]。
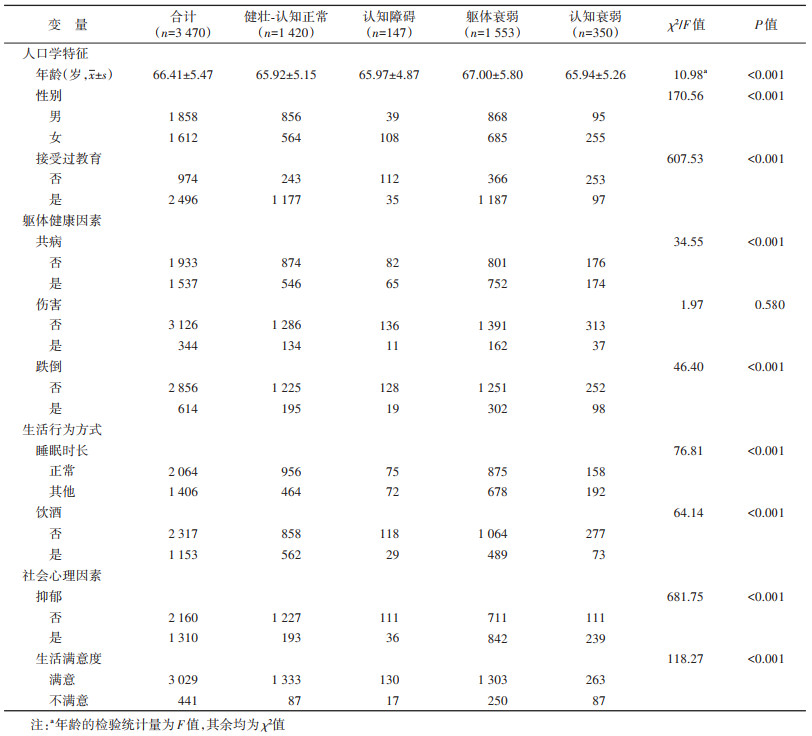
4. 影响因素分析:基于既往研究[8, 14-15],本研究纳入人口学特征、躯体健康、社会心理、生活行为方式等方面影响因素,其中人口学特征包括年龄、性别、教育(是否接受过教育);躯体健康包括共病(CHARLS的13种慢性病中的两种及以上)、跌倒(过去两年是否发生跌倒)、伤害(是否经历过交通事故或重大意外伤害并接受治疗);社会心理因素包括抑郁(CESD-10得分≥10分为抑郁)、生活满意度;生活行为方式包括饮酒(过去一年是否饮酒)、睡眠时长(睡眠时长>5 h/d且 < 9 h/d为正常,≤5 h/d或≥9 h/d为其他)。
5. 统计学分析:计数资料采用频数进行描述,组间比较采用χ2检验;计量资料采用x±s进行描述,组间比较采用方差分析。采用多状态Markov模型估计不同状态间的转移强度和转移概率矩阵,Pearson型拟合优度检验用于评价所构建的模型。以上统计分析在SPSS 23.0软件以及R 4.0.2的“msm”软件包中实现。
结果1基本情况:共纳入3 470名老年人,平均年龄66.41岁。其中男性1 858人(53.54%),文盲974人(28.07%),共病1 537人(44.29%),发生过意外伤害344人(9.91%),发生跌倒614人(17.69%),睡眠时长正常2 064人(59.48%),饮酒1 153人(33.23%),抑郁1 310人(37.75%),对生活不满意441人(12.71%)。4种健康状态中,认知障碍147人(4.24%),躯体衰弱1 553人(44.76%),认知衰弱350人(10.09%)。见表 1。
2. 认知衰弱转移情况:
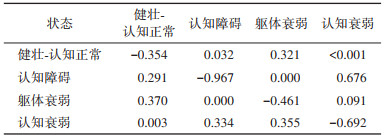
(1)各状态间转移强度:健壮-认知正常人群在极短时间内最有可能转移至躯体衰弱;认知障碍进展为认知衰弱的强度是逆转至健壮-认知正常状态的2.30倍(0.672/0.292);躯体衰弱逆转为健壮-认知正常的强度是进展为认知衰弱的4.08倍(0.371/0.091);认知障碍进展为认知衰弱的强度是躯体衰弱的7.38倍(0.672/0.091)。见表 2。
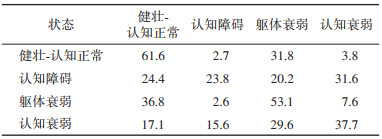
(2)各状态间转移概率:两年后,躯体衰弱者保持原有状态或逆转至健壮-认知正常的概率为89.9%(53.1%+36.8%),认知障碍人群保持原有状态或逆转至健壮-认知正常的概率为48.2%(23.8%+24.4%)。认知障碍人群发生认知衰弱的概率是躯体衰弱者发生认知衰弱的4.16倍(31.6%/7.6%)。认知衰弱转移至躯体衰弱(即认知障碍状态的改善)的概率是转移至认知障碍(即躯体衰弱状态的改善)的1.90倍(29.7%/15.6%);健壮-认知正常人群发生躯体衰弱的概率是发生认知障碍的11.36倍(31.8%/2.8%)。见表 3。
(3)模型拟合结果评价:
① 图示法:通过绘图获得每个状态在观测时间点的实际频数和理论频数百分比曲线,观察两条曲线的重合程度,重合程度越高则表示模型拟合越好。结果显示,两条曲线吻合程度较高,拟合效果较好(图略)。
② 检验法:采用Pearson型拟合优度检验,该检验原理与经典Pearson χ2检验相似,通过将样本的频数分布拟合某种理论分布后,比较实际观察频数与理论频数的吻合程度。计算得出拟合优度检验结果,检验统计量为81.7,P=0.846,说明拟合效果较好。
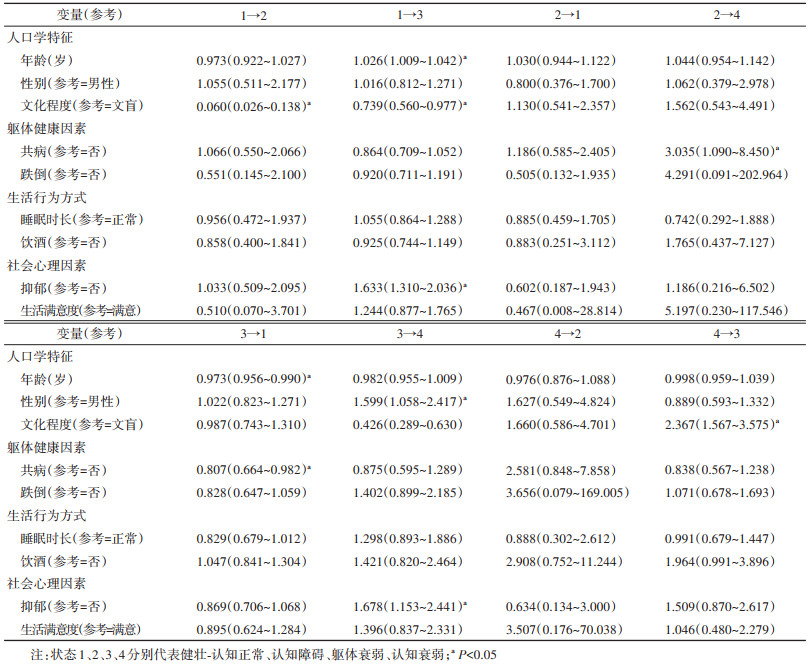
3. Markov模型影响因素分析:将单因素分析中P < 0.05的变量纳入多因素分析。对于健壮-认知正常状态人群,非文盲者更不易发生认知障碍和躯体衰弱(HR=0.060,95%CI:0.026~0.138;HR=0.739,95%CI:0.560~0.977),年龄较大(HR=1.026,95%CI:1.009~1.042)、抑郁者(HR=1.633,95%CI:1.310~2.036)易发生躯体衰弱;对于认知障碍状态人群,存在共病者更易进展为认知衰弱(HR=3.035,95%CI:1.090~8.450);对于躯体衰弱状态人群,年龄较大(HR=0.973,95%CI:0.956~0.990)、共病者(HR=0.807,95%CI:0.664~0.982)更不易逆转为健壮-认知正常状态,女性(HR=1.599,95%CI:1.058~2.417)、抑郁者(HR=1.678,95%CI:1.153~2.441)则更易进展为认知衰弱;对于认知衰弱状态人群,非文盲者(HR=2.367,95%CI:1.567~3.575)较有可能改善认知功能,从而转移至躯体衰弱状态。见表 4。
4. 敏感性分析:通过构建允许健壮-认知正常和认知衰弱之间相互转换的模型进行敏感性分析,检验结果稳定性。采用似然比检验比较两个模型的差异,结果显示检验统计量G=1.437,df=2,P>0.05,提示两个模型差异无统计学意义。模型转移强度及两年转移概率见表 5,6。对比表 2、3可以看到,两个模型在转移强度和两年转移概率上差异很小,结果稳定性较好。
本研究结果显示,认知衰弱基线患病率为10.09%,认知障碍者发生认知衰弱的概率高于躯体衰弱人群,认知衰弱转移至躯体衰弱的概率高于其转移至认知障碍。性别、抑郁、共病是认知衰弱发生的危险因素,接受过教育者更易发生认知衰弱转移至躯体衰弱。
相较于躯体衰弱者,认知障碍者转移至认知衰弱的概率更高。认知障碍与躯体衰弱存在双向关系,但两者间相互影响的程度可能不同。在一项通过治疗痴呆症患者并观察躯体功能与认知障碍如何变化的临床研究中,认知障碍导致躯体衰弱得到证实[16];而躯体衰弱引起认知障碍仅在一些观察研究中被指出[3]。本研究结果显示,认知衰弱转移至躯体衰弱的概率要高于其转移至认知障碍,这可能由于两种状态逆转率的不同。基于Meta分析结果显示,轻度认知障碍逆转率 > 20%[17],而躯体衰弱改善率仅为13.7%[18],逆转率的差异可能是导致认知衰弱逆转至躯体衰弱概率较高的原因之一。
对于认知障碍人群,存在共病使其转移至认知衰弱的风险增加2.035倍。已有研究显示,共病与躯体衰弱互为因果、相互影响,共病会导致躯体衰弱的发生,最终发展为认知衰弱[19]。对于躯体衰弱状态人群,女性发生认知衰弱的风险是男性的1.599倍,这与Liu等[20]的研究结果一致。Rivan等[14]的研究显示,抑郁是认知衰弱的独立影响因素,本研究结果也显示,躯体衰弱合并抑郁发生认知衰弱的风险是无抑郁者的1.678倍。抑郁合并躯体衰弱会导致老年人产生不良健康结局[21],如生活质量降低、认知障碍等风险增加,进而发展为认知衰弱。对于认知衰弱人群,非文盲者认知功能改善的可能性增加1.367倍。接受教育可增加大脑的认知储备[22],从而在一定程度上延缓认知能力下降,促进认知衰弱的改善。
本研究存在局限性。首先,通过研究对象自我报告收集共病及阿尔茨海默病等的患病情况,无法核实确认疾病史,可能对结果带来一定偏差。但是在流行病学研究中,疾病诊断的自我报告已被广泛使用且被证明具有有效性[23]。其次,本研究未考虑关键变量缺失、失访、死亡等人群,而这些人群在基本特征上可能不同于分析样本,一定程度上影响了结果的外推性。后续可考虑选择更具代表性的样本或将失访、死亡等人群纳入研究以增强外推性。最后,本研究未考虑多状态Markov模型转移概率随时间变化而变化的情况。随着个体年龄的增加,状态转移概率可能发生变化。后续可通过应用时间转换Markov模型进一步优化研究。
利益冲突 所有作者声明无利益冲突
作者贡献声明 徐传海:数据整理分析、论文撰写;袁满琼:研究指导、论文修改;方亚:研究指导、论文修改、经费支持
| [1] |
Fried LP, Tangen CM, Walston J, et al. Frailty in older adults: evidence for a phenotype[J]. J Gerontol A Biol Sci Med Sci, 2001, 56(3): M146-157. DOI:10.1093/gerona/56.3.m146 |
| [2] |
Kojima G, Iliffe S, Jivraj S, et al. Association between frailty and quality of life among community-dwelling older people: a systematic review and meta-analysis[J]. J Epidemiol Commun Health, 2016, 70(7): 716-721. DOI:10.1136/jech-2015-206717 |
| [3] |
Feng L, Zin Nyunt MS, Gao Q, et al. Physical frailty, cognitive impairment, and the risk of neurocognitive disorder in the Singapore longitudinal ageing studies[J]. J Gerontol A Biol Sci Med Sci, 2017, 72(3): 369-375. DOI:10.1093/gerona/glw050 |
| [4] |
Robertson DA, Savva GM, Kenny RA. Frailty and cognitive impairment-a review of the evidence and causal mechanisms[J]. Age Res Rev, 2013, 12(4): 840-851. DOI:10.1016/j.arr.2013.06.004 |
| [5] |
Kelaiditi E, Cesari M, Canevelli M, et al. Cognitive Frailty: rational and definition from an (I.A.N.A./I.A.G.G.) international consensus group[J]. J Nutr Health Aging, 2013, 17(9): 726-734. DOI:10.1007/s12603-013-0367-2 |
| [6] |
Feng L, Zin Nyunt MS, Gao Q, et al. Cognitive frailty and adverse health outcomes: findings from the SINGAPORE Longitudinal Ageing Studies (SLAS)[J]. J Am Med Dir Assoc, 2017, 18(3): 252-258. DOI:10.1016/j.jamda.2016.09.015 |
| [7] |
Chen C, Park J, Wu CK, et al. Cognitive frailty in relation to adverse health outcomes independent of multimorbidity: results from the China health and retirement longitudinal study[J]. Aging, 2020, 12(22): 23129-23145. DOI:10.18632/aging.104078 |
| [8] |
Xie BQ, Ma CJ, Chen Y, et al. Prevalence and risk factors of the co-occurrence of physical frailty and cognitive impairment in Chinese community-dwelling older adults[J]. Health Soc Care Commu, 2021, 29(1): 294-303. DOI:10.1111/hsc.13092 |
| [9] |
Zhao Y, Hu Y, Smith JP, et al. Cohort profile: the China Health and Retirement Longitudinal Study (CHARLS)[J]. Int J Epidemiol, 2014, 43(1): 61-68. DOI:10.1093/ije/dys203 |
| [10] |
Jak AJ, Bondi MW, Delano-Wood L, et al. Quantification of five neuropsychological approaches to defining mild cognitive impairment[J]. Am J Geriatr Psychiatry, 2009, 17(5): 368-375. DOI:10.1097/JGP.0b013e31819431d5 |
| [11] |
Wu CK, Smit E, Xue QL, et al. Prevalence and correlates of frailty among community-dwelling Chinese older adults: the China health and retirement longitudinal study[J]. J Gerontol A Biol Sci Med Sci, 2017, 73(1): 102-108. DOI:10.1093/gerona/glx098 |
| [12] |
Malek RNF, Shahar S, Rajab NF, et al. Cognitive frailty among Malaysian older adults: baseline findings from the LRGS TUA cohort study[J]. Clin Interv Aging, 2019, 14: 1343-1352. DOI:10.2147/cia.S211027 |
| [13] |
Jackson C. Multi-State Models for Panel Data: The msm Package for R[J]. J Stat Soft, 2011, 38(8): 1-28. DOI:10.18637/jss.v038.i08 |
| [14] |
Rivan NFM, Shahar S, Rajab NF, et al. Incidence and predictors of cognitive frailty among older adults: a community-based longitudinal study[J]. Int J Environ Res Public Health, 2020, 17(5): 1547. DOI:10.3390/ijerph17051547 |
| [15] |
潘利妞, 张伟宏, 余珍, 等. 郑州市社区老年人认知衰弱患病现状及影响因素[J]. 护理学杂志, 2019, 34(11): 79-82. Pan LN, Zhang WH, Yu Z, et al. The current status and influencing factors of cognitive frailty among elderly community residents in Zhengzhou city, China[J]. J Nurs Sci, 2019, 34(11): 79-82. DOI:10.3870/j.issn.1001-4152.2019.11.079 |
| [16] |
Halil M, Kizilarslanoglu MC, Kuyumcu ME, et al. Cognitive aspects of frailty: Mechanisms behind the link between frailty and cognitive impairment[J]. J Nutr Health Aging, 2015, 19(3): 276-283. DOI:10.1007/s12603-014-0535-z |
| [17] |
Malek-Ahmadi M. Reversion from mild cognitive impairment to normal cognition: a meta-analysis[J]. Alzheimer Dis Associat Disord, 2016, 30(4): 324-330. DOI:10.1097/wad.0000000000000145 |
| [18] |
Kojima G, Taniguchi Y, Iliffe S, et al. Transitions between frailty states among community-dwelling older people: A systematic review and meta-analysis[J]. Ageing Res Rev, 2019, 50: 81-88. DOI:10.1016/j.arr.2019.01.010 |
| [19] |
Parekh AK, Barton MB. The challenge of multiple comorbidity for the US health care system[J]. JAMA, 2010, 303(13): 1303-1304. DOI:10.1001/jama.2010.381 |
| [20] |
Liu LK, Chen CH, Lee WJ, et al. Cognitive frailty and its association with all-cause mortality among community-dwelling older adults in Taiwan: results from I-Lan longitudinal aging study[J]. Rejuvenation Res, 2018, 21(6): 510-517. DOI:10.1089/rej.2017.2038 |
| [21] |
Soysal P, Veronese N, Thompson T, et al. Relationship between depression and frailty in older adults: A systematic review and meta-analysis[J]. Ageing Res Rev, 2017, 36: 78-87. DOI:10.1016/j.arr.2017.03.005 |
| [22] |
Stern Y. What is cognitive reserve? Theory and research application of the reserve concept[J]. J Int Neuropsychol Soc, 2002, 8(3): 448-460. DOI:10.1017/S1355617702813248 |
| [23] |
Simpson CF, Boyd CM, Carlson MC, et al. Agreement between self-report of disease diagnoses and medical record validation in disabled older women: factors that modify agreement[J]. J Am Geriatr Soc, 2004, 52(1): 123-127. DOI:10.1111/j.1532-5415.2004.52021.x |
 2022, Vol. 43
2022, Vol. 43