文章信息
- 常越, 姚添, 石璟, 武媛婷, 杨峰, 原琛利, 聂晓勇, 王富珍, 冯永亮, 王素萍.
- Chang Yue, Yao Tian, Shi Jing, Wu Yuanting, Yang Feng, Yuan Chenli, Nie Xiaoyong, Wang Fuzhen, Feng Yongliang, Wang Suping
- HIV感染者不同免疫程序乙型肝炎疫苗无/弱应答情况及其影响因素分析
- Non/hypo-response to hepatitis B vaccination and influencing factors in HIV-infected patients in the context of different immunization schedules
- 中华流行病学杂志, 2022, 43(5): 696-701
- Chinese Journal of Epidemiology, 2022, 43(5): 696-701
- http://dx.doi.org/10.3760/cma.j.cn112338-20211214-00982
-
文章历史
收稿日期: 2021-12-14
2. 运城市第二医院感染性疾病科,运城 044000;
3. 山西省疾病预防控制中心性病艾滋病防控科,太原 030012;
4. 中国疾病预防控制中心免疫规划中心,北京 100050
2. Department of Infectious Diseases, The Second Hospital of Yuncheng, Yuncheng 044000, China;
3. Department of STD/AIDS Prevention and Control, Shanxi Provincial Center for Disease Control and Prevention, Taiyuan 030012, China;
4. Department of National Immunization Program, Chinese Center for Disease Control and Prevention, Beijing 100050, China
HBV感染是全球重大公共卫生问题。据估计,目前全球约有2.96亿HBV慢性感染者[1],我国是HBV感染的中流行区,2016年一项模型研究显示HBsAg流行率仍高达6.1%[2]。HIV感染者因其进行性免疫功能低下以及HIV和HBV存在共同的传播途径,其HBV感染风险高,HIV感染者中有5%~15%合并感染HBV[3],且合并感染后,HIV感染者发生肝硬化、肝癌和死亡的风险明显增加[4-5],严重危害机体健康。目前全球约有3 770万HIV感染者[6],且呈现由高危人群向一般人群扩散趋势,该人群已成为HBV感染的高危人群,是2030年全球及我国消除病毒性肝炎的关键所在。接种乙型肝炎(乙肝)疫苗是预防HBV感染最经济有效的方法[7]。然而,HIV感染者接种乙肝疫苗后,易于发生无/弱应答(25.30%~74.00%)[8-11],且弱应答者短期内易出现抗体浓度下降[11-12],难以有效预防该人群免于HBV感染,为我国乙肝防控带来挑战。亟待探讨HIV感染者乙肝疫苗无/弱应答影响因素及因素间的交互作用,但目前国内外尚缺乏相关研究。为此,本研究在前期随机对照研究基础上,通过分析HIV感染者乙肝疫苗无/弱应答情况及影响因素间的交互作用,为制定特殊人群乙肝防制策略措施提供参考依据。
对象与方法1. 研究对象:来自2020年5月至2021年1月运城市第二医院参加随机对照试验的HIV感染者,年龄为18~70岁、HBsAg、抗-HBs和抗-HBc均为阴性,均签署知情同意书。本研究已通过山西医科大学伦理委员会批准(审批文号:2019006)。
2. 乙肝疫苗免疫方案:研究对象分别接受0-1-6月和0-1-2-6月20 μg和0-1-2-6月60 μg全程接种并完成接种后1个月随访。乙肝疫苗为深圳康泰生物制品股份有限公司生产的重组酵母乙肝疫苗(批号:B201809043和A201805008)。
3. 资料收集:通过面对面问卷调查及病历查阅进行资料收集。问卷调查内容包括年龄、性别、民族、婚姻状况、职业状况、文化程度、收入和BMI等一般人口学特征,查阅相关医疗记录收集疾病史、HIV感染年限、CD4+T淋巴细胞(CD4)计数、乙肝疫苗接种史、抗病毒治疗情况等。
4. 标本采集和实验室检测:于乙肝疫苗全程接种后1个月时,采集研究对象非抗凝静脉血5 ml,采用化学发光微粒子免疫分析法(CMIA)(ARCHITECT-i2000免疫发光检测仪,美国雅培公司)检测抗-HBs。
5. 相关定义:①无应答:抗-HBs浓度 < 10 mIU/ml;②弱应答:10 mIU/ml≤抗-HBs浓度 < 100 mIU/ml;③强应答:抗-HBs浓度≥100 mIU/ml[13]。
6. 质量控制:进行预调查以完善问卷设计;现场调查员进行严格岗前培训,加强现场督导和问卷抽样复核等措施提高问卷质量;加强宣传教育,提高研究对象依从性。在同一实验室由固定的检测人员严格按照试剂盒说明书完成检测。
7. 统计学分析:问卷采用EpiData 3.1软件进行双录入,采用SAS 9.3软件进行数据整理和统计学分析,计量资料采用x±s描述,计数资料以百分率表示。采用t检验、χ2检验等进行组间比较,采用非条件logistic回归分析进行多因素分析及相乘交互作用,采用Andersson等[14]编制的交互作用计算表分析相加交互作用,计算相对超额危险度(RERI)、交互作用归因比(AP)、交互作用指数(S)及其95%CI。以P < 0.05为差异有统计学意义。
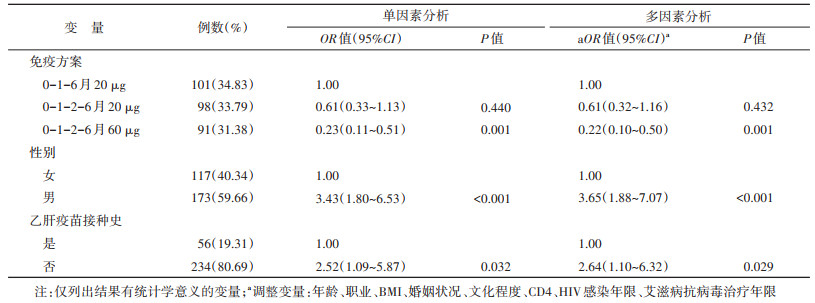
结果1. 人口学特征:完成乙肝疫苗全程接种后1个月随访者290人,随访率为87.35%(290/332)。其中,男性173人,女性117人,性别比为1.48∶1;年龄(43.58±10.43)岁;BMI为18.5~23.9 kg/m2者占65.52%(190/290);已婚占70.69%(205/290);初中文化程度占48.97%(142/290);有职业者占94.14%(273/290);CD4≥350个/μl者占75.17%(218/290);19.31%(56/290)有乙肝疫苗接种史。见表 1。
2. HIV感染者乙肝疫苗无/弱应答发生情况:乙肝疫苗全程接种后1个月时,0-1-6月和0-1-2-6月20 μg、0-1-2-6月60 μg组乙肝疫苗无/弱应答率分别为34.65%(35/101)、24.49%(24/98)和10.99%(10/91);0-1-2-6月60 μg组乙肝疫苗无/弱应答率明显低于0-1-6月和0-1-2-6月20 μg组(P < 0.05),0-1-2-6月20 μg组低于0-1-6月20 μg组(P>0.05);男性无/弱应答率为31.79%(55/173),明显高于女性(11.97%,14/117)(P < 0.05);有乙肝疫苗接种史者无/弱应答率为12.50%(7/56),明显低于无接种史者(26.50%,62/234)(P < 0.05);年龄、BMI、婚姻状况、民族、文化程度、职业状况、CD4、HIV感染年限和艾滋病抗病毒治疗年限等特征间无/弱应答率差异均无统计学意义(P>0.05)。见表 1。
3. HIV感染者乙肝疫苗无/弱应答影响因素分析:全程接种后1个月,以HIV感染者是否发生乙肝疫苗无/弱应答(无/弱应答=1,强应答=0)作为因变量,建立非条件logistic回归模型,结果显示,控制混杂因素(年龄、职业、BMI、婚姻状况、文化程度、CD4、HIV感染年限、艾滋病抗病毒治疗年限)后,按照0-1-2-6月20 μg方案接种乙肝疫苗者发生无/弱应答的风险是0-1-6月20 μg者的0.61倍(95%CI:0.32~1.16),按照0-1-2-6月60 μg方案接种乙肝疫苗者发生无/弱应答的风险是0-1-6月20 μg者的0.22倍(95%CI:0.10~0.50),即与常规方案组(0-1-6月20 μg)的HIV感染者相比,多针次高剂量组(0-1-2-6月60 μg)在疫苗接种后1个月乙肝疫苗无/弱应答的概率低;男性较女性发生无/弱应答的风险高(OR=3.65,95%CI:1.88~7.07);无乙肝疫苗接种史者发生无/弱应答的风险是有接种史者的2.64倍(95%CI:1.10~6.32)。见表 2。
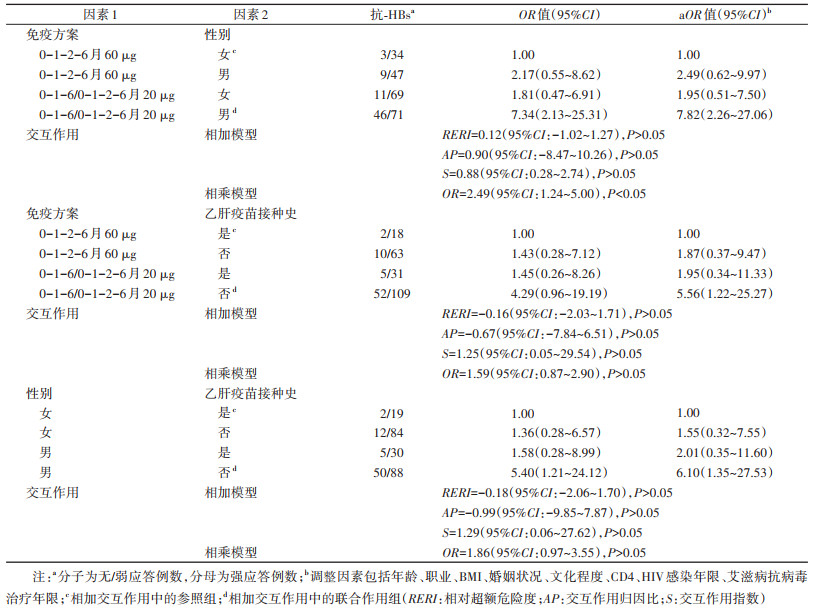
4. HIV感染者乙肝疫苗无/弱应答影响因素交互作用分析:免疫方案与性别存在相乘交互作用(OR=2.49,95%CI:1.24~5.00)(P < 0.05),接种20 μg乙肝疫苗且为男性其无/弱应答率明显增加;免疫方案与乙肝疫苗接种史、性别与乙肝疫苗接种史之间未发现相加和相乘交互作用(P>0.05)。见表 3。
乙肝疫苗是预防HBV感染最有效措施,HIV感染者由于进行性免疫缺陷易发生无/弱应答,不能有效保护其免于感染。本研究中HIV感染者接种乙肝疫苗后无/弱应答率为10.99%~34.65%,与现有其他研究(25.30%~74.00%)相比[8-11],处于较低水平,可能本研究与这些研究乙肝疫苗接种方案不同、HIV感染者自身免疫功能差异等有关,无/弱应答的发生受到了多种因素的影响,但目前尚不明确。建议进一步研究相关的影响因素及交互作用,制定针对性干预措施,为实现WHO提出2030年消除病毒性肝炎的目标奠定基础。
接种乙肝疫苗后无/弱应答的发生是一个受到多种因素影响的综合过程,本研究结果显示,男性和无乙肝疫苗接种史是HIV感染者乙肝疫苗无/弱应答的危险因素,按照多针次高剂量免疫方案接种乙肝疫苗是其保护因素。HIV感染者中男性发生无/弱应答的风险是女性的3.65倍,提示男性发生无/弱应答的风险高于女性,与Launay等[8]和Landrum等[15]结果一致。这可能由于两性的性激素分泌不同,也可能是由于两性的性行为生活方式不同导致男性的社交环境更广并且吸烟、酗酒更为常见[16],因此其应答反应比女性差。同时,本次研究发现按照0-1-2-6月60 μg免疫方案接种乙肝疫苗者发生无/弱应答的风险是0-1-6月20 μg者的0.22倍,提示接种多针次高剂量乙肝疫苗者接种后1个月乙肝疫苗无/弱应答风险较低。这可能是由于提高疫苗接种剂量可在局部形成足够的免疫原刺激T和B淋巴细胞的激活和增殖以及细胞因子的产生[17-18],增加疫苗接种针次可能促进了B细胞的增殖、分泌及抗体的产生,从而提高疫苗的免疫应答水平。因此,结合我国指南推荐[7],对于HIV感染者可以考虑增加乙肝疫苗接种剂量和针次,以减少无/弱应答的发生,但仍需要更深入的研究加以论证。此外,本研究还发现既往接种过乙肝疫苗是HIV感染者发生无/弱应答的保护因素,接种乙肝疫苗是预防HBV感染最有效的措施,无乙肝疫苗接种史者发生无/弱应答的风险是接种者的2.64倍,提示乙肝疫苗接种史可能对HIV感染者产生了一定的保护作用,可能的原因是既往接种过乙肝疫苗可能会产生疫苗免疫记忆,在接种疫苗后,抗原进入机体,在抗原提呈细胞的辅助下,初始T细胞活化、增殖并分化形成效应T细胞,大部分效应T细胞在收缩期凋亡,大约5%~10%的细胞作为记忆细胞长期存活,并在再次发生相同的抗原暴露时,迅速活化增殖并产生细胞因子参与免疫应答[19-21],康爽[22]的研究也表明,成功产生体液免疫应答的患者相较于接种疫苗前,记忆T细胞亚群的比例显著增加,提示HBV特异性免疫记忆的产生。本研究中HIV感染者既往乙肝疫苗接种率仅为19.31%,尤其是≥40岁人群(7.73%),建议对≥40岁HIV感染者应加强乙肝疫苗接种的健康教育和管理,无免疫史者尽早接种,以提高该人群接种覆盖率,并关注其免疫效果及持久性,及时加强免疫或全程再免,减少该人群HBV感染的发生和传播。
本研究发现性别与免疫方案之间存在相乘交互作用,男性及接种20 μg乙肝疫苗两因素同时存在时HIV感染者发生乙肝疫苗无/弱应答的风险显著高于两因素单独存在时的乙肝疫苗无/弱应答的发生风险。提示,应重点关注接种20 μg乙肝疫苗的男性HIV感染者,定期检测其HBV血清学标志物,加强HBV感染和免疫状态监测,适时进行乙肝疫苗加强接种,降低HBV感染的风险。
本研究存在不足。一是此次研究仅报道了乙肝疫苗接种后1个月时无/弱应答情况及影响因素,本研究将会继续对该人群的免疫持久性及影响因素进行随访研究;二是本研究失访率为12.65%,可能存在失访偏倚;三是本研究无/弱应答人数相对较少,样本量不足,特别是在分析交互作用时可能受一定的影响。
综上所述,HIV感染者0-1-2-6月60 μg接种者的乙肝疫苗无/弱应答率明显低于0-1-6月和0-1-2-6月20 μg接种者;性别、接种方案及乙肝疫苗接种史是无/弱应答的影响因素;免疫方案与性别之间存在相乘交互作用,男性接种20 μg乙肝疫苗的无/弱应答风险更高。应对HIV感染者加强乙肝疫苗接种并着力优化免疫方案,减少无/弱应答的发生,为实现2030年消除病毒性肝炎目标做出贡献。
利益冲突 所有作者声明无利益冲突
作者贡献声明 常越:论文撰写、数据整理、数据分析、论文修改;姚添、石璟、武媛婷:数据整理;杨峰:现场调查实施;原琛利、聂晓勇、王富珍:研究指导;冯永亮、王素萍:研究设计、论文修改、研究指导、经费支持
| [1] |
World Health Organization. Hepatitis B[EB/OL]. (2021-07-27)[2021-12-01]. https://www.who.int/news-room/fact-sheets/detail/hepatitis-b.
|
| [2] |
Polaris Observatory Collaborators. Global prevalence, treatment, and prevention of hepatitis B virus infection in 2016:a modelling study[J]. Lancet Gastroenterol Hepatol, 2018, 3(6): 383-403. DOI:10.1016/S2468-1253(18)30056-6 |
| [3] |
Inoue T, Tanaka Y. Hepatitis B virus and its sexually transmitted infection -an update[J]. Microb Cell, 2016, 3(9): 420-436. DOI:10.15698/mic2016.09.527 |
| [4] |
Kourtis AP, Bulterys M, Hu DJ, et al. HIV-HBV coinfection-a global challenge[J]. N Engl J Med, 2012, 366(19): 1749-1752. DOI:10.1056/NEJMp1201796 |
| [5] |
Thio CL, Seaberg EC, Skolasky R, et al. HIV-1, hepatitis B virus, and risk of liver-related mortality in the Multicenter Cohort Study (MACS)[J]. Lancet, 2002, 360(9349): 1921-1926. DOI:10.1016/s0140-6736(02)11913-1 |
| [6] |
AIDSinfo, UNAIDS. Fact sheet-Latest global and regional statistics on the status of the AIDS epidemic[EB/OL]. (2021-11-29)[2021-12-01]. https://www.unaids.org/en/resources/documents/2021/UNAIDS_FactSheet.
|
| [7] |
中华医学会感染病学分会, 中华医学会肝病学分会. 慢性乙型肝炎防治指南(2019年版)[J]. 中华肝脏病杂志, 2019, 27(12): 938-961. Chinese Society of Infectious Diseases, Chinese Medical Association, Chinese Society of Hepatology, Chinese Medical Association. The guidelines of prevention and treatment for chronic hepatitis B (2019 version)[J]. Chin J Hepatol, 2019, 27(12): 938-961. DOI:10.3760/cma.j.issn.1007-3418.2019.12.007 |
| [8] |
Launay O, van der Vliet D, Rosenberg AR, et al. Safety and immunogenicity of 4 intramuscular double doses and 4 intradermal low doses vs standard hepatitis B vaccine regimen in adults with HIV-1:a randomized controlled trial[J]. JAMA, 2011, 305(14): 1432-1440. DOI:10.1001/jama.2011.351 |
| [9] |
Rey D, Piroth L, Wendling MJ, et al. Safety and immunogenicity of double-dose versus standard-dose hepatitis B revaccination in non-responding adults with HIV-1 (ANRS HB04 B-BOOST): a multicentre, open-label, randomised controlled trial[J]. Lancet Infect Dis, 2015, 15(11): 1283-1291. DOI:10.1016/S1473-3099(15)00220-0 |
| [10] |
Chaiwarith R, Praparattanapan J, Kotarathititum W, et al. Higher rate of long-term serologic response of four double doses vs. standard doses of hepatitis B vaccination in HIV-infected adults: 4-year follow-up of a randomised controlled trial[J]. AIDS Res Ther, 2019, 16(1): 33. DOI:10.1186/s12981-019-0249-8 |
| [11] |
Feng YL, Yao T, Chang Y, et al. Immunogenicity and persistence of high-dose recombinant hepatitis B vaccine in adults infected with human immunodeficiency virus in China: A randomized, double-blind, parallel controlled trial[J]. Vaccine, 2021, 39(27): 3582-3589. DOI:10.1016/j.vaccine.2021.05.044 |
| [12] |
Launay O, Rosenberg AR, Rey D, et al. Long-term immune response to hepatitis B virus vaccination regimens in adults with human immunodeficiency virus 1:Secondary analysis of a randomized clinical trial[J]. JAMA Intern Med, 2016, 176(5): 603-610. DOI:10.1001/jamainternmed.2016.0741 |
| [13] |
杨志清, 郝海昀, 史晓红, 等. HBsAg阳性母亲HBV感染状况与婴儿乙肝疫苗无/弱应答的关系[J]. 中华流行病学杂志, 2018, 39(6): 805-809. Yang ZQ, Hao HY, Shi XH, et al. Relationship between the HBsAg-positive infection status of mothers and the non/low-response to hepatitis B vaccine of their infants[J]. Chin J Epidemiol, 2018, 39(6): 805-809. DOI:10.3760/cma.j.issn.0254-6450.2018.06.021 |
| [14] |
Andersson T, Alfredsson L, Källberg H, et al. Calculating measures of biological interaction[J]. Eur J Epidemiol, 2005, 20(7): 575-579. DOI:10.1007/s10654-005-7835-x |
| [15] |
Landrum ML, Hullsiek KH, Ganesan A, et al. Hepatitis B vaccine responses in a large U.S. military cohort of HIV-infected individuals: another benefit of HAART in those with preserved CD4 count[J]. Vaccine, 2009, 27(34): 4731-4738. DOI:10.1016/j.vaccine.2009.04.016 |
| [16] |
李娟, 魏明伟, 朱凤才. 乙型肝炎疫苗免疫无/低应答影响因素的研究进展[J]. 中华流行病学杂志, 2021, 42(11): 2066-2070. Li J, Wei MW, Zhu FC. Progress in research of influential factors for non-or low-immune response to hepatitis B vaccination[J]. Chin J Epidemiol, 2021, 42(11): 2066-2070. DOI:10.3760/cma.j.cn112338-20200910-01145 |
| [17] |
Feng YL, Wang JM, Shao ZH, et al. Predicting related factors of immunological response to hepatitis B vaccine in hemodialysis patients based on integration of decision tree classification and logistic regression[J]. Hum Vaccin Immunother, 2021, 17(9): 3214-3220. DOI:10.1080/21645515.2021.1895603 |
| [18] |
Sabry R, Mohamed ZAZ, Abdallah AM. Relationship between Th1 and Th2 cytokine serum levels and immune response to Hepatitis B vaccination among Egyptian health care workers[J]. J Immunoassay Immunochem, 2018, 39(5): 496-508. DOI:10.1080/15321819.2018.1509871 |
| [19] |
Omilusik KD, Goldrath AW. The origins of memory T cells[J]. Nature, 2017, 552(7685): 337-339. DOI:10.1038/d41586-017-08280-8 |
| [20] |
Dimeloe S, Burgener AV, Grählert J, et al. T-cell metabolism governing activation, proliferation and differentiation; a modular view[J]. Immunology, 2017, 150(1): 35-44. DOI:10.1111/imm.12655 |
| [21] |
余思菲, 吴长有. 组织定居记忆性T细胞的免疫学特征研究进展[J]. 中国免疫学杂志, 2017, 33(7): 1093-1100. Yu SF, Wu CY. Research progress of immunological characteristics of tissue-resident memory T cells[J]. Chin J Immunol, 2017, 33(7): 1093-1100. DOI:10.3969/j.issn.1000-484X.2017.07.030 |
| [22] |
康爽. HBV疫苗在HIV感染者中的有效性及免疫应答研究[D]. 北京: 北京协和医学院, 2019. DOI: 10.27648/d.cnki.gzxhu.2019.000052. Kang S. HBV vaccine in HIV infected patients: efficacy & corresponding immune response[D]. Beijing: Peking Union Medical College, 2019. DOI: 10.27648/d.cnki.gzxhu.2019.000052. |
 2022, Vol. 43
2022, Vol. 43