文章信息
- 王继宝, 陈凯, 赫晓霞, 龚渝蓉, 杨锦, 段星, 王译葵, 杨跃诚, 叶润华, 蒋岩, 段松, 邢文革.
- Wang Jibao, Chen Kai, He Xiaoxia, Gong Yurong, Yang Jin, Duan Xing, Wang Yikui, Yang Yuecheng, Ye Runhua, Jiang Yan, Duan Song, Xing Wenge
- HIV-1感染者抗病毒治疗后HIV-1DNA载量动力学变化及影响因素分析
- Dynamic changes and influencing factors of HIV-1 DNA load in HIV-1 infected individuals under antiretroviral therapy
- 中华流行病学杂志, 2022, 43(5): 692-695
- Chinese Journal of Epidemiology, 2022, 43(5): 692-695
- http://dx.doi.org/10.3760/cma.j.cn112338-20211129-00922
-
文章历史
收稿日期: 2021-11-29
2. 北京祥瑞生物制品股份有限公司,北京 101407;
3. 北京市理化分析测试中心/北京市食品安全分析测试工程技术研究中心/北京市基因测序与功能分析工程技术研究中心,北京 100089;
4. 中国疾病预防控制中心性病艾滋病预防控制中心参比实验室,北京 102206
2. Beijing Sanroad Biological Products Company Limited, Beijing 101407, China;
3. Beijing Engineering Technology Research Centre of Gene Sequencing and Gene Function Analysis, Beijing Engineering Research Center of Food Safety Analysis, Beijing Center for Physical & Chemical Analysis, Beijing 100089, China;
4. National HIV/AIDS Reference Laboratory, National Center for AIDS/STD Control and Prevention, Chinese Center for Disease Control and Prevention, Beijing 102206, China
艾滋病抗病毒治疗能改善HIV感染者的生存状况。对于抗病毒治疗的效果,目前主要通过病毒学指标、免疫学指标和临床症状3个方面评估,其中,病毒学指标最为重要。对于大多数感染者而言,抗病毒治疗3~6个月之后,体内的病毒载量会降至现有试剂检测不到的水平,从而达到病毒学抑制,采用HIV储存库检测的方法进一步评价HIV感染者体内病毒学指标是艾滋病诊疗工作中的重要课题[1]。HIV储存库一般指整合到人基因组内的HIV-1前病毒,主要存在于淋巴结、血液、脑脊液等组织中[2]。目前,HIV储存库检测通常以总HIV-1 DNA为标志物,最常用的总HIV-1 DNA检测方法为荧光探针PCR法,检测样本为全血[3-9]。目前关于HIV储存库的检测尚无统一标准,临床上并未展开应用。德宏傣族景颇族自治州(德宏州)是我国最早成批出现HIV感染者的地区,积累了大样本量的队列,本研究选取样本量较大、时间跨度较长的新发队列作为研究对象,分析HIV-1感染者抗病毒治疗后HIV-1 DNA载量动力学变化及影响因素,为HIV-1 DNA定量检测在抗病毒治疗效果监测及评估的应用提供参考依据。
对象与方法1. 研究对象:来源于德宏州CDC建立的2009-2018年HIV新发感染队列,HIV-1确证阳性后即入组为HIV新发感染者,每年定期参加随访。剔除标准为抗病毒治疗时间 < 12个月或随访次数 < 3次。
2. 研究方法与内容:
(1)HIV-1 DNA定量检测:用全血DNA提取试剂盒(快而精医药股份有限公司,荷兰)提取样本中DNA,提取的DNA置-20 ℃保存备用。用HIV-1 DNA检测试剂盒(北京金豪制药股份有限公司,北京)对样本进行HIV-1 DNA定量检测(试剂盒的检测下限为20拷贝/106 PBMCs),荧光PCR仪型号为Bio-Rad CFX96(伯乐生命医学产品有限公司,美国)。
(2)相关定义:①HIV-1新发感染:最近1次HIV-1检测结果分别为阴性与阳性(阳转)的时间间隔 < 12个月,判定为HIV-1新发感染;≥12个月判定为既往感染。②基线HIV-1 DNA载量值:阳转后采集的第一份静脉血样本中HIV-1 DNA载量值。③最近1次随访HIV-1 DNA载量值分为2组:(a)病毒库清除效果较好:HIV-1 DNA载量值< 100拷贝/106 PBMCs;(b)病毒库清除效果不佳:HIV-1 DNA载量值≥100拷贝/106 PBMCs。
3. 统计学分析:采用SPSS 17.0软件进行统计学分析。以抗病毒治疗时长为横坐标,HIV-1 DNA载量均值为纵坐标,构建HIV-1 DNA载量值随抗病毒治疗时长动力学变化曲线图。采用单因素和多因素logistic回归模型,分析HIV-1病毒库清除效果的影响因素,单因素分析后进行多因素分析,自变量筛选的纳入标准为0.1。双侧检验,检验水准为α=0.05。
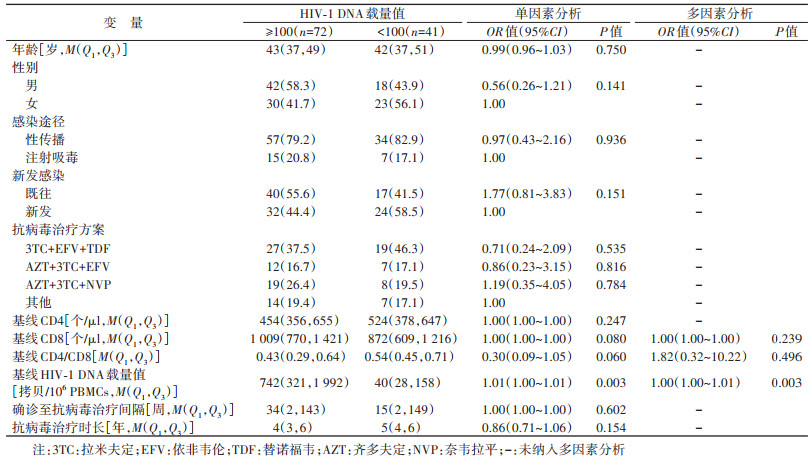
结果1. 研究对象基本情况:招募175例HIV感染者中,入组为研究对象113例,HIV新发感染者占49.6%(56/113),男性占53.1%(60/113),性传播占80.5%(91/113),注射吸毒传播占19.5%(22/113)。抗病毒治疗方案以拉米夫定+依非韦伦+替诺福韦(3TC+EFV+TDF)为主(40.7%,46/113);年龄M(Q1,Q3)为43(37,50)岁;确诊至抗病毒治疗的时间间隔M(Q1,Q3)为29(2,144)周;基线CD4、基线CD8和基线CD4/CD8的M(Q1,Q3)分别为460(356,650)个/μl、958(699,1 414)个/μl和0.49(0.34,0.68)。最近1次随访HIV-1 DNA载量值< 100和≥100拷贝/106 PBMCs的分别有41例(36.3%)和72例(63.7%)。
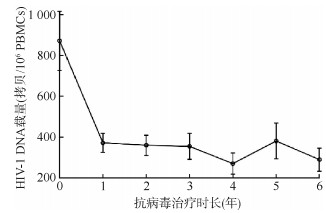
2. HIV-1 DNA载量随治疗时间动力学变化趋势:113例HIV感染者中,均成功提取核酸和HIV-1 DNA定量测定。抗病毒治疗前,HIV-1 DNA载量均值>800拷贝/106 PBMCs;抗病毒治疗1年后,HIV-1 DNA载量值迅速下降至 < 400拷贝/106 PBMCs;此后,随着抗病毒治疗的持续进行,HIV-1 DNA载量值趋于稳定,无明显下降趋势。HIV-1 DNA载量值随治疗时间动力学变化趋势见图 1。抗病毒治疗开始后0~6年HIV-1 DNA载量值(拷贝/106 PBMCs,x±s)分别为854±1 481、364±461、352±472、356±545、252±352、365±596和269±271。
|
| 图 1 HIV-1感染者抗病毒治疗后体内HIV-1 DNA载量动力学变化趋势(误差线为95%CI) |
3. 抗病毒治疗后HIV-1 DNA载量值的影响因素:单因素logistic分析结果显示,HIV-1 DNA载量值的影响因素包括基线CD8(P=0.080)、基线CD4/CD8(P=0.060)和基线HIV-1 DNA载量值(P=0.003),将这3个因素纳入多因素logistic分析结果显示,影响因素为基线HIV-1 DNA载量值。见表 1。
本研究发现,113例HIV-1感染者的HIV-1 DNA载量值在抗病毒治疗后第1年随访下降幅度最大,随后下降到一定水平之后保持稳定不再下降,维持在380拷贝/106 PBMCs,这与Besson等[10]和Koelsch等[11]研究结果相似。抗病毒治疗初期HIV-1 DNA载量值大幅下降的原因是游离HIV-1 DNA较易被清除,抗病毒治疗第1年被清除的多数为该类型HIV-1 DNA[12],但整合的HIV-1 DNA很难被清除,导致抗病毒治疗后期DNA水平降低不明显。据估计,抗病毒治疗1年之后,HIV-1 DNA半衰期为13年[13]。
开始抗病毒治疗后,HIV-1 DNA载量值在不同个体中显示出明显差异。一般认为影响HIV-1 DNA载量的因素有抗病毒治疗前HIV-1 DNA载量值(基线HIV-1 DNA载量)、基线病毒载量、基线CD4计数、基线CD8计数、感染至开始治疗时间间隔等[13-15]。本研究通过对113例HIV感染者治疗后1~6年数据分析结果表明,与HIV-1 DNA载量值相关的因素为基线HIV-1 DNA载量值。表明被HIV感染且形成前病毒的CD4计数是影响HIV储存库规模的关键因素,被感染的CD4越多,则HIV储存库越不易被清除。本研究结果显示,基线CD4计数、感染至开始治疗时间间隔等因素对HIV-1 DNA载量值无显著关系,这与其他研究结论有所区别。考虑到本研究样本有限,且参与分析的因素仅限于感染者的一般人口统计学信息,研究结果具有一定的局限性。
综上所述,HIV-1 DNA载量是治疗效果评估的重要指标。早诊断与早治疗措施有利于降低HIV-1 DNA载量和HIV-1感染者的免疫功能重建。这一结果印证了HIV-1核酸诊断的重要意义,为核酸检测的应用提供了重要的参考依据,也对今后HIV-1诊断和抗病毒治疗工作提出了更高的要求和挑战。
利益冲突 所有作者声明无利益冲突
作者贡献声明 王继宝、陈凯:研究设计、数据收集、数据分析、论文撰写、论文修改;赫晓霞:数据收集;龚渝蓉、杨锦、段星、王译葵、杨跃诚、叶润华:数据收集、数据整理;蒋岩、段松:研究设计;邢文革:论文修改
| [1] |
Hocqueloux L, Avettand-Fènoël V, Jacquot S, et al. Long- term antiretroviral therapy initiated during primary HIV-1 infection is key to achieving both low HIV reservoirs and normal T cell counts[J]. J Antimicrob Chemother, 2013, 68(5): 1169-1178. DOI:10.1093/jac/dks533 |
| [2] |
Blankson JN, Persaud D, Siliciano RF. The challenge of viral reservoirs in HIV-1 infection[J]. Annu Rev Med, 2002, 53: 557-593. DOI:10.1146/annurev.med.53.082901.104024 |
| [3] |
Siliciano JD, Siliciano RF. Enhanced culture assay for detection and quantitation of latently infected, resting CD4+ T-cells carrying replication-competent virus in HIV-1-infected individuals[M]//Zhu TF. Human retrovirus protocols. Totowa: Humana Press, 2005, 304: 3-15. DOI: 10.1385/1-59259-907-9:003.
|
| [4] |
Eriksson S, Graf EH, Dahl V, et al. Comparative analysis of measures of viral reservoirs in HIV-1 eradication studies[J]. PLoS Pathog, 2013, 9(2): e1003174. DOI:10.1371/journal.ppat.1003174 |
| [5] |
Ho YC, Shan L, Hosmane N, et al. Replication-competent noninduced proviruses in the latent reservoir increase barrier to HIV-1 cure[J]. Cell, 2013, 155(3): 540-551. DOI:10.1016/j.cell.2013.09.020 |
| [6] |
Désiré N, Dehée A, Schneider V, et al. Quantification of human immunodeficiency virus type 1 proviral load by a TaqMan real-time PCR assay[J]. J Clin Microbiol, 2001, 39(4): 1303-1310. DOI:10.1128/JCM.39.4.1303-1310.2001 |
| [7] |
韩根鹏, 熊勇, 高雨, 等. TaqMan荧光定量PCR检测HIV-1 DNA方法的建立及初步应用[J]. 中华实验和临床感染病杂志: 电子版, 2017, 11(2): 129-133. Han GP, Xiong Y, Gao Y, et al. TaqMan real-time PCR assay for the quantification of HIV-1 DNA[J]. Chin J Exp Clin Infect Dis: Electr Ed, 2017, 11(2): 129-133. DOI:10.3877/cma.j.issn.1674-1358.2017.02.006 |
| [8] |
Lewin SR, Rouzioux C. HIV cure and eradication: how will we get from the laboratory to effective clinical trials?[J]. Aids, 2011, 25(7): 885-897. DOI:10.1097/QAD.0b013e3283467041 |
| [9] |
Henrich TJ, Gallien S, Li JZ, et al. Low-level detection and quantitation of cellular HIV-1 DNA and 2-LTR circles using droplet digital PCR[J]. J Virol Methods, 2012, 186(1/2): 68-72. DOI:10.1016/j.jviromet.2012.08.019 |
| [10] |
Besson GJ, Lalama CM, Bosch RJ, et al. HIV-1 DNA decay dynamics in blood during more than a decade of suppressive antiretroviral therapy[J]. Clin Infect Dis, 2014, 59(9): 1312-1321. DOI:10.1093/cid/ciu585 |
| [11] |
Koelsch KK, Liu L, Haubrich R, et al. Dynamics of total, linear nonintegrated, and integrated HIV‐1 DNA in vivo and in vitro[J]. J Infect Dis, 2008, 197(3): 411-419. DOI:10.1086/525283 |
| [12] |
Murray JM, Zaunders JJ, Mcbride KL, et al. HIV DNA subspecies persist in both activated and resting memory CD4+ T cells during antiretroviral therapy[J]. J Virol, 2014, 88(6): 3516-3526. DOI:10.1128/JVI.03331-13 |
| [13] |
Gandhi RT, McMahon DK, Bosch RJ, et al. Levels of HIV-1 persistence on antiretroviral therapy are not associated with markers of inflammation or activation[J]. PLoS Pathog, 2017, 13(4): e1006285. DOI:10.1371/journal.ppat.1006285 |
| [14] |
Strain MC, Little SJ, Daar ES, et al. Effect of treatment, during primary infection, on establishment and clearance of cellular reservoirs of HIV-1[J]. J Infect Dis, 2005, 191(9): 1410-1418. DOI:10.1086/428777 |
| [15] |
Avettand-Fènoël V, Hocqueloux L, Ghosn J, et al. Total HIV-1 DNA, a marker of viral reservoir dynamics with clinical implications[J]. Clin Microbiol Rev, 2016, 29(4): 859-880. DOI:10.1128/CMR.00015-16 |
 2022, Vol. 43
2022, Vol. 43