文章信息
- 董帅兵, 王小莉, 赵好, 王宇, 刘白薇, 刘永红, 潘阳, 贾蕾, 王全意, 杨鹏.
- Dong Shuaibing, Wang Xiaoli, Zhao Hao, Wang Yu, Liu Baiwei, Liu Yonghong, Pan Yang, Jia Lei, Wang Quanyi, Yang Peng
- 北京市境外输入性新型冠状病毒感染者的流行特征分析
- Epidemiological characteristics of imported COVID-19 cases in Beijing
- 中华流行病学杂志, 2022, 43(4): 478-482
- Chinese Journal of Epidemiology, 2022, 43(4): 478-482
- http://dx.doi.org/10.3760/cma.j.cn112338-20211213-00975
-
文章历史
收稿日期: 2021-12-13
2. 北京市疾病预防控制中心全球健康中心办公室, 北京 100013
2. Office of Beijing Center for Global Health, Beijing Center for Disease Prevention and Control, Beijing 100013, China
新型冠状病毒(新冠病毒)肺炎(新冠肺炎)大流行给全球健康和经济发展造成严重影响[1]。截至2021年10月18日,北京市累计报告1 128例新冠肺炎确诊病例,其中境外输入291例[2]。接种疫苗被认为是预防新冠病毒感染最有效的方式之一[3]。但是,全球疫苗接种速度总体迟缓,不足以建立免疫屏障,即使接种疫苗也依然存在感染和传播的风险[4-5],具体可能与疫苗保护效果、疫苗保护持久性、变异株影响以及个体差异等因素有关[6-7]。截至2021年10月20日,我国新冠病毒疫苗接种已超过23亿剂次[8],但在接种疫苗对新冠病毒感染和疾病严重程度的真实世界研究报道较少。本研究利用境外输入性新冠病毒感染者数据,分析其流行病学特征,探索疫苗接种对新冠病毒感染者病毒载量和疾病严重程度的影响。
资料与方法1. 数据来源:中国疾病预防控制信息系统传染病报告信息管理系统,按录入日期收集2021年6月1日至9月30日的北京市境外输入性新冠病毒感染者个案。同时通过现场流行病学调查,补充了感染者疫苗接种情况、入境日期及是否有临床症状等信息。
2. 相关定义:新冠病毒感染者分为确诊病例和阳性检测者,疾病严重程度分为无症状、轻型、普通型、重型和危重型,具体分类及判定标准参见文献[9]。境外输入性感染者指在发病前或无症状感染者核酸检测阳性前14 d,旅居境外疫情国家,入境后新冠病毒核酸检测阳性的感染者[9]。输入性感染者来源国家/地区指境外输入性感染者旅居境外疫情的国家/地区,排除中转的国家/地区。本研究所有新冠病毒感染者接种的疫苗免疫程序均为推荐的2针剂次。全程接种:末次暴露于新冠病毒前接种了2针新冠病毒疫苗且第2针接种满14 d[10];未全程接种:末次暴露于新冠病毒前仅接种1针新冠病毒疫苗,或完成第2针接种但不满14 d者;未接种:末次暴露于新冠病毒前未接种过新冠病毒疫苗。
3. 检测方法:新冠病毒核酸检测[9]:采集感染者的咽拭子、鼻拭子或鼻咽拭子标本后,采用磁珠法提取核酸;采用实时荧光RT-PCR法进行核酸检测,针对新冠病毒基因组2个靶标即开放读码框1ab(ORF1ab)基因和N基因,手动调整阈值线读取2个靶标Ct值。基因Ct值:荧光信号达到设定的阈值时所经历的循环数,可间接反应病毒载量的高低。由于Ct值是动态变化过程,研究选择双基因阳性感染者的最小N基因值,以及对应ORFlab基因值进行分析。
4. 统计学分析:应用Excel 2010软件建立数据库,将中国疾病预防控制信息系统传染病报告信息管理系统中的数据和现场流行病学调查的数据进行整合。应用SPSS 22.0软件进行统计学分析。对于计数资料,用构成比或率进行描述。对于呈偏态分布的资料,用M(Q1,Q3)描述其集中和离散趋势。采用χ2检验进行率的比较。疫苗接种对病毒载量和疾病严重程度影响采用Kruskal-Wallis秩和检验进行差异比较,双侧检验,检验水准α=0.05。
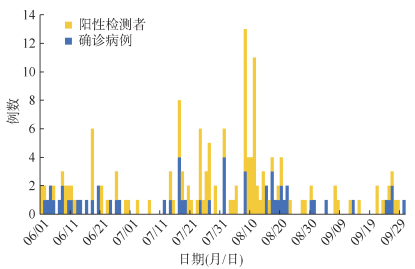
结果1. 时间分布:2021年6月1日至9月30日,北京市累计发现171例境外输入性新冠病毒感染者,其中包括57例确诊病例,114例阳性检测者。41.52%(71/171)的感染者在8月报告,包括确诊病例21例,阳性检测者50例。见图 1。
|
| 图 1 北京市境外输入性新型冠状病毒感染者报告时间分布 |
2. 地区分布:171例境外输入性感染者来源于23个国家/地区,其中输入性感染者超过10例的国家有菲律宾(41例,23.98%)、阿联酋(39例,22.81%)、英国(25例,14.62%)和俄罗斯(11例,6.43%),4个国家累计输入性感染者占67.84%(116/171)。
3. 人群分布:171例境外输入性感染者中,男女比例为2∶1(114∶57)。年龄范围10月龄至64岁,M(Q1,Q3)为28(23,36)岁。感染者主要集中在20~39岁,占69.59%(119/171)。80.12%(137/171)为中国籍。24.56%(42/171)的境外输入性感染者为学生,其次为干部职员、家务及待业人员,均占18.71%(32/171)。不同性别、年龄、职业以及国籍在确诊病例和阳性检测者中分布差异均无统计学意义(P > 0.05)。见表 1。
4. 毒株分布:新冠病毒全基因序列分析需要较高病毒载量,本研究对47例境外输入性感染者样本进行全基因组测序,结果显示:Delta变异株、B.1.318、Alpha变异株和Beta变异株分别占76.60%(36/47)、10.64%(5/47)、6.38%(3/47)和6.38%(3/47)。
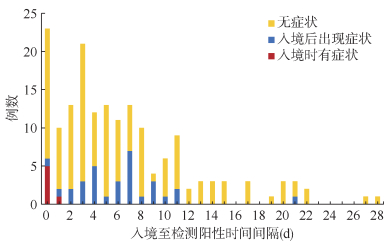
5. 核酸阳性检测时间分析:对新冠病毒感染者入境和首次采样核酸检测阳性时间间隔进行分析,发现除去1例入境时间不明确外,13.53%(23/170)的感染者入境当天筛查出核酸阳性,68.24%(116/170)的感染者在入境7 d内检测出核酸阳性,入境超过14 d的感染者占10.00%(17/170),入境超过21 d的感染者占2.35%(4/170),所有感染者均在入境28 d内检测出核酸阳性。
78.24%(133/170)的感染者核酸检测为阳性时,未出现临床相关症状。37例出现症状的感染者中,16.22%(6/37)入境时即有临床症状,83.78%(31/37)入境后出现临床症状。见图 2。
|
| 图 2 北京市境外输入性新型冠状病毒感染者入境至检测阳性时间间隔分布 |
6. 疫苗接种情况:171例境外输入性感染者中,104例接种过新冠病毒疫苗,其中92例有明确的接种疫苗种类,灭活疫苗、mRNA疫苗和腺病毒载体疫苗分别占85.87%(79/92)、7.61%(7/92)和6.52%(6/92)。104例接种过疫苗的感染者中,99例接种过2剂次疫苗,92例为全程接种疫苗,接种时间间隔为21 d的占27.27%(27/99),28 d的占22.22%(22/99)。2针接种间隔M(Q1,Q3)为25.00(21.00,28.00)d。第2针接种时间至首次采样阳性时间间隔M(Q1,Q3)为106.50(31.50,204.25)d。
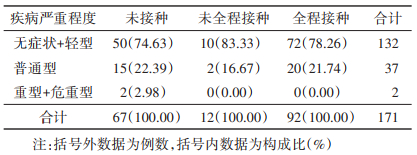
7. 疫苗接种对疾病严重程度影响:未接种组中无症状感染者和轻型占74.63%(50/67),低于未全程接种组(83.33%,10/12)和全程接种组(78.26%,72/92)。未接种组中普通型占22.39%(15/67),高于未全程接种组(16.67%,2/12)和全程接种组(21.74%,20/92)(H=170.00,P < 0.001)。同时,未接种组中出现了1例重型和1例危重型病例(表 2)。
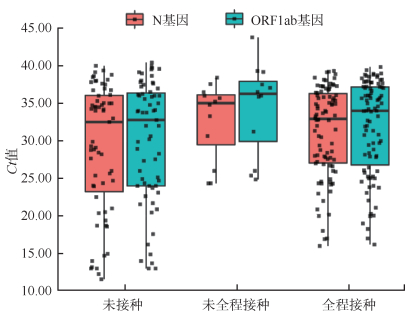
8. 疫苗接种与病毒载量的关系:去除6例单基因阳性感染者,对165例双基因阳性感染者的Ct值进行分析,未接种组、未全程接种组和全程接种组N基因Ct值M(Q1,Q3)分别为32.51(23.23,36.06)、35.02(29.48,36.12)和32.93(27.05,36.29),差异无统计学意义(H=1.88,P=0.391);3组ORFlab基因Ct值M(Q1,Q3)分别为32.78(24.00,36.38)、36.26(29.92,37.92)和34.00(26.79,37.17),差异无统计学意义(H=3.77,P=0.152)。见图 3。
|
| 图 3 北京市境外输入性新型冠状病毒感染者中新型冠状病毒疫苗未接种组与接种组的核酸Ct值 |
本研究分析了北京市境外输入性新冠病毒感染者的流行特征及疫苗接种对病毒载量和疾病严重程度的影响。2021年6月1日至9月30日北京市境外输入性新冠病毒感染者以无症状感染者为主,与早期有所不同,2021年3月25日以前,无症状感染者仅占5.96%(14/235)[11],感染者输入国家/地区与北京市早期境外输入国家/地区也有所不同[11-12]。人群以中国籍中、青年男性居多,与既往研究结果一致[13]。
全基因测序发现,新冠病毒主要以Delta变异株为主,与全球新冠病毒变异株流行形势相似[14]。Delta变异株可显著增加传染性、住院风险以及降低疫苗的保护效果[7, 15]。截至2021年10月20日,全球已有171个国家/地区报告出现了Delta变异株。即使在疫苗接种率高的国家,由Delta变异株感染导致的新冠肺炎仍然造成巨大的疾病负担[14]。
本研究显示,绝大多数新冠病毒感染者在入境后14 d内可通过核酸检测识别,所有感染者均可在28 d内发现,但以往研究也存在潜伏期超过28 d并造成本地传播的现象[16]。目前《全国新型冠状病毒肺炎诊疗方案(试行第八版修订版)》中对入境人员实施“14+7”的管控策略[9],但全国各省份对入境人员隔离管控政策有所不同,可能存在入境人员优先选择从隔离时间短、政策相对宽松的省份入境,隔离结束后回归社区,存在一定的风险。
本研究发现,新冠病毒感染者无论是否接种疫苗,其体内均有相似的病毒载量。四川省成都市曾对20例接种过疫苗的感染者与55例未接种的感染者的病毒载量进行比较,发现疫苗接种组和未接种组感染者的新冠病毒(ORF1ab和N基因)Ct值差异无统计学意义[13],与本研究结果相似。但也有研究显示,接种过疫苗的感染者的核酸检测Ct值似乎高于未接种疫苗的感染者,但由于该研究样本量不足(仅为3例),其结果的可靠性有待进一步证明[17]。
本研究虽未显示接种新冠病毒疫苗可显著降低感染者体内病毒载量,但接种新冠病毒疫苗可降低感染者的疾病严重程度,与Voysey等[18]和Bernal等[19]研究的结论一致。同时,大量研究显示,新冠病毒疫苗接种可显著降低感染者住院率、住院时间和新冠肺炎症状持续时间[20-21]。即使未全程接种疫苗,也可一定程度上缩短新冠病毒在体内存在时间[22]。但也有真实世界研究结果显示,未全程接种新冠病毒疫苗者,疫苗保护效果并不明显[23]。因此,在医疗资源有限的情况下,建议未接种疫苗人群尽快接种,以避免感染后出现严重结局。在保证疫苗接种率的同时,依然要继续落实勤洗手、常通风、戴口罩和保持社交距离等综合的疫情防控策略,以遏制新冠病毒的传播[5]。
本研究存在局限性。分析疫苗接种对病毒载量和疾病严重程度的影响时,可能受到感染者性别、年龄和基础性疾病的影响,后期会进一步深入调查,分析其可能的影响因素。
利益冲突 所有作者声明无利益冲突
作者贡献声明 董帅兵:研究设计、论文撰写、数据整理、数据分析、论文修改;王小莉:研究指导;赵好、王宇、刘白薇、刘永红、潘阳:数据收集与整理;贾蕾、王全意:研究支持;杨鹏:研究设计、论文修改、经费支持
| [1] |
Mofijur M, Fattah IMR, Alam MA, et al. Impact of COVID-19 on the social, economic, environmental and energy domains: Lessons learnt from a global pandemic[J]. Sustain Prod Consum, 2021, 26: 343-359. DOI:10.1016/j.spc.2020.10.016 |
| [2] |
北京市卫生健康委员会. 北京市新冠肺炎防控信息[EB/OL]. (2021-10-19)[2021-10-19]. http://wjw.beijing.gov.cn/.
|
| [3] |
Vashishtha VM, Kumar P. Development of SARS-CoV-2 vaccines: challenges, risks, and the way forward[J]. Hum Vaccin Immunother, 2021, 17(6): 1635-1649. DOI:10.1080/21645515.2020.1845524 |
| [4] |
Brown CM, Vostok J, Johnson H, et al. Outbreak of SARS-CoV-2 infections, including COVID-19 vaccine breakthrough infections, associated with large public gatherings-Barnstable County, Massachusetts, July 2021[J]. MMWR Morb Mortal Wkly Rep, 2021, 70(31): 1059-1062. DOI:10.15585/mmwr.mm7031e2 |
| [5] |
Sonabend R, Whittles LK, Imai N, et al. Non-pharmaceutical interventions, vaccination, and the SARS-CoV-2 delta variant in England: a mathematical modelling study[J]. Lancet, 2021, 398(10313): 1825-1835. DOI:10.1016/S0140-6736(21)02276-5 |
| [6] |
Mcewen AE, Cohen S, Bryson-Cahn C, et al. Variants of concern are overrepresented among postvaccination breakthrough infections of severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2) in Washington State[J]. Clin Infect Dis, 2021, ciab581. DOI:10.1093/cid/ciab581 |
| [7] |
Bernal JL, Andrews N, Gower C, et al. Effectiveness of COVID-19 vaccines against the B.1.617.2 (Delta) Variant[J]. N Engl J Med, 2021, 385(7): 585-594. DOI:10.1056/NEJMoa2108891 |
| [8] |
Global Initiative on Sharing All Influenza Data. Tracking of variantss[EB/OL]. (2021-10-21)[2021-10-21]. https://www.gisaid.org/hcov19-variants/.
|
| [9] |
中华人民共和国国家卫生健康委员会. 关于印发新型冠状病毒肺炎诊疗方案(试行第八版修订版)的通知[EB/OL]. (2021-04-15)[2021-10-20]. http://www.nhc.gov.cn/xcs/zhengcwj/202104/7de0b3837c8b4606a0594aeb0105232b.shtml.
|
| [10] |
Pollett SD, Richard SA, Fries AC, et al. The severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2) mRNA vaccine-breakthrough infection phenotype includes significant symptoms, live virus shedding, and viral genetic diversity[J]. Clin Infect Dis, 2021, ciab543. DOI:10.1093/cid/ciab543 |
| [11] |
王宇, 贾蕾, 董帅兵, 等. 北京市新型冠状病毒肺炎境外输入病例流行病学及病例发现特征分析[J]. 国际病毒学杂志, 2021, 28(6): 498-503. Wang Y, Jia L, Dong SB, et al. Epidemiological characteristics and case-finding of imported COVID-19 cases in Beijing[J]. Int J Virol, 2021, 28(6): 498-503. DOI:10.3760/cma.j.issn.1673-4092.2021.06.014 |
| [12] |
马春娜, 吴双胜, 孙瑛, 等. 2020年1-7月北京市不同阶段新型冠状病毒肺炎疫情特征分析[J]. 国际病毒学杂志, 2020, 27(6): 448-454. Ma CN, Wu SS, Sun Y, et al. Characteristics of COVID-19 epidemics at different stages in Beijing from January to July, 2020[J]. Int J Virol, 2020, 27(6): 448-454. DOI:10.3760/cma.j.issn.1673-4092.2020.06.003 |
| [13] |
岳勇, 梁娴, 毛毅, 等. 新型冠状病毒疫苗接种对成都市境外输入病例流行病学及临床特征的影响分析[J]. 中华流行病学杂志, 2021, 42(8): 1365-1370. Yue Y, Liang X, Mao Y, et al. Influence of SARS-CoV-2 vaccination on the epidemiological and clinical characteristics of imported COVID-19 cases in Chengdu[J]. Chin J Epidemiol, 2021, 42(8): 1365-1370. DOI:10.3760/cma.j.cn112338-20210330-00261 |
| [14] |
Bian LL, Gao QS, Gao F, et al. Impact of the Delta variant on vaccine efficacy and response strategies[J]. Expert Rev Vaccin, 2021, 20(10): 1201-1209. DOI:10.1080/14760584.2021.1976153 |
| [15] |
Sheikh A, Mcmenamin J, Taylor B, et al. SARS-CoV-2 delta VOC in Scotland: demographics, risk of hospital admission, and vaccine effectiveness[J]. Lancet, 2021, 397(10293): 2461-2462. DOI:10.1016/S0140-6736(21)01358-1 |
| [16] |
COVID-19 Epidemiology Investigation Team, Laboratory Testing Team, Zhang WZ. Local Outbreak of COVID-19 in Shunyi district attributed to an asymptomatic carrier with a history of stay in Indonesia-Beijing Municipality, China, December 23, 2020[J]. China CDC Wkly, 2021, 3(10): 214-217. DOI:10.46234/ccdcw2020.062 |
| [17] |
Chen H, Mao Y, Duan ZH, et al. Three cases of COVID-19 variant delta with and without vaccination-Chengdu City, Sichuan Province, April–May, 2021[J]. China CDC Wkly, 2021, 3(25): 544-546. DOI:10.46234/ccdcw2021.137 |
| [18] |
Voysey M, Costa Clemens SA, Madhi SA, et al. Single-dose administration and the influence of the timing of the booster dose on immunogenicity and efficacy of ChAdOx1 nCoV-19 (AZD1222) vaccine: a pooled analysis of four randomised trials[J]. Lancet, 2021, 397(10277): 881-891. DOI:10.1016/S0140-6736(21)00432-3 |
| [19] |
Bernal JL, Andrews N, Gower C, et al. Effectiveness of the Pfizer-BioNTech and Oxford-AstraZeneca vaccines on covid-19 related symptoms, hospital admissions, and mortality in older adults in England: test negative case-control study[J]. BMJ, 2021, 373: n1088. DOI:10.1136/bmj.n1088 |
| [20] |
Pawlowski C, Lenehan P, Puranik A, et al. FDA-authorized mRNA COVID-19 vaccines are effective per real-world evidence synthesized across a multi-state health system[J]. Med, 2021, 2(8): 979-992. DOI:10.1016/j.medj.2021.06.007 |
| [21] |
Ella R, Vadrevu KM, Jogdand H, et al. Safety and immunogenicity of an inactivated SARS-CoV-2 vaccine, BBV152:a double-blind, randomised, phase 1 trial[J]. Lancet Infect Dis, 2021, 21(5): 637-646. DOI:10.1016/S1473-3099(20)30942-7 |
| [22] |
Coppeta L, Balbi O, Grattagliano Z, et al. First dose of the BNT162b2 mRNA COVID-19 vaccine reduces symptom duration and viral clearance in healthcare workers[J]. Vaccines (Basel), 2021, 9(6): 659. DOI:10.3390/vaccines9060659 |
| [23] |
Li XN, Huang Y, Wang W, et al. Effectiveness of inactivated SARS-CoV-2 vaccines against the Delta variant infection in Guangzhou: a test-negative case-control real-world study[J]. Emerg Microbes Infect, 2021, 10(1): 1751-1759. DOI:10.1080/22221751.2021.1969291 |
 2022, Vol. 43
2022, Vol. 43