文章信息
- 黄宁浩, 吕筠, 余灿清, 郭彧, 裴培, 杜怀东, 陈君石, 陈铮鸣, 黄涛, 李立明, 代表中国慢性病前瞻性研究项目协作组.
- Huang Ninghao, Lyu Jun, Yu Canqing, Guo Yu, Pei Pei, Du Huaidong, Chen Junshi, Chen Zhengming, Huang Tao, Li Liming, for the China Kadoorie Biobank Collaborative Group
- 中国儿童肥胖的遗传易感性与成年期缺血性心脏病发病风险的研究
- Association between genetic predisposition to childhood obesity and the risk of adult ischemic heart disease in China
- 中华流行病学杂志, 2022, 43(4): 445-451
- Chinese Journal of Epidemiology, 2022, 43(4): 445-451
- http://dx.doi.org/10.3760/cma.j.cn112338-20210413-00309
-
文章历史
收稿日期: 2021-04-13
2. 北京大学公众健康与重大疫情防控战略研究中心, 北京 100191;
3. 分子心血管学教育部重点实验室, 北京 100191;
4. 中国医学科学院阜外医院, 国家心血管病中心, 北京 100037;
5. 中国医学科学院, 北京 100730;
6. 英国牛津大学医学研究委员会人口健康研究组/临床与流行病学研究中心纳菲尔德人群健康系 OX3 7LF;
7. 国家食品安全风险评估中心, 北京 100022
2. Peking University Center for Public Health and Epidemic Preparedness & Response, Beijing 100191, China;
3. Key Laboratory of Molecular Cardiovascular Sciences, Ministry of Education, Beijing 100191, China;
4. Fuwai Hospital Chinese Academy of Medical Sciences, National Center for Cardiovascular Diseases, Beijing 100037, China;
5. Chinese Academy of Medical Sciences, Beijing 100730, China;
6. Medical Research Council Population Health Research Unit/Clinical Trial Service Unit and Epidemiological Studies Unit, Nuffield Department of Population Health, University of Oxford, Oxford OX3 7LF, UK;
7. China National Center for Food Safety Risk Assessment, Beijing 100022, China
在过去的40年中,全球儿童肥胖人数呈现显著增长的趋势,2016年共有1.2亿肥胖儿童,而在1975年仅为1 100万,其中增长最多的为东亚、中东等地区[1]。《中国居民营养与慢性病状况报告(2020年)》显示,我国6~17岁儿童青少年的超重/肥胖率达到19%[2],已成为我国重要的公共卫生问题。既往有观察性研究结果显示,儿童肥胖会增加成年期缺血性心脏病(ischemic heart disease,IHD)的发病风险[3-4],但目前研究结果尚不一致[5];同时缺乏来自中国人群的大型研究证据。因此,在中国人群中识别儿童肥胖与IHD的关联效应成为一项重要的公共卫生任务。传统的观察性研究会受到残余混杂、测量误差等因素的影响,可能会导致虚假关联。利用全基因组关联研究(genome-wide association study,GWAS)中发现的相关位点构建遗传风险评分[6],可以量化儿童肥胖的遗传易感性。因此,本研究拟基于中国慢性病前瞻性研究(China Kadoorie Biobank,CKB)基线和长期随访的数据,探究儿童肥胖的测量学指标BMI的相关基因与成年人IHD发病风险之间的关联。
对象与方法1. 研究对象:CKB项目的研究现场为中国的5个城市和5个农村,于2004年6月至2008年7月开展基线调查,纳入了512 725名有完整基线调查数据并签署知情同意书的研究对象,研究内容包括问卷调查、体格测量和血标本采集。项目具体信息见相关文献[7-8]。项目组于2016年随机选取了6.9万余名研究对象进行全基因组基因分型,由深圳华大基因科技服务有限公司完成测定。经过样本质控后,参照千人基因计划东亚人群数据进行基因填补。本研究以通过基因数据质控的68 391名研究对象为基础,剔除基线自报患有冠心病(2 606人)、卒中(1 212人)、恶性肿瘤(357人)的研究对象,去重后最终纳入64 454人。
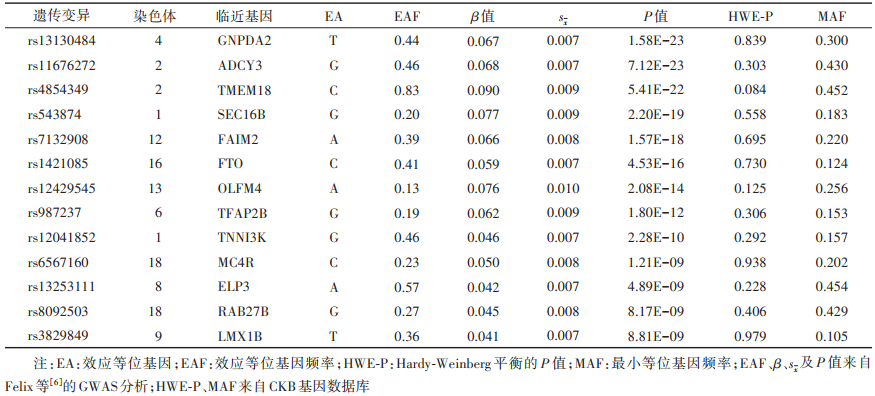
2. 暴露评价:基于2016年的一项GWAS中对35 668名欧洲血统儿童BMI的联合分析,共有15个单核苷酸多态性(SNPs)位点达到了全基因组显著性(P < 5×10-8)[6],被选取用以构建遗传风险评分。这些SNPs位点在中国儿童群体中的关联效应大小已在其他研究中得到验证[9]。其中有2个SNPs位点未在CKB中进行基因分型(rs7550711、rs13387838)。剩余13个SNPs位点不存在连锁不平衡(R2≤0.01),符合Hardy-Weinberg平衡(P > 10-6)。最终,13个SNPs位点均被纳入分析。见表 1。
根据纳入的13个SNPs位点构建儿童BMI相关的遗传风险评分,每个SNP位点的效应等位基因数量简单相加为非加权遗传风险评分(SNP1+SNP2+ ……+ SNP13),基于GWAS中每个SNP位点与儿童BMI关联的效应大小(β)[6]加权即得到加权遗传风险评分[(β1×SNP1 + β2×SNP2+……+β13×SNP13)×13÷(β1 + β2 +……+ β13)]。对研究对象根据遗传风险评分的五分位进行分组,Q1为低遗传风险组,Q2~Q4为中等遗传风险组,Q5为高遗传风险组。
其他协变量的评价:通过问卷收集的人口和社会经济状况(年龄、性别、文化程度、婚姻状况、家庭年收入),生活方式因素(吸烟、饮酒、饮食、体力活动水平),自我报告的病史。研究对象在维持坐姿休息至少5 min后,使用UA-779数字监测仪测量血压,测量2次取均值。身高(身高仪)、体重(TANITA-TBF-300GS体质构成分析仪)等体格指标由经过统一培训的调查员采用统一校正的工具测量获得,测量读数精确到0.1。BMI=体重(kg)/身高(m)2。为了控制人群分层的影响,采用统一的流程计算遗传主成分。
3. 随访结局评价:研究对象的发病信息通过当地的死亡和常规疾病监测系统、全民医疗保险数据库,以及主动的定向监测获得。疾病分类采用国际疾病分类第十版(ICD-10)。本研究的主要终点包括:①缺血性心脏病(I20~I25);②急性冠心病事件(major coronary event,MCE):包括致死性IHD(I20~I25)和非致死性心肌梗死(I21~I23)。
4. 统计学分析:采用一般线性模型(连续变量)、二元logistic回归(二分类变量)模型比较不同遗传风险评分分组的研究对象的基线特征,报告调整年龄、性别、地区后的均数或构成比。CKB的长期随访从研究对象完成基线调查之日开始算起,直到出现结局事件、失访、死亡或截至2017年12月31日。采用Cox比例风险回归模型,以年龄作为时间尺度,估计加权遗传风险评分分组(低遗传风险组为参照组)与IHD发生风险的关联,计算风险比(HR)及其95%CI。对遗传风险评分进行Z值标准化转换,即(原始评分-均值)÷标准差,将Z值评分作为连续性变量进行趋势性检验。模型以年龄(5岁一组)和项目地区(10个地区)分层,分步调整混杂因素:模型1调整性别;模型2进一步调整前10个遗传主成分;模型3进一步调整基线BMI。
为验证结果的稳健性,在模型2的基础上进行敏感性分析:①采用非加权遗传风险评分进行分析;②剔除基线患有糖尿病的研究对象。另外,根据性别(男、女)、年龄(< 50、50~、≥60岁)、城乡(城市、农村)、每日吸烟(是、否)、每日饮酒(是、否)、体力活动水平(< 12.2、12.2~、≥25.0 MET-h/d)、BMI(< 18.5、18.5~、≥24.0 kg/m2)、冠心病家族史(有、无)进行亚组分析。交互作用检验采用似然比检验法,比较有无交互项的模型是否存在差异。使用Stata 15.0软件进行分析,采用双侧检验,以P < 0.05为差异有统计学意义。
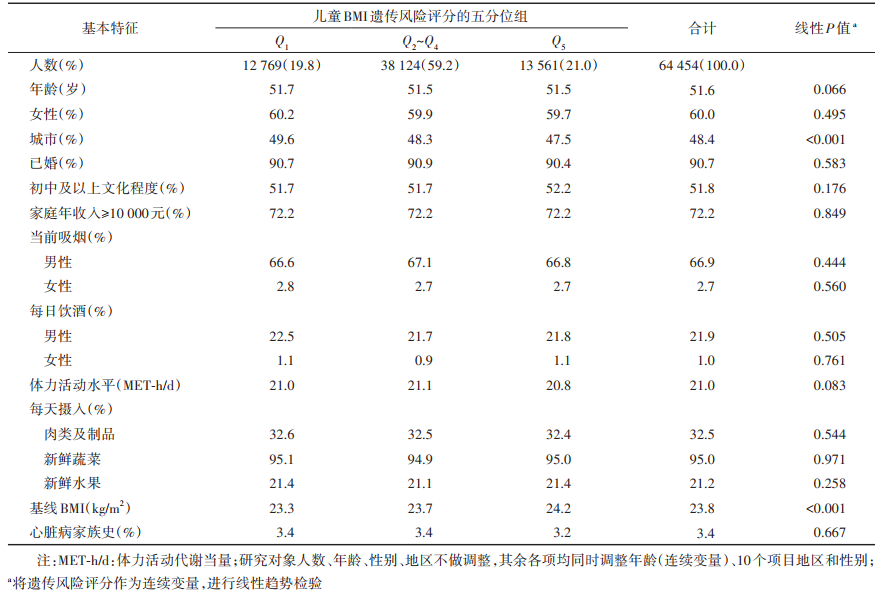
结果1. 一般情况:在纳入的64 454名队列成员中,年龄为(51.6±10.6)岁,女性占60.0%,城市居民占48.4%。儿童BMI遗传风险得分为(9.5±2.1)分。见表 2。与低遗传风险组相比,遗传风险评分越高者的城市居民占比越低,基线BMI水平越高,其余因素并未见明显关联。
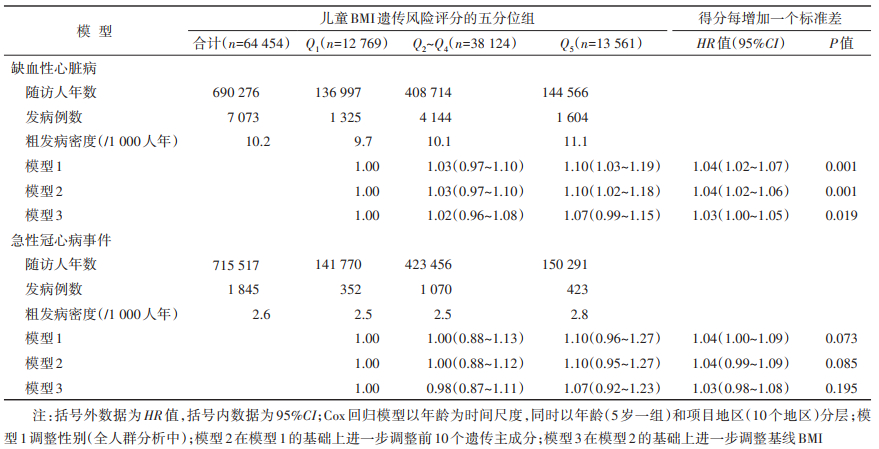
2. 遗传风险评分与IHD发病风险的关联:研究对象随访(10.7±2.5)年,累计随访690 276人年。随访期间,共观察到IHD发病7 073例,MCE发病1 845例。调整性别、年龄、地区及前10个遗传主成分后(模型2),与低遗传风险组相比,高遗传风险组诊断为IHD、MCE的HR值(95%CI)分别为1.10(1.02~1.18)、1.10(0.95~1.27)。遗传风险评分与IHD发病风险之间的关联存在有统计学意义的线性趋势(P=0.001)。遗传风险评分每增加一个标准差,IHD的发病风险增加4%(2%~6%)。进一步调整基线BMI后(模型3),高遗传风险组与低遗传风险组的效应值差异无统计学意义,但遗传风险评分与IHD发病风险之间仍具有线性趋势(P=0.019),表现为遗传风险评分每增加一个标准差,IHD的发病风险增加3%(0%~5%)。考虑到成年人BMI水平增高可能是儿童BMI与发病结局的中间因素[10-11],调整成年人BMI会低估儿童期效应,故主结果与亚组分析均报告模型2的结果。见表 3。
3. 敏感性分析:采用非加权遗传风险评分进行分析,剔除基线患有糖尿病的研究对象后,效应值无明显变化(结果未展示)。
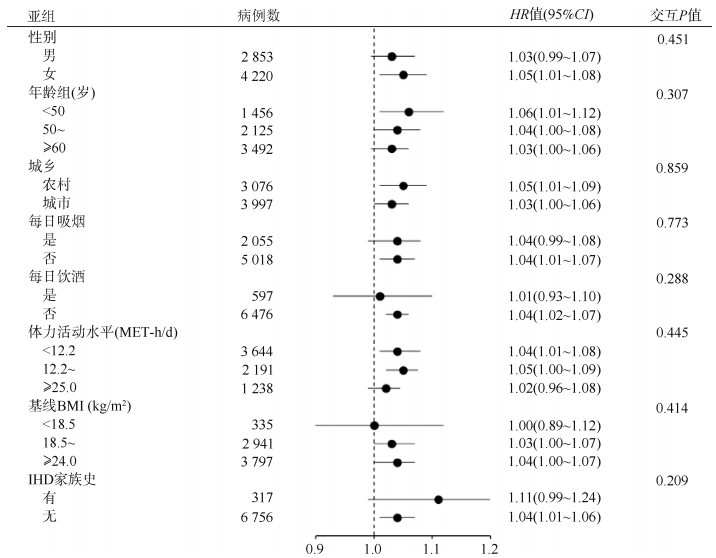
4. 亚组分析:性别、年龄、城乡、每日吸烟、每日饮酒、体力活动水平、基线BMI和IHD家族史对儿童BMI的遗传风险评分与IHD发病风险间的关联均不存在效应修饰作用(交互P值均 > 0.05)。见图 1。
|
| 注:Cox回归模型以年龄为时间尺度,同时以年龄(5岁一组)和项目地区(10个地区)分层,模型调整性别、前10个遗传主成分;MET:代谢当量;IHD:缺血性心脏病 图 1 按其他基线特征对儿童BMI的遗传风险评分与缺血性心脏病发病风险的关联进行亚组分析讨论 |
本研究利用我国10个地区6万余人的基因数据,构建儿童BMI的个体遗传风险评分,分析儿童肥胖的遗传易感性与成年期IHD发病风险的关联。结果显示,与得分最低五分位组相比,最高五分位组的研究对象成年期发生IHD的风险增加了10%。调整基线BMI后,关联不再显著。而由于新发MCE病例数很少,未观察到儿童BMI的遗传风险评分与发生MCE风险有统计学显著性的关联。
既往有关儿童BMI与成年人心血管疾病发病风险的观察性研究较少,且不同研究报告的关联效应值并不一致。一项纳入了6项队列研究的Meta分析发现,7~11岁儿童、12岁及以上的儿童BMI水平较高与成年人IHD的发病率增加有关,发生IHD的OR值(95%CI)分别为1.14(1.08~1.21)、1.30(1.16~1.47),而在6岁及以下的儿童中的关联结果则无统计学意义[4]。研究对象主要为欧、美洲地区人群的3项研究的Meta分析显示,2~18岁儿童BMI与成年人动脉粥样硬化性心血管事件的关联较小,OR值(95%CI)为1.04(1.02~1.07)[5]。此外,欧洲地区人群中的一项两样本孟德尔随机化(Mendelian randomization,MR)研究,提供了儿童BMI与IHD发生风险的遗传学证据。研究报告,儿童BMI每增加一个标准差,冠状动脉疾病风险增加28%[12]。
综上,既往研究表明儿童肥胖会增加成年人患IHD的风险。但是,以上纳入的分析均未对成年人BMI进行调整,仅强调儿童肥胖的独立危险作用。从公共卫生的角度来讲,体重生长轨迹至关重要,可能会提示潜在的干预目标。本研究发现,调整成年人BMI后,儿童BMI的遗传风险评分与IHD无统计学关联,这一现象与既往研究结果一致。一项来自英国3个队列汇总数据的研究显示,与从不超重的研究对象相比,从儿童期到成年期持续超重的研究对象,其患IHD的风险增加了近4倍,而仅在儿童期超重的研究对象的发病风险并未增加[13]。Tirosh等[14]的研究也表明,尽管生命早期BMI升高是冠心病的独立危险因素,但成年人动脉粥样硬化的风险同样会受到超重或肥胖暴露累积时间的影响。研究提示,如果在成年时体重状况恢复正常,可能有机会减轻儿童期BMI过高对成年期心血管结局的不良影响[14]。
儿童肥胖与IHD的关联可由多种原因造成。首先,儿童肥胖会引起糖代谢改变、血压和血脂异常、炎症生物标志物增加等[15]。由于这些危险因素的早期累积,儿童肥胖会增加成年后患心血管疾病的可能性[16]。相反,儿童肥胖程度的降低则会改善心血管疾病结局。一项前瞻性队列研究结果显示,与9~12岁、15~16岁两个阶段均保持肥胖的儿童相比,在15~16岁转变为正常体重的儿童的心血管危险因素水平得到了明显的改善[17]。其次,儿童和青少年肥胖与较高的动脉僵硬度有关,不良的代谢指标更是进一步加重了肥胖对动脉僵硬的不良影响。而动脉僵硬度高是动脉粥样硬化的一个明显信号,会增加心肌梗死、中风发病的风险[18]。最后,遗传学研究还发现了儿童BMI相关的遗传位点与成年后心血管代谢性疾病之间具有多效性遗传效应[19],在功能上扩展了儿童肥胖和心血管疾病之间可能的生物学途径,为儿童BMI与成年人冠状动脉疾病的关联提供了遗传学证据。
本研究在中国人群中采用儿童BMI的遗传风险评分,研究其与IHD的关联。本研究的优势:研究人群样本量大、随访时间较长、累计新发病例较多,具有足够的统计学检验效力;其次,长期随访队列多采用自报的方式收集儿童期体格数据,本研究采用遗传风险评分替代暴露因素,一定程度上降低既有研究中的回忆偏倚。然而,本研究仍存在一定的局限性。首先,既往没有大规模的东亚地区人群研究,本研究使用的SNPs位点均来自欧洲地区人群。由于CKB人群未对儿童期体格指标进行调查,因此无法在本人群中验证所使用的位点与儿童期BMI的关联。尽管已有其他文献在中国儿童中进行了验证,以间接说明SNPs对CKB研究人群的儿童期BMI水平具有一定的代表性,但仍有必要在中国人群中进一步开展儿童BMI相关的GWAS,利用其发现的、对中国儿童BMI解释度更高的相关位点对本研究结果进行验证。其次,虽然儿童BMI与成年人BMI之间的遗传位点并不完全重叠,且位点可解释的成年人BMI的变异也要低于儿童,但二者之间仍然存在共同的遗传学基础[6]。既往儿童BMI遗传学研究也同样指出遗传效应对结局产生的影响具体是在哪一阶段发生的仍不能明确,儿童期BMI可能仅通过成年BMI对心血管疾病产生间接影响[12, 20-21]。然而,与成年期相比,迄今为止进行的儿童BMI的GWAS样本量较小,很难获得更多仅与儿童BMI相关而不与成年期BMI相关的遗传位点。当存在更大规模儿童基因组数据时,将提高识别与儿童BMI相关且多效性较小的位点的能力,可以用来更新本研究分析结果。尽管如此,既往研究证据表明,BMI对心血管疾病的影响贯穿生命始终,但在不同年龄具有不同的效应[22-23]。鉴于中国正面临着儿童期超重、肥胖流行的局面,识别儿童期肥胖遗传易感性较高的个体,尽早进行体重管理,对于成年人心血管疾病的早期预防和控制至关重要。最后,GWAS发现的全部遗传位点仅能解释2%的儿童BMI的变异[6],本研究由于两个位点未分型,剩余的位点对儿童BMI的解释度可能会更低。且由于基因-环境的交互作用,个体的遗传效应可能会因为环境的改变而有所不同,因此实际关联的效应值可能被低估。
综上所述,本研究基于中国最大规模的前瞻性队列人群,提供了儿童肥胖的遗传易感性与其成年患IHD的风险的关联证据。本研究结果提示,应抓住早期干预的重要时间窗,实现IHD的一级预防。此外,成年期体重水平的降低可以改善因儿童肥胖遗传易感造成的风险增加,故关注BMI的发展轨迹至关重要。然而,上述研究结果仍需要在中国人群的大型前瞻性、观察性研究中做进一步的验证。未来中国相关研究也可以应用MR设计,在符合MR前提假设条件下研究儿童期BMI与成年人疾病的因果关联,可以为因果机制提供新的见解。
利益冲突 所有作者声明无利益冲突
作者贡献声明 王文秀:数据整理、统计学分析、结果解释、论文撰写;黄宁浩:统计学分析;吕筠、余灿清、郭彧、裴培、杜怀东:实施研究、采集数据;陈君石、陈铮鸣:项目设计和方案制定、经费支持;黄涛:制定研究方案、结果解释、经费支持;李立明:项目设计和方案制定;所有作者均对文章的知识性内容作批评性审阅
志谢 感谢所有参加中国慢性病前瞻性研究项目的队列成员和各项目地区的现场调查队调查员;感谢项目管理委员会、国家项目办公室、牛津协作中心和10个项目地区办公室的工作人员
| [1] |
NCD Risk Factor Collaboration (NCD-RisC). Worldwide trends in body-mass index, underweight, overweight, and obesity from 1975 to 2016:a pooled analysis of 2 416 population-based measurement studies in 128·9 million children, adolescents, and adults[J]. Lancet, 2017, 390(10113): 2627-2642. DOI:10.1016/s0140-6736(17)32129-3 |
| [2] |
国家卫生健康委员会. 中国居民营养与慢性病状况报告(2020年)[M]. 北京: 北京大学医学出版社, 2020. National Health Commission of the People's Republic of China. Report on Chinese residents' chronic diseases and nutrition (2020)[M]. Beijing: Peking University Medical Press, 2020. |
| [3] |
Raghuveer G. Lifetime cardiovascular risk of childhood obesity[J]. Am J Clin Nutr, 2010, 91(5): 1514S-1519S. DOI:10.3945/ajcn.2010.28701D |
| [4] |
Llewellyn A, Simmonds M, Owen CG, et al. Childhood obesity as a predictor of morbidity in adulthood: a systematic review and meta-analysis[J]. Obes Rev, 2016, 17(1): 56-67. DOI:10.1111/obr.12316 |
| [5] |
Ajala O, Mold F, Boughton C, et al. Childhood predictors of cardiovascular disease in adulthood. A systematic review and meta-analysis[J]. Obes Rev, 2017, 18(9): 1061-1070. DOI:10.1111/obr.12561 |
| [6] |
Felix JF, Bradfield JP, Monnereau C, et al. Genome-wide association analysis identifies three new susceptibility loci for childhood body mass index[J]. Hum Mol Genet, 2016, 25(2): 389-403. DOI:10.1093/hmg/ddv472 |
| [7] |
Chen ZM, Lee L, Chen JS, et al. China Kadoorie Biobank of 0.5 million people: survey methods, baseline characteristics and long-term follow-up[J]. Int J Epidemiol, 2011, 40(6): 1652-1666. DOI:10.1093/ije/dyr120 |
| [8] |
Chen ZM, Lee L, Chen JS, et al. Cohort profile: the kadoorie study of chronic disease in China (KSCDC)[J]. Int J Epidemiol, 2005, 34(6): 1243-1249. DOI:10.1093/ije/dyi174 |
| [9] |
Sun Y, Fang J, Wan YH, et al. Polygenic differential susceptibility to cumulative stress exposure and childhood obesity[J]. Int J Obes (Lond), 2018, 42(6): 1177-1184. DOI:10.1038/s41366-018-0116-z |
| [10] |
Magnussen CG, Koskinen J, Juonala M, et al. A diagnosis of the metabolic syndrome in youth that resolves by adult life is associated with a normalization of high carotid intima-media thickness and type 2 diabetes mellitus risk: the Bogalusa heart and cardiovascular risk in young Finns studies[J]. J Am Coll Cardiol, 2012, 60(17): 1631-1639. DOI:10.1016/j.jacc.2012.05.056 |
| [11] |
Araújo J, Severo M, Barros H, et al. Developmental trajectories of adiposity from birth until early adulthood and association with cardiometabolic risk factors[J]. Int J Obes (Lond), 2015, 39(10): 1443-1449. DOI:10.1038/ijo.2015.128 |
| [12] |
Geng TT, Smith CE, Li CW, et al. Childhood BMI and adult type 2 diabetes, coronary artery diseases, chronic kidney disease, and cardiometabolic traits: a Mendelian randomization analysis[J]. Diabetes Care, 2018, 41(5): 1089-1096. DOI:10.2337/dc17-2141 |
| [13] |
Bjerregaard LG, Adelborg K, Baker JL. Change in body mass index from childhood onwards and risk of adult cardiovascular disease[J]. Trends Cardiovasc Med, 2020, 30(1): 39-45. DOI:10.1016/j.tcm.2019.01.011 |
| [14] |
Tirosh A, Shai I, Afek A, et al. Adolescent BMI trajectory and risk of diabetes versus coronary disease[J]. N Engl J Med, 2011, 364(14): 1315-1325. DOI:10.1056/NEJMoa1006992 |
| [15] |
Weiss R, Shaw M, Savoye M, et al. Obesity dynamics and cardiovascular risk factor stability in obese adolescents[J]. Pediatr Diabetes, 2009, 10(6): 360-367. DOI:10.1111/j.1399-5448.2008.00504.x |
| [16] |
Baker JL, Olsen LW, Sørensen TIA. Childhood body-mass index and the risk of coronary heart disease in adulthood[J]. N Engl J Med, 2007, 357(23): 2329-2337. DOI:10.1056/NEJMoa072515 |
| [17] |
Lawlor DA, Benfield L, Logue J, et al. Association between general and central adiposity in childhood, and change in these, with cardiovascular risk factors in adolescence: prospective cohort study[J]. BMJ, 2010, 341: c6224. DOI:10.1136/bmj.c6224 |
| [18] |
Dangardt F, Charakida M, Georgiopoulos G, et al. Association between fat mass through adolescence and arterial stiffness: a population-based study from The Avon Longitudinal Study of Parents and Children[J]. Lancet Child Adolesc Health, 2019, 3(7): 474-481. DOI:10.1016/s2352-4642(19)30105-1 |
| [19] |
Tekola-Ayele F, Lee A, Workalemahu T, et al. Shared genetic underpinnings of childhood obesity and adult cardiometabolic diseases[J]. Hum Genomics, 2019, 13(1): 17. DOI:10.1186/s40246-019-0202-x |
| [20] |
Dong SS, Zhang K, Guo Y, et al. Phenome-wide investigation of the causal associations between childhood BMI and adult trait outcomes: a two-sample Mendelian randomization study[J]. Genome Med, 2021, 13(1): 48. DOI:10.1186/s13073-021-00865-3 |
| [21] |
Richardson TG, Sanderson E, Elsworth B, et al. Use of genetic variation to separate the effects of early and later life adiposity on disease risk: mendelian randomisation study[J]. BMJ, 2020, 369: m1203. DOI:10.1136/bmj.m1203 |
| [22] |
Vogelezang S, Bradfield JP, Ahluwalia TS, et al. Novel loci for childhood body mass index and shared heritability with adult cardiometabolic traits[J]. PLoS Genet, 2020, 16(10): e1008718. DOI:10.1371/journal.pgen.1008718 |
| [23] |
Hohenadel MG, Baier LJ, Piaggi P, et al. The impact of genetic variants on BMI increase during childhood versus adulthood[J]. Int J Obes (Lond), 2016, 40(8): 1301-1309. DOI:10.1038/ijo.2016.53 |
 2022, Vol. 43
2022, Vol. 43