文章信息
- 刘艳梅, 任燕, 贾玉龙, 姚明宏, 邹康, 林凯, 孙鑫.
- Liu Yanmei, Ren Yan, Jia Yulong, Yao Minghong, Zou Kang, Lin Kai, Sun Xin
- 真实世界数据体系构建的模式探索
- Exploration of construction mode of real-world data system
- 中华流行病学杂志, 2022, 43(3): 418-423
- Chinese Journal of Epidemiology, 2022, 43(3): 418-423
- http://dx.doi.org/10.3760/cma.j.cn112338-20210824-00675
-
文章历史
收稿日期: 2021-08-24
2. 国家药品监督管理局海南真实世界数据研究与评价重点实验室, 成都 610041;
3. 海南省博鳌先行区药品不良反应监测中心, 海口 570216
2. NMPA Key Laboratory for Real World Data Research and Evaluation in Hainan, Chengdu 610041, China;
3. Center for Adverse Drug Reaction Monitoring of Boao Pilot Zone of Hainan province, Haikou 570216, China
2020年,国家药品监督管理局陆续发布真实世界证据(real-world evidence,RWE)支持药物和医疗器械(药械)审评审批的技术指导原则[1-6],表明RWE可作为临床证据来源支持医疗产品注册,该系列指导原则是我国监管科学的重要发展和创新。2020年3月,在博鳌乐城开展的“青光眼引流管”真实世界数据(real-world data,RWD)研究的注册申请成功通过审查,成为我国首个使用境内RWE成功获批上市的医疗器械产品,标志着RWE应用于特许药物和医疗器械(药械)上市申请的切实性和可行性[7]。
完整、准确、可利用、适用性的RWD,是获得高质量RWE的必要前提[8-10]。目前,在各类医疗政策的支持下,RWD已成为我国开展临床研究的沃土[11-12],本课题组近年来亦开展了基于RWD研究的方法学系列探索。因RWD来源及产生环境复杂多样,在国内外相关研究的基础上,结合前期博鳌乐城RWD研究经验,本文提出RWD体系的结构和构建流程,并探索RWD体系可能存在的模式,以期为开展高质量的RWD研究奠定基础。
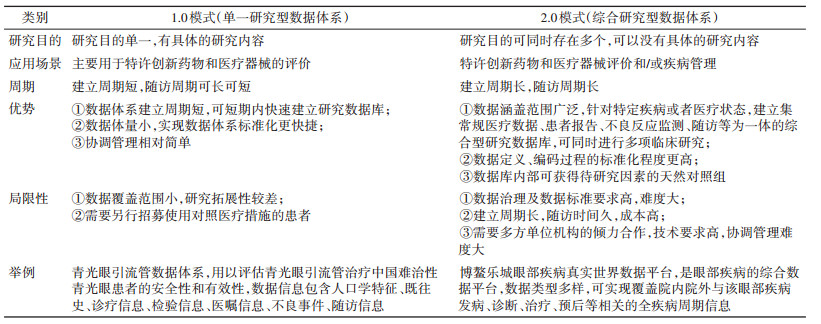
1. RWD资源的构成:鉴于我国很多大病重病辗转求医的特殊性,全国各地患者通过当地医生推荐或自己申请,前往中心城市(上级医疗单位或者名医名院)接受诊疗,出院后或带药返回居住地,且在当地医疗机构完成后期随访。RWD不仅指患者一次就医的院内医疗数据,而且包含从患者居住地到接受诊疗的中心城市医疗机构,再到患者出院回居住地进行随访的全过程数据。见图 1。
|
| 注:药械:药物和医疗器械;ePRO:电子化的患者报告结局 图 1 真实世界数据体系的数据资源构成 |
在数据的地点分布上,从全国各地多汇集于直辖市或省会城市,呈现“放射状分布”;在数据的时间分布上,包含患者既往病史数据、当前诊疗数据以及随访数据;在数据分布载体上,包含医院电子病历(electronic medical record,EMR)系统、医保系统、不良反应监测平台、特许药械追溯管理平台、电子化的患者报告结局(electronic patient reported outcome,ePRO)系统、智能可穿戴设备等多个信息平台。除此之外,还会根据研究目的不同,加入既往已开展临床研究的数据,以及特定疾病的外对照数据,最终形成以患者疾病干预为核心的多维度全疾病周期RWD体系。
在获取方式上,RWD体系中包含两种数据收集方式:常规收集和主动收集。常规收集的数据来源于医疗机构(如EMR系统、实验室信息系统、影像和放射信息系统内的数据)、不良反应监测平台、特许药械追溯管理平台,这些平台基于管理或日常监测目的收集初始数据[13],在构建数据体系过程中,不需要额外再收集;主动收集的数据是指常规临床实践中不存在,为了相对清晰的研究目的而收集的数据,如患者自报结局数据、智能可穿戴设备、医嘱依从性数据等[14]。
不同于常规研究数据资源,目前国内用于注册上市开展的RWD研究多在博鳌乐城[7],根据具体研究目的还可以结合外部数据和外对照数据。基于药械产品的外部数据一般指该药械产品国外注册上市的完整数据库、国外已开展的研究数据、国内正在同步开展的Ⅱ、Ⅲ期临床试验数据;某些药械在博鳌乐城内难以找到使用对照产品的患者,可选择其他地区或其他人群的外对照数据[15-16]。
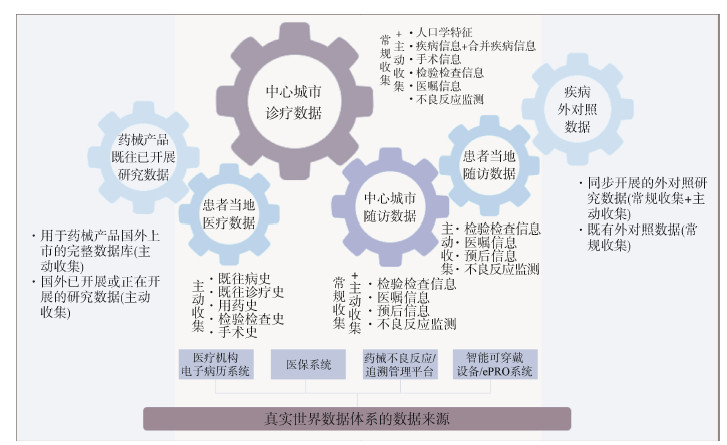
2. 构建RWD体系的流程:RWD产生环境复杂多样,只有经过严密的顶层设计、科学的数据资源评估、多学科交叉的团队协作、严格的数据处理流程,才能构建标准的RWD体系,产生高质量的研究数据,以满足临床研究和监管决策需求,整体构建流程见图 2。
|
| 注:CRA:临床监查员;CRC:研究协调员;ePRO:电子化的患者报告结局 图 2 真实世界数据体系构建流程 |
(1)基于研究目的,评估数据资源:基于既定研究目的,研究者首先应根据不同的研究问题评估数据资源(图 2),是否存在既有数据,应充分考虑是否存在足够多的既有患者、数据的可获得性如何,并初步评估数据质量,如数据的完整性,以及数据所在系统的可链接性等[6],既有数据对于既有患者样本量不够的情况,还需要额外招募患者,部分既有患者可能还存在随访不充分、关键变量缺失等问题,还需要主动收集这类补充数据,如回顾性收集疾病史、前瞻性收集院外随访结局等。
(2)组建数据团队,明确职责分工:构建RWD体系涉及多环节多任务。组建数据研究团队,分工明确、责任到人、协力合作,是构建高质量数据体系的基础。数据团队的基本人员构成和任务分配:①数据体系搭建的顶层设计:临床专家、RWD研究专家和统计师,无论是基于回顾性还是前瞻性数据,他们的参与会贯穿数据体系建立的始终。临床专家最了解数据的产生过程,RWD研究专家最熟悉从发现数据到产生证据的全流程,而统计师则参与数据评估、数据构成方案的制定,以及回顾性数据的清洗工作。②前瞻性数据:包含了大量患者管理和数据管理的工作,以临床协调员、临床监查员、数据管理师为主,可能还需要临床工作者的参与。具体工作环节包括但不限于电子数据采集(electronic data capturing,EDC)系统的建立、病历报告表设计(case report form,CRF)设计、患者招募与管理、主动收集的患者数据与数据录入、数据核查等环节,其中EDC的建立需要计算机编程人员的协助。③回顾性数据:以统计师为主,其中在数据提取环节需要医学信息工程师的协助,主要包括数据资源评估、数据提取与链接以及数据治理。
(3)形成科学的数据构成方案:在整体评估了解现有数据资源后,研究者再结合具体的研究问题或研究方案,形成科学的数据构成方案。数据构成方案主要是为了指明以下问题:
第一,数据体系需要包含的数据变量指标及具体定义,如想要获取患者术前的血糖水平,可以定义为术前最后一次的FPG值。对于单一目的的研究数据体系,数据变量应做到减少冗余、避免缺失;对于综合研究型数据体系模式,在成本可控的前提下,可以细化变量指标,如添加同一指标不同时间点多次测量的纵向数据。此外,多中心研究应尽量采用客观变量以保证各中心同一指标数据的同质性。
第二,明确数据来源,该变量指标是通过EMR数据、医保数据、不良反应监测数据、患者自报数据、智能穿戴设备,还是其他更多渠道。
第三,说明数据采集方式,近年来信息化进展迅速,数据采集方式多种多样。需要前瞻性招募的患者,主动收集的数据应细化采集方式,如随访信息,是通过面诊、电话还是微信问询来获取?除必须主动收集的数据外,大部分数据仍然是同步存储在EMR系统中的常规医疗数据,这部分常规收集的医疗数据,是人工提取,还是通过人工智能的方式自动读取,应综合考虑获取数据的不同途径所需的资源和时间、可行性以及具体措施,以保证高质量的研究数据满足研究需求[17]。回顾性数据,是直接链接EMR系统,通过设置数据标准转化读取到EDC中;还是通过信息工程师从EMR系统中提取后,再经统计师进行数据治理才能获取准确的数据变量;亦或通过人工的方式,从电子病历读取后手工录入CRF,也应充分考虑利弊之后综合考量[18]。同一个指标仅采用一种采集方式,常规数据有可能出现矛盾数据时,应提前设置好优先级。
(4)严格数据处理流程,保证高质量数据输出:严格的数据处理流程是确保数据的准确性、可溯源性和透明性的基础,是构建高质量RWD体系的关键[19],不同的数据来源、既有数据与前瞻性主动收集数据在数据处理过程都截然不同,前期已有RWD与研究技术规范详细阐述[13-14],此处仅概括说明:对于直接从EMR系统中提取的既有健康医疗数据,数据处理主要是指数据提取、数据治理、数据核查(图 2的蓝色模块)[20]。对于主动采集的数据,此处的数据处理是指数据管理全过程。在准备阶段,需要进行CRF的设计、数据管理计划的撰写和电子数据采集系统的建立,以及逻辑核查计划的嵌入;在数据体系构建阶段的工作主要包括源数据核查、数据审核、不良事件一致性检查、医学编码等[21-23]。
无论是常规收集还是主动收集数据,只有通过加强数据管理和/或数据治理的标准流程,降低数据产生过程中的人为误差和信息偏倚,才能达到监管机构对数据完整性标准(ALCOA+CCEA原则)的高要求,如完整性、准确性、真实性和一致性等[21, 24-25]。
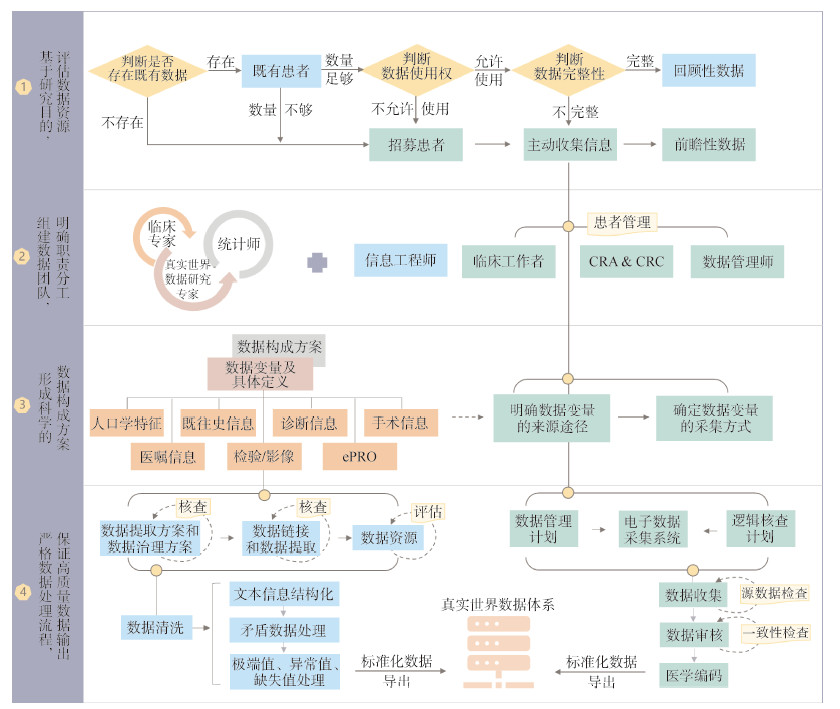
3. RWD体系的模式探索:根据RWD资源所包含的数据范围、数据结构以及整体研究目的,RWD体系具体分为两种模式。见表 1。
1.0模式:即单一研究型数据体系模式,以药械产品登记为主,主要用于特定药械上市前有效性和安全性的快速评价、药械上市后的监管评价以及依从性评价等。该类数据体系是基于明确的研究目的和研究设计而建立,建立周期短、效率高,但研究拓展性较差,也不能同时开展多个研究[7, 17]。
2.0模式:即综合研究型数据体系模式,建立目的是多样化和框架性的,比如既要探索疾病的自然史,又要评价干预措施的有效性和安全性,构建体系之初,只需明确研究目的的方向性和边界,无需具体化。对于研究问题,则也可以提前预设若干感兴趣的具体问题。需要注意的是,一个数据体系解决不了所有的疾病问题,研究目的和研究问题越多,所消耗的资源就会越大。以具体疾病(如青光眼)或二级亚专科(如眼科)的患者登记为例,可同时进行药械评价研究和疾病管理[26],药械评价的适用场景可覆盖1.0模式,且该模式下的产品评价,还可在数据体系中存在天然对照医疗产品,更有利于评价产品的有效性和安全性[27];此外,该模式的适用场景可用于疾病管理,包括不限于疾病自然史研究、疾病预后研究、疾病复杂干预研究、罕见病防治与管理研究[28]。该种数据体系模式可同时进行多项研究,多种流行病学设计共存[29],除常规实效性临床试验和队列研究之外,还可开展特殊的研究设计类型,如基于注册登记研究的随机对照试验[30]。
目前,已开展的用于药械注册上市的研究多是博鳌乐城基于1.0模式,围绕特许药械审批监管,使用EDC系统采集数据,以患者为载体,跨越时间、地点、疾病进展,建立了器械追踪的多维度全生命周期的RWD体系,不仅开展了特许药械的RWD研究支持国内注册上市,也为该药械的上市后再评价奠定基础。随着患者数量的增加,博鳌乐城RWD研究经验的积累和数据的积累,已建立基于2.0模式的数据体系—博鳌乐城眼部疾病RWD平台,随着其平台的成熟,研究者可根据各自的研究目的在2.0模式上架构自己的数据平台,实现两种数据体系模式的融合,推进数据体系技术创新,确保数据安全和患者隐私的前提下开展RWD研究,助力临床RWD研究在乐城先行区的应用试点工作。
4. 小结:由于我国辗转求医路径的特殊性导致了多源异构复杂的RWD,必须构建标准化的RWD体系,才能保证高质量的研究数据产出。随着对真实世界研究的正确认识和理解,由RWD产生的RWE用于临床决策和药械评价,日益受到关注并投入实际应用[31]。数据质量是决定研究质量的底线,期待研究者发起的RWD研究也能参考药械监管下对数据体系的严格要求,根据自身特点选择合适的数据体系模式,采用标准化的RWD体系构建流程,完成高质量、规范化的临床研究[32]。
利益冲突 所有作者声明无利益冲突
作者贡献声明 刘艳梅、任燕:论文撰写;贾玉龙、姚明宏:论文修改;邹康:文献资料收集;林凯:研究指导、论文修改;孙鑫:研究指导、经费支持
| [1] |
国家发展改革委, 国家卫生健康委, 国家中医药局, 等. 四部门印发《关于支持建设博鳌乐城国际医疗旅游先行区的实施方案》[EB/OL]. (2019-09-10)[2021-08-20]. http://www.gov.cn/xinwen/2019-09/17/content_5430452.htm.
|
| [2] |
中国网. 海南博鳌乐城先行区实现"两个100"新突破[EB/OL]. (2020-06-09)[2021-08-20]. http://hainan.china.com.cn/2020-06/09/content_41179157.html.
|
| [3] |
国家药品监督管理局. 国家药监局关于发布真实世界证据支持药物研发与审评的指导原则(试行)的通告(2020年第1号)[EB/OL]. (2020-01-03)[2021-08-20]. https://www.nmpa.gov.cn/yaopin/ypggtg/ypqtgg/20200107151901190.html.
|
| [4] |
国家药品监督管理局. 真实世界数据用于医疗器械临床评价技术指导原则(试行)的通告2020年第77号[EB/OL]. (2020-11-24)[2021-08-20]. https://www.nmpa.gov.cn/xxgk/ggtg/qtggtg/20201126090030150.html.
|
| [5] |
国家药品监督管理局药品审评中心. 真实世界研究支持儿童药物研发与审评的技术指导原则(试行)的通告(2020年第22号)[EB/OL]. (2020-08-27)[2021-08-20]. https://www.nmpa.gov.cn/xxgk/ggtg/qtggtg/20200901104448101.html.
|
| [6] |
国家药品监督管理局药品审评中心. 用于产生真实世界证据的真实世界数据指导原则(试行)[EB/OL]. (2021-04-13)[2021-08-20]. http://www.cde.org.cn/news.do?method=largeInfo&id=eaed86b800e8d9d9.
|
| [7] |
任燕, 梁远波, 刘密密, 等. 构建博鳌乐城创新药械真实世界数据研究体系: 基于我国首个使用境内真实世界数据获批上市的医疗器械研究的探讨[J]. 中国循证医学杂志, 2020, 20(10): 1117-1123. Ren Y, Liang YB, Liu MM, et al. Exploration and practice of real-world data studies on innovative medical products in Boao Lecheng: analysis based on Chinese first case of approved medical device using domestic real-world data[J]. Chin J Evid Based Med, 2020, 20(10): 1117-1123. DOI:10.7507/1672-2531.202007133 |
| [8] |
The Food and Drug Administration. Framework for FDA's real-world evidence program[EB/OL]. [2021-08-20]. https://www.fda.gov/science-research/science-and-research-special-topics/real-world-evidence.
|
| [9] |
Sherman RE, Anderson A, Dal Pan GJ, et al. Real-world evidence-what is it and what can it tell us?[J]. N Engl J Med, 2016, 375(23): 2293-2297. DOI:10.1056/NEJMsb1609216 |
| [10] |
Sun X, Tan J, Tang L, et al. Real world evidence: experience and lessons from China[J]. BMJ, 2018, 360: j5262. DOI:10.1136/bmj.j5262 |
| [11] |
姚明宏, 贾玉龙, 任燕, 等. 特许医疗政策下的药械真实世界数据研究常见设计及其关键考虑[J]. 中华流行病学杂志, 2021, 42(7): 1306-1311. Yao MH, Jia YL, Ren Y, et al. Real-world data studies of medical products in the context of special healthcare policy: study designs and key considerations[J]. Chin J Epidemiol, 2021, 42(7): 1306-1311. DOI:10.3760/cma.j.cn112338-20210201-00085 |
| [12] |
任燕, 姚明宏, 姚晨, 等. 特许创新药械在博鳌乐城开展真实世界数据研究的模式探索[J]. 中国食品药品监管, 2020(11): 14-20. Ren Y, Yao MH, Yao C, et al. Exploration of framework for real world data studies on special innovative medical products in Boao Lecheng[J]. China Food Drug Admin Magaz, 2020(11): 14-20. DOI:10.3969/j.issn.1673-5390.2020.11.002 |
| [13] |
王雯, 高培, 吴晶, 等. 构建基于既有健康医疗数据的研究型数据库技术规范[J]. 中国循证医学杂志, 2019, 19(7): 763-770. Wang W, Gao P, Wu J, et al. Technical guidance for developing research databases using existing health and medical data[J]. Chin J Evid Based Med, 2019, 19(7): 763-770. DOI:10.7507/1672-2531.201904160 |
| [14] |
谭婧, 彭晓霞, 舒啸尘, 等. 患者登记数据库构建技术规范[J]. 中国循证医学杂志, 2019, 19(7): 771-778. Tan J, Peng XX, Shu XC, et al. Technical guidance for developing patient registry databases[J]. Chin J Evid Based Med, 2019, 19(7): 771-778. DOI:10.7507/1672-2531.201904161 |
| [15] |
Ventz S, Lai A, Cloughesy TF, et al. Design and evaluation of an external control arm using prior clinical trials and real-world data[J]. Clin Cancer Res, 2019, 25(16): 4993-5001. DOI:10.1158/1078-0432.Ccr-19-0820 |
| [16] |
Burcu M, Dreyer NA, Franklin JM, et al. Real-world evidence to support regulatory decision-making for medicines: Considerations for external control arms[J]. Pharmacoepidemiol Drug Saf, 2020, 29(10): 1228-1235. DOI:10.1002/pds.4975 |
| [17] |
晋菲斐, 姚晨, 马军, 等. 高效可行的临床真实世界数据采集模式探索——海南博鳌乐城国际医疗旅游先行区的实践[J]. 中国食品药品监管, 2020(11): 21-31. Jin FF, Yao C, Ma J, et al. Explore efficient and feasible clinical real world data collection mode in Hainan Boao Lecheng international medical tourism Pilot Zone[J]. China Food Drug Admin Magaz, 2020(11): 21-31. DOI:10.3969/j.issn.1673-5390.2020.11.003 |
| [18] |
Cammel SA, de Vos MS, van Soest D, et al. How to automatically turn patient experience free-text responses into actionable insights: a natural language programming (NLP) approach[J]. BMC Med Inform Decis Mak, 2020, 20(1): 97. DOI:10.1186/s12911-020-1104-5 |
| [19] |
Group GCP Inspectors Working. Reflection paper on expectations for electronic source data and data transcribed to electronic data collection tools in clinical trials[EB/OL]. (2010-06-09)[2021-08-20]. https://www.ema.europa.eu/en/documents/regulatory-procedural-guideline/reflection-paper-expectations-electronic-source-data-data-transcribed-electronic-data-collection_en.pdf.
|
| [20] |
王雯, 刘艳梅, 谭婧, 等. 回顾性数据库研究的概念、策划与研究数据库构建[J]. 中国循证医学杂志, 2018, 18(2): 230-237. Wang W, Liu YM, Tan J, et al. Concept and planning of retrospective database study and development of research database[J]. Chin J Evid Based Med, 2018, 18(2): 230-237. DOI:10.7507/1672-2531.201712085 |
| [21] |
Management Society for Clinical Data. Good clinical data management practices[EB/OL]. [2021-08-20]. https://scdm.org/gcdmp/.
|
| [22] |
董冲亚, 姚晨, 高嵩, 等. 加强医院临床研究源数据管理, 提高我国临床研究数据质量[J]. 中国循证医学杂志, 2019, 19(11): 1255-1261. Dong CY, Yao C, Gao S, et al. Strengthening clinical research source data management in hospitals to promote data quality of clinical research in China[J]. Chin J Evid Based Med, 2019, 19(11): 1255-1261. DOI:10.7507/1672-2531.201908047 |
| [23] |
国家食品药品监管总局. 总局关于发布临床试验的电子数据采集技术指导原则的通告(2016年第114号)[EB/OL]. (2016-07-29)[2021-08-20]. https://www.nmpa.gov.cn/directory/web/nmpa/xxgk/ggtg/qtggtg/20160729184001958.html.
|
| [24] |
国家食品药品监管总局. 总局关于发布临床试验数据管理工作技术指南的通告(2016年第112号)[EB/OL]. (2016-07-29)[2021-08-20]. https://www.nmpa.gov.cn/yaopin/ypggtg/ypqtgg/20160729183801891.html.
|
| [25] |
Consortium Clinical Data Interchange Standards. CDISC standards in the clinical research process[EB/OL]. [2021-08-20]. https://www.cdisc.org/standards.
|
| [26] |
陈蔚, 刘密密, 梁远波, 等. 博鳌乐城眼科特许医疗器械真实世界研究实践与临床医生的思考[J]. 中国食品药品监管, 2020(11): 32-35. Chen W, Liu MM, Liang YB, et al. The practice of real world research of ophthalmic licensed medical devices in Boao Lecheng and reflection of clinicians[J]. China Food Drug Admin Magaz, 2020(11): 32-35. DOI:10.3969/j.issn.1673-5390.2020.11.004 |
| [27] |
谭婧, 刘兴会, 孙鑫. 基于真实世界数据的疾病管理研究[J]. 协和医学杂志, 2019, 10(3): 284-288. Tan J, Liu XH, Sun X. Research on disease management based on real-world data[J]. Med J Peking Union Med College Hosp, 2019, 10(3): 284-288. DOI:10.3969/j.issn.1674-9081.2019.03.017 |
| [28] |
Gliklich RE, Dreyer NA, Leavy MB. Quality Agency for Healthcare Research and Registries for evaluating patient outcomes: a user's guide[M]. 3rd ed. Rockville: Agency for Healthcare Research and Quality (AHRQ), 2014.
|
| [29] |
彭晓霞, 舒啸尘, 谭婧, 等. 基于真实世界数据评价治疗结局的观察性研究设计技术规范[J]. 中国循证医学杂志, 2019, 19(7): 779-786. Peng XX, Shu XC, Tan J, et al. Technical guidance for designing observational studies to assess therapeutic outcomes using real-world data[J]. Chin J Evid Based Med, 2019, 19(7): 779-786. DOI:10.7507/1672-2531.201904164 |
| [30] |
James S, Rao SV, Granger CB. Registry-based randomized clinical trials-a new clinical trial paradigm[J]. Nat Rev Cardiol, 2015, 12(5): 312-316. DOI:10.1038/nrcardio.2015.33 |
| [31] |
王雯, 谭婧, 任燕, 等. 重新认识真实世界数据研究: 更新与展望[J]. 中国循证医学杂志, 2020, 20(11): 1241-1246. Wang W, Tan J, Ren Y, et al. Real-world data studies: update and future development[J]. Chin J Evid Based Med, 2020, 20(11): 1241-1246. DOI:10.7507/1672-2531.202006183 |
| [32] |
高国彪. 创新助力临床真实世界数据研究在乐城先行区的应用试点[J]. 中国食品药品监管, 2020(11): 6-13. Gao GB. Facilitating the clinical real world data research application in the Hainan Boao Lecheng international medical tourism pilot zone through multi-dimentional innovation[J]. China Food Drug Admin Magaz, 2020(11): 6-13. DOI:10.3969/j.issn.1673-5390.2020.11.001 |
 2022, Vol. 43
2022, Vol. 43