文章信息
- 徐晶, 袁满琼, 方亚.
- Xu Jing, Yuan Manqiong, Fang Ya
- 基于联合模型的老年人轻度认知功能障碍发病风险预测研究
- Research on predicting the risk of mild cognitive impairment in the elderly based on the joint model
- 中华流行病学杂志, 2022, 43(2): 269-276
- Chinese Journal of Epidemiology, 2022, 43(2): 269-276
- http://dx.doi.org/10.3760/cma.j.cn112338-20210620-00484
-
文章历史
收稿日期: 2021-06-20
轻度认知功能障碍(mild cognitive impairment,MCI)是介于正常老化与痴呆的中间状态,其中遗忘型MCI(aMCI)亦是发生阿尔茨海默病(Alzheimer's disease,AD)的高危因素。在临床中aMCI进展为AD的年转化率为11.0%~16.5%[1],是正常老年人的10倍。相反,在实施合理的干预措施后,MCI向正常认知逆转的概率可达53%[2]。可见,MCI是一个风险高、不稳定的阶段,是AD防治的最佳“干预窗口期”,因此早期识别MCI并进行发病风险预测显得尤为重要。在认知相关研究中,认知功能评估量表如简易精神状态量表(mini mental state examination,MMSE)、Rey听觉词语学习测验(Rey auditory verbal learning test,RAVLT)等常作为判断认知障碍是否发生的工具。在相关随访调研中通常会收集认知功能评估指标重复测量的纵向数据或记录认知障碍发生时间的生存数据[3],然而现有预测模型多数仅对纵向数据或生存数据单独建模,忽略了纵向数据与生存数据之间的潜在关联。本研究基于AD神经影像学倡议(Alzheimer's disease neuroimaging initiative,ADNI)长达15年的纵向数据,考虑个体纵向认知功能评估指标的动态变化及与时间终点事件MCI发生之间的关联性,利用联合模型构建并比较基于6种不同认知功能测量量表的老年人MCI发病风险预测模型,为实现老年人MCI风险预测提供依据。
对象与方法1. 研究对象:数据提取自ADNI数据库(https://ida.loni.usc.edu)里“ADNIMERGE”文件中2005-2020年的数据。ADNI是一项始于2004年的纵向多中心研究,覆盖美国和加拿大的57个地区,参与者年龄≥55岁。该数据库收集了正常老化、MCI和AD 3个阶段的老年人的认知功能评估、生物学标记物、神经影像学和遗传学等数据。其中正常老化、MCI和AD的诊断标准详见ADNI数据库操作手册(http://adni.loni.usc.edu/wp-content/uploads/2010/09/ADNI_GeneralProceduresManual.pdf)。
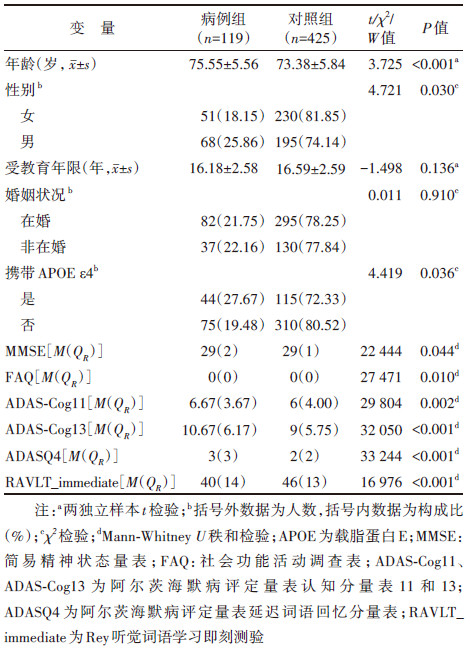
选取基线认知状态诊断为正常老化且至少完成了一次随访追踪的老年人(≥60岁)作为研究对象。以随访期间发生MCI为终末事件,随访期间认知状态进展为MCI的参与者视为病例组,但剔除由正常老化直接进展为AD状态后逆转为MCI的个体,最终纳入病例119名;诊断结果始终保持正常老化状态的参与者视为对照组,同时为确保数据的有效性,要求对照组的随访时间≥24个月,最终纳入对照425名。
2. 研究方法:模型预测因子包括基线协变量和纵向认知功能评估指标。
基线协变量:包括年龄、性别、受教育年限、婚姻状况以及是否携带载脂蛋白E(APOE)ε4基因。
纵向认知功能评估量表:①MMSE:该量表涉及定向力、注意力、计算能力、即刻与延迟听觉词语记忆、视空间、语言等测试项目,得分范围为0~30,分值越高说明被测试者认知功能越好。②社会功能活动调查表(functional activities questionnaire,FAQ):该量表用于评估受试者在日常生活中完成10项社会技能的能力,以此来反映受试者的社会功能障碍程度,得分范围为0~30,分数越高表明社会功能状况越差。③AD评定量表认知分量表(Alzheimer's disease assessment scale-cognitive,ADAS-Cog):该量表常用于抗痴呆治疗试验的疗效评估,包含11或13个测试项目,ADAS-Cog13由单词回忆、命名物体、命令、结构性练习、意向性练习、定向力、单词辨认、回忆测验指令、口语能力、找词困难、语言理解力、延迟词语回忆和注意力13个项目组成,相较于ADAS-Cog11增加了延迟词语回忆项和注意力项。两种量表得分范围分别为0~70/0~85,分值越高说明被测试者认知功能越差。④AD评定量表延迟词语回忆分量表(ADAS delayed word recall,ADASQ4):是ADAS-Cog中的延迟回忆测试项目。评分者一次向被试者显示10个单词,并要求被试者在提出所有单词后,回忆尽可能多的单词。约5 min后,再次要求被试者回忆同样的10个单词,并记录未能正确回忆的单词数,得分范围为0~10,分值越高表明记忆能力越差。⑤Rey听觉词语学习即刻测验(RAVLT_immediate):用于测试情景记忆的神经心理学工具。RAVLT包括即刻回忆和延迟回忆两个维度,该量表前5个部分用于评估即时回忆,满分为75分,得分越高表明记忆能力越好。
3. 统计学分析:
(1)描述性分析:服从正态分布的计量资料采用x±s进行描述,组间比较采用两独立样本t检验;不服从正态分布的计量资料通过M(QR)进行统计描述,组间比较采用Mann-Whitney U秩和检验。计数资料采用率进行描述,组间比较采用χ2检验。以P < 0.05为差异有统计学意义。
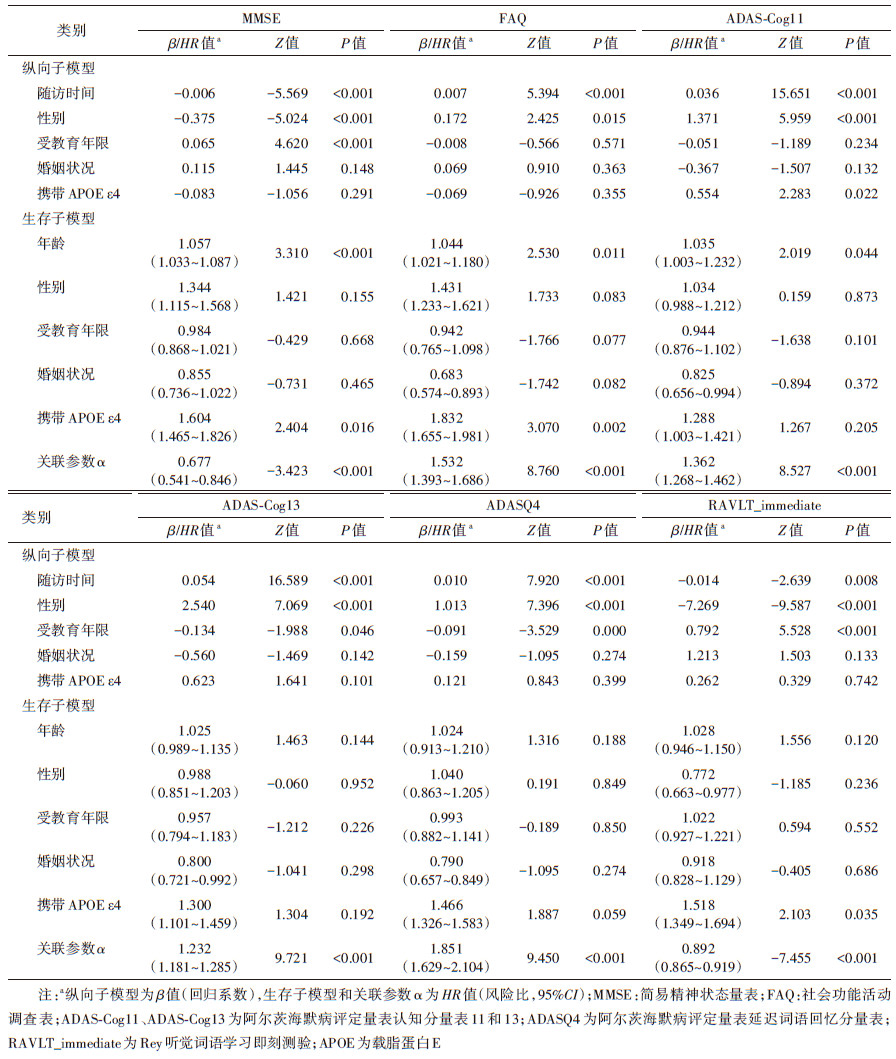
(2)联合模型:由纵向子模型和生存子模型通过共享参数联合构成。其中,纵向子模型采用线性混合模型描述纵向认知功能评估指标的轨迹及其与基线协变量的关联,生存子模型采用比例风险模型评估MCI的发生风险及其预测因子的影响,其预测因子包括基线协变量和纵向认知功能评估指标。通过关联参数(α)将上述两种模型同时组合到一个统计模型中,以同时分析纵向认知功能评估指标变化轨迹和基线协变量对结局事件MCI发生风险的影响。通常联合模型一次只能分析一个纵向指标,因此在单独的联合模型中分析上述每个纵向指标,并且基于单个纵向指标和基线协变量对MCI发生风险进行预测。
纵向子模型选取线性混合模型,表示为:
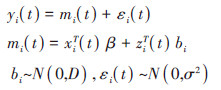
式中,yi(t)表示个体i的纵向认知功能评估指标在时间点t的观测值,mi(t)表示yi(t)在时间点t潜在的(不可观测的)真实值,,εi(t)表示随机误差,且满足εi(t) ~N(0,σ2)。mi(t)可分解为固定效应和随机效应两部分,xiT和ziT分别表示固定效应和随机效应设计矩阵的行向量,改变协变量值的影响由对应回归系数向量β和bi表示。
生存子模型选择比例风险模型,表示为:

其中,t > 0;h(t,ω)表示具有协变量ω的个体i在t时刻的风险函数;Mi(t)表示mi在t时刻之前真实的(未观察到的)纵向过程轨迹;ωi为个体i的基线协变量向量(年龄、性别、受教育年限、婚姻状况、APOE ε4基因型),γ为对应的回归系数向量;h0(t)表示基线风险函数,即所有ω都取值为0时个体在t时刻的瞬时风险率;α为两个子模型的关联参数,量化了真实的纵向评估指标mi(t)变化对MCI发生风险的影响;exp(γi)表示在时间t内基线协变量变化一个单位的风险比,exp(α)表示在时间t内真实的纵向评估指标mi(t)每增加一个单位,生存风险增加到exp(α)倍。模型的参数估计采用极大似然估计法。
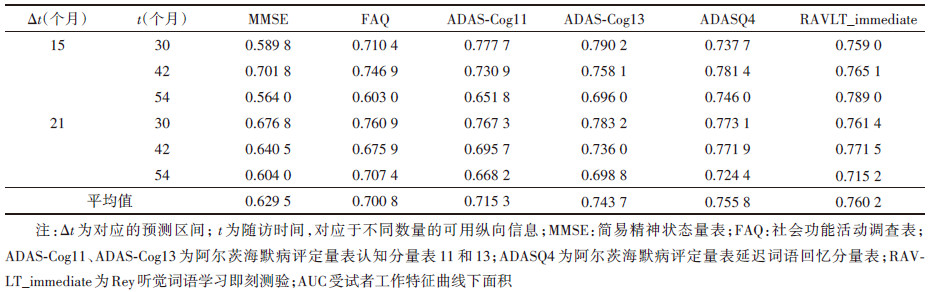
(3)模型预测效能:采用受试者工作特征曲线下面积(AUC)评价联合模型的预测能力,AUC值越高表明模型预测准确度越好。通过计算研究对象在不同随访时间窗(t,t+Δt)的AUC值,比较基于6种纵向认知功能评估指标的联合模型在随访期间不同时间对MCI发生风险预测的准确性。具体来说,AUC值评估了模型使用随访至第t个月剩余的正常老化个体(未进展为MCI)之前的观察信息来预测他们在(t,t+Δt)之间MCI发生风险的能力。起点t选择第30、42、54个月,Δt对应不同的预测区间,选择15和21个月。进一步选取预测效能(AUC平均值)较高的联合模型进行MCI发生风险个体动态预测。
(4)分析软件:采用SPSS 22.0软件进行基线资料的统计描述,采用R 4.0.2软件中的“JM”程序包拟合联合模型及预测效果评价。
结果1. 一般情况:最终共纳入研究对象544名,随访过程中119名(21.9%)研究对象发生MCI。正常老化向MCI的转归时间为(49.76±31.68)个月,其中最短为6个月,最长为144个月。共有425名(78.1%)研究对象仍保持正常老化状态,视为对照组。对照组随访时间为(59.69±37.46)个月,其中最短为24个月,最长为168个月。相比于对照组,病例组的基线平均年龄较高。男性、APOE ε4携带者MCI的发生率较高。病例组的MMSE和RAVLT_immediate评分低于对照组,FAQ、ADAS-Cog11、ADAS-Cog13和ADASQ4评分高于对照组,均提示病例组的基线认知水平低于对照组。见表 1。
2. 不同纵向认知功能评估指标的联合模型结果:在联合模型中,纵向子模型部分引入随访时间、性别、受教育年限、婚姻状况和携带APOE ε4基因;生存子模型部分引入年龄、性别、受教育年限、婚姻状况、携带APOE ε4基因和单个纵向认知功能评估指标。不同纵向认知评估指标的联合模型结果见表 2。纵向子模型分析显示,随着随访时间推进,MMSE和RAVLT_immediate得分下降(β值分别为-0.006和-0.014),FAQ、ADAS-Cog11、ADAS- Cog13和ADASQ4得分增加(β值分别为0.007、0.036、0.054和0.010),均提示老年人认知功能随时间推移逐渐下降(P < 0.001)。在生存子模型部分,6个模型中的关联参数α均有统计学意义(P < 0.001)。MMSE、FAQ、ADAS-Cog11、ADAS-Cog13、ADASQ4、RAVLT_immediate评分每纵向增加1分,MCI的发生风险对应降低32.3%(HR=0.677,95%CI:0.541~0.846),增加53.2%(HR=1.532,95%CI:1.393~1.686),增加36.2%(HR=1.362,95%CI:1.268~1.462),增加23.2%(HR=1.232,95%CI:1.181~1.285),增加85.1%(HR=1.851,95%CI:1.629~2.104),降低10.8%(HR=0.892,95%CI:0.865~0.919)。
3. 基于不同认知功能测量指标的联合模型预测效能比较:通过计算研究对象在第30、42、54个月的时间相关AUC值比较各纵向认知功能评估指标对MCI发生风险的预测准确性,同时计算AUC平均值,综合评价各模型的预测能力。在(t,t+Δt)的随访时间内,RAVLT_immediate和ADASQ4具有较高的平均预测效能,AUC平均值分别为0.760 2和0.755 8;之后依次为ADAS-Cog13、ADAS-Cog11、FAQ,其AUC平均值分别为0.743 7、0.715 3、0.700 8;MMSE的平均预测效能最差,其AUC平均值为0.629 5。见表 3。
4. 个体预测:根据AUC评价结果,RAVLT_immediate和ADASQ4的联合模型对MCI发生风险的预测能力较强,但考虑到认知检查所带来的时间消耗,ADASQ4可能比RAVLT_immediate可能更具有时间经济性和临床实用性。因此选取基于ADASQ4的联合模型进行MCI发病风险个体预测。随机选取1名研究对象示例,该个体74岁进入队列,男性,受教育年限为16年,已婚,不携带APOE ε4,目前已随访36个月且均为正常老化状态,根据该个体随访前36个月的ADASQ4变化来预测随访60个月后(79岁)及120个月后(84岁)的MCI发病风险。该个体79岁发生MCI的平均概率(1-生存概率)为8%,84岁发生MCI的平均概率为40%。见图 1。
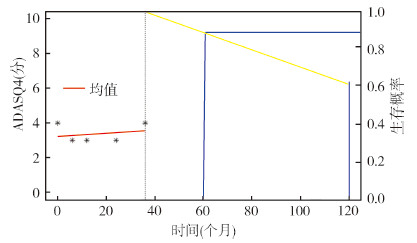
|
| 注:ADASQ4:阿尔茨海默病评定量表延迟词语回忆分量表;*代表该个体在随访前36个月的ADASQ4变化,红线代表ADASQ4平均值;黄线代表该个体轻度认知功能障碍发生概率,蓝线分别对应个体79岁和84岁的轻度认知功能障碍发生概率 图 1 个体轻度认知功能障碍风险动态预测 |
本研究基于6种不同纵向认知功能评估指标构建联合模型,预测老年人MCI发生风险并比较不同模型的预测效能。结果表明,6种指标纵向轨迹与MCI发生风险均相关,且基于RAVLT_immediate和ADASQ4的联合模型对MCI发生风险的预测能力较强,而MMSE与FAQ的预测效果相对较弱。
仅针对记忆的测验量表RAVLT_immediate与ADASQ4在预测MCI发生风险的准确性上优于其他总体认知评估指标,这可能与MCI的认知障碍主要表现为记忆损害有关,情景记忆被认为是AD最早出现的认知功能减退的领域。本研究中RAVLT_immediate对MCI发生风险的预测能力较强,平均AUC值为0.760 2。同样地,国内有学者发现RAVLT_immediate能较好地区分MCI和正常老化,AUC值为0.833,并被推荐用于筛查MCI[4]。已有研究证实RAVLT是最敏感的情景记忆测试之一,其得分可较好地反映AD引起的潜在病理变化,从而使RAVLT成为在主观记忆障碍人群中识别MCI和AD的有效早期标记[5]。此外,Moradi等[6]使用弹性网线性回归模型发现RAVLT_immediate与AD引起的脑萎缩密切相关,其准确性与基于MRI的生物标志物相当。ADASQ4为ADAS-Cog中的延迟回忆测试,有研究发现该记忆测试部分可作为相对独立的因子,反映受试者记忆功能[7],延迟词语回忆项目在区分MCI和正常老年人方面相对于ADAS-Cog总分表现较好[8],这与本结果一致,即ADASQ4的预测能力高于ADAS-Cog11和ADAS-Cog13。多数研究认为,延迟回忆为情景记忆中最具诊断意义的指标,但本研究即刻回忆RAVLT_immediate的AUC平均值略高于ADASQ4,这种结果差异可能与预测区间Δt的选取有限相关。若考虑到认知检查所带来的时间消耗,ADASQ4可能比RAVLT_immediate更具有时间经济性和临床实用性,因此更推荐使用ADASQ4来预测MCI发生风险。
ADAS-Cog11和ADAS-Cog13对MCI发病风险也表现出适度的预测能力。ADAS-Cog目前广泛用于AD患者认知障碍的纵向观察以及AD药物疗效评价。近年来ADAS-Cog得到推广应用于MCI[9],但其应用仍存在争议。Pyo等[10]认为ADAS-Cog可以准确地区分MCI和正常老年人,但多数学者认为ADAS-Cog具有“天花板效应”,即ADAS-Cog对MCI与正常对照老年人的区分并不理想,且对文化程度较高的老年人可能存在假阴性,不建议使用ADAS-Cog筛选MCI[8]。同时,相较ADASQ4,ADAS-Cog耗时较长,且过于强调语言功能,需要被试者文化程度在小学以上,有基本的阅读书写能力,因此本研究同样不推荐将其作为预测MCI发生风险的工具。
MMSE和FAQ对MCI发病风险未表现出较好的预测能力,可能的原因:首先,MMSE本为痴呆筛查所设计,认知负载不大,其用于痴呆筛查的价值高于MCI;同时,MCI患者的记忆损害主要表现为延迟性情景记忆障碍[11],而MMSE中的延迟记忆测试项目未能充分体现“延迟”这一特点,其瞬时记忆和延迟回忆测试项目之间间隔时间较短(仅穿插连续减法这一测试,对于注意力未明显受损的MCI患者数秒即可完成该项测试[12]),导致MMSE识别MCI的敏感性较低。有研究通过荟萃分析得出其识别MCI与正常老年人的敏感度仅为63.4%,特异度仅为65.4%[13]。再者,MCI患者日常生活能力基本完好,仅复杂的日常或社会功能存在轻度损害[14],因此仅以FAQ中涉及的社会功能状况对MCI与正常老年人进行区分的效果不佳。但也有研究显示,记住购物清单、约会、整理邮件和书信往来、记录日程等能力显著下降或完成相同日常活动的时间显著增加,均可预示MCI的发生[15]。
本研究应用联合模型预测MCI发生风险的优势如下:一是将纵向数据和生存数据合并到一个统计模型中,揭示了纵向认知功能评估指标的动态变化与MCI发生之间的关联性;二是通过对生存数据建模同时调整间歇性测量的纵向结果,解决了线性混合效应模型无法单独处理因信息丢失导致的数据缺失问题;三是联合模型基于纵向数据的预测是动态性质,动态预测随着纵向信息的收集被不断更新,因此相比Cox比例回归模型仅基于基线信息的标准预测其可提供更准确的预测。
本研究存在局限性。首先,预测因子的选择尚不全面,未考虑与MCI发生相关的生化指标(淀粉样蛋白,tau蛋白等)和神经影像学指标;未纳入常见的MCI筛查量表蒙特利尔认知评估量表。在未来的研究中,需纳入更为全面的因子以提高预测准确性;其次,联合模型只能纳入单个纵向标记,导致模型总体预测能力并不理想。若将认知功能与社会功能评估指标结合起来,可能对MCI的识别效果会更加理想。对此,Chang等[16]也提出RAVLT在结合定向测验后对MCI的预测效果更佳。因此,未来研究可扩展到包括多个纵向标记的联合模型,以确定模型中预测MCI风险的最优组合[17]。
综上所述,本研究建议使用ADASQ4或RAVLT_immediate作为MCI发病风险的纵向认知功能评估指标构建联合模型,进行老年人MCI发病风险动态预测。对正常认知或主观抱怨记忆力下降的老年人群进行定期认知功能随访评估,有助于早期识别MCI高危人群。
利益冲突 所有作者声明无利益冲突
作者贡献声明 徐晶:采集数据、分析和解释数据、论文撰写;袁满琼:数据整理、统计学分析、技术和材料支持;方亚:对文章的知识性内容作批评性审阅、经费支持
| [1] |
Ward A, Tardiff S, Dye C, et al. Rate of conversion from prodromal Alzheimer's disease to Alzheimer's dementia: a systematic review of the literature[J]. Dement Geriatr Cognit Disord Extra, 2013, 3(1): 320-332. DOI:10.1159/000354370 |
| [2] |
Wood H. Alzheimer disease: Meta-analysis finds high reversion rate from MCI to normal cognition[J]. Nat Rev Neurol, 2016, 12(4): 189. DOI:10.1038/nrneurol.2016.29 |
| [3] |
王旭霞. 基于联合模型的认知功能和社会功能对阿尔茨海默病风险预测研究[D]. 太原: 山西医科大学, 2019. Wang XX. Risk prediction of Alzheimer's disease with cognitive and functional measures: a joint modeling approach[D]. Taiyuan: Shanxi Medical University, 2019. |
| [4] |
刘园园, 肖世富, 王涛, 等. 中文版成套神经心理测验诊断轻度认知损害的临床应用[J]. 中华临床医师杂志: 电子版, 2011, 5(9): 2554-2558. Liu YY, Xiao SF, Wang T, et al. Clinical application of Chinese version of neuropsychological test battery in the dignosis of mild cognitive impairment in the elderly objectives[J]. Chin J Clinic: Electr Ed, 2011, 5(9): 2554-2558. DOI:10.3877/cma.j.issn.1674-0785.2011.09.011 |
| [5] |
Simard DM, van Reekum R. Memory assessment in studies of cognition-enhancing drugs for Alzheimer's disease[J]. Drugs Aging, 1999, 14(3): 197-230. DOI:10.2165/00002512-199914030-00004 |
| [6] |
Moradi E, Hallikainen I, Hänninen T, et al. Rey's auditory verbal learning test scores can be predicted from whole brain MRI in Alzheimer's disease[J]. NeuroImage Clin, 2017, 13: 415-427. DOI:10.1016/j.nicl.2016.12.011 |
| [7] |
郭起浩, 王蓓, 洪震, 等. ADAS评估阿尔茨海默病的认知功能研究[J]. 神经疾病与精神卫生, 2003, 3(4): 251-253. Guo QH, Wang B, Hong Z, et al. Study on assessing cognitive function impairment of Alzheimer's disease by ADAS[J]. J Neurosci Ment Health, 2003, 3(4): 251-253. DOI:10.3969/j.issn.1009-6574.2003.04.002 |
| [8] |
李霞, 肖世富, 李华芳, 等. 轻度认知功能障碍、轻度阿尔茨海默病和正常对照老人的ADAS-Cog中文版评分比较[J]. 中国心理卫生杂志, 2010, 24(6): 425-429, 439. Li X, Xiao SF, Li HF, et al. Comparison of Chinese version of ADAS-Cog scores among the elderly with mild cognitive impairment, Alzheimer's disease and normal control[J]. Chin Ment Health J, 2010, 24(6): 425-429, 439. DOI:10.3969/j.issn.1000-6729.2010.06.009 |
| [9] |
Benge JF, Balsis S, Geraci L, et al. How well do the ADAS-cog and its subscales measure cognitive dysfunction in Alzheimer's disease[J]. Dement Geriatr Cognit Disord, 2009, 28(1): 63-69. DOI:10.1159/000230709 |
| [10] |
Pyo G, Elble RJ, Ala T, et al. The characteristics of patients with uncertain/mild cognitive impairment on the Alzheimer disease assessment scale-cognitive subscale[J]. Alzheimer Dis Assoc Disord, 2006, 20(1): 16-22. DOI:10.1097/01.wad.0000201846.22213.76 |
| [11] |
周卫东, 贾建平, 魏岗之. 轻度认知损害研究进展[J]. 中华神经科杂志, 2002, 35(1): 49-51. Zhou WD, Jia JP, Wei GZ. Progress of mild cognitive impairment[J]. Chin J Neurol, 2002, 35(1): 49-51. DOI:10.3760/j.issn:1006-7876.2002.01.026 |
| [12] |
孙云闯, 秦斌. 中文版MoCA和MMSE在诊断遗忘型轻度认知功能障碍中的应用[J]. 中国神经免疫学和神经病学杂志, 2011, 18(2): 91-93, 97. Sun YC, Qin B. The application of Montreal cognitive assessment in amnestic mild cognitive impairment[J]. Chin J Neuroimmunol Neurol, 2011, 18(2): 91-93, 97. DOI:10.3969/j.issn.1006-2963.2011.02.005 |
| [13] |
Mitchell AJ. A meta-analysis of the accuracy of the mini-mental state examination in the detection of dementia and mild cognitive impairment[J]. J Psychiatr Res, 2009, 43(4): 411-431. DOI:10.1016/j.jpsychires.2008.04.014 |
| [14] |
Wadley VG, Okonkwo O, Crowe M, et al. Mild cognitive impairment and everyday function: evidence of reduced speed in performing instrumental activities of daily living[J]. Am J Geriatr Psychiatry, 2008, 16(5): 416-424. DOI:10.1097/01.JGP.0000310780.04465.13 |
| [15] |
Marshall GA, Zoller AS, Kelly KE, et al. Everyday cognition scale items that best discriminate between and predict progression from clinically normal to mild cognitive impairment[J]. Curr Alzheimer Res, 2014, 11(9): 853-861. DOI:10.2174/1567205011666141001120903 |
| [16] |
Chang YL, Bondi MW, Fennema-Notestine C, et al. Brain substrates of learning and retention in mild cognitive impairment diagnosis and progression to Alzheimer's disease[J]. Neuropsychologia, 2010, 48(5): 1237-1247. DOI:10.1016/j.neuropsychologia.2009.12.024 |
| [17] |
He B, Luo S. Joint modeling of multivariate longitudinal measurements and survival data with applications to Parkinson's disease[J]. Statist Methods Med Res, 2016, 25(4): 1346-1358. DOI:10.1177/0962280213480877 |
 2022, Vol. 43
2022, Vol. 43