文章信息
- 冯永亮, 韩雨洁, 姚添, 王建民, 柳红婷, 郭红萍, 柴国伟, 刘黎明, 王富珍, 王素萍.
- Feng Yongliang, Han Yujie, Yao Tian, Wang Jianmin, Liu Hongting, Guo Hongping, Chai Guowei, Liu Liming, Wang Fuzhen, Wang Suping
- 慢性肾脏病患者不同免疫方案接种乙型肝炎疫苗的免疫效果及影响因素分析
- Immunogenicity and influencing factors of hepatitis B vaccination based on different vaccination schedules among chronic kidney disease patients
- 中华流行病学杂志, 2022, 43(2): 241-247
- Chinese Journal of Epidemiology, 2022, 43(2): 241-247
- http://dx.doi.org/10.3760/cma.j.cn112338-20210807-00618
-
文章历史
收稿日期: 2021-08-07
2. 临汾市中心医院肾内科, 临汾 041000;
3. 运城市中心医院肾内科, 运城 044000;
4. 临汾市人民医院肾内科, 临汾 041081;
5. 侯马市人民医院肾内科, 侯马 043011;
6. 中国疾病预防控制中心免疫规划中心, 北京 100050
2. Department of Nephrology, Linfen Central Hospital, Linfen 041000, China;
3. Department of Nephrology, Yuncheng Central Hospital, Yuncheng 044000, China;
4. Department of Nephrology, Linfen People's Hospital, Linfen 041081, China;
5. Department of Nephrology, Houma People's Hospital, Houma 043011, China;
6. Department of National Immunization Program, Chinese Center for Disease Control and Prevention, Beijing 100050, China
HBV感染是全球重大公共卫生问题,截至2019年,全球约有2.96亿HBV慢性感染者[1]。我国是HBV感染的中流行区,乙型肝炎表面抗原(HBsAg)携带者达8 600万[2]。慢性肾脏病(chronic kidney disease,CKD)患者由于自身先天性和获得性免疫功能障碍、慢性炎症、内皮细胞功能障碍或服用激素/免疫抑制剂类药物等原因,处于免疫抑制状态[3-6],HBV感染风险高。截至2017年我国CKD患者已超过1.32亿[7],加强该人群HBV感染的防治是实现2030年消除病毒性肝炎目标的重要内容。接种乙肝疫苗是预防HBV感染最有效的措施。CKD患者按常规免疫方案(0-1-6月20 µg)接种乙肝疫苗后乙型肝炎表面抗体(抗-HBs)阳性率为46%~75%[8],低于普通人群(90%~95%),且抗-HBs消减较快[9]。优化CKD患者乙肝疫苗的免疫方案,提高该人群免疫效果是降低其HBV感染的关键所在。增加接种针次和(或)剂量是提高免疫效果最简单可行的方式。目前国内未见CKD患者乙肝疫苗优化方案的研究报道,国外仅有几项研究证实该人群同时增加接种针次(0-1-2-6月)和剂量(40 μg)抗-HBs阳性率为50.6%~89.7%[8, 10-11],多数免疫效果不佳、缺乏抗-HBs消减的观察,且未进行优化方案后免疫效果影响因素的研究。结合国内外研究现状及我国的《慢性乙型肝炎防治指南(2019年版)》建议[12],本研究分析不同免疫方案对CKD患者接种乙肝疫苗的免疫效果及影响因素,为制定和优化高危人群乙肝疫苗免疫方案提供参考依据。
对象与方法1. 研究对象:来自2019年5月至2020年7月山西省4家医院(运城市中心医院、临汾市人民医院、临汾市中心医院和侯马市人民医院)参加随机对照试验的CKD患者[13],年龄18~70岁、HBsAg、抗-HBs和乙肝核心抗体(hepatitis B core antibody,抗-HBc)均阴性,均签署知情同意书。本研究经山西医科大学伦理委员会审批(批准文号:2019007)。
2. 乙肝疫苗免疫方案:研究对象按1∶1∶1比例采用区组随机分为3组(每组91人),分别接受0-1-6月20 µg、0-1-2-6月20 µg、0-1-2-6月60 µg乙肝疫苗全程接种。乙肝疫苗为由深圳康泰生物制品股份有限公司生产的重组酵母乙肝疫苗(批号:B201809043和A201805008)。
3. 资料收集:采用面对面问卷调查并结合病历查阅的方法,收集研究对象社会人口学特征、CKD疾病特征、治疗史及乙肝疫苗接种史等信息。
4. 血样采集与检测:乙肝疫苗全程接种后1个月和6个月,采集研究对象的非抗凝肘静脉血5 ml,采用化学发光微粒子免疫分析法(chemiluminescent microparticle immunoassay,CMIA)(雅培ARCHITECT- i2000免疫发光检测仪)进行HBsAg、抗-HBs及抗-HBc的定量检测。
5. 相关定义:①抗-HBs阴性、阳性和强阳性[14]:抗-HBs浓度分别为 < 10 mIU/ml、≥10 mIU/ml和≥100 mIU/ml;②CKD诊断标准[15]:各种原因引起的慢性肾脏结构和功能障碍(肾脏损害病史 > 3个月);③CKD分期标准[肾小球滤过率(estimated glomerular filtration Rate,eGFR),ml·min-1·(1.73 m2)-1][16]:eGFR < 15、15~29、30~59、60~89和≥90分别定义为5、4、3、2和1期CKD;④接受激素/免疫抑制剂治疗:CKD患者接受基线问卷调查时正在服用该类药物。
6.统计学分析:采用EpiData 3.1软件进行数据双录入,采用SAS 9.4软件整理数据和统计学分析。符合正态分布的定量资料以x±s描述,定性资料以频数(%)描述。抗-HBs GMC采用方差分析、定性变量采用χ2检验或Fisher确切概率法进行统计推断。采用非条件logistic回归模型分析乙肝疫苗免疫效果的影响因素,各随访期CKD患者抗-HBs是否阳性作为因变量,结合单因素分析有统计学意义和文献报道的相关因素,进行多因素分析。双侧检验,检验水准α=0.05。
结果1. 一般情况:273例CKD患者随机分组到0-1-6月20 µg、0-1-2-6月20 µg、0-1-2-6月60 µg的3个组中,每组91例,分别有77例(84.61%)、75例(82.42%)和78例(85.71%)完成乙肝疫苗全程接种。全程接种后1个月随访共215例,年龄(50.7±10.4)岁,年龄范围18~70岁。男性和女性分别占58.60%和41.40%。已婚占95.35%,农村户籍占74.88%,家庭人均月收入 < 1 000元占49.30%。原发疾病为肾病综合征者125例(58.14%),患病时间 < 3年者167例(77.67%),接受激素/免疫抑制剂治疗者88例(40.93%)。不同方案组均衡可比,各变量的差异均无统计学意义(P > 0.05)。完成全程接种后6个月随访的CKD患者共188例,组间均衡可比。见表 1。
2. 全程接种后1个月和6个月随访期的免疫效果:1个月随访期,0-1-6月20 µg、0-1-2-6月20 µg和0-1-2-6月60 µg组的抗-HBs阳性率分别为81.69%(58/71)、92.96%(66/71)和93.15%(68/73),抗-HBs强阳性率分别为69.01%(49/71)、83.10%(59/71)和83.56%(61/73),抗-HBs GMC(mIU/ml)分别为1 675.21、2 091.11和2 441.50。0-1-2-6月20 µg和0-1-2-6月60 µg组的抗-HBs的阳性率、强阳性率和GMC较接近(P > 0.05),均明显高于0-1-6月20 µg组(P < 0.05)。与1个月随访期相比,6个月随访期的抗-HBs强阳性率和GMC均有所下降,0-1-2-6月60 µg组的抗-HBs强阳性率和GMC均明显高于0-1-2-6月20 µg组(P < 0.05)和0-1-6月20 µg组(P < 0.05),0-1-2-6月60 µg组抗-HBs阳性率明显高于0-1-6月20 µg组(P < 0.05)。见表 2。1个月和6个月随访期未出现HBsAg阳性者。
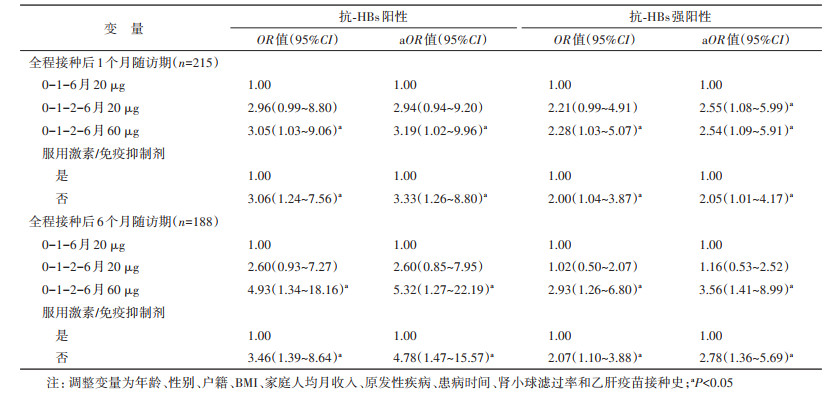
3. 乙肝疫苗免疫效果的影响因素:控制年龄、性别、户籍、BMI、家庭人均月收入、CKD疾病类型、患病时长、eGFR和乙肝疫苗接种史等潜在混杂因素后,logistic回归分析结果显示,全程接种后1个月和6个月随访期,按0-1-2-6月接种60 µg乙肝疫苗者抗-HBs阳性的概率分别是常规方案组的3.19倍(95%CI:1.02~9.96)和5.32倍(95%CI:1.27~22.19),抗-HBs强阳性的概率分别是常规方案组的2.54(95%CI:1.09~5.91)和3.56(95%CI:1.41~8.99)倍;0-1-2-6月20 µg组仅显示出与全程接种后1个月的抗-HBs强阳性率高有关(OR=2.55,95%CI:1.08~5.99)。全程接种后1个月和6个月随访期,不服用激素/免疫抑制剂者抗-HBs阳性的概率分别是服用者的3.33倍(95%CI:1.26~8.80)和4.78倍(95%CI:1.47~15.57),抗-HBs强阳性的概率分别是服用者的2.05倍(95%CI:1.01~4.17)和2.78倍(95%CI:1.36~5.69)。见表 3。
CKD患者乙肝疫苗免疫应答率低,保护性抗体抗-HBs消减较快,HBV感染风险高,是2030年消除乙肝目标的重点防控人群。然而,目前我国未见关于CKD患者不同方案乙肝疫苗免疫效果的研究报道,国外多数研究中免疫效果依然不佳、缺乏抗-HBs消减的观察,且未进行优化方案后免疫效果影响因素的研究。本研究发现,0-1-2-6月20 µg和60 µg均可提高CKD患者乙肝疫苗免疫效果,0-1-2-6月60 µg免疫方案在全程接种后6个月时抗-HBs水平及强阳性率较0-1-2-6月20 µg和0-1-6月20 µg组高。
增加接种针次和(或)剂量是提高乙肝疫苗免疫效果最常见的措施。美国免疫实践咨询委员会(ACIP)建议CKD患者接种4针Energix-B乙肝疫苗(0-1-2-6月40 µg)、3针Recombivax-HB乙肝疫苗(0-1-6月40 µg)或2针Heplisav乙肝疫苗(0-1月20 µg)[4],国外现有研究多以Energix-B乙肝疫苗免疫方案(0-1-2-6月40 µg)为主,抗-HBs阳性率有一定程度提高(50.6%~89.7%)[8, 10-11],但仍低于普通人群(90%~95%)。我国《慢性乙型肝炎防治指南(2019年版)》指出,免疫功能低下或无应答者应增加疫苗的接种剂量(60 µg)和针次[12]。目前国内外尚未见CKD患者多针次高剂量(60 µg)乙肝疫苗免疫效果的研究报道。本研究通过增加针次(0-1-2-6月20 µg)和增加针次与剂量(0-1-2-6月60 µg)提高CKD患者乙肝疫苗免疫效果,发现该人群接种0-1-2-6月20 µg或0-1-2-6月60 µg乙肝疫苗抗-HBs阳性率(92.96%和93.15%)明显高于0-1-6月20 µg组(81.69%),说明增加针次对提高CKD患者乙肝疫苗免疫效果有积极作用。
抗-HBs在体内生成后,如果缺乏相应免疫刺激,会随着时间的推移逐渐消减。健康人群按常规方案接种乙肝疫苗后有抗体应答者5年内抗-HBs水平仍能维持≥10 mIU/ml者占50%~93%,9~11年内占40%~70%[17],且存在免疫记忆,其对HBV感染的保护作用一般可持续≥30年[18]。而对于免疫功能低下者,疫苗接种后1年内抗-HBs水平仍能维持≥10 mIU/ml者不足80%[19-20],且由于免疫系统受损,可能无法迅速启动免疫记忆产生抗-HBs[21]。因此,预防CKD患者HBV感染的发生主要依赖于体内抗-HBs水平[21]。既往研究表明,全程接种后抗-HBs的峰值水平是抗-HBs维持的重要因素之一,抗-HBs水平较高者,其抗-HBs的维持时间长[4, 22]。同时,欧洲疫苗接种咨询机构指出抗-HBs≥100 mIU/ml是保护免疫功能低下者预防HBV感染所必需的[23]。本研究中,CKD患者按0-1-2-6月接种60 µg乙肝疫苗后抗-HBs GMC和强阳性率水平较高,虽在全程接种后6月时有所降低,但依然维持在较高水平。提示接种多针次高剂量(0-1-2-6月60 µg)乙肝疫苗有助于提高CKD患者抗-HBs水平及持久性。此外,由于患者体内抗体存在消减,提示在着力优化方案的同时,应加强CKD患者抗-HBs监测,必要时及时补种乙肝疫苗,减少HBV感染的风险。
服用激素或免疫抑制剂是CKD患者的常规治疗方法。激素或免疫抑制剂对机体免疫功能具有抑制作用,其通过抑制与免疫反应有关细胞的增殖和功能,降低机体免疫反应[24]。研究发现,与健康成年人相比,接受免疫抑制剂治疗的患者其抗-HBs水平和阳性率均较低,免疫持久性也较差[25]。一项肾移植患者的研究发现,服用免疫抑制剂者即使接种多针次和高剂量乙肝疫苗(0-1-2-6月40 μg),抗-HBs阳性率也较低(38.9%,14/36)[26]。王福珍等[27]对1~3期CKD患者的研究发现,服用激素/免疫抑制剂与不服用者按0-1-6月10 μg方案接种乙肝疫苗后抗-HBs阳性率(94.7%与85.0%)差异无统计学意义,但该研究的样本量较小。本研究发现,在全程接种后1个月和6个月随访期不服用激素/免疫抑制剂者的抗-HBs阳性的概率分别是服用者的3.33(95%CI:1.26~8.80)和4.78(95%CI:1.47~15.57)倍,说明服用激素/免疫抑制剂者乙肝疫苗免疫效果不佳。因此,CKD患者宜尽早接种乙肝疫苗,尤其应关注服用激素/免疫抑制剂者。
本研究存在不足。一是仅对CKD患者全程接种后半年进行随访,尚不能确定免疫持久性及影响因素,需进行长时间随访;二是存在失访,样本量减少;三是激素/免疫抑制剂服用情况资料来自基线调查,随着病程发展处于动态变化中,结果可能受到影响。
综上所述,0-1-2-6月20 µg和0-1-2-6月60 µg乙肝疫苗免疫方案均可提高CKD患者免疫效果,且0-1-2-6月60 µg免疫方案对该人群抗-HBs水平的维持有积极作用。服用激素/免疫抑制剂的CKD患者乙肝疫苗免疫效果不佳。建议对CKD患者尽早接种多针次和/或高剂量乙肝疫苗,应特别关注服用激素/免疫抑制剂的CKD患者,预防HBV感染。
利益冲突 所有作者声明无利益冲突
作者贡献声明 冯永亮:研究设计、论文撰写、数据整理、数据分析、论文修改;韩雨洁、姚添:数据整理、数据分析、论文修改;王建民、柳红婷、郭红萍、柴国伟、刘黎明:现场调查实施;王富珍:研究设计、研究指导;王素萍:研究设计、研究指导、论文修改、经费支持
| [1] |
World Health Organization. Global progress report on HIV, viral hepatitis and sexually transmitted infections, 2021[EB/OL]. (2021-05-27)[2021-07-07]. https://www.who.int/publications/i/item/9789240027077.
|
| [2] |
The Polaris Observatory Collaborators. Global prevalence, treatment, and prevention of hepatitis B virus infection in 2016:a modelling study[J]. Lancet, 2018, 3(6): 383-403. DOI:10.1016/S2468-1253(18)30056-6 |
| [3] |
Syed-Ahmed M, Narayanan M. Immune dysfunction and risk of infection in chronic kidney disease[J]. Adv Chronic Kidney Dis, 2019, 26(1): 8-15. DOI:10.1053/j.ackd.2019.01.004 |
| [4] |
Krueger KM, Ison MG, Ghossein C. Practical guide to vaccination in all stages of CKD, including patients treated by dialysis or kidney transplantation[J]. Am J Kidney Dis, 2020, 75(3): 417-425. DOI:10.1053/j.ajkd.2019.06.014 |
| [5] |
Kato S, Chmielewski M, Honda H, et al. Aspects of immune dysfunction in end-stage renal disease[J]. Clin J Am Soc Nephrol, 2008, 3(5): 1526-1533. DOI:10.2215/CJN.00950208 |
| [6] |
Unger JK, Peters H. Hepatitis B in chronic kidney disease: moving toward effective prevention[J]. Kidney Int, 2008, 73(7): 799-801. DOI:10.1038/ki.2008.57 |
| [7] |
GBD Chronic Kidney Disease Collaboration. Global, regional, and national burden of chronic kidney disease, 1990-2017:a systematic analysis for the Global Burden of Disease Study 2017[J]. Lancet, 2020, 395(10225): 709-733. DOI:10.1016/S0140-6736(20)30045-3 |
| [8] |
Dimitrov Y, Ducher M, Kribs M, et al. Variables linked to hepatitis B vaccination success in non-dialyzed chronic kidney disease patients: Use of a Bayesian model[J]. Nephrol Thér, 2019, 15(4): 215-219. DOI:10.1016/j.nephro.2019.02.010 |
| [9] |
Chan TM. Hepatitis B and renal disease[J]. Curr Hepat Rep, 2010, 9(2): 99-105. DOI:10.1007/s11901-010-0042-6 |
| [10] |
Ahmadi F, Ramezani M, Razeghi E, et al. A randomized controlled trial of two schedules of hepatitis B vaccination in predialysed chronic renal failure patients[J]. Hepat Mon, 2012, 12(5): 344-348. DOI:10.5812/hepatmon.6438 |
| [11] |
Ghadiani MH, Besharati S, Mousavinasab N, et al. Response rates to HB vaccine in CKD stages 3-4 and hemodialysis patients[J]. J Res Med Sci, 2012, 17(6): 527-533. |
| [12] |
中华医学会感染病学分会, 中华医学会肝病学分会. 慢性乙型肝炎防治指南(2019年版)[J]. 中华肝脏病杂志, 2019, 27(12): 938-961. Chinese Society of Infectious Diseases, Chinese Medical Association, Chinese Society of Hepatology, Chinese Medical Association. The guidelines of prevention and treatment for chronic hepatitis B (2019 version)[J]. Chin J Hepatol, 2019, 27(12): 938-961. DOI:10.3760/cma.j.issn.1007-3418.2019.12.007 |
| [13] |
Feng YL, Yao T, Han YJ, et al. Immunogenicity and safety of a high-dose and prolonged-schedule hepatitis B vaccine among chronic kidney disease patients: a randomized, parallel-controlled trial[J]. Expert Rev Vaccines, 2021, 20(6): 743-751. DOI:10.1080/14760584.2021.1915777 |
| [14] |
杨志清, 郝海昀, 史晓红, 等. HBsAg阳性母亲HBV感染状况与婴儿乙肝疫苗无/弱应答的关系[J]. 中华流行病学杂志, 2018, 39(6): 805-809. Yang ZQ, Hao HY, Shi XH, et al. Relationship between the HBsAg-positive infection status of mothers and the non/low-response to hepatitis B vaccine of their infants[J]. Chin J Epidemiol, 2018, 39(6): 805-809. DOI:10.3760/cma.j.issn.0254-6450.2018.06.021 |
| [15] |
Stevens PE, Levin A. Evaluation and management of chronic kidney disease: synopsis of the kidney disease: improving global outcomes 2012 clinical practice guideline[J]. Ann Intern Med, 2013, 158(11): 825-830. DOI:10.7326/0003-4819-158-11-201306040-00007 |
| [16] |
Ma YC, Zuo L, Chen JH, et al. Modified glomerular filtration rate estimating equation for Chinese patients with chronic kidney disease[J]. J Am Soc Nephrol, 2006, 17(10): 2937-2944. DOI:10.1681/ASN.2006040368 |
| [17] |
Leuridan E, van Damme P. Hepatitis B and the need for a booster dose[J]. Clin Infect Dis, 2011, 53(1): 68-75. DOI:10.1093/cid/cir270 |
| [18] |
Bruce MG, Bruden D, Hurlburt D, et al. Antibody levels and protection after hepatitis B vaccine: results of a 30-year follow-up study and response to a booster dose[J]. J Infect Dis, 2016, 214(1): 16-22. DOI:10.1093/infdis/jiv748 |
| [19] |
Yao T, Shao ZH, Wu LN, et al. Long-term persistent immunogenicity after successful standard and triple-dosed hepatitis B vaccine in hemodialysis patients: A 3-year follow-up study in China[J]. Vaccine, 2021, 39(18): 2537-2544. DOI:10.1016/j.vaccine.2021.03.074 |
| [20] |
Launay O, Rosenberg AR, Rey D, et al. Long-term immune response to hepatitis B virus vaccination regimens in adults with human immunodeficiency virus 1:secondary analysis of a randomized clinical trial[J]. JAMA Intern Med, 2016, 176(5): 603-610. DOI:10.1001/jamainternmed.2016.0741 |
| [21] |
Tong NKC, Beran J, Kee SANN, et al. Immunogenicity and safety of an adjuvanted hepatitis B vaccine in pre-hemodialysis and hemodialysis patients[J]. Kidney Int, 2005, 68(5): 2298-2303. DOI:10.1111/j.1523-1755.2005.00689.x |
| [22] |
European Consensus Group on Hepatitis B Immunity. Are booster immunisations needed for lifelong hepatitis B immunity?[J]. Lancet, 2000, 355(9203): 561-565. DOI:10.1016/S0140-6736(99)07239-6 |
| [23] |
Salisbury DM, Begg NT. Immunisation against infectious disease[M]. London: HMSO, 2019.
|
| [24] |
Eickenberg S, Mickholz E, Jung E, et al. Mycophenolic acid counteracts B cell proliferation and plasmablast formation in patients with systemic lupus erythematosus[J]. Arthritis Res Ther, 2012, 14(3): R110. DOI:10.1186/ar3835 |
| [25] |
Ma BM, Yap DYH, Yip TPS, et al. Vaccination in patients with chronic kidney disease—Review of current recommendations and recent advances[J]. Nephrology (Carlton), 2021, 26(1): 5-11. DOI:10.1111/nep.13741 |
| [26] |
Lefebure AF, Verpooten GA, Couttenye MM, et al. Immunogenicity of a recombinant DNA hepatitis B vaccine in renal transplant patients[J]. Vaccine, 1993, 11(4): 397-399. DOI:10.1016/0264-410x(93)90278-6 |
| [27] |
王福珍, 吴森超, 丘昭文, 等. 慢性肾脏病患者接种乙肝疫苗疗效研究[J]. 中国中西医结合肾病杂志, 2015, 16(5): 418-421. Wang FZ, Wu SC, Qiu ZW, et al. Chronic kidney diseases hepatitis B vaccine efficacy[J]. Chin J Integr Tradit West Nephrol, 2015, 16(5): 418-421. |
 2022, Vol. 43
2022, Vol. 43