文章信息
- 吉赛赛, 吕跃斌, 赵峰, 曲英莉, 李峥, 李亚伟, 宋士勋, 张文丽, 刘迎春, 蔡嘉旖, 宋皓璨, 李丹丹, 吴兵, 刘洋, 郑栩琳, 胡俊明, 朱英, 曹兆进, 施小明.
- Ji Saisai, Lyu Yuebin, Zhao Feng, Qu Yingli, Li Zheng, Li Yawei, Song Shixun, Zhang Wenli, Liu Yingchun, Cai Jiayi, Song Haocan, Li Dandan, Wu Bing, Liu Yang, Zheng Xulin, Hu Junming, Zhu Ying, Cao Zhaojin, Shi Xiaoming
- 我国19~79岁成年人血铅和血硒与血清超敏C反应蛋白的关联
- Association of blood lead and blood selenium with serum high-sensitivity C-reactive protein among Chinese adults aged 19 to 79 years
- 中华流行病学杂志, 2022, 43(2): 195-200
- Chinese Journal of Epidemiology, 2022, 43(2): 195-200
- http://dx.doi.org/10.3760/cma.j.cn112338-20210715-00555
-
文章历史
收稿日期: 2021-07-15
2. 南京医科大学公共卫生学院全球健康中心, 南京 211166;
3. 吉林大学公共卫生学院, 长春 130012
2. Center for Global Health, School of Public Health, Nanjing Medical University, Nanjing 211166, China;
3. School of Public Health, Jilin University, Changchun 130012, China
C反应蛋白(C-reactive protein,CRP)是肝脏表达和分泌的一种非特异性的急性期蛋白,是一种炎症生物标志物。超敏CRP(high-sensitivity C-reactive protein,hs-CRP)是采用超敏感检测方法测得的CRP。血清hs-CRP水平升高与心血管相关疾病风险增加密切相关[1-2],是动脉粥样硬化发生、演变和发展相关的促炎因子[3],也是缺血性中风、心肌梗死和心源性猝死等不良心血管事件的独立预测因子[4]。既往有研究发现,相较于低水平铅暴露人群,高水平铅暴露人群中血清hs-CRP浓度增加[5]。慢性铅暴露可能通过诱导氧化应激和炎症反应增加心血管疾病的发生和死亡风险[6-8]。而微量营养素可能会降低有毒金属对心血管疾病相关的炎症生物标志物的影响[9-11]。硒作为一种人体必需的微量元素,是氧化还原反应酶的重要辅基,能够清除炎症过程产生的自由基,并能通过降低炎性介质的表达来抵抗炎症[12]。硒是否能够抑制铅暴露导致的心血管疾病相关的炎性生物标志物升高需进一步研究。因此,本研究基于中国国家人体生物监测项目(China National Human Biomonitoring,CNHBM)第一轮调查数据,分析我国19~79岁成年人中血铅和血硒及其交互作用与血清hs-CRP的关联。
对象与方法1. 研究对象:来自CNHBM,采用多阶段分层抽样方法,在全国31个省份抽取152个县(区)作为监测点,在每个监测点抽取3个社区(村)作为调查单元,在每个抽取的调查单元中,按照年龄(3~、6~、12~、19~、40~和60~79岁)和性别划分成12层,每层随机抽取4名调查对象,共抽取了21 888名调查对象(152个监测点×3个调查单元×2个性别×6个年龄组×4名参与者=21 888名)构成全国代表性样本。具体抽样方法和步骤参见文献[13-14]。CNHBM于2017-2018年完成了第一轮横断面调查,共完成10 903名19~79岁调查对象的信息收集和生物样本采集。排除未采血者19名、hs-CRP结果缺失者286名、处于临床活跃期的炎症状态者(hs-CRP > 10 mg/L)290名[4, 15],以及其他变量缺失者171名,最终本研究纳入10 153名调查对象(这些缺失的调查对象有重复,如hs-CRP结果缺失的人可能同时缺失其他变量)。CNHBM已通过中国CDC环境与健康相关产品安全所伦理委员会审查(批准文号:201701),所有研究对象和/或其监护人均签署书面知情同意书。
2. 研究方法:
(1)问卷调查:调查员通过面对面访谈的方式收集调查对象的一般人口学特征和生活行为方式(吸烟、饮酒等)等信息。
(2)体格检查:由临床医生采用统一的测量仪器测量调查对象的体重和身高。
(3)实验室检测:现场采集调查对象空腹静脉血,部分样本在-80 ℃的条件下保存运输,由CNHBM重点实验室按照统一的标准操作程序(Standard Operating Procedures)采用电感耦合等离子体质谱法检测全血中的铅和硒水平,由迪安医学检验中心统一检测本研究纳入调查对象的血清hs-CRP水平。
(4)相关指标定义:hs-CRP > 3.0 mg/L定义为升高[15];BMI=体重(kg)/身高(m)2,BMI < 18.5 kg/m2为低体重,18.5 kg/m2≤BMI < 24.0 kg/m2为正常体重,24.0 kg/m2≤BMI < 28.0 kg/m2为超重,BMI≥28.0 kg/m2为肥胖[16]。
3. 统计学分析:采用SAS 9.4软件进行数据分析。血铅和血硒的检出限分别是0.4 μg/L和1.4 μg/L,低于检出限的数据用检出限除以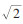
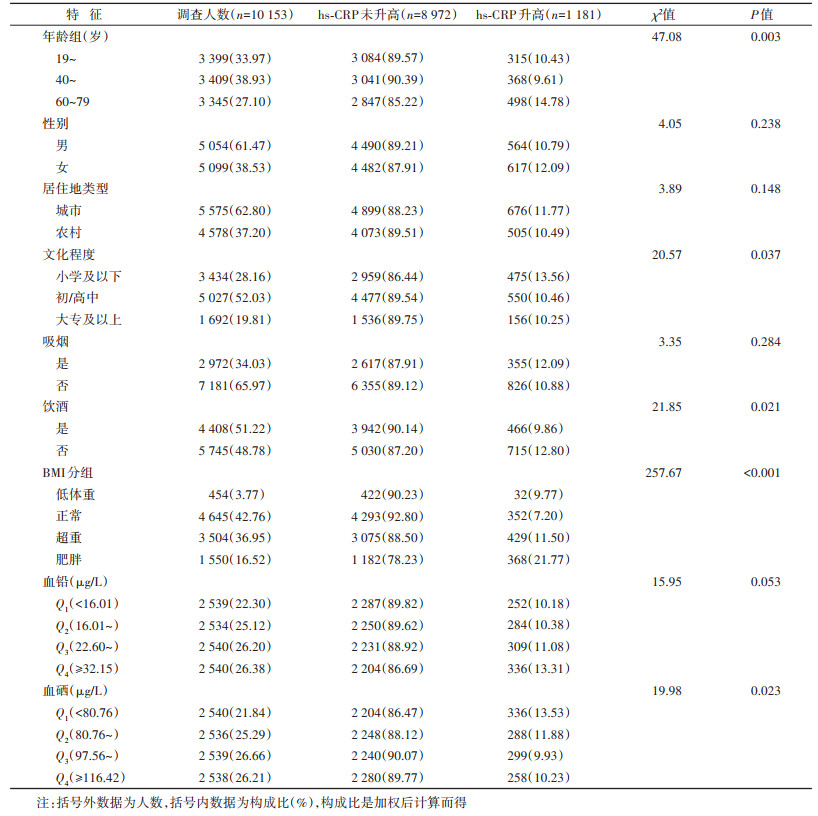
1. 基本情况:10 153名调查对象的年龄为(48.91±15.38)岁,其中男性5 054名(61.47%),hs-CRP升高者1 181名(11.29%)。调查对象血铅和血硒水平的M(Q1,Q3)分别为23.41(16.70,32.72)μg/L和99.08(83.30,117.74)μg/L。不同年龄组、文化程度、是否饮酒、BMI和血硒水平调查对象的hs-CRP升高率差异有统计学意义(均P < 0.05),血硒水平处于Q1组者hs-CRP升高率最高。见表 1。
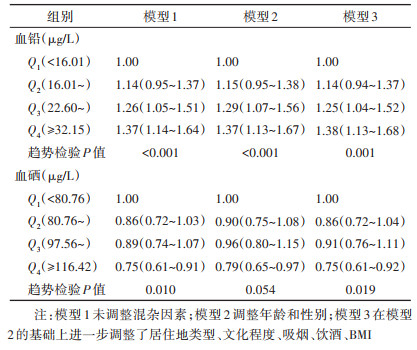
2. 血铅和血硒水平与血清hs-CRP升高的关系:在调整了相关混杂因素后,与血铅水平处于Q1组者相比较,Q2、Q3和Q4组者hs-CRP升高的OR值(95%CI)分别为1.14(0.94~1.37)、1.25(1.04~1.52)和1.38(1.13~1.68);与血硒水平处于Q1组者相比较,Q2、Q3和Q4组者hs-CRP升高的OR值(95%CI)分别为0.86(0.72~1.04)、0.91(0.76~1.11)和0.75(0.61~0.92)。见表 2。
RCS的结果显示,在调整了相关混杂因素后,血铅水平与hs-CRP升高风险呈正向线性相关(总关联P=0.006),血硒水平与hs-CRP升高风险呈负向线性相关(总关联P=0.050)。见图 1。
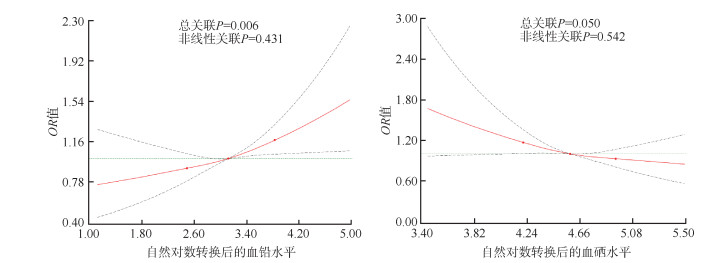
|
| 注:红色实线表示基于限制性立方样条的OR值,黑色虚线表示OR值的95%CI,绿色虚线为参照线 图 1 我国19~79岁成年人血铅和血硒水平与血清超敏C反应蛋白升高的限制性立方样条图 |
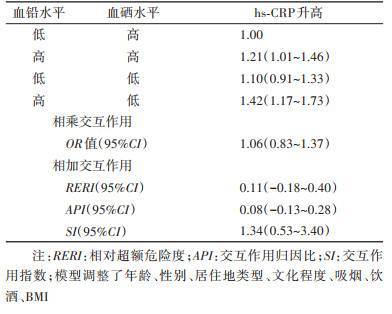
3. 血铅和血硒对血清hs-CRP升高的交互作用:多变量logistic回归结果显示,在调整了相关混杂因素后,血铅和血硒对血清hs-CRP升高的相乘交互作用的OR值(95%CI)为1.06(0.83~1.37);相加交互作用分析结果显示,RERI和API的95%CI均包含0,SI的95%CI包含1。未发现血铅和血硒对hs-CRP升高存在相乘和相加交互作用。见表 3。
本研究基于CNHBM具有全国代表性的人群样本数据分析了我国19~79岁成年人中血铅和血硒水平与血清hs-CRP升高的关联,并探索了血硒对血铅与hs-CRP升高关联的影响。研究结果显示,我国19~79岁成年人中血铅水平与血清hs-CRP升高存在正向关联,血硒水平与hs-CRP升高存在负向关联,未发现血铅和血硒水平对血清hs-CRP升高的相乘和相加交互作用。
本研究中发现的血铅与hs-CRP升高的关联与Sirivarasai等[5]基于泰国成年人的研究结果相似,基于慢性铅暴露工人的研究中也观察到类似结果[18]。但Songdej等[19]基于美国国家健康与营养调查(1999-2004年)的研究未观察到研究人群中血铅与CRP存在统计学关联。研究结果的差异可能与美国人群血铅平均水平低于中国人群[20],以及hs-CRP较CRP更为灵敏有关。既往有关血硒水平与CRP关联的结果与本研究结果相似[11, 21]。
铅暴露可能通过促进炎症反应和氧化应激增加hs-CRP浓度。体外实验和动物实验的研究表明,铅暴露能够增加促炎细胞因子的表达,促进炎症反应[22]。此外,铅暴露可以增加机体脂质过氧化和活性氧的产生,而脂质过氧化和活性氧可进一步诱导炎症反应[22-23],从而增加hs-CRP等炎症生物标志物的浓度。由硒参与构成的谷胱甘肽过氧化物酶和磷脂谷胱甘肽过氧化物酶是机体重要的抗氧化酶,能够清除活性氧,减少脂质过氧化物产生,降低炎症反应[24]。硒同时能够通过抑制NF-κB信号通路,抑制肿瘤坏死因子-α和白细胞介素6等炎性介质表达,在慢性炎症中发挥重要作用[24]。因此推测,硒可能通过清除铅暴露诱导氧化应激产生的活性氧来降低由此导致的炎症反应。但本研究未发现血铅和血硒对血清hs-CRP升高的统计学交互作用。研究结果提示,硒对铅暴露导致的炎症反应可能没有效应修饰作用;但也可能是由于本研究中仅将血铅和血硒水平按照中位值分为高、低两个水平分析相乘和相加交互作用,以及样本量较少等问题未观察到铅和硒的统计学交互作用。以后需要更多的前瞻性研究来分析硒对铅暴露导致炎症反应的影响。
本研究是基于全国人群范围的随机抽样研究,人群代表性较好。本研究同时存在一定的局限性,首先,本研究为横断面研究,发现的血铅和血硒与血清hs-CRP升高的关系需要进一步验证;其次,可能存在其他潜在的混杂因素未调整;最后,未评估外源性营养素补充剂的影响。
综上所述,本研究发现血铅水平与血清hs-CRP升高存在正向关联,未发现血铅和血硒对hs-CRP升高的统计学交互作用。hs-CRP是机体重要的炎症生物标志物,研究结果可能对防治重金属相关的不良健康结局有重要的提示作用。未来需要更多的研究来探索微量营养元素对重金属导致的机体氧化损伤和炎症反应的影响。
利益冲突 所有作者声明无利益冲突
作者贡献声明 吉赛赛:研究设计、采集数据、分析/解释数据、论文撰写;吕跃斌、赵峰、曲英莉:采集数据、分析/解释数据、论文修改;李峥、李亚伟、宋士勋、张文丽、刘迎春、蔡嘉旖:实施研究、采集数据;宋皓璨、李丹丹、吴兵、刘洋、郑栩琳:实施研究、清理数据;胡俊明、朱英、曹兆进:审阅、研究指导;施小明:研究指导、论文修改、经费支持
| [1] |
董莹, 王增武, 王馨, 等. 中国中年人群超敏C反应蛋白与心血管事件、总死亡事件的关联研究[J]. 中华流行病学杂志, 2018, 39(4): 428-432. Dong Y, Wang ZW, Wang X, et al. Association between high-sensitivity C-reactive protein and both cardiovascular, total mortality events in middle-aged Chinese adults[J]. Chin J Epidemiol, 2018, 39(4): 428-432. DOI:10.3760/cma.j.issn.0254-6450.2018.04.008 |
| [2] |
Denegri A, Boriani G. High sensitivity C-reactive protein (hsCRP) and its implications in cardiovascular outcomes[J]. Curr Pharm Des, 2021, 27(2): 263-275. DOI:10.2174/1381612826666200717090334 |
| [3] |
Castro AR, Silva SO, Soares SC. The use of high sensitivity C-reactive protein in cardiovascular disease detection[J]. J Pharm Pharm Sci, 2018, 21(1): 496-503. DOI:10.18433/jpps29872 |
| [4] |
Avan A, Sany SBT, Ghayour-Mobarhan M, et al. Serum C-reactive protein in the prediction of cardiovascular diseases: overview of the latest clinical studies and public health practice[J]. J Cell Physiol, 2018, 233(11): 8508-8525. DOI:10.1002/jcp.26791 |
| [5] |
Sirivarasai J, Wananukul W, Kaojarern S, et al. Association between inflammatory marker, environmental lead exposure, and glutathione S-transferase gene[J]. Biomed Res Int, 2013, 2013: 474963. DOI:10.1155/2013/474963 |
| [6] |
Navas-Acien A, Guallar E, Silbergeld EK, et al. Lead exposure and cardiovascular disease-a systematic review[J]. Environ Health Perspect, 2007, 115(3): 472-482. DOI:10.1289/ehp.9785 |
| [7] |
Vaziri ND. Mechanisms of lead-induced hypertension and cardiovascular disease[J]. Am J Physiol Heart Circ Physiol, 2008, 295(2): H454-465. DOI:10.1152/ajpheart.00158.2008 |
| [8] |
Chen C, Li Q, Nie XM, et al. Association of lead exposure with cardiovascular risk factors and diseases in Chinese adults[J]. Environ Sci Pollut Res, 2017, 24(28): 22275-22283. DOI:10.1007/s11356-017-9884-6 |
| [9] |
Bakulski KM, Park SK, Weisskopf MG, et al. Lead exposure, B vitamins, and plasma homocysteine in men 55 years of age and older: the VA normative aging study[J]. Environ Health Perspect, 2014, 122(10): 1066-1074. DOI:10.1289/ehp.1306931 |
| [10] |
Pollack AZ, Mumford SL, Sjaarda L, et al. Blood lead, cadmium and mercury in relation to homocysteine and C-reactive protein in women of reproductive age: a panel study[J]. Environ Health, 2017, 16(1): 84. DOI:10.1186/s12940-017-0293-6 |
| [11] |
Yuan Y, Long PP, Liu K, et al. Multiple plasma metals, genetic risk and serum C-reactive protein: a metal-metal and gene-metal interaction study[J]. Redox Biol, 2020, 29: 101404. DOI:10.1016/j.redox.2019.101404 |
| [12] |
刘成龙, 田宗仁, 张克, 等. 硒蛋白生理功能研究综述[J]. 中国食品学报, 2021, 21(2): 358-366. Liu CL, Tian ZR, Zhang K, et al. Review of physiological function of selenoprotein[J]. J Chin Inst Food Sci Technol, 2021, 21(2): 358-366. DOI:10.16429/j.1009-7848.2021.02.043 |
| [13] |
曹兆进, 曲英莉, 赵峰, 等. 国家人体生物监测项目抽样方法及误差估计[J]. 中华流行病学杂志, 2018, 39(12): 1642-1647. Cao ZJ, Qu YL, Zhao F, et al. Sampling methods and errors appearing in the China National Human Biomonitoring Program[J]. Chin J Epidemiol, 2018, 39(12): 1642-1647. DOI:10.3760/cma.j.issn.0254-6450.2018.12.020 |
| [14] |
Cao ZJ, Lin SB, Zhao F, et al. Cohort profile: China National Human Biomonitoring (CNHBM)-A nationally representative, prospective cohort in Chinese population[J]. Environ Int, 2021, 146: 106252. DOI:10.1016/j.envint.2020.106252 |
| [15] |
Pearson TA, Mensah GA, Alexander RW, et al. Markers of inflammation and cardiovascular disease: application to clinical and public health practice: a statement for healthcare professionals from the centers for disease control and prevention and the American heart association[J]. Circulation, 2003, 107(3): 499-511. DOI:10.1161/01.cir.0000052939.59093.45 |
| [16] |
中华人民共和国国家卫生和计划生育委员会. WS/T 428-2013成人体重判定[S]. 北京: 中国标准出版社, 2013. State Health and Family Planning Commission of the People's Republic of China. WS/T 428-2013 Criteria of weight for adults[S]. Beijing: Standards Press of China, 2013. |
| [17] |
Andersson T, Alfredsson L, Källberg H, et al. Calculating measures of biological interaction[J]. Eur J Epidemiol, 2005, 20(7): 575-579. DOI:10.1007/s10654-005-7835-x |
| [18] |
Prokopowicz A, Sobczak A, Szuła-Chraplewska M, et al. Effect of occupational exposure to lead on new risk factors for cardiovascular diseases[J]. Occup Environ Med, 2017, 74(5): 366-373. DOI:10.1136/oemed-2016-103996 |
| [19] |
Songdej N, Winters PC, McCabe MJ, et al. A population-based assessment of blood lead levels in relation to inflammation[J]. Environ Res, 2010, 110(3): 272-277. DOI:10.1016/j.envres.2009.12.008 |
| [20] |
Centers for Disease Control and Prevention. Fourth national report on human exposure to environmental chemicals, 2009[R]. Atlanta, GA: U.S. Department of Health and Human Services, Centers for Disease Control and Prevention, 2009.
|
| [21] |
Ford ES, Liu S, Mannino DM, et al. C-reactive protein concentration and concentrations of blood vitamins, carotenoids, and selenium among United States adults[J]. Eur J Clin Nutr, 2003, 57(9): 1157-1163. DOI:10.1038/sj.ejcn.1601667 |
| [22] |
ATSDR (Agency for Toxic Substances and Disease Registry). Toxicological profile for lead[R]. Atlanta, GA: U.S. Department of Health and Human Services, 2020.
|
| [23] |
Mitra P, Sharma S, Purohit P, et al. Clinical and molecular aspects of lead toxicity: an update[J]. Crit Rev Clin Lab Sci, 2017, 54(7/8): 506-528. DOI:10.1080/10408363.2017.1408562 |
| [24] |
Hariharan S, Dharmaraj S. Selenium and selenoproteins: it's role in regulation of inflammation[J]. Inflammopharmacology, 2020, 28(3): 667-695. DOI:10.1007/s10787-020-00690-x |
 2022, Vol. 43
2022, Vol. 43