文章信息
- 何凤蝶, 胡亚男, 王秋童, 沙宇婷, 王丹, 王丽敏, 王宝华.
- He Fengdie, Hu Yanan, Wang Qiutong, Sha Yuting, Wang Dan, Wang Limin, Wang Baohua
- 2015年中国成年人自报癌症患者分布特征与危险因素分析
- Distribution and risk factors of self-reported cancer cases in adults in China, 2015
- 中华流行病学杂志, 2022, 43(1): 22-31
- Chinese Journal of Epidemiology, 2022, 43(1): 22-31
- http://dx.doi.org/10.3760/cma.j.cn112338-20210509-00380
-
文章历史
收稿日期: 2021-05-09
2. 中国医科大学公共卫生学院, 沈阳 110122;
3. 中国疾病预防控制中心慢性非传染性疾病预防控制中心慢病危险因素监测室, 北京 100050
2. School of Public Health, China Medical University, Shenyang 110122, China;
3. Division of Chronic Disease Risk Factors Surveillance, National Center for Chronic and Non-communicable Disease Control and Prevention, Chinese Center for Disease Control and Prevention, Beijing 100050, China
癌症已经成为严重威胁中国人群健康的主要公共卫生问题之一,根据世界卫生组织国际癌症研究机构(IARC)发布的2020年全球最新癌症负担数据,中国癌症新发病例457万例,癌症死亡占居民全部死因的23.91%[1-2]。我国 > 15岁人群中癌症患病率最高的是食管癌,其次是乳腺癌、肺癌、甲状腺癌、胃癌和肝癌[3]。目前癌症已被纳入到慢性病管理范畴,除了医疗技术的发展,提高癌症患者的生命质量逐渐被认可与重视[4-7]。因此,本研究选用2015年中国慢性病及其危险因素监测(China Chronic Disease and Risk Factors Surveillance,CCDRFS)的癌症自报数据,研究中国成年人癌症流行状况及其影响因素,为探讨癌症防控及患者管理策略提供依据。
资料与方法1. 研究对象:本研究为横断面调查。2015年CCDRFS工作在31个省(直辖市、自治区)的298个监测县(区)和新疆生产建设兵团的4个师(监测点)开展。经过专家论证,CCDRFS系统不仅具有全国、城乡、东/中/西部代表性,而且兼顾省级代表性[8]。调查对象为≥18岁常住居民(调查前12个月内在监测点累计居住6个月以上者)。排除居住在功能区(如工棚、军队、学生宿舍、养老院等)中的居民。本研究通过中国疾病预防控制中心慢性非传染性疾病预防控制中心伦理委员会审查(批准文号:201519-A)。所有参与者均签署知情同意书。
CCDRFS包括问卷调查、身体测量、实验室检测3个部分,本研究主要涉及问卷调查和身体测量两个方面的内容。问卷调查包括家庭问卷和个人问卷。由经过统一培训的调查员以面对面的方式进行调查。≥60岁人群健康相关问题,若本人回答困难,则由最熟悉其情况的家庭成员协助回答。家庭问卷内容包括家庭成员基本信息、家庭经济状况、饮食等,个人问卷包括吸烟、饮酒、饮食、身体活动状况等,身体测量内容包括身高、体重、腰围、血压、血糖、血脂等。
2. 分组及指标定义:
(1)主要自变量:吸烟、饮酒、蔬菜摄入、水果摄入、红肉摄入、高/中等强度活动频率、静坐时间,其中吸烟为现在吸烟,即调查时有吸烟行为;饮酒为过去12个月有饮酒行为。具体指标定义和计算参考文献[9]。
(2)因变量:癌症自报患病率,通过问卷调查获得各个癌症的患病人数,计算癌症自报患病率。患病率是指某特定时间内总人口中某病新旧病例之和所占的比例。对慢性病进行现况调查,最适宜计算的指标为患病率,具体计算公式见文献[10]。本研究因变量的调查问题如下:“你是否曾被县/区级及以上医疗机构诊断为癌症(包括全身恶性肿瘤和颅脑良性肿瘤)?如果有,是什么部位的癌症?”
3. 质量控制:为了保证调查结果真实可靠,中国疾病预防控制中心慢性非传染性疾病预防控制中心建立了国家、省和监测点三级的质量控制体系,在调查的前、中和后期对各个环节实施严格的质量控制,组织专家多次讨论确定数据清理和分析方案,分两组人员独立撰写数据清理程序并合并清理结果及数据分析,发现问题及时与监测点人员沟通、核对。数据项缺失、逻辑错误和不合理值比例均 < 1%。
4. 统计学分析:所有统计学分析都经过加权,以代表国家和区域的具体估计[11],这个权重比例代表了中国≥18岁成年人的基本特征。本研究通过描述性统计分析分类变量的频率和比例,采用χ2检验比较无序分类变量,采用单因素logistic回归和多因素logistic回归筛选出癌症患者可能的危险因素。将单因素分析中差异有统计学意义的变量纳入多因素分析模型,将可能的混杂因素作为协变量纳入该模型,选出最终有统计学意义的变量,分析癌症患者的具体危险因素。双侧检验,以P < 0.05为差异有统计学意义。所有的统计学分析使用SAS 9.4软件。
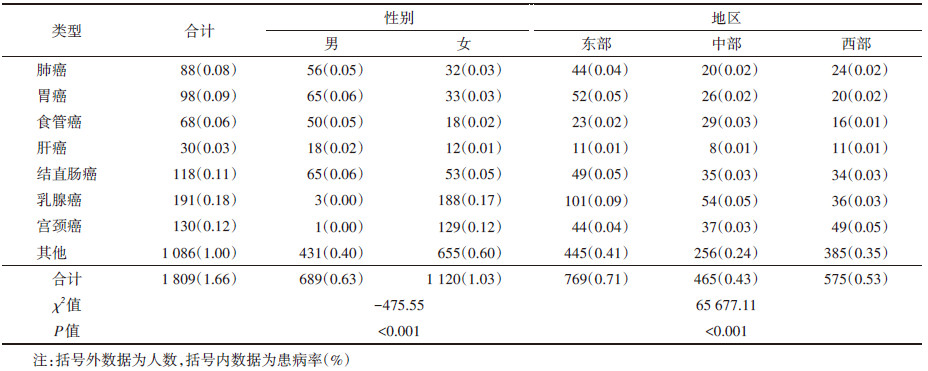
结果1. 中国成年人自报癌症分布情况:2015年,来自88 250个家庭的189 605名参与者完成了调查,家庭应答率为95.4%,个人应答率为94.9%。共有108 665人完成了癌症自报,1 809人自报患有癌症,男性689人(0.63%),女性1 120人(1.03%);东部地区769人(0.71%),中部地区465人(0.43%),西部地区575人(0.53%)。本研究癌症患病顺位为乳腺癌191人(0.18%)、宫颈癌130人(0.12%)、结直肠癌118人(0.11%)、胃癌98人(0.09%)、肺癌88人(0.08%)、食管癌68人(0.06%)、肝癌30人(0.03%),其他癌症1 086人(1.00%)。各癌症及总癌患病率性别、地区分布的组内比较χ2检验结果均有统计学意义(P < 0.001)。见表 1。
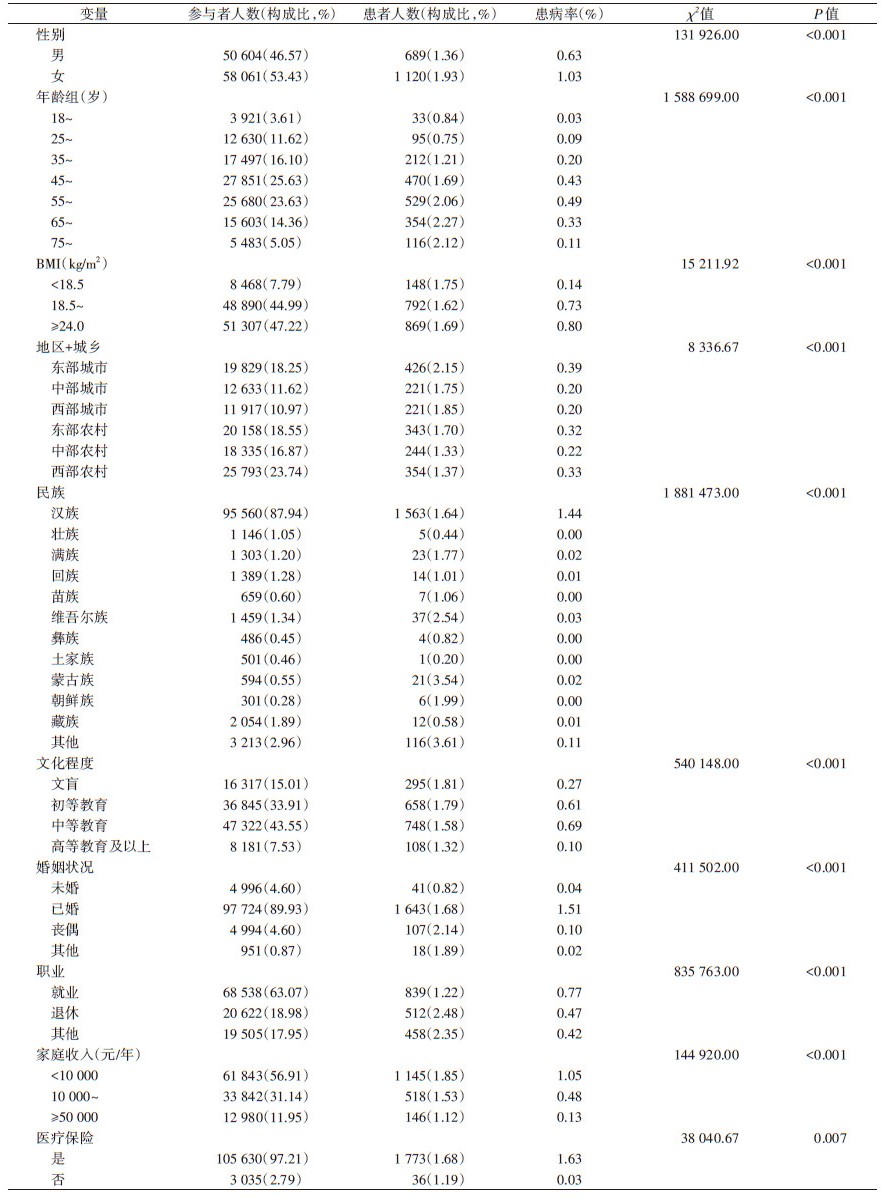
2. 中国成年人自报癌症患者基本特征分析:2015年,中国自报癌症患者中,女性癌症自报率高于男性,患病人群主要分布在45~岁及55~岁年龄组、超重或肥胖人群、东部城市地区、汉族、初等或中等教育、已婚、家庭年收入低、有医疗保险和就业的人群中。患病组与健康人群组的特征比较的χ2检验结果均有统计学意义(P < 0.05)。见表 2。
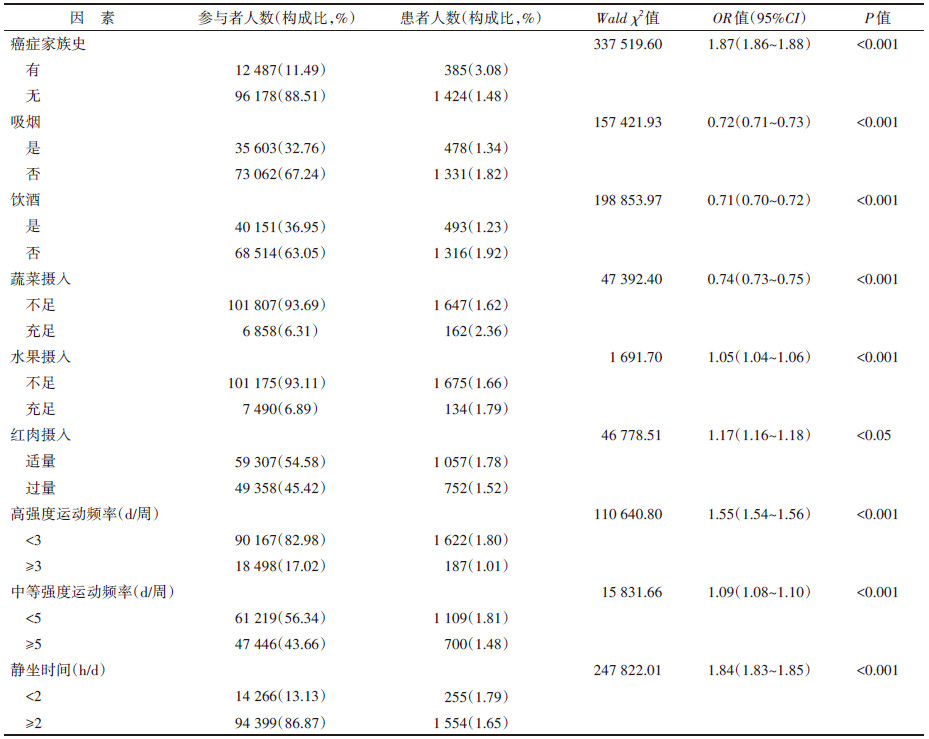
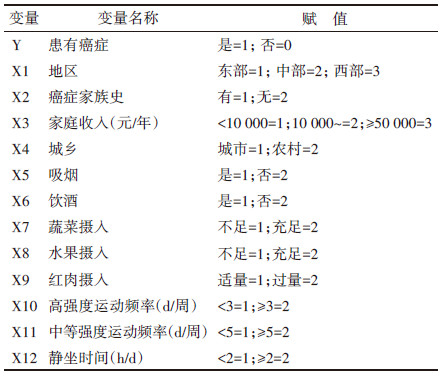
3. 中国成年人自报癌症影响因素分析:单因素logistic回归分析结果显示,所有影响因素均有统计学意义(P < 0.001)。见表 3。将所有因素纳入多因素logistic回归分析,各变量赋值情况见表 4。
多因素logistic回归结果显示,在社会经济因素方面,相对于西部,东部地区患癌风险较高(OR=1.05,95%CI:1.04~1.06),而中部地区较低(OR=0.94,95%CI:0.93~0.95);有癌症家族史的人群患癌风险高于无癌症家族史人群(OR=1.95,95%CI:1.94~1.96);家庭年收入 < 10 000元或者10 000~元的人群患癌风险高于年收入≥50 000元人群(< 10 000元:OR=1.59,95%CI:1.58~1.60;10 000~元:OR=1.27,95%CI:1.26~1.28);城市地区患癌风险低于农村地区(OR=0.98,95%CI:0.97~0.99)。在个人行为与饮食方面,吸烟人群患癌风险是不吸烟人群的1.25倍(OR=1.25,95%CI:1.24~1.26)、饮酒人群患癌风险是不饮酒人群的1.16倍(OR=1.16,95%CI:1.15~1.17)、蔬菜摄入不足和水果摄入不足人群患癌风险分别是蔬菜、水果摄入充足人群的1.29倍和1.03倍(OR=1.29,95%CI:1.28~1.30;OR=1.03,95%CI:1.02~1.04),高强度运动频率低患癌风险高于高强度运动频率较高人群(OR=1.32,95%CI:1.31~1.33),中等强度运动频率低患癌风险高于中等强度运动频率较高人群(OR=1.08,95%CI:1.07~1.09),静坐时间 < 2 h人群患癌风险高于静坐时间≥2 h人群(OR=1.69,95%CI:1.68~1.70),红肉摄入适量人群的患癌风险低于摄入过量人群(OR=0.86,95%CI:0.85~0.87)。见表 5。
癌症的发生和分布在不同地区之间存在较大差异,这种差异是由不同地区的人口构成、社会、经济、生活方式等多方面因素共同作用的结果,即使是针对某一个癌种来说,不同地区的危险因素也可能是不同的。因此,分析中国不同地区癌症流行状况及其影响因素,对制定有针对性的癌症患者管理策略有重要意义。
本研究结果显示,2015年成年人自报癌症顺位为乳腺癌、宫颈癌、结直肠癌、胃癌、肺癌、食管癌、肝癌,还有未进行分类的其他癌症。顺位与GBD2015顺位基本一致[12],宫颈癌患病率较高可能由于自2009年以来国家重大公共卫生服务项目开展农村妇女宫颈癌检查工作带来的筛查力度加大,检出率也就相对于其他癌症更高[13];此外宫颈癌的存活率也相对较高,Lancet Global Health中的一项研究数据显示,2012-2015年中国统计的宫颈癌五年生存率为59.8%[14]。据2020年最新数据显示,女性乳腺癌已超过肺癌成为世界上最常见的癌症(占全部新发病例的11.7%),居全球癌症类型的首位[15]。我国东部地区成年人患癌率高于中部和西部地区,这可能与不同地区的地理、气候、习俗、社会经济等因素不同有关[16-17]。
本研究结果显示,汉族患癌率高于其他民族。我国是多民族聚集地区,各民族间不同癌症分布亦存在差异。本研究结果与分癌症的研究中发现基本一致,因汉族人口基数较大,癌症患者数量均显著多于其他民族[18]。
社会经济的发展也是影响癌症患病的主要因素,2015年,中国成年人自报癌症患者中,东部城市地区、文化程度低、已婚、家庭年收入低、有医疗保险和就业的人群中患癌率较高。我国第1次死因调查显示,城市肝癌死亡率高于农村,但第2次和第3次农村略高于城市[19]。同样,过去肺癌在发达国家高发,如今却已成为世界各国的主要癌症,且由于发展中国家和落后国家的癌症防控措施力度不足,加上多数癌症确证时已为晚期,导致发展中国家及落后国家的癌症负担逐年增加[20]。2013年全国第五次卫生服务统计调查报告显示[21],我国95.1%的居民参加了基本医疗保险,并且就医比例达到84.5%,这可能解释了在有医疗保险人群中癌症患者数量要显著高于无医疗保险人群。
本研究结果显示,有癌症家族史人群患癌风险较高。在乳腺癌的研究中,miR146a、miR-196a2、miR-499等微小RNA[22-23]以及lncRNA HOTAIR[24]、lncRNA SRA[25]等长链非编码RNA可能与增加不同人群乳腺癌的发病风险相关。此外,女性肺癌具有家族聚集性,家族癌症史、一级亲属患肺癌病史是女性肺癌的危险因素[26-27]。因此,癌症管理不仅是对癌症患者的管理,还应包含对高危人群的引导,可将有癌症家族史的人群作为重点健康引导的对象。
本研究结果显示,吸烟人群患癌风险高于不吸烟人群。烟草制品已经在2012年被国际癌症研究机构列为1类致癌物,西方国家人群超过80%的肺癌病例与吸烟相关[1]。顾晓平等[28]的研究发现,与不吸烟者相比,吸烟者患肺癌的风险增加;吸烟≥40年者患肺癌的风险是不吸烟者的4.79倍,每日吸烟≥20支者患肺癌的风险是不吸烟者的4.44倍。此外,我国吸烟率仍保持一个较高的水平,2015年成年人烟草调查报告指出,我国15岁以上人群现在吸烟率为27.7%,男性为52.1%,女性为2.7%。农村男性现在吸烟率(55.4%)高于城市(49.0%),女性则差异不大(2.8%、2.7%)[29]。因此,在对癌症患者进行戒烟建议的同时,也需要加强控烟立法工作,并采取提高烟草价格和税率等措施,有效减少烟草制品的消费。
在本研究中,饮酒人群患癌风险是不饮酒人群的1.16倍(95%CI:1.15~1.17)。饮酒是食管鳞癌[30]、肺癌[31]、肝癌[31]、结直肠癌[32]、胃癌[33]和乳腺癌[34]等癌症的主要危险因素,这与本研究结果相一致。酒精导致癌症负担增加主要由于酒精消费量的持续增加有关。1990-2017年,全球成年人酒精人均消费量从5.9 L增至6.5 L,预计到2030年达到7.6 L;在中国,55.6%的男性和15.0%的女性是饮酒者[35]。面对酒精消费带来的沉重疾病负担,不应仅关注患者自身的饮酒行为,还应该关注患者所处的社会环境。因此,除了对个人进行戒酒建议,还应实施相关的政策加以限制。WHO提出的“最适宜购买”干预策略,其中包括提高酒精饮料的消费税、限制获得零售酒精饮料、限制酒精产品的广告和促销等,都可有效降低酒精产品的消费[36]。
癌症患者更容易出现营养不良[37],其中食管癌患者营养不良风险发生率高居各类癌症榜首[38]。放化疗也会进一步加剧营养不良,48.1%的食管癌放化疗营养不良患者出现体重丢失[39-40]。因此,癌症患者及其治疗后的日常饮食管理就变得愈发重要。本研究对癌症患者的饮食情况调查发现,蔬菜摄入不足和水果摄入不足人群患癌风险高于蔬菜、水果摄入充足人群,红肉摄入适量人群的患癌风险要低于红肉摄入过量人群。新鲜的水果和蔬菜、坚果、豆类和全谷物富含维生素、植物化学物质和膳食纤维等可抑制引发癌症的物质起到抗癌作用[41-43]。此外,有明确的证据表明加工肉类会增加结直肠癌的风险[44],而富含红肉或者加工肉类的饮食与结肠癌风险增高有关[45]。而且有证据显示,对消化系统癌症患者提供营养支持可有效改善预后和缩短住院时间等[46]。因此,在日常对癌症患者的饮食管理中建议增大新鲜蔬菜和水果的摄入比例,并控制红肉摄入。
本研究结果显示,高/中等强度运动频率低的人群患癌风险高于高/中等强度运动频率较高人群。一项针对全球癌症人群的可改变因素研究发现,乳腺癌、结肠癌和子宫内膜癌可归因于缺乏运动的中位人群归因分值估计在12%~19%之间,最高估计超过25%[47]。确切的流行病学证据表明,体育锻炼可以降低膀胱癌、乳腺癌、结肠癌、子宫内膜癌、肾癌、食道癌和胃癌的风险[41, 48-49],而且长期进行中等强度以上的身体活动,或者进行低强度的运动,都可降低乳腺癌的发病风险[50]。此外,有学者评估了运动对癌症患者的安全性和益处,结果发现运动是安全的,身体活动对恢复患者的体力非常重要,并且为癌症患者带来了许多好处,由此制定了《癌症生存者运动指南》[51-52]。临床证据也显示,一项关于高强度运动训练对胃食管结合部食管癌切除术后体能、生活质量及治疗结局的影响研究发现,运动后,肌肉力量和心肺适应性增强,并恢复到前处理水平[53]。因此,癌症患者通过定期的身体活动可以相应地减少运动不足带来的患癌风险,并且可较快恢复日常生活。
本研究结果发现,静坐时间 < 2 h/d人群患癌风险高于静坐时间≥2 h/d人群,这可能是因为当健康人群转变为癌症患者时,行为模式发生了改变。但与癌症风险相关的每日久坐行为的累积量和模式尚未确定。此外,还不清楚在整个生命历程中是否有特定的时期,一个人可能特别容易受到长时间久坐行为的不利影响。所以,目前还没有足够的证据来制定关于限制每天久坐时间的具体建议[54],需后续相关研究提供更多的人群、临床、实验等方面的证据。
本研究使用的数据经过严格的抽样加权,这个权重比例代表了中国≥18岁成年人的基本特征,具有全国代表性。而且,问卷调查涉及了行为、膳食、运动等多方面的个体数据,可以综合评估个体层面的因素对结局变量的影响。此外,问卷涉及的自报癌症种类较多,可以较为全面地了解到中国目前癌症患者的患病情况及危险因素。
本研究存在局限性。由于患癌属于自报,未进行医院病理和影像核实,可能存在少量回忆信息偏倚;同时,一些被诊断为晚期癌症的重症患者可能被排除在现场调查人群之外,或者由于家人隐瞒病情导致患者本人并不知晓实情,导致调查的患者数量可能会比实际的患病人数少,对分析结果存在低估。此外,本研究是基于全国横断面调查进行因素分析,并非癌症病因学研究的设计,在引用本研究的结果时,应明确其数据来源和抽样方法,了解数据本身的局限性,适度进行解读和推论。但癌症患者的基本情况和行为因素是相对稳定的,一定时期变化不大,本研究结果对探讨癌症防控及患者管理具有一定的参考价值。
综上所述,东部地区、家庭年收入低、吸烟、饮酒、蔬菜摄入不足、水果摄入不足、高/中等强度运动少是我国成年人癌症患者的主要危险因素,中部地区、城市地区和红肉摄入适量为保护因素。因此,重视经济落后地区的癌症防治、改变不良的行为方式和饮食模式、适当增加身体活动等综合措施对癌症防控及患者管理具有积极作用。
利益冲突 所有作者声明无利益冲突
作者贡献声明 何凤蝶:统计分析、论文撰写;胡亚男、王秋童、沙宇婷、王丹:分析/解释数据、论文修改;王丽敏:实施研究、研究指导;王宝华:研究指导、论文修改、经费支持
| [1] |
World Health Organization. World cancer report: cancer research for cancer prevention[R/OL]. (2020-02-04)[2021-04-01]. https://www.iarc.who.int/featured-news/new-world-cancer-report/.
|
| [2] |
中国疾病预防控制中心慢性非传染性疾病预防控制中心, 国家卫生和计划生育委员会统计信息中心. 中国死因监测数据集-2016[M]. 北京: 中国科学技术出版社, 2017: 26. National Center for Chronic and Non-communicable Disease Control and Prevention, Chinese Center for Disease Control and Prevention, Statistical Information Center of the National Health and Family Planning Commission. China death cause monitoring dataset 2016[M]. Beijing: China Science and Technology Press, 2017: 26. |
| [3] |
Ferlay J, Ervik M, Lam F, et al. Global cancer observatory: cancer today[R]. Lyon, France: International Agency for Research on Cancer, 2020.
|
| [4] |
Walling AM, Weeks JC, Kahn KL, et al. Symptom prevalence in lung and colorectal cancer patients[J]. J Pain Symptom Manage, 2015, 49(2): 192-202. DOI:10.1016/j.jpainsymman.2014.06.003 |
| [5] |
van Lancker A, Velghe A, van Hecke A, et al. Prevalence of symptoms in older cancer patients receiving palliative care: a systematic review and meta-analysis[J]. J Pain Symptom Manage, 2014, 47(1): 90-104. DOI:10.1016/j.jpainsymman.2013.02.016 |
| [6] |
肖益萍, 李琼. 癌症症状管理的研究进展[J]. 解放军护理杂志, 2016, 33(17): 34-37. Xiao YP, Li Q. Research progress of cancer symptom management[J]. Nurs J Chin PLA, 2016, 33(17): 34-37. DOI:10.3969/j.issn.1008-9993.2016.17.009 |
| [7] |
段晓磊, 朱大乔, 徐燕. 癌症病人应对方式的研究进展[J]. 护理研究, 2012, 26(25): 2307-2309. Duan XL, Zhu DQ, Xu Y. Research progress on coping style of cancer patients[J]. Chin Nurs Res, 2012, 26(25): 2307-2309. DOI:10.3969/j.issn.1009-6493.2012.25.002 |
| [8] |
赵振平, 王丽敏, 李镒冲, 等. 2013年中国慢性病及其危险因素监测系统省级代表性评价[J]. 中华预防医学杂志, 2018, 52(2): 165-169. Zhao ZP, Wang LM, Li YC, et al. Provincial representativeness assessment of China Non-communicable and chronic disease risk factor surveillance system in 2013[J]. Chin J Prev Med, 2018, 52(2): 165-169. DOI:10.3760/cma.j.issn.0253-9624.2018.02.009 |
| [9] |
中国疾病预防控制中心, 中国疾病预防控制中心慢性非传染性疾病预防控制中心. 中国慢性病及其危险因素监测报告2013[M]. 北京: 军事医学出版社, 2016: 23-24. Chinese Center for Disease Control and Prevention, National Center for Chronic and Non-communicable Disease Control and Prevention, Chinese Center for Disease Control and Prevention. Report on chronic disease risk factor surveillance in China 2013[M]. Beijing: Military Medical Science Press, 2016: 23-24. |
| [10] |
詹思延. 流行病学[M]. 8版. 北京: 人民卫生出版社, 2017: 16. Zhan SY. Epidemiology[M]. 8th ed. Beijing: People's Medical Publishing House, 2017: 16. |
| [11] |
胡楠, 姜勇, 李镒冲, 等. 2010年中国慢病监测数据加权方法[J]. 中国卫生统计, 2012, 29(3): 424-426. Hu N, Jiang Y, Li YC, et al. Weighting method of chronic disease surveillance data in China in 2010[J]. Chin J Health Stat, 2012, 29(3): 424-426. DOI:10.3969/j.issn.1002-3674.2012.03.045 |
| [12] |
Institute for Health Metrics and Evaluation. Global Burden of Disease study 2015 (GBD2015). Results by location, cause, and factorrisk, Institute for Health Metrics and Evaluation (IHME), 2016, Seattle, United States, 2016[EB/OL]. http://ghdx.healthdata.org/gbd-results-tool.
|
| [13] |
卫生部. 卫生部印发农村妇女宫颈癌检查项目技术方案通知(卫办妇社发〔2009〕135号)[EB/OL]. (2009-08-24)[2021-04-01]. http://www.gov.cn/gzdt/2009-09/28/content_1428784.htm. Ministry of Health. Notice on printing and distributing the "Technical Plan for Cervical Cancer Examination Projects for Rural Women (Trial)" (Health Office Women's Social Development (2009) No. 135)[EB/OL]. (2009-08-24)[2021-04-01]. http://www.gov.cn/gzdt/2009-09/28/content_1428784.htm. |
| [14] |
Zeng HM, Chen WQ, Zheng RS, et al. Changing cancer survival in China during 2003-15: a pooled analysis of 17 population-based cancer registries[J]. Lancet Glob Health, 2018, 6(5): e555-567. DOI:10.1016/S2214-109X(18)30127-X |
| [15] |
刘军兰. 乳腺癌首次成为全球最常见的癌症[J]. 中华乳腺病杂志: 电子版, 2020, 14(6): 389. Liu JL. Breast cancer became the most common cancer in the world for the first time[J]. Chin J Breast Dis: Electr Ed, 2020, 14(6): 389. DOI:10.3877/cma.j.issn.1674-0807.2020.06.013 |
| [16] |
中华人民共和国癌症死亡率地图集编辑委员会. 中华人民共和国癌症死亡率地图集[M]. 北京: 中国地图出版社, 1979: 40-46. The Editorial Committee for the Atlas of Cancer Mortality in the People's Republic of China. Atlas of Cancer Mortality in the People's Republic of China[M]. Beijing: Sino Maps Press China, 1979: 40-46. |
| [17] |
李冰, 黎钧耀. 中国恶性肿瘤的死亡情况和分布特点[J]. 中华肿瘤学杂志, 1980, 2(1): 1-10. Li B, Li JY. Chinese cancer death and its geographic characteristics[J]. Chin J Oncol, 1980, 2(1): 1-10. |
| [18] |
王宇, 宋淑芳, 刘凤. 我国宫颈癌流行病学特征和发病高危因素的研究进展[J]. 中国妇幼保健, 2019, 34(5): 1206-1208. Wang Y, Song SF, Liu F. Research progress on epidemiological characteristics and risk factors of cervical cancer in China[J]. Matern Child Health Care China, 2019, 34(5): 1206-1208. DOI:10.7620/zgfybj.j.issn.1001-4411.2019.05.74 |
| [19] |
陈竺. 全国第三次死因回顾抽样调查报告[M]. 北京: 中国协和医科大学出版社, 2008: 37-51. Chen Z. The third national retrospective sampling survey of all death causes[M]. Beijing: Peking Union Medical College Press, 2008: 37-51. |
| [20] |
邓大君. 《世界癌症报告》2020版问世——调整癌症预防对策, 适应癌症流行新趋势[J]. 肿瘤综合治疗电子杂志, 2020, 6(3): 27-32. Deng DJ. World cancer report 2020 comes out-adjusting cancer prevention strategies to adapt to the new trend of cancer epidemic[J]. J Multidisciplinary Cancer Management (Electronic Version), 2020, 6(3): 27-32. DOI:10.12151/JMCM.2020.03-05 |
| [21] |
国家卫生计生委统计信息中心. 2013第五次国家卫生服务调查分析报告[M]. 北京: 中国协和医科大学出版社, 2013. Center for Health Statistics and Information NHFPC. An analysis report of national health services survey in China, 2013[R]. Beijing: Peking Union Medical College Press, 2013. |
| [22] |
Upadhyaya A, Smith RA, Chacon-Cortes D, et al. Association of the microRNA-single nucleotide polymorphism rs2910164 in miR146a with sporadic breast cancer susceptibility: a case control study[J]. Gene, 2016, 576(1 Pt 2): 260. DOI:10.1016/j.gene.2015.10.019 |
| [23] |
Dai ZM, Kang HF, Zhang WG, et al. The associations of single nucleotide polymorphisms in miR196a2, miR-499, and miR-608 with breast cancer susceptibility: a STROBE- compliant observational study[J]. Medicine, 2016, 95(7): e2826. DOI:10.1097/MD.0000000000002826 |
| [24] |
Yan R, Cao JJ, Song CH, et al. Polymorphisms in lncRNA HOTAIR and susceptibility to breast cancer in a Chinese population[J]. Cancer Epidemiol, 2015, 39(6): 978-985. DOI:10.1016/j.canep.2015.10.025 |
| [25] |
Yan R, Wang KJ, Peng R, et al. Genetic variants in lncRNA SRA and risk of breast cancer[J]. Oncotarget, 2016, 7(16): 22486-22496. DOI:10.18632/oncotarget.7995 |
| [26] |
施海龙, 何钦成, 戴晓淳, 等. 非吸烟女性肺癌危险因素的研究[J]. 中国肺癌杂志, 2005, 8(4): 279-282. Shi HL, He QC, Dai XC, et al. Study on risk factors of lung cancer in non-smoking women[J]. Chin J Lung Cancer, 2005, 8(4): 279-282. DOI:10.3779/j.issn.1009-3419.2005.04.06 |
| [27] |
奉水东, 凌宏艳, 陈锋. 烹调油烟与女性肺癌关系的Meta分析[J]. 环境与健康杂志, 2003, 20(6): 353-354. Feng SD, Ling HY, Chen F. Meta analysis of female lung cancer associated with cooking oil fume[J]. J Environ Health, 2003, 20(6): 353-354. DOI:10.3969/j.issn.1001-5914.2003.06.012 |
| [28] |
顾晓平, 王银存, 智恒奎, 等. 吸烟与饮酒对肺癌发病的影响及交互作用[J]. 江苏预防医学, 2015, 26(5): 39-41. Gu XP, Wang YC, Zhi HK, et al. A case-control study on relationship of cigarette smoking, alcohol drinking and their interaction with lung cancer[J]. Jiangsu Prev Med, 2015, 26(5): 39-41. DOI:10.13668/j.issn.1006-9070.2015.05.013 |
| [29] |
中国疾病预防控制中心. 2015中国成人烟草调查报告[R]. 北京: 中国疾病预防控制中心, 2015: 9-20. Chinese Center for Disease Control and Prevention. 2015 China adult tobacco survey[R]. Beijing: Chinese Center for Disease Control and Prevention, 2015: 9-20. |
| [30] |
Blot WJ, Tarone RE. Esophageal cancer[M]//Thun MJ, Linet MS, Cerhan JR, et al. Cancer epidemiology and prevention. 4th ed. New York: Oxford University Press, 2017: 579-592.
|
| [31] |
杨晨煜, 邢沐祺, 吕心怡, 等. 饮酒行为与癌症发生关系的Meta分析——以胰腺癌和肺癌为例[J]. 现代预防医学, 2020, 47(3): 546-551, 571. Yang CY, Xing MQ, Lv XY, et al. Meta-analysis of the relationships between alcoholic drinking and incidence of pancreatic cancer and lung cancer[J]. Mod Prev Med, 2020, 47(3): 546-551, 571. |
| [32] |
周海茸, 王琛琛, 韩仁强, 等. 2011年与2017年江苏省南京市20岁以上人群归因于饮酒的恶性肿瘤疾病负担分析[J]. 中国肿瘤, 2020, 29(12): 946-951. Zhou HR, Wang CC, Han RQ, et al. Burden of malignant tumors attributable to alcohol use in Nanjing in 2011 and 2017[J]. China Cancer, 2020, 29(12): 946-951. DOI:10.11735/j.issn.1004-0242.2020.12.A010 |
| [33] |
Jayasekara H, MacInnis RJ, Lujan-Barroso L, et al. Lifetime alcohol intake, drinking patterns over time and risk of stomach cancer: A pooled analysis of data from two prospective cohort studies[J]. Int J Cancer, 2021, 148(11): 2759-2773. DOI:10.1002/IJC.33504 |
| [34] |
Shield KD, Soerjomataram I, Rehm J. Alcohol use and breast cancer: a critical review[J]. Alcohol Clin Exp Res, 2016, 40(6): 1166-1181. DOI:10.1111/acer.13071 |
| [35] |
Manthey J, Shield KD, Rylett M, et al. Global alcohol exposure between 1990 and 2017 and forecasts until 2030: a modelling study[J]. Lancet, 2019, 393(10190): 2493-2502. DOI:10.1016/S0140-6736(18)32744-2 |
| [36] |
Chisholm D, Moro D, Bertram M, et al. Are the "best buys" for alcohol control still valid? An update on the comparative cost-effectiveness of alcohol control strategies at the global level[J]. J Stud Alcohol Drugs, 2018, 79(4): 514-522. DOI:10.15288/jsad.2018.79.514 |
| [37] |
Marshall KM, Loeliger J, Nolte L, et al. Prevalence of malnutrition and impact on clinical outcomes in cancer services: A comparison of two time points[J]. Clin Nutr, 2019, 38(2): 644-651. DOI:10.1016/j.clnu.2018.04.007 |
| [38] |
Bozzetti F, Mariani L, Lo Vullo S, et al. The nutritional risk in oncology: a study of 1, 453 cancer outpatients[J]. Support Care Cancer, 2012, 20(8): 1919-1928. DOI:10.1007/s00520-012-1387-x |
| [39] |
韩东景, 赵楠, 李伟, 等. 食管癌患者术前营养不足和营养风险发生率及临床营养支持现状调查[J]. 中华肿瘤防治杂志, 2013, 20(16): 1274-1278. Han DJ, Zhao N, Li W, et al. Occurrence rate of preoperative nutritional risk, malnutrition and the current status of clinical nutritional support of patients with esophageal cancer[J]. Chin J Cancer Prev Treat, 2013, 20(16): 1274-1278. DOI:10.16073/j.cnki.cjcpt.2013.16.018 |
| [40] |
Pan P, Tao GZ, Sun XC. Subjective global assessment and prealbumin levels of esophageal cancer patients undergoing concurrent chemoradiotherapy[J]. Nutr Hosp, 2015, 31(5): 2167-2173. DOI:10.3305/nh.2015.31.5.8596 |
| [41] |
WCRF, AICR. Diet, nutrition, physical activity and cancer: a global perspective[R/OL]. World Cancer Research Fund, American Institute for Cancer Research, 2018 [2021- 04-02]. https://www.wcrf.org/dietandcancer.
|
| [42] |
聂爱英, 梁丽娟, 雷超, 等. 饮食和生活习惯与胃癌的相关性研究进展[J]. 现代生物医学进展, 2017, 17(3): 578-581. Nie AY, Liang LJ, Lei C, et al. Research progress of the relationship between dietary habit and gastric cancer[J]. Progr Mod Biomed, 2017, 17(3): 578-581. DOI:10.13241/j.cnki.pmb.2017.03.047 |
| [43] |
詹超英, 周盛荣, 庄坤东, 等. 饮食与肺癌关系的Meta分析[J]. 中国肿瘤, 2016, 25(9): 734-741. Zhan CY, Zhou SR, Zhuang KD, et al. Relationship between diet and lung cancer: a Meta-analysis[J]. China Cancer, 2016, 25(9): 734-741. DOI:10.11735/j.issn.1004-0242.2016.09.A014 |
| [44] |
World Cancer Research Fund, American Institute for Cancer Research (WCRF/AICR). Diet, nutrition, physical activity and stomach cancer 2016[R/OL]. [2021-04-02]. https://www.wcrf.org/sites/default/files/Stomach-Cancer-2016-Report.pdf.
|
| [45] |
Magalhães B, Peleteiro B, Lunet N. Dietary patterns and colorectal cancer: systematic review and meta-analysis[J]. Eur J Cancer Prev, 2012, 21(1): 15-23. DOI:10.1097/CEJ.0b013e3283472241 |
| [46] |
石汉平. 营养治疗是肿瘤的一线治疗[J]. 临床药物治疗杂志, 2019, 17(4): 20-25. Shi HP. Nutrition therapy is the first-line therapy for cancer[J]. Clin Med J, 2019, 17(4): 20-25. DOI:10.3969/j.issn.1672-3384.2019.04.005 |
| [47] |
Whiteman DC, Wilson LF. The fractions of cancer attributable to modifiable factors: a global review[J]. Cancer Epidemiol, 2016, 44: 203-221. DOI:10.1016/j.canep.2016.06.013 |
| [48] |
2018 Physical Activity Guidelines Advisory Committee. 2018 physical activity guidelines advisory committee scientific report[R]. Washington, DC, USA: U. S. Department of Health and Human Services, 2018.
|
| [49] |
Moore SC, Lee IM, Weiderpass E, et al. Association of leisure-time physical activity with risk of 26 types of cancer in 1.44 million adults[J]. JAMA Intern Med, 2016, 176(6): 816-825. DOI:10.1001/jamainternmed.2016.1548 |
| [50] |
Hildebrand JS, Gapstur SM, Campbell PT, et al. Recreational physical activity and leisure-time sitting in relation to postmenopausal breast cancer risk[J]. Cancer Epidemiol Biomarkers Prev, 2013, 22(10): 1906-1912. DOI:10.1158/1055-9965.EPI-13-0407 |
| [51] |
Morris GS. Exercise guidelines for the cancer survivor: why a physical therapist should be a part of the conversation[J]. Rehabil Oncol, 2014, 32(1): 36-38. DOI:10.1097/01893697-201432010-00006 |
| [52] |
Wolin KY, Schwartz AL, Matthews CE, et al. Implementing the exercise guidelines for cancer survivors[J]. J Support Oncol, 2012, 10(5): 171-177. DOI:10.1016/j.suponc.2012.02.001 |
| [53] |
Simonsen C, Thorsen-Streit S, Sundberg A, et al. Effects of high-intensity exercise training on physical fitness, quality of life and treatment outcomes after oesophagectomy for cancer of the gastro-oesophageal junction: PRESET pilot study[J]. BJS Open, 2020, 4(5): 855-864. DOI:10.1002/bjs5.50337 |
| [54] |
Stamatakis E, Ekelund U, Ding D, et al. Is the time right for quantitative public health guidelines on sitting? A narrative review of sedentary behaviour research paradigms and findings[J]. Br J Sports Med, 2019, 53(6): 377-382. DOI:10.1136/bjsports-2018-099131 |
 2022, Vol. 43
2022, Vol. 43