文章信息
- 彭晓霞, 苏健, 蔡思雨, 彭瑞玲, 彭亚光, 马晓莉, 倪鑫.
- Peng Xiaoxia, Su Jian, Cai Siyu, Peng Ruiling, Peng Yaguang, Ma Xiaoli, Ni Xin
- 开发专病临床数据交换标准协会病例报告表助力我国真实世界数据生态建设
- Development of case report form based on clinical data interchange standards consortium on special diseases to promote the ecology construction of real-world data in China
- 中华流行病学杂志, 2021, 42(12): 2201-2207
- Chinese Journal of Epidemiology, 2021, 42(12): 2201-2207
- http://dx.doi.org/10.3760/cma.j.cn112338-20210629-00505
-
文章历史
收稿日期: 2021-06-29
2. 海南省真实世界数据研究院, 海口 571435;
3. 北京医普科诺科技有限公司 100089
2. Hainan Real World Data Research Institute, Haikou 571435, China;
3. Beijing Improve-Quality Technology Co., Ltd. Beijing 100089, China
真实世界数据(real world data,RWD)是指在日常医疗活动、生活与工作等环境下产生的数据,如住院病案首页数据、电子病历数据(electronic medical record,EMR)、实验室信息系统(laboratory information system,LIS)数据、心脏健康研究等APP记录的数据、医疗保险相关数据、生产环境暴露物的监测数据、大气环境监测数据等。
RWD在临床与公共卫生研究中一直被广泛应用,例如:利用大气污染监测数据与健康医疗数据,评估大气污染暴露与健康效应之间是否存在因果关联[1];或采用医疗EMR和医疗保险报销数据评价不同干预措施的效果[2]等。自从美国食品和药物管理局(Food and Drug Administration,FDA)发布“真实世界证据计划”以来[3-4],RWD对于医疗保健和监管决策的支持已越来越重要,如针对临床与公共卫生关切的问题开展疗效比较研究[5]与实效性临床试验[6]等。与此同时,人们也越来越关注RWD的质量,针对RWD质量相关问题,如不完整性、不一致性和准确性等进行了广泛讨论与报告[7-8],并开始研究针对RWD的质量评估工具与方法[9]。本文基于我国RWD应用中存在的问题,提出“开发专病临床数据交换标准协会病例报告表(case report form based on clinical data interchange standards consortium,CDISC-CRF)助力我国RWD生态建设”的设想与同行分享,希望可以推动我国RWD生态建设。
1. 应用数据标准弥补RWD到真实世界证据之间的裂痕:为了推动我国RWD生态建设,Jin等[10]调查了临床研究最常用的RWD来源,即EMR与研究者发起的临床研究之间的裂痕,并对其潜在原因进行分析,发现EMR的质量是影响临床研究可行性与质量的关键所在。本研究在前期开展真实世界研究过程中,也发现临床诊疗行为的规范化程度、EMR的质量以及EMR的非标准化现状直接影响了基于RWD开展临床研究的可行性。因此,如何推动RWD生产单位采用数据标准来提高EMR的质量已成为国际范围内的研究热点[11-12]。我国国家药品监督管理局在《用于产生真实世界证据的真实世界数据指导原则(试行)》中也建议将RWD质量保证贯穿于数据治理的每一个环节,其核心策略也是提倡应用数据标准[13]。
目前,被广泛应用的数据标准是CDISC开发的标准,该标准涵盖研究方案设计、数据采集、分析、交换、递交等环节的一系列标准。继FDA于2004年宣布将CDISC中的研究数据制表标准(study data tabulation model,SDTM)作为提交临床试验数据的推荐标准后[14],CDISC已越来越得到业内的认可和广泛使用,成为临床试验数据的国际“通用语言”。为了提高临床试验数据质量以及统计分析的质量和效率,方便数据的交流与汇总分析,我国国家药品监督管理局于2020年发布的《药物临床试验数据递交指导原则(试行)》通告中,建议在新药上市注册申请时,采用CDISC标准递交原始数据库和分析数据库[15]。而其他国家已开始应用CDISC标准来实现电子病历与临床数据管理系统的互联,以此提高RWD的质量及使用效率。
例如:日本大阪大学医院医学信息学系和电子病历系统合作开发了一个电子数据采集系统(electronic data capture,EDC),可以从EMR中自动抓取CRF中所需的数据,并通过网络发送到研究数据库中,他们称这个系统为“电子临床研究表格接收器(eCRF-reportor)”。电子临床研究表格接收器的接口模块可以检索EMR数据库中的数据,包括患者人口学数据、实验室检查数据、处方数据以及疾病进展模板中录入的数据,也允许用户在电子临床研究表格中直接录入数据,然后生成CDISC操作数据模型(operational data model,ODM)文件,以便于数据的流通和传递[11]。
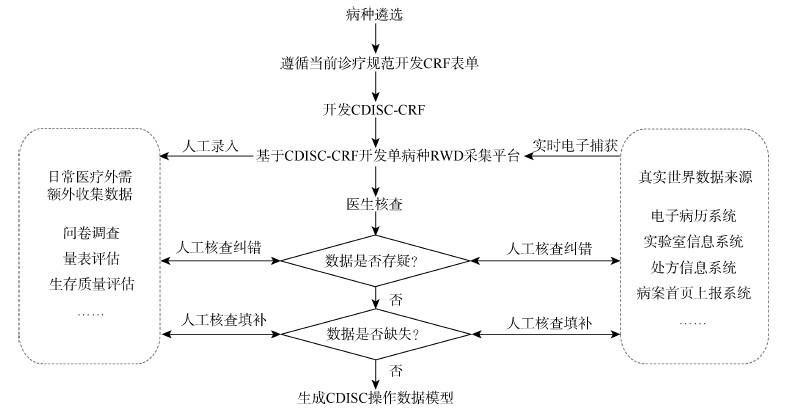
2. 基于专病CDISC-CRF建设RWD生态的流程:为了应对EMR的质量与标准化程度不高导致RWD适用性不足、可利用程度有限的困境,我们提出“开发专病CDISC-CRF助力我国RWD生态建设”的设想,该设想首先以发病率不高,但具有重要临床与研究意义的疾病(如儿童神经母细胞瘤)为模板试行,实现流程见图 1。
|
| 注:CRF:病例报告表;CDISC:临床数据交换标准协会;RWD:真实世界数据 图 1 基于专病CDISC-CRF建设真实世界数据生态的实现流程 |
(1)遴选适用病种:一般来说,开发专病CDISC-CRF,建设RWD一定是为开展多目标研究提供数据基础的,但是在选择病种时,建议考虑以下3点:①针对该病种,是否存在重大问题需要进一步研究。以儿童神经母细胞瘤为例,我国目前尚无基于全国数据的神经母细胞瘤流行病学数据,而且50%的高危神经母细胞瘤患者会经历疾病进展或复发[16-17],近期研究报告GD2抗体免疫疗法可明显改善高危神经母细胞瘤患者的生存[18-20],鉴于改善高危神经母细胞瘤生存的重要意义,亟需临床研究证据回答GD2抗体对中国高危神经母细胞瘤患儿的生存获益、治疗时机、合理剂量、优化联合治疗方案等一系列重要临床问题。②针对该病种,是否具有操作可行性。因我国目前电子病历中有很多模块是非结构数据,需要评估该病种电子病历的标准化程度与源数据质量水平,以确保采用EDC可以抓取大部分CDISC-CRF包含的数据,减少实施数据核查与填补的人工负担,提高该数据采集平台的可行性。③针对该病种,是否有达成同行共识的临床实践指南或诊疗规范。RWD的记录流程势必会影响临床诊疗程序的进一步规范,因此需要有达成同行共识的临床实践指南或诊疗规范作为CDISC-CRF开发的基础文本。
(2)遵循当前诊疗规范开发CRF表单:首先成立神经母细胞瘤CRF表单开发小组,组成人员有:神经母细胞瘤诊治专家:马晓莉、苏雁、王焕民、倪鑫;临床流行病学中心:彭晓霞、刘雅莉;国家儿童肿瘤监测中心:李哲;信息中心:徐新。参照国家卫生健康委员会医政医管局发布的儿童神经母细胞瘤诊疗规范(2019年版)[21],逐步定义以下内容:①数据点(filed-variable),即CRF中拟收集的性别、年龄、是否进行了血常规检查等,这些信息都是CRF的数据点,针对各个数据点,若设置为结构性问题时,应对备选项进行编码;②表单(form-domain),即由数据点组合而成的问题集合,一个CRF中的表单会在不同阶段的访视中被调用;③访视(visit),即诊疗规范或研究方案中规定的访视设置;④访视矩阵(visit structure),类似研究方案中的流程图,通过访视矩阵明确各个表单在访视中的位置。然后初步拟定神经母细胞瘤专病队列的CRF表单,扩大范围邀请专家进行论证后,最终确定神经母细胞瘤专病队列建设CRF表单。见表 1。
(3)开发CDISC-CRF表单:基于临床诊疗规范与潜在研究需求确定专病队列建设的CRF表单后,接下来将采用国际通用的CDISC标准建立CDISC-CRF表单,因为CRF的标准化,不仅可以满足研究者、研究中心协调员、研究监督员、数据录入人员、医学编码员和统计员等用户的需求[22],提高数据管理系统的效率,还可以使EDC能更加正确、有效地抓取数据[15]。
CDISC-CRF开发过程中,主要采用研究数据制表模块(study data tabulation model,SDTM)和临床数据获取协调标准(clinical data acquisition standards harmonization,CDASH)两个模块,同时参考受控术语(controlled terminology)。首先,参考SDTM模块,对拟采集数据一致的展现方式进行定义,如:性别统一编码为SEX;实验室检查项目统一编码为LBTEST,从而使临床研究机构可以向相应部门提交采用了统一标准的数据。SDTM将域定义为主题相同、逻辑相同的记录,如伴随用药(concomitant medicine)、疾病史(medical history)及不良事件(adverse event)等[23]。首先将每类观察数据划分成若干个域来描述特定类型的临床数据,然后按照不同数据间的逻辑关系,将其汇总到不同的主题中。此外,SDTM还规定了数据导出及提交时的格式、结构和内容,从而大大提高了数据核查及管理效率。
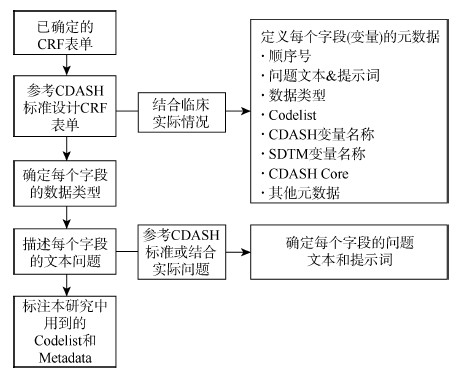
接下来,参考SDTM的数据结构,建立标准的CDISC-CRF。CDISC-CRF的开发与使用可以使研究者直接生成符合SDTM数据标准的数据集,而不需要花费大量时间精力将CRF或eCRF转化为符合SDTM标准的数据集,同时保证了临床研究数据的真实性和可溯源性。CDISC-CRF表单的具体设计程序:①确定表单样式,如,是否采用关系型多记录表单。②确定每个表单需要收集哪些数据字段,根据CDASH Core的定义,结合临床实际情况,由研究人员充分讨论后确定。在CDASH Core的定义中,有些数据是必须收集和记录的,定义为高度推荐(highly recommended,HR);有些数据在一定的条件下视情况收集,定义为推荐或有条件采用(recommended/conditional,R/C);可以选择性收集的数据则定义为可选(optional,O)。确定拟收集所有字段后,根据临床操作流程对各字段进行排序。③描述每个字段的问题文本,并根据CDASH元数据定义或数据收集的实际需求来确定数据类型(data type),如:字符型变量(Char)、数字型变量(Num)、日期变量(Date)和时间变量(Time)等。在进行数据收集时应根据数据类型选择不同的收集方式,尽量避免设计自由填写文本框。当设置文本问题时,若设置的问题有预期的答复,应根据CDISC提供的受控术语文件来设置预设选项;当设置的问题无预期答复时,可建立文本框来录入自由文本。④标注本研究CRF表单用到的选项(Codelist)和元数据(Metadata)以方便后期研究检索使用。具体步骤参见CDISC-CRF开发流程图(图 2)。
|
| 注:CDISC:临床数据交换标准协会;CRF:病例报告表;CDASH:临床数据获取协调标准;Codelist:选项;SDTM:研究数据制表模块;CDASH Core:临床数据获取协调标准核心;Metadata:元数据 图 2 CDISC-CRF开发流程图 |
在建立临床数据库时,对数据变量的命名要根据已经设计好的病例报告表注释来实现。病例报告表注释(annotated CRF,aCRF)是指在空白病例报告表的基础上,对采集的受试者数据(电子化的或纸质的)信息单元(即字段信息)与递交原始数据集中对应的变量或者变量值之间映射关系的具体描述[24]。它用文件记录来说明临床试验病例报告表的表格、变量条目名称、列表、访视及其他任何数据记录,也包括数据变量代码列表[25]。在进行药政申报时,监管评审人员也会根据aCRF来确定源数据[26]。aCRF主要是对CDASH变量名、SDTM变量名、CDASH核心和选项名称进行注释。注释的方式是在设计好的CRF基础上使用Word软件直接进行注释,不同颜色和符号标记不同的注释内容,神经母细胞瘤aCRF示例见图 3。

|
| 图 3 神经母细胞瘤病例报告表注释示意图 |
(4)开发CDISC-CRF单病种RWD采集平台:基于CDISC-CRF开发神经母细胞瘤RWD采集平台,该平台同时具备基于网络的电子数据采集功能与人工数据录入功能。将CDISC-CRF的关键词传递给EMR、LIS供应商制作的接口模块,利用EDC中的CDISC-CRF模板来检索EMR、LIS等数据库中的人口学数据、化验数据、处方数据等,并将检索到的数据返回到CDISC-CRF模板。同时,可以针对EMR、LIS等数据库中没有的变量采用人工录入。在设计EDC时,要考虑将数据核查程序与管理程序嵌套在其中,可以将不完整或核查有误的CDISC-CRF保存在本地服务器中,在以后进行填补或更正。
(5)生成CDISC数据操作模型:基于可扩展标记语言(extensible markup language,XML)生成符合CRF临床研究数据归档的内容和格式标准的CDISC数据操作模型,用于获取、交换、报告或递交数据。同时未来若使用相同的EMR和EDC系统实施神经母细胞瘤专病研究时,该模型和语言的数据有望实现直接交换和传输,从而快速建库、快速导出数据,快速产生SDTM数据集。
3. 基于专病CDISC-CRF建设RWD的应用前景及意义:虽然RWD在临床与公共卫生研究中一直被广泛应用,但自从FDA发布真实世界证据计划以来,RWD对于医疗保健和监管决策的支持已越来越重要,随之,人们对基于RWD开展研究的热情也空前高涨。即便如此,基于RWD开展的研究,尤其是观察性研究的真实性由于可重复性不足而广受诟病,其可能的原因有:①持有相同研究假设的不同研究者,可以基于RWD构建不同的研究数据集,基于诸多适用的统计分析方法制订不同的统计分析计划,然后针对获得的结果给予合理化解释而不管这些研究结果是否有合理的可解释的机制[27]。②RWD质量存在诸多不足,如完整性、可溯源性、准确性等,不论是前瞻性还是回顾性采集RWD,如果没有切实有效的操作标准与质控策略,都很难改变这一现状。③RWD的标准化程度低,导致应用RWD时,需要花大量的时间与精力进行数据清洗与事后标准化,才能确保数据统计分析的顺利实施。
正是这些现实推动我们建立统一的RWD采集模型、遴选有重要临床及研究意义且具有可行性的病种,按照当前诊疗规范开发CDISC-CRF,采用标准化的CRF从临床EMR及LIS等源数据文件中提取相关数据,同时可以完成数据核查,并允许专业人员进行人工数据填补。采用CDISC标准的优势在于:①可以导出统一变量名、统一测量标准、统一编码的CDISC数据操作模型,用于获取、交换、报告或递交数据,提高RWD的可溯源性、标准化水平、数据可及性及应用效率,避免花费大量精力与时间在将临床数据转换为符合监管或研究要求数据的过程上。②根据当前诊疗规范构建的专病CDISC-CRF,为RWD采集提供了标准化模型,不仅可以推动该病的诊疗规范化,而且可以推动不同医院之间的治疗决策分享与数据共享[28]。③允许研究者在此平台上根据新的研究需求做一些调整后便可生成新的CDISC-CRF,为我国高效启动新药临床试验、开展不同药物或治疗方案之间的疗效比较研究等提供高质量数据源。
利益冲突 所有作者均声明不存在利益冲突
| [1] |
Sarovar V, Malig BJ, Basu R. A case-crossover study of short-term air pollution exposure and the risk of stillbirth in California, 1999-2009[J]. Environ Res, 2020, 191: 110103. DOI:10.1016/j.envres.2020.110103 |
| [2] |
Baxter M, Morimoto Y, Tamiwa M, et al. A real-world observational study evaluating the probability of glycemic control with basal insulin or glucagon-like peptide-1 receptor agonist in Japanese patients with type 2 diabetes[J]. Diabetes Ther, 2020, 11(7): 1481-1496. DOI:10.1007/s13300-020-00836-8 |
| [3] |
US FDA. Real-world evidence[EB/OL]. (2020-11-30) [2021-05-21]. https://www.fda.gov/science-research/science-and-research-special-topics/real-world-evidence.
|
| [4] |
Sherman RE, Anderson SA, Pan GJ, et al. Real-world evidence-what is it and what can it tell us?[J]. N Engl J Med, 2016, 375(23): 2293-2297. DOI:10.1056/NEJMsb1609216 |
| [5] |
Sox HC, Greenfield S. Comparative effectiveness research: a report from the Institute of Medicine[J]. Ann Intern Med, 2009, 151(3): 203. DOI:10.7326/0003-4819-151-3-200908040-00125 |
| [6] |
Ford I, Norrie J. Pragmatic trials[J]. N Engl J Med, 2016, 375(5): 454-463. DOI:10.1056/NEJMra1510059 |
| [7] |
Nahm M. Data quality in clinical research[M]//Richesson RL, Andrews JE. Clinical research informatics. London: Springer, 2012: 175-201. DOI:10.1007/978-1-84882-448-5_10.
|
| [8] |
Chan KS, Fowles JB, Weiner JP. Review: electronic health records and the reliability and validity of quality measures: a review of the literature[J]. Med Care Res Rev, 2010, 67(5): 503-527. DOI:10.1177/1077558709359007 |
| [9] |
Bian J, Lyu TC, Loiacono A, et al. Assessing the practice of data quality evaluation in a national clinical data research network through a systematic scoping review in the era of real-world data[J]. J Am Med Inform Assoc, 2020, 27(12): 1999-2010. DOI:10.1093/jamia/ocaa245 |
| [10] |
Jin FF, Yao C, Yan XY, et al. Gap between real-world data and clinical research within hospitals in China: a qualitative study[J]. BMJ Open, 2020, 10(12): e038375. DOI:10.1136/bmjopen-2020-038375 |
| [11] |
Matsumura Y, Hattori A, Manabe S, et al. Interconnection of electronic medical record with clinical data management system by CDISC ODM[J]. Stud Health Technol Inform, 2014, 205: 868-872. DOI:10.3233/978-1-61499-432-9-868 |
| [12] |
Blitz R, Dugas M. Conceptual design, implementation, and evaluation of generic and Standard-Compliant data transfer into electronic health records[J]. Appl Clin Inform, 2020, 11(3): 374-386. DOI:10.1055/s-0040-1710023 |
| [13] |
国家药品监督管理局. 药审中心关于发布《用于产生真实世界证据的真实世界数据指导原则(试行)》的通告[EB/OL]. (2021-04-15) [2021-05-01]. http://www.cde.org.cn/zdyz.do?method=largePage&id=d283b75c0a57f24f. National Medicine and Products Administration. Guiding principles for real world data used to generate real world evidence (Trial version)[EB/OL]. (2021-04-15) [2021-05-01]. http://www.cde.org.cn/zdyz.do?method=largePage&id=d283b75c0a57f24f. |
| [14] |
Souza T, Kush R, Evans JP. Global clinical data interchange standards are here[J]. Drug Discov Today, 2007, 12(3/4): 174-181. DOI:10.1016/j.drudis.2006.12.012 |
| [15] |
国家药品监督管理局. 总局关于发布临床试验数据管理工作技术指南的通告(2016年第112号)[EB/OL]. (2016-07-27) [2021-05-01]. http://www.cde.org.cn/zdyz.do?method=largePage&id=20c3cd5ea30a51f9. National Medicine and Products Administration. Technical guideline for clinical trial data management[EB/OL]. (2016-07-27) [2021-05-01]. http://www.cde.org.cn/zdyz.do?method=largePage&id=20c3cd5ea30a51f9. |
| [16] |
Su Y, Qin H, Chen CH, et al. Treatment and outcomes of 1 041 pediatric patients with neuroblastoma who received multidisciplinary care in China[J]. Pediatr Invest, 2020, 4(3): 157-167. DOI:10.1002/ped4.12214 |
| [17] |
Smith V, Foster J. High-risk neuroblastoma treatment review[J]. Children (Basel), 2018, 5(9): 114. DOI:10.3390/children5090114 |
| [18] |
London WB, Bagatell R, Weigel BJ, et al. Historical time to disease progression and progression-free survival in patients with recurrent/refractory neuroblastoma treated in the modern era on Children's Oncology Group early-phase trials[J]. Cancer, 2017, 123(24): 4914-4923. DOI:10.1002/cncr.30934 |
| [19] |
Yu AL, Gilman AL, Ozkaynak MF, et al. Anti-GD2 antibody with GM-CSF, interleukin-2, and isotretinoin for neuroblastoma[J]. N Engl J Med, 2010, 363(14): 1324-1334. DOI:10.1056/NEJMoa0911123 |
| [20] |
Mora J, Castañeda A, Flores MA, et al. The role of autologous stem-cell transplantation in high-risk neuroblastoma consolidated by anti-GD2 immunotherapy. Results of two consecutive studies[J]. Front Pharmacol, 2020, 30(11): 575009. DOI:10.3389/fphar.2020.575009 |
| [21] |
马晓莉, 王焕民, 王珊, 等. 儿童神经母细胞瘤诊疗规范(2019年版)[EB/OL]. (2019-09-05) [2021-06-14]. http://www.nhc.gov.cn/yzygj/s3593/201909/5f1d3329606e4cd2aa6e501603703ee4/files/eaee74feeca94706b1fbc2ac85297762.pdf. Ma XL, Wang HM, Wang S, et al. Guideline for diagnosis and treatment of neuroblastoma in children (2019 Edition)[EB/OL]. (2019-09-05) [2021-06-14]. http://www.nhc.gov.cn/yzygj/s3593/201909/5f1d3329606e4cd2aa6e501603703ee4/files/eaee74feeca94706b1fbc2ac85297762.pdf. |
| [22] |
Bellary S, Krishnankutty B, Latha MS. Basics of case report form designing in clinical research[J]. Perspect Clin Res, 2014, 5(4): 159-166. DOI:10.4103/2229-3485.140555 |
| [23] |
王雅倩, 杨悦. CDISC标准与临床试验数据标准化[J]. 中国医药指南, 2016, 14(12): 296-297. Wang YQ, Yang Y. CDISC standards and clinical trial data standardization[J]. Guide China Med, 2016, 14(12): 296-297. DOI:10.15912/j.cnki.gocm.2016.12.246 |
| [24] |
国家药监局药审中心. 关于发布《药物临床试验数据递交指导原则(试行)》的通告[EB/OL]. (2020-07-20) [2021-06-20].https://www.nmpa.gov.cn/yaopin/ypggtg/ypqtgg/20200720171201514.html. Center for Drug Evaluation of National Medicine and Products Administration. Guiding principles for submission of drug clinical trial data (Trial version)[EB/OL]. (2020-07-20) [2021-06-20].https://www.nmpa.gov.cn/yaopin/ypggtg/ypqtgg/20200720171201514.html. |
| [25] |
王宏伟, 邓亚中, 刘川. 基于CDISC标准的病例报告表注释流程及方法[J]. 药学学报, 2015, 50(11): 1474-1479. Wang HW, Deng YZ, Liu C. Process and method for CDISC-based CRF annotation[J]. Acta Pharmaceut Sin, 2015, 50(11): 1474-1479. DOI:10.16438/j.0513-4870.2015.11.026 |
| [26] |
US FDA. Study Data Standards Resources. Study data technical conformance guide[EB/OL]. (2021-05-01) [2021-06-20].https://www.fda.gov/industry/fda-resources-data-standards/study-data-standards-resources.
|
| [27] |
Schuemie MJ, Cepeda MS, Suchard MA, et al. How confident are we about observational findings in healthcare: a benchmark study[J]. Harv Data Sci Rev, 2020, 2(1): 10. DOI:10.1162/99608f92.147cc28e |
| [28] |
孙一鑫, 裴正存, 詹思延. 呼吸系统疾病专病队列研究的标准制定与数据共享[J]. 中华流行病学杂志, 2018, 39(2): 233-239. Sun YX, Pei ZC, Zhan SY. Data harmonization and sharing in study cohorts of respiratory diseases[J]. Chin J Epidemiol, 2018, 39(2): 233-239. DOI:10.3760/cma.j.issn.0254-6450.2018.02.019 |
 2021, Vol. 42
2021, Vol. 42



