文章信息
- 白皙, 罗云云, 周智博, 苏明亮, 杨柳青, 陈适, 阳洪波, 朱惠娟, 潘慧.
- Bai Xi, Luo Yunyun, Zhou Zhibo, Su Mingliang, Yang Liuqing, Chen Shi, Yang Hongbo, Zhu Huijuan, Pan Hui
- 基于机器学习算法的大于胎龄儿风险预测模型
- Development and evaluation of a machine learning prediction model for large for gestational age
- 中华流行病学杂志, 2021, 42(12): 2143-2148
- Chinese Journal of Epidemiology, 2021, 42(12): 2143-2148
- http://dx.doi.org/10.3760/cma.j.cn112338-20210824-00677
-
文章历史
收稿日期: 2021-08-24
2. 东华医为科技有限公司, 北京 100190
2. DHC Mediway Technology Co., Ltd, Beijing 100190, China
大于胎龄儿(large for gestational age,LGA)是指出生体质量高于同种族同胎龄同性别新生儿出生体质量第90百分位的新生儿[1]。LGA不仅出现新生儿低血糖、肩难产等急性围产期并发症风险高于正常体重新生儿,其成年后患肥胖症、2型糖尿病等慢性病的风险也会升高[2-4],因此早期准确地预测LGA具有重要意义。目前,LGA的检测手段仍以B型超声为主,但妊娠早期的超声检查结果对LGA的预测价值有限;既往虽有研究曾利用孕妇的社会人口学特征结合临床生化指标,建立LGA的预测模型[5],但建模仅依赖于传统的统计学方法,存在固有的局限性,可能影响其在多变量、大样本量数据集中的应用和性能。相比之下,机器学习算法可以更准确地从复杂数据集中提取关键特征,已被越来越多地应用于不同疾病的诊断和预后预测中[6-9]。迄今为止还没有研究应用机器学习算法建立适用于中国人口的LGA预测模型。本研究利用一项多中心、大样本数据集,开发和验证基于机器学习算法的孕期LGA预测模型,并比较其与传统逻辑回归方法建模的性能差异。
对象与方法1.研究对象:来自“中国免费孕前优生健康检查项目”。该项目于2010年1月至2012年12月,通过国家卫生健康委员会在全国31个省市的220个县开展检测,目标人群覆盖全部农村计划妊娠夫妇,包括流动人口。项目的总体设计及实施在既往文献中已报道[10-11]。本研究从中选取分娩新生儿胎龄在24~42周内,单胎活产,且出生体重记录完整的所有育龄期夫妇及其新生儿为研究对象,共涉及214 636条记录。排除基线特征存在缺失值及异常值的记录后,最终纳入104 936条记录。该项目通过国家计划生育研究所伦理委员会批准,研究对象均签署知情同意书。
2.研究方法:项目包括孕前检查以及产前和产后随访。由经过专业培训的工作人员通过面对面调查的方式,收集父母与新生儿的社会人口学特征、孕前及孕期生活习惯、社会心理状态、饮食及营养状况、环境风险暴露因素、既往病史、家族史、用药情况、体格检查、实验室检查等方面的223个特征。所有数据均上传至全国电子数据采集系统,并由国家质量检测中心进行质量控制。
3.指标定义:① LGA:基于1995年WHO的诊断标准[12],将出生体质量高于相同胎龄体质量的第90百分位的新生儿定义为LGA,具体标准参照《2015年中国不同胎龄新生儿出生体重曲线研制》中的出生体重百分位数参考值[13]。②母亲分娩时年龄:按照年龄数据将记录分为:< 22、22~、30~、≥35岁。③母亲身高:按照母亲身高数据将记录分为:< 150、150~、160~、≥170 cm。④父亲身高:按照父亲身高数据将记录分为:< 160、160~、170~、≥180 cm。⑤父母职业:将职业为农民和工人的记录归为“体力劳动”组,服务业归为“服务业”组,职员和经商归为“脑力劳动”组,家务归为“无业”组,其他归为“其他”组。⑥父母文化程度:将文盲、小学和初中者归为“初中及以下”组,高中者归为“高中”组,大学及研究生者归为“大专及以上”组。⑦孕期丈夫和妇女吸烟情况:将不吸烟和戒烟者归为“戒烟”组,吸烟量减少归为“减少”组,吸烟量不变和增加者归为“未戒烟”组。⑧父母生活、人际关系及经济压力:将“无”者归为“无”组,“很少”和“有一点”者归为“较小”组,“比较大”和“很大”者归为“较大”组。⑨人口密度:将西藏、新疆、青海、宁夏、甘肃、内蒙古6个省份划分为人口密度较低地区,其余省份为人口密度较高地区。
4.统计学分析:在Python 3.8.5软件的环境下进行模型训练及数据分析。通过单因素显著性分析、单因素相关性分析(Spearman)及单因素逻辑回归分析,综合以上3项P值结果,将P>0.1的特征进行删除。此外,经过特征共线性分析,将与其余特征之间有较强共线性的特征进行删除。最终保留115个特征(表 1)。对数据集使用9∶1比例随机划分训练集与测试集。此外,数据集中的阳性结局特征LGA的记录占比较低(n=12 279,11.7%),属于非平衡数据集。为解决数据集不平衡的问题,本研究通过下采样(under-sampling)的方法处理训练集,使用随机算法对阴性样本进行删除,进而得到目标等比的训练集。采用逻辑回归、决策树、随机森林、朴素贝叶斯、GBDT、XGBoost、AdaBoost、CatBoost、LightGBM、KNN 10种算法进行机器学习模型训练,评价各种算法建立的模型对LGA的预测价值。此外,在115个特征中选取既往研究证实的少量比较明确的LGA危险因素作为预测因子[14-17],通过传统的逻辑回归方法构建LGA风险预测模型,比较机器学习模型与传统统计学模型的预测效能差异。计量资料采用中位数(P25,P75)表示,其中符合正态分布的特征通过t检验进行组间比较,非正态分布的特征通过Mann-Whitney U检验进行组间比较。计数资料采用例数(百分比)的形式描述,通过χ2检验进行组间比较。所有分析均采用双侧统计检验,P<0.05为差异有统计学意义。
1.基本特征:共纳入104 936名研究对象。其中,男婴54 856例(52.3%),女婴50 080例(47.7%),胎龄为40.0(39.0,40.0)周,出生体重为3 350.0(3 025.0,3 600.0)g,LGA的发生率为11.7%(12 279例)。纳入对象的社会人口学特征的单因素分析结果显示,母亲分娩年龄、母亲文化程度、母亲生活/工作压力、母亲是否服用叶酸及时间、父亲文化程度、父亲生活/工作压力、父亲饮酒情况在LGA组与非LGA组间的差异有统计学意义(P<0.01)。见表 1。
2.预测模型结果:本研究人群中存在阳性结局的LGA新生儿仅占总新生儿人数的11.7%,说明数据集存在严重的不平衡现象。因此,本研究通过under-sampling方法对原始数据集进行处理后,分别利用10种算法对原始数据集和平衡后的数据集构建LGA预测模型,预测模型的曲线下面积(AUC)、灵敏度、特异度、阳性预测值、阴性预测值。见表 2。在不平衡数据集中使用机器学习方法建模后,测试集中预测模型的AUC和特异度均较低。相比之下,经过数据平衡处理后,机器学习方法建立模型的整体效能出现显著提高,尤其以随机森林、GBDT、LightGBM、XGBoost、CatBoost模型最为显著。其中,CatBoost模型的AUC从0.692增加到0.932,特异度从93.1%增加到99.2%,灵敏度从20.2%增加到39.6%,阳性预测值从61.9%增加至95.2%,阴性预测值从67.8%增加至80.8%。
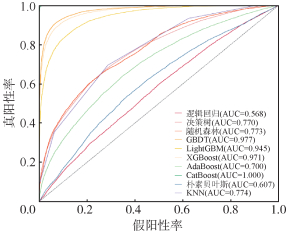
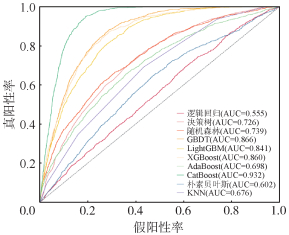
经过模型训练,10种算法建立的LGA预测模型中,CatBoost模型对LGA的预测效能最佳,在训练集中,模型的受试者工作特征曲线(ROC)的AUC为1.000;在测试集中,模型的ROC的AUC为0.932。其次是GBDT模型,在训练集中ROC的AUC为0.977,测试集中AUC为0.866。在测试集中,除逻辑回归模型在预测LGA风险方面表现较差,AUC仅为0.555外,其余9种机器学习算法建立的LGA预测模型的效能均较佳:XGBoost(AUC:0.860),LightGBM(AUC:0.841),随机森林(AUC:0.739),决策树(AUC:0.726),AdaBoost(AUC:0.698),KNN(AUC:0.676),朴素贝叶斯(AUC:0.602)。见图 1,2。
|
| 图 1 基于机器学习模型的训练集工作特征曲线 |
|
| 图 2 基于机器学习模型的测试集工作特征曲线 |
从机器学习模型纳入的115个预测特征中,选取已证实的少量比较明确的LGA危险因素作为预测因子,包括父母孕前BMI、母亲既往怀孕次数、母亲孕前血糖值、母亲年龄、父母身高、父母民族、胎儿性别、母亲妊娠第1~6月PM2.5暴露值,通过传统的逻辑回归方法构建LGA风险预测模型。传统逻辑回归模型在测试集中的AUC仅为0.584,见图 3。其特异度、灵敏度、阳性预测值和阴性预测值分别为91.7%、14.8%、66.3%和49.4%,均明显低于机器学习模型中表现最佳的CatBoost模型。
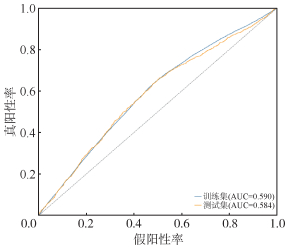
|
| 图 3 基于传统逻辑回归模型的工作特征曲线 |
本研究利用多中心、大样本数据集建立基于机器学习算法的LGA预测模型。结果表明,与传统的逻辑回归方法相比,利用机器学习算法可产生更有效的LGA预测模型,其中CatBoost模型对LGA的预测效能最佳,AUC为0.932。此外,本研究所采用的数据集属于不平衡数据集,LGA新生儿(n=12 279)和非LGA(n=92 657)新生儿的数量存在明显差异,基于此类阳性结局占比较少的预测模型往往表现不佳,通常因过度拟合低估了低危患者的事件发生率,同时高估了高危患者的事件发生风险[18]。与预期一致,直接利用不平衡数据集建立的LGA预测模型的性能较差,而经过数据平衡处理后,机器学习预测模型的综合性能出现明显提高,说明通过数据平衡方法,可以有效地改善数据集不平衡的问题,对准确预测来说至关重要。
既往研究表明,孕妇具有糖尿病家族史、妊娠期糖尿病史、孕前BMI较高、孕前及孕期体重增加过多、LGA分娩史、父亲BMI较高、胎次、男性新生儿等均为LGA的风险因素[14-17]。如何通过综合这些LGA的风险因素建立日常可行的LGA孕期预测模型,是目前仍待解决的问题。虽然曾有研究尝试利用孕妇的社会人口学特征结合临床生化指标建立LGA的预测模型[5],但建模仅依赖于传统的统计学方法,无法避免其存在的固有局限性。传统的统计学方法是模型驱动的,即从一个模型开始,并检查数据是否符合建立的模型,其潜在的假设是,数据由随机模型提供,验证是基于拟合优度检验,即R2和χ2检验[19-20]。因此,其固有的局限性包括[19-23]:首先,传统的统计学方法通常假设数据符合正态分布,变量具有独立性和线性关联。然而,真实的数据是存在噪声的,并不符合这样的预先假设。其次,得到的结论是数据拟合模型,而非模型拟合数据,强制对数据行为进行严格的假设。此外,传统的统计学方法对大样本量数据集的处理能力是有限的。相比之下,可解释多种因素的机器学习算法的发展,可帮助建立稳健和准确的预测模型。
机器学习是人工智能的一种形式,它的理论基础为,系统从数据中学习、识别模式,并在无需明确编程的情况下做出决策,可通过使用从数据中迭代学习的算法预测复杂数据集的结果[24]。机器学习算法不考虑对数据行为和变量预选的固定假设,而是允许数据通过检测或学习潜在模式来创建模型[25]。既往已有研究提出,当阳性结果较少时,机器学习方法可以建立更优的预测模型[26]。本研究采用了10种算法进行机器学习模型训练,其中逻辑回归、决策树、朴素贝叶斯和KNN属于简单模型,随机森林、GBDT、XGBoost、CatBoost、AdaBoost和LightGBM属于集成模型,以上算法均适用于本研究中的二分类问题。
本研究首次利用多中心、大样本数据集建立了基于机器学习算法的孕早期LGA预测模型。结果表明,与传统的逻辑回归方法相比,利用机器学习算法可产生更有效的LGA预测模型。此外,在预测模型结果评估时,AUC为0.7~0.8通常被解释为较好,0.8~0.9为良好,0.9~1.0为优秀[27]。在本研究中,CatBoost模型对LGA的预测效能最佳,在测试集中的AUC可达到0.932,其特异度、灵敏度、阳性预测值和阴性预测值在10种算法模型中均为最高。CatBoost算法是在GBDT算法框架下的一种改进实现,是一种基于对称决策树实现的参数较少、支持分类型变量和具有高准确性的算法,可以处理分类型、数值型变量,尤其对分类型变量表现优异,还解决了梯度偏差及预测偏移的问题,从而有效减少过拟合的发生,进而提高算法的准确性和泛化能力。这种算法采用特殊的方式处理分类型变量,极大减少了处理的工作量,还可以利用变量之间的联系,极大地丰富特征维度,为优化模型效果提供了可能性。然而,本研究存在一定的局限性。虽然模型的特异度、阳性预测值、阴性预测值分别高达99.2%、95.2%、80.8%,但测试集中的灵敏度仅为39.6%。原因可能与数据集中LGA的发生率不高有关,尽管存在一些已知的危险因素,但每一种危险因素仅会导致LGA的发生风险小幅度增加[28-30]。此外,当前模型中缺乏孕期超声结果等重要指标,也可能造成模型的灵敏度降低。如何使机器学习模型在测试集中仍维持较高的灵敏度已成为许多研究面临的问题[24, 28, 31],值得进一步研究。
本研究首次利用多中心、大样本数据集建立了基于多种机器学习算法的孕期LGA风险预测模型。与传统的逻辑回归方法相比,利用机器学习算法可建立更有效的LGA预测模型,其中以CatBoost模型的预测效能最佳,AUC可高达0.932。虽然模型的误诊率极低,但灵敏度偏低,仍需进一步纳入更多重要特征以优化当前的风险预测模型。
利益冲突 所有作者均声明不存在利益冲突
| [1] |
Esakoff TF, Cheng YW, Sparks TN, et al. The association between birthweight 4 000 g or greater and perinatal outcomes in patients with and without gestational diabetes mellitus[J]. Am J Obstet Gynecol, 2009, 200(6): 672.e1-672.e4. DOI:10.1016/j.ajog.2009.02.035 |
| [2] |
McGrath RT, Glastras SJ, Hocking SL, et al. Large-for-gestational-age neonates in type 1 diabetes and pregnancy:contribution of factors beyond hyperglycemia[J]. Diabetes Care, 2018, 41(8): 1821-1828. DOI:10.2337/dc18-0551 |
| [3] |
Oken E, Gillman MW. Fetal origins of obesity[J]. Obes Res, 2003, 11(4): 496-506. DOI:10.1038/oby.2003.69 |
| [4] |
Yamamoto JM, Kallas-Koeman MM, Butalia S, et al. Large-for-gestational-age (LGA) neonate predicts a 2.5-fold increased odds of neonatal hypoglycaemia in women with type 1 diabetes[J]. Diabetes Metab Res Rev, 2017, 33(1): e2824. DOI:10.1002/dmrr.2824 |
| [5] |
Åmark H, Westgren M, Persson M. Prediction of large-for-gestational-age infants in pregnancies complicated by obesity:A population-based cohort study[J]. Acta Obstet Gynecol Scand, 2019, 98(6): 769-776. DOI:10.1111/aogs.13546 |
| [6] |
Deo RC. Machine learning in medicine[J]. Circulation, 2015, 132(20): 1920-1930. DOI:10.1161/CIRCULATIONAHA.115.001593 |
| [7] |
Kourou K, Exarchos TP, Exarchos KP, et al. Machine learning applications in cancer prognosis and prediction[J]. Comput Struct Biotechnol J, 2015, 13: 8-17. DOI:10.1016/j.csbj.2014.11.005 |
| [8] |
Pan LY, Liu GJ, Lin FQ, et al. Machine learning applications for prediction of relapse in childhood acute lymphoblastic leukemia[J]. Sci Rep, 2017, 7(1): 7402. DOI:10.1038/s41598-017-07408-0 |
| [9] |
Shouval R, Bondi O, Mishan H, et al. Application of machine learning algorithms for clinical predictive modeling:a data-mining approach in SCT[J]. Bone Marrow Transplant, 2014, 49(3): 332-337. DOI:10.1038/bmt.2013.146 |
| [10] |
张世琨, 王巧梅, 沈海屏. 中国免费孕前优生健康检查项目的设计、实施及意义[J]. 中华医学杂志, 2015, 95(3): 162-165. Zhang SK, Wang QM, Shen HP. Design of the national free preconception health examination project in China[J]. Natl Med J China, 2015, 95(3): 162-165. DOI:10.3760/cma.j.issn.0376-2491.2015.03.002 |
| [11] |
Wang YY, Li Q, Guo YM, et al. Association of long‐term exposure to airborne particulate matter of 1 μm or less with preterm birth in China[J]. JAMA Pediatr, 2018, 172(3): e174872. DOI:10.1001/jamapediatrics.2017.4872 |
| [12] |
World Health Organization.Physical status:the use and interpretation of anthropometry[R].Report of a WHO Expert Committee.Technical Report Series No.854.Geneva:WHO, 1995.
|
| [13] |
朱丽, 张蓉, 张淑莲, 等. 中国不同胎龄新生儿出生体重曲线研制[J]. 中华儿科杂志, 2015, 53(2): 97-103. Zhu L, Zhang R, Zhang SL, et al. Chinese neonatal birth weight curve for different gestational age[J]. Chin J Pediatr, 2015, 53(2): 97-103. DOI:10.3760/cma.j.issn.0578-1310.2015.02.007 |
| [14] |
Júnior EA, Peixoto AB, Zamarian ACP, et al. Macrosomia[J]. Best Pract Res Clin Obstet Gynaecol, 2017, 38: 83-96. DOI:10.1016/j.bpobgyn.2016.08.003 |
| [15] |
Curti A, Zanello M, de Maggio I, et al. Multivariable evaluation of term birth weight:a comparison between ultrasound biometry and symphysis-fundal height[J]. J Matern Fetal Neonatal Med, 2014, 27(13): 1328-1332. DOI:10.3109/14767058.2013.858241 |
| [16] |
Levy A, Wiznitzer A, Holcberg G, et al. Family history of diabetes mellitus as an independent risk factor for macrosomia and cesarean delivery[J]. J Matern Fetal Neonatal Med, 2010, 23(2): 148-152. DOI:10.3109/14767050903156650 |
| [17] |
He XJ, Qin FY, Hu CL, et al. Is gestational diabetes mellitus an independent risk factor for macrosomia:a meta-analysis?[J]. Arch Gynecol Obstet, 2015, 291(4): 729-735. DOI:10.1007/s00404-014-3545-5 |
| [18] |
Pavlou M, Ambler G, Seaman SR, et al. How to develop a more accurate risk prediction model when there are few events[J]. BMJ, 2015, 351: h3868. DOI:10.1136/bmj.h3868 |
| [19] |
Breiman L. Statistical modeling:The two cultures (with comments and a rejoinder by the author)[J]. Stat Sci, 2001, 16(3): 199-231. DOI:10.1214/ss/1009213726 |
| [20] |
Hand DJ. Data mining:statistics and more?[J]. Am Stat, 1998, 52(2): 112-118. |
| [21] |
Bagley SC, White H, Golomb BA. Logistic regression in the medical literature:standards for use and reporting, with particular attention to one medical domain[J]. J Clin Epidemiol, 2001, 54(10): 979-985. DOI:10.1016/s0895-4356(01)00372-9 |
| [22] |
Sun GW, Shook TL, Kay GL. Inappropriate use of bivariable analysis to screen risk factors for use in multivariable analysis[J]. J Clin Epidemiol, 1996, 49(8): 907-916. DOI:10.1016/0895-4356(96)00025-X |
| [23] |
Tu JV. Advantages and disadvantages of using artificial neural networks versus logistic regression for predicting medical outcomes[J]. J Clin Epidemiol, 1996, 49(11): 1225-1231. DOI:10.1016/s0895-4356(96)00002-9 |
| [24] |
O'Neill AC, Yang DY, Roy M, et al. Development and evaluation of a machine learning prediction model for flap failure in microvascular breast reconstruction[J]. Ann Surg Oncol, 2020, 27(9): 3466-3475. DOI:10.1245/s10434-020-08307-x |
| [25] |
Shouval R, Hadanny A, Shlomo N, et al. Machine learning for prediction of 30-day mortality after ST elevation myocardial infraction:an acute coronary syndrome Israeli survey data mining study[J]. Int J Cardiol, 2017, 246: 7-13. DOI:10.1016/j.ijcard.2017.05.067 |
| [26] |
Kruppa J, Ziegler A, König IR. Risk estimation and risk prediction using machine-learning methods[J]. Hum Genet, 2012, 131(10): 1639-1654. DOI:10.1007/s00439-012-1194-y |
| [27] |
Kleinbaum DG, Klein M.Logistic regression[M].New York, NY:Springer, 2010.DOI:10.1007/978-1-4419-1742-3.
|
| [28] |
Cao Y, Fang X, Ottosson J, et al. A comparative study of machine learning algorithms in predicting severe complications after bariatric surgery[J]. J Clin Med, 2019, 8(5): 668. DOI:10.3390/jcm8050668 |
| [29] |
Stenberg E, Szabo E, Ågren G, et al. Early complications after laparoscopic gastric bypass surgery:results from the Scandinavian Obesity Surgery Registry[J]. Ann Surg, 2014, 260(6): 1040-1047. DOI:10.1097/SLA.0000000000000431 |
| [30] |
Finks JF, Kole KL, Yenumula PR, et al. Predicting risk for serious complications with bariatric surgery:results from the Michigan Bariatric Surgery Collaborative[J]. Ann Surg, 2011, 254(4): 633-640. DOI:10.1097/SLA.0b013e318230058c |
| [31] |
Miller R, Tumin D, Cooper J, et al. Prediction of mortality following pediatric heart transplant using machine learning algorithms[J]. Pediatr Transplant, 2019, 23(3): e13360. DOI:10.1111/petr.13360 |
 2021, Vol. 42
2021, Vol. 42