文章信息
- 魏玥, 林进龙, 陈功, 裴丽君.
- Wei Yue, Lin Jinlong, Chen Gong, Pei Lijun
- 中国65岁及以上老年人睡眠时长与其认知障碍风险的关联研究
- Association between sleep duration and cognitive impairment in Chinese people aged 65 years and older
- 中华流行病学杂志, 2021, 42(12): 2138-2142
- Chinese Journal of Epidemiology, 2021, 42(12): 2138-2142
- http://dx.doi.org/10.3760/cma.j.cn112338-20201106-01313
-
文章历史
收稿日期: 2020-11-06
痴呆严重危害老年人的身心健康。据估计,2010年全球约有3 560万人患有痴呆,随着老龄化程度的不断加深,这一数字将持续扩大,特别是在中低收入国家[1]。在我国,痴呆的死因顺位由1990年的第28位上升为2017年的第8位[2]。目前,还没有特效方法逆转痴呆病情的进展,而作为其前驱症状的认知障碍得到越来越多的关注。认知障碍的发生和发展与多种疾病和不良生活习惯密切相关,创伤性脑损伤、高血压、糖尿病、肥胖、饮酒、缺乏正规教育和缺乏体育锻炼是重要的危险因素[3]。近年来越来越多的国外研究发现睡眠时长与认知障碍存在一定关联[4-9],但研究结果不一致,同时针对我国老年人群的相关研究大多集中在省级层面和社区层面[10-12]。本研究利用2018年中国老年健康影响因素跟踪调查(Chinese Longitudinal Healthy Longevity Survey,CLHLS),探索我国≥65岁的老年人睡眠时长与其认知障碍的关联,为认知障碍和痴呆的预防、延缓其发生发展提供科学依据。
对象与方法1.数据来源:本研究利用CLHLS 2018年追踪调查数据,该调查覆盖全国23个省份,调查对象为≥65岁老年人。调查内容包括基本状况、社会经济背景、健康和生活质量自评、认知功能、性格心理特征、日常活动能力、生活方式、生活照料、疾病治疗和医疗费承担。有关CLHLS数据库的研究设计、样本分布和总体质量已做过评估[13]。每位参与者都接受了经过统一培训的调查员、护士或医科高年级学生的入户访谈和健康检查。CLHLS经北京大学伦理委员会审查批准通过,所有参与者(或其代理人)均签署书面知情同意书。
2.研究对象的纳入标准:对老年人年龄申报质量的评估显示[14],年龄 >105岁的老年人申报质量较差,因此,本研究选择年龄≥65岁且≤105岁的老年人;完整参与中文版简易智力状态检查测试量表(Chinese version of Mini-mental State Examination,CMMSE)且教育年限变量无缺失值;CMMSE结果为认知正常时不患有医院诊断的痴呆。根据纳入标准筛选出7 111人,并将有效样本分为认知障碍组和认知正常组,具体筛选流程见图 1。

|
| 图 1 ≥65岁老年人睡眠与认知障碍风险关联的研究对象筛选流程 |
3.指标定义及分组:睡眠时长通过“您现在一般每天睡几小时”获得,并将该变量分为≤5、6、7、8和≥9 h组,以睡眠时长7 h为参照组。通过调查问卷中的CMMSE量表评价认知功能,共24个题目,包括一般能力、反应能力、注意力及计算能力、回忆能力和语言、理解与自我协调能力5个认知领域,除“一分钟说出的食物数”最高记为7分外,其他题目均为1分,共30分,得分越高说明认知功能越好。根据上海市精神卫生中心制定的文化调整划界值判断认知功能是否正常[15]。未受过教育的受试者≤17分,受教育年限≤6年的受试者≤20分,受教育年限 > 6年的受试者≤24分为认知障碍,未受过教育的受试者 > 17分,受教育年限≤6年的受试者 > 20分,受教育年限 > 6年的受试者 > 24分为认知正常。身高体重由经统一培训的访员测量并计算BMI,参照《中国成人超重和肥胖症预防控制指南》[16]分为4组。采用简版流调中心抑郁水平评定量表(10-item Version of Center for Epidemiological Studies-Depression,CES-D10)界定抑郁症状,得分越高表明老年人的抑郁程度越高,分值≤10分表明没有抑郁症状[17]。日常生活活动(ADL)界定通过问卷中的Katz评估量表,该量表共6项,包含洗澡、穿衣、上厕所、室内活动、控制大小便、吃饭,每项评估结果均为不需要帮助、部分需要帮助、完全需要帮助3个等级,至少有一项部分需要帮助或完全需要帮助为ADL受损,6项均不需要帮助为ADL完好[18]。
4.统计学分析:使用Stata 14.0软件分析老年人睡眠及行为因素暴露与认知障碍风险的关联。使用频数(百分比)描述各个暴露因素的分布情况,单因素分析使用χ2检验,多因素分析采用logistic回归,调整可能的混杂因素,以OR值衡量睡眠时长与认知障碍的关联,并计算95%CI,以P < 0.05为差异有统计学意义。
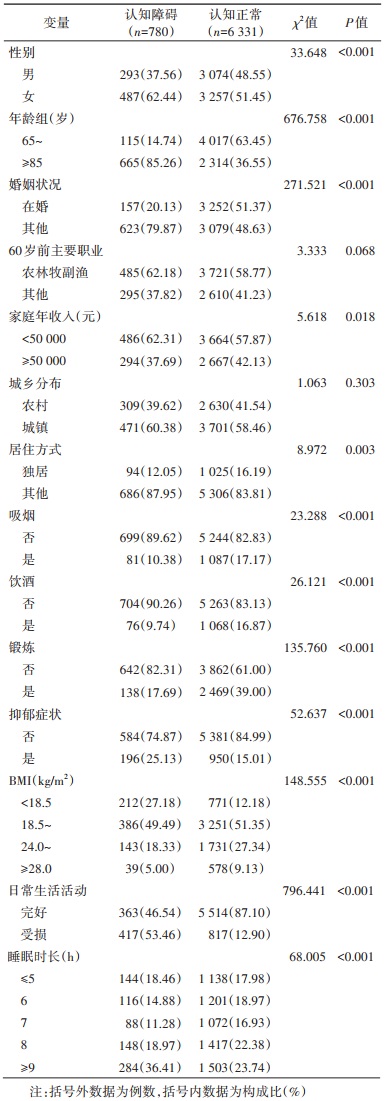
结果1.基本特征及单因素分析:研究对象共7 111人,男性3 367人(47.35%),女性3 744人(52.65%)。≥65岁老年人认知障碍组和认知正常组的暴露因素单因素分析结果显示(表 1),性别、年龄、婚姻状况、家庭年收入、居住方式、吸烟、饮酒、锻炼、抑郁症状、BMI和ADL在认知障碍组和认知正常组之间差异有统计学意义。
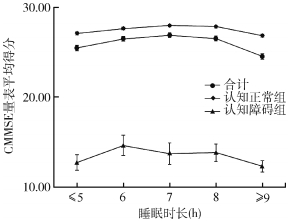
2.睡眠时长与认知障碍关联的多因素logistic回归分析:≥65岁老年人CMMSE得分随睡眠时长呈倒“U”形分布,见图 2。在单因素分析中,不同睡眠时长患认知障碍的OR值点估计也呈“U”形分布。以睡眠时长7 h为参照组,睡眠时长≤5 h和≥9 h的老年人患认知障碍的OR值分别为1.54(95%CI:1.16~2.06)和2.30(95%CI:1.78~2.99)。见表 2。
|
| 图 2 ≥65岁老年人不同睡眠时长的CMMSE量表平均得分 |
调整了性别、年龄、婚姻状况、家庭年收入、居住方式、吸烟、饮酒、锻炼、抑郁症状、BMI和ADL的可能混杂影响后,在我国≥65岁老年人中,与睡眠时长为7 h的老年人相比,睡眠时长≥9 h的老年人患认知障碍的OR值为1.41(95%CI:1.06~1.86),趋势检验显示,随着睡眠时间的延长(> 7 h)老年人患认知障碍的风险增加,且存在剂量反应关系(趋势性P=0.017),睡眠时间过短(≤5 h)与认知障碍无关。见表 2,图 3。

|
| 图 3 ≥65岁老年人睡眠时长与认知障碍的关联 |
本研究显示,我国≥65岁老年人群中,与睡眠时长为7 h的老年人相比,随着睡眠时长的减少和增加,CMMSE得分呈倒“U”形分布。调整了人口学因素、社会经济因素、生活习惯和健康状况后,睡眠时长≥9 h与老年人患认知障碍风险存在关联,而睡眠时长过短(≤5 h)则与认知障碍风险无统计学关联。
本研究与已有的研究结果类似,代表西班牙≥60岁老年人的横断面研究显示,睡眠时间越长(7~≥11 h)患认知障碍的风险越大(趋势性P < 0.001),未发现睡眠时长不足(< 7 h)与认知障碍的关联[4]。同样,美国曼哈顿北部≥40岁人群的调查(The Northern Manhattan Study,NOMAS)显示,自报夜间睡眠时长≥9 h的调查对象患认知障碍的风险是睡眠时长为6~8.9 h调查对象的2.4(95%CI:1.1~5.0)倍[5]。本研究的认知功能测试方法与上述调查一致,均采用CMMSE评价认知功能,睡眠时长均为自报时长。本研究的睡眠时长与西班牙的研究一致,包含夜间睡眠时长和午睡时长,而美国曼哈顿的研究只考察了夜间睡眠时长与认知功能的关联。与本研究不同,2000年芬兰健康研究(The Finnish Health 2000 Survey)显示≥30岁的成年人睡眠总时长过短(≤6 h)或过长(≥9 h)与认知功能下降有关[6]。同样,英国老龄化追踪调查(The English Longitudinal Study of Ageing,ELSA)第4次全国追踪调查发现,≥50岁调查对象的认知功能得分随着自报夜间睡眠时长的变化呈倒“U”形分布[7]。而针对日本社区 > 60岁老年人的小样本研究利用活动记录仪测量调查对象的睡眠状况,发现睡眠总时长过短(< 5 h)和睡眠效率 < 85%(睡眠效率=实际的睡眠时间/躺在床上的时间)会显著影响老年人的记忆力[8]。同时,法国巴黎的电话访问调查显示夜间睡眠过短(≤6 h)和午睡时间过长(≥1 h)与认知障碍有关[9]。对于睡眠时长与认知障碍的关联,不同研究在研究人群、研究设计、访问方式、睡眠时长分组、认知功能的测量和混杂因素的调整等方面存在差异,报道的结果并不一致。以往的研究大多针对发达国家的老年人口,本研究聚焦于中国中低收入老年人群,与国内相关研究相比覆盖的省份较多,样本量较大,调整了人口学因素、社会经济因素、生活方式和健康状况等多个混杂因素,反映了我国≥65岁老年人睡眠时长与认知障碍的关联。
目前,关于睡眠和认知功能关系的生物学机制尚不明确。但在睡眠过程中神经生理状态的变化,如激素、神经递质和组织胺的分泌,都表明睡眠是一个改变认知的过程[19]。随着年龄的增长,老年人的睡眠模式发生变化,会出现失眠、睡眠质量下降、日间嗜睡、睡眠呼吸紊乱和昼夜节律紊乱等问题,这些睡眠障碍都与老年人的认知衰退有关[20]。病理学的相关研究表明,在痴呆发病的无症状阶段,即认知功能显著下降前的10~15年,大脑中会出现不可溶解性淀粉样蛋白β(amyloid-β)斑块。而小鼠实验和人类的相关研究都表明,睡眠和淀粉样蛋白β水平存在双向互动。睡眠问题会导致淀粉样蛋白β的沉积,而淀粉样蛋白β斑块的形成又会影响大脑中控制睡眠和昼夜节律的相关区域,从而降低睡眠质量[21]。
虽然老年人的睡眠总时长增加,但睡眠碎片化、夜间清醒频繁和白天睡眠时间过长等睡眠问题更加严重。本研究的发现可以用睡眠碎片化来解释。因为睡眠碎片化可能会导致睡眠时间的补偿性增加。美国拉什大学开展的记忆与衰老调查(The Rush Memory and Aging Project,MAP)利用活动记录仪监测社区居家老年人的活动和睡眠状况,横断面研究中发现较高程度的睡眠碎片化与较差的认知功能相关[22],进一步的前瞻性研究也表明睡眠碎片化与阿尔兹海默病和认知功能下降相关[23]。除了睡眠碎片化,日间嗜睡也会导致睡眠总时长的增加。而针对老年人的横断面研究和前瞻性研究都表明白天过度嗜睡与认知障碍相关[24-25]。因此,睡眠碎片化、夜间清醒频繁和白天睡眠时间过长等睡眠障碍问题会导致老年人的认知功能衰退。
本研究利用CLHLS 2018年跟踪调查数据,探索我国≥65岁老年人睡眠时长与其认知障碍发生风险的关联。虽然剔除缺失样本后在老年人性别、年龄上存在差异,但在最后的分析中,利用多因素logistic回归进行了调整,控制了认知障碍组和认知正常组性别、年龄差异的可能混杂影响。研究存在一定的局限性。首先,调查中没有利用活动记录仪测量睡眠状况,而是自报睡眠时长,带有一定的主观性。但国内外关于睡眠时长与认知的研究中,睡眠时长大多通过受访者自报获得[4-7, 9, 12-14]。美国一项关于男性骨质疏松和骨折的研究(The Osteoporotic Fractures in Men Study)抽取了部分受访者参与睡眠专项调查,通过活动记录仪和问卷调查两种方式收集睡眠的相关数据,对比发现客观测量的睡眠总时长(6.4±1.2)h和主观自报的睡眠总时长(6.9±1.2)h之间差异没有统计学意义[26]。其次,该调查没有区分夜间睡眠和午睡,无法单独考察不同时间的睡眠与认知障碍的关联。然后,该数据中主要慢性疾病存在大量缺失值,因此,在模型中没有纳入慢性疾病这一重要危险因素。最后,本研究为横断面研究,同时测量了睡眠时长和认知状况,无法推断两者的因果关系。因此仍需要进一步的前瞻性研究来验证睡眠对认知障碍的影响。
利益冲突 所有作者均声明不存在利益冲突
志谢 感谢中国老年健康影响因素跟踪调查项目组提供数据支持
| [1] |
Prince M, Bryce R, Albanese E, et al. The global prevalence of dementia:A systematic review and metaanalysis[J]. Alzheimer's Dement, 2013, 9(1): 63-75.e2. DOI:10.1016/j.jalz.2012.11.007 |
| [2] |
Zhou MG, Wang HD, Zeng XY, et al. Mortality, morbidity, and risk factors in China and its provinces, 1990-2017:a systematic analysis for the Global Burden of Disease Study 2017[J]. Lancet, 2019, 394(10204): 1145-1158. DOI:10.1016/S0140-6736(19)30427-1 |
| [3] |
Baumgart M, Snyder HM, Carrillo MC, et al. Summary of the evidence on modifiable risk factors for cognitive decline and dementia:A population-based perspective[J]. Alzheim Dem, 2015, 11(6): 718-726. DOI:10.1016/j.jalz.2015.05.016 |
| [4] |
Faubel R, López-García E, Guallar-Castillón P, et al. Usual sleep duration and cognitive function in older adults in Spain[J]. J Sleep Res, 2009, 18(4): 427-435. DOI:10.1111/j.1365-2869.2009.00759.x |
| [5] |
Ramos AR, Dong CH, Elkind MSV, et al. Association between sleep duration and the mini-mental score:the northern Manhattan study[J]. J Clin Sleep Med, 2013, 9(7): 669-673. DOI:10.5664/jcsm.2834 |
| [6] |
Kronholm E, Sallinen M, Suutama T, et al. Self-reported sleep duration and cognitive functioning in the general population[J]. J Sleep Res, 2009, 18(4): 436-446. DOI:10.1111/j.1365-2869.2009.00765.x |
| [7] |
Miller MA, Wright H, Ji C, et al. Cross-sectional study of sleep quantity and quality and amnestic and non-amnestic cognitive function in an ageing population:the English Longitudinal Study of Ageing (ELSA)[J]. PLoS One, 2014, 9(6): e100991. DOI:10.1371/journal.pone.0100991 |
| [8] |
Miyata S, Noda A, Iwamoto K, et al. Poor sleep quality impairs cognitive performance in older adults[J]. J Sleep Res, 2013, 22(5): 535-541. DOI:10.1111/jsr.12054 |
| [9] |
Ohayon MM, Vecchierini MF. Normative sleep data, cognitive function and daily living activities in older adults in the community[J]. Sleep, 2005, 28(8): 981-989. DOI:10.1093/sleep/28.8.981 |
| [10] |
Ding GW, Li JL, Lian ZW. Both short and long sleep durations are associated with cognitive impairment among community-dwelling Chinese older adults[J]. Medicine (Baltimore), 2020, 99(13): e19667. DOI:10.1097/MD.0000000000019667 |
| [11] |
Xu L, Jiang CQ, Lam TH, et al. Short or long sleep duration is associated with memory impairment in older Chinese:the Guangzhou Biobank cohort study[J]. Sleep, 2011, 34(5): 575-580. DOI:10.1093/sleep/34.5.575 |
| [12] |
Lin JF, Li FD, Chen XG, et al. Association of postlunch napping duration and night-time sleep duration with cognitive impairment in Chinese elderly:a cross-sectional study[J]. BMJ Open, 2018, 8(12): e023188. DOI:10.1136/bmjopen-2018-023188 |
| [13] |
Zeng Y. Toward deeper research and better policy for healthy aging-using the unique data of Chinese longitudinal healthy longevity survey[J]. China Econ J, 2012, 5(2/3): 131-149. DOI:10.1080/17538963.2013.764677 |
| [14] |
Zeng Y, James WV, Xiao ZY, et al. The healthy longevity survey and the active life expectancy of the oldest old in China[J]. Population, 2001, 13(1): 95-116. |
| [15] |
Zhang MY, Katzman R, Salmon D, et al. The prevalence of dementia and Alzheimer's disease in Shanghai, China:impact of Age, Gender, and Education[J]. Ann Neurol, 1990, 27(4): 428-437. DOI:10.1002/ana.410270412 |
| [16] |
卫生部疾病控制司.中国成人超重和肥胖症预防控制指南[M].北京:人民卫生出版社, 2003. Division of Disease Control, Ministry of Health of the People's Republic of China.Prevention and control guidelines of overweight and obesity in Chinese adults[M].Beijing:People's Medical Publishing House, 2003. |
| [17] |
Andresen EM, Malmgren JA, Carter WB, et al. Screening for depression in well older adults:Evaluation of a short form of the CES-D[J]. Am J Prev Med, 1994, 10(2): 77-84. DOI:10.1016/S0749-3797(18)30622-6 |
| [18] |
Purser JL, Feng QS, Zeng Y, et al. A new classification of function and disability in China:subtypes based on performance-based and self-reported measures[J]. J Aging Health, 2012, 24(5): 779-798. DOI:10.1177/0898264312444310 |
| [19] |
Deak MC, Stickgold R. Sleep and cognition[J]. WIREs Cogn Sci, 2010, 1(4): 491-500. DOI:10.1002/wcs.52 |
| [20] |
Yaffe K, Falvey CM, Hong TN. Connections between sleep and cognition in older adults[J]. Lancet Neurol, 2014, 13(10): 1017-1028. DOI:10.1016/S1474-4422(14)70172-3 |
| [21] |
Ju YES, Lucey BP, Holtzman DM, et al. Sleep and Alzheimer disease pathology—a bidirectional relationship[J]. Nat Rev Neurol, 2014, 10(2): 115-119. DOI:10.1038/nrneurol.2013.269 |
| [22] |
Lim ASP, Yu L, Costa MD, et al. Increased fragmentation of rest-activity patterns is associated with a characteristic pattern of cognitive impairment in older individuals[J]. Sleep, 2012, 35(5): 633-640. DOI:10.5665/sleep.1820 |
| [23] |
Lim ASP, Kowgier M, Yu L, et al. Sleep fragmentation and the risk of incident Alzheimer's disease and cognitive decline in older persons[J]. Sleep, 2013, 36(7): 1027-1032. DOI:10.5665/sleep.2802 |
| [24] |
Ohayon MM, Vecchierini MF. Daytime Sleepiness and cognitive impairment in the elderly population[J]. Arch Intern Med, 2002, 162(2): 201-208. DOI:10.1001/archinte.162.2.201 |
| [25] |
Keage HAD, Banks S, Yang KL, et al. What sleep characteristics predict cognitive decline in the elderly?[J]. Sleep Med, 2012, 13(7): 886-892. DOI:10.1016/j.sleep.2012.02.003 |
| [26] |
Blackwell T, Yaffe K, Laffan A, et al. Associations of objectively and subjectively measured sleep quality with subsequent cognitive decline in older community-dwelling men:the MrOS sleep study[J]. Sleep, 2014, 37(4): 655-663. DOI:10.5665/sleep.3562 |
 2021, Vol. 42
2021, Vol. 42