文章信息
- 朱国玲, 陈朔华, 樊学东, 樊家成, 门秀丽, 张艳敏, 孙秋, 张冰, 吉瑞更, 王珊, 佟博, 张杰, 吴寿岭, 蒋晓忠.
- Zhu Guoling, Chen Shuohua, Fan Xuedong, Fan Jiacheng, Men Xiuli, Zhang Yanmin, Sun Qiu, Zhang Bing, Ji Ruigeng, Wang Shan, Tong Bo, Zhang Jie, Wu Shouling, Jiang Xiaozhong
- 基线BMI水平对急性胰腺炎发病风险影响的前瞻性队列研究
- A prospective cohort study on BMI levels and risk of acute pancreatitis
- 中华流行病学杂志, 2021, 42(12): 2131-2137
- Chinese Journal of Epidemiology, 2021, 42(12): 2131-2137
- http://dx.doi.org/10.3760/cma.j.cn112338-20201027-01286
-
文章历史
收稿日期: 2020-10-27
2. 开滦员工健康保障中心, 唐山 063000;
3. 开滦总医院心胸外科, 唐山 063000;
4. 内蒙古科技大学包头医学院, 包头 014010;
5. 华北理工大学, 唐山 063000;
6. 唐山中心医院消化内科, 唐山 063000;
7. 开滦总医院肝胆外科三病区, 唐山 063000;
8. 开滦总医院心内科, 唐山 063000
2. Healthcare Center of Kailuan Group, Tangshan 063000, China;
3. Department of Cardiothoracic Surgery, Kailuan General Hospital, Tangshan 063000, China;
4. Baotou Medical College, Inner Mongolia University of Science and Technology, Baotou 014010, China;
5. North China University of Science and Technology, Tangshan 063000, China;
6. Department of Gastroenterology, Tangshan Central Hospital, Tangshan 063000, China;
7. No.3 Ward of Hepatobiliary Surgery, Kailuan General Hospital, Tangshan 063000, China;
8. Department of Cardiology, Kailuan General Hospital, Tangshan 063000, China
目前肥胖已成为一种全球性疾病,其发病率逐年升高[1-2]。根据WHO全球疾病负担研究(Global Burden of Disease Study,GBD)的分析显示[3]:1980-2013年全世界肥胖/超重的成年人比率增长了27.5%。有文献报道,美国自2000年始因病理性肥胖住院人数增加了约314%[4],而与肥胖关联密切的急性胰腺炎(AP)发病率也呈增长趋势[5],2009年美国因AP住院患者27.4万余人[4],比1988年增加2倍以上[6]。AP发病率上升与全球肥胖流行几乎同时发生[7],提示肥胖可能与AP发病有一定关系。欧、美洲地区前瞻性研究均证明较高的BMI与AP的发病风险相关[8-9],但瑞典一项研究发现BMI与AP的发病风险无关[7]。BMI升高是否引起AP发病风险增加尚存在争议。
中国健康营养调查(China Health and Nutrition Survey,CHNS)的数据显示[10]:1993-2009年,成年人超重/肥胖的患病率从13.4%增加至26.4%,总体呈线性增长。2016年的研究结果表明,我国目前已有接近1亿的肥胖人口,肥胖症总人数已超过美国,位居世界首位[11],但我国鲜有肥胖与AP发病风险关系的前瞻性研究报道。本研究采用前瞻性队列研究方法,利用开滦研究(临床试验注册号:Chi-CTR-TRNC-11001489)数据资料,分析基线BMI水平与AP发病风险的关系,旨在探讨BMI水平对中国人群AP发病风险的影响。
对象与方法1.研究对象:2006年7月至2007年10月开滦总医院及所属10家医院对开滦集团在职和离退休职工进行第一次健康体检,此后每二年随访1次。本研究以首次参加2006-2007、2008-2009年健康体检的人群作为观察对象,收集所有查体人员相应的流行病学、人体测量学及实验室检查指标。本研究遵守赫尔辛基宣言原则,并通过开滦医疗集团伦理委员会审核批准([2006]医伦字5号)。
2.纳入标准和排除标准:
(1)纳入标准:①首次参加2006年7月至2007年10月、2008年7月至2009年10月健康体检的开滦集团在职和离退休职工;②同意参加本研究并签署知情同意书者。
(2)排除标准:①有胰腺炎病史者;②基线BMI资料缺失者;③有恶性肿瘤史及妊娠等可能影响BMI水平者。
3.相关定义和诊断标准:流行病学调查、人体测量学指标和生物化学指标检测见本课题组已发表的文献[12]。体格检查时由研究人员测量身高、体重,按体重除以身高的平方(kg/m2)计算BMI值。吸烟定义为每天≥1支,持续1年以上。饮酒定义为平均每日饮白酒(乙醇含量 > 50%)≥100 ml,持续1年以上。体育锻炼定义为每周锻炼≥3次,每次持续时间≥30 min。胆石症确定:根据《超声诊断学》胆石症诊断标准:腹部超声检查发现胆囊内有形态稳定的强回声团,后方伴声影,并随体位改变而移动,可确诊为胆囊结石;因患胆石症行胆囊切除术者;胆管扩张,胆管腔内有形态稳定的强回声团,后方伴声影,强回声团与胆管壁之间分界清楚,可随体位改变移动,可确诊为胆管结石。新发AP指既往无AP病史,随访期间发生包括轻症、中度重症、重症AP事件。根据新修订的《中国急性胰腺炎诊治指南(2019,沈阳)》诊断标准进行诊断[13],典型AP的诊断至少存在以下3项特征中的2项:腹痛、血浆淀粉酶或脂肪酶超过正常上限的3倍以上、AP的典型影像学表现。
4.随访和终点事件的确定:以观察对象参加第一次健康体检时间为随访起点,以新发AP事件、死亡或至随访结束(2019年12月31日)为随访终点,发生2次以上AP计为1次AP事件,以最先发生AP的时间和事件为结局,每年由经过培训的医务人员,通过唐山市职工医疗保险定点结算系统提供的住院信息,检索观察对象AP的发病情况,到新发病例诊治的医院收集AP住院资料并核实确认。因医保系统的完整性,随访没有丢失,AP病例没有漏诊。
5.统计学方法:观察对象健康体检资料由各医院统一培训的专业人员录入,通过网络上传至开滦总医院Oracle 10.2数据库,应用SAS 9.4软件进行统计学分析。根据《中国超重/肥胖医学营养治疗专家共识》定义的BMI分类标准[10],将观察人群分为正常体重组(BMI < 24 kg/m2),超重组(BMI 24~kg/m2),肥胖组(BMI≥28 kg/m2)。符合正态分布的计量资料以均数±标准差(x±s)表示,组间比较采用单因素方差分析;非正态分布计量资料以M(P25,P75)表示,组间比较采用非参数检验。计数资料采用绝对频率和百分比表示,组间比较采用χ2检验,以Kaplan-Meier法计算不同分组中AP累积发病率,累积发病率的组间比较采用log-rank法进行检验。采用人年发病率(发病密度)计算不同BMI分组中的AP发病率,发病密度计算:万人年发病率=各组发病例数/各组总随访时间(人年)×10 000。采用Cox比例风险回归模型计算3组新发AP的HR值(95%CI)。将BMI以连续性变量的形式带入Cox模型中,分析BMI每增加1 kg/m2发生AP的HR值(95%CI)。此外,根据年龄、性别分层进行亚组分析,计算各分层AP的HR值(95%CI)。敏感性分析:排除随访2年内发生AP的患者,重复Cox比例风险回归模型进行分析。P < 0.05(双侧检验)为差异有统计学意义。
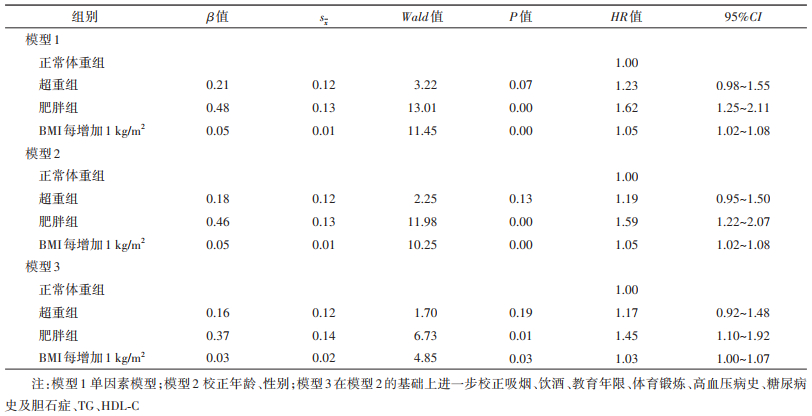
结果1.基线资料:2006-2007和2008-2009年首次参加健康体检的开滦集团在职及离退休职工共计126 847人,排除AP病史者21人、BMI资料缺失者2 410人,排除恶性肿瘤者439人、女性妊娠者136人,最终纳入统计分析者123 841人,其中男性99 051人,女性24 790人,年龄(51.01±12.99)岁。正常体重组49 682人、超重组51 523人、肥胖组22 636人,3组间观察对象的性别比、年龄、BMI、SBP、FPG、TC、HDL-C、TG以及吸烟、饮酒、教育年限≥9年、体育锻炼≥3次/周、高血压病史、糖尿病史、胆石症的比例差异有统计学意义(均P < 0.01)。见表 1。
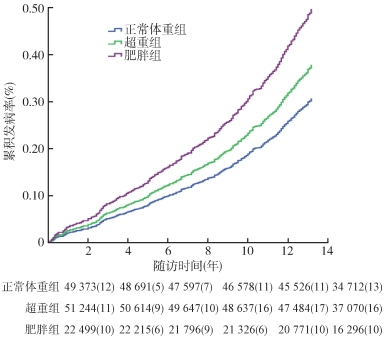
2.观察对象AP发生率的组间比较:在随访(11.94±2.13)年期间,共发生AP 395例,总人群AP发病密度为2.67例/万人年,其中正常体重组新发AP 130例,发病密度为2.20例/万人年;超重组和肥胖组新发AP分别为168例和97例,发病密度分别为2.72例/万人年、3.58例/万人年;3组新发AP的累积发病率分别为0.32%、0.40%、0.49%,经log-rank法检验,累积发病率的组间比较差异有统计学意义(χ2 =13.17,P< 0.01)。见图 1。
|
| 图 1 不同BMI水平急性胰腺炎累积发病率 |
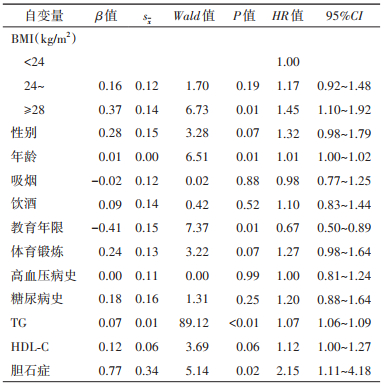
3.影响AP事件的Cox比例风险回归模型:调整相关因素后,超重组和肥胖组发生AP的HR=1.17(95%CI:0.92~1.48)和1.45(95%CI:1.10~1.92)。将BMI以连续性变量的形式带入Cox模型中,BMI每增加1 kg/m2,发生AP的HR=1.03(95%CI:1.00~1.07)。见表 2。与非胆石症组人群相比,胆石症人群发生AP的HR=2.15(95%CI:1.11~4.18);TG每增加1 mmol/L,发生AP的HR=1.07(95%CI:1.06~1.09);与教育年限 < 9年的人群相比,教育年限≥9年的人群发生AP的HR=0.67(95%CI:0.50~0.89)。见表 3。
按年龄分层,以正常体重组为对照,年龄 < 60岁时,超重组和肥胖组发生AP的HR值(95%CI)分别为1.18(0.89~1.57)和1.58(1.14~2.19);BMI每增加1 kg/m2,发生AP的HR值(95%CI)为1.25(1.06~1.48)。年龄≥60岁时,超重组和肥胖组发生AP的HR值(95%CI)分别为1.20(0.77~1.87)和1.19(0.68~2.09);BMI每增加1 kg/m2,发生AP的HR值(95%CI)为1.10(0.84~1.45)。按性别分层,男性超重组和肥胖组发生AP的HR值(95%CI)分别为1.15(0.89~1.49)和1.40(1.03~1.90);BMI每增加1 kg/m2,发生AP的HR值(95%CI)为1.18(1.01~1.38)。女性超重组和肥胖组发生AP的HR值(95%CI)分别为1.06(0.57~1.98)和1.62(0.81~3.21);BMI每增加1 kg/m2,发生AP的HR值(95%CI)为1.26(0.89~1.79)。见表 4。
4.敏感性分析:排除随访2年内发生AP的患者43例,Cox比例风险回归分析显示,以正常体重组为对照,超重组和肥胖组发生AP的HR=1.30(95%CI:1.01~1.68)和1.60(95%CI:1.18~2.15)。
讨论本研究人群来自开滦研究队列,通过分析研究人群不同基线BMI水平对新发AP发病风险的影响发现,肥胖是独立危险因素,且在中青年男性人群中发病风险更高。
基于我国开滦研究队列,分析显示BMI值越高,AP的发病风险越大。与正常体重组人群相比,肥胖组人群AP发病风险增加了45%;BMI每增加1 kg/m2,AP的发病风险增加3%,BMI对AP发病风险的影响呈剂量效应关系,与Hansen等[8]及Prizment等[9]的研究结果一致。Hansen等[8]对丹麦哥本哈根纳入的118 085人组成的队列进行前瞻性研究,而Prizment等[9]对美国爱荷华州36 436例 > 65岁老年女性组成的前瞻性队列进行研究,均发现BMI≥25 kg/m2与AP的较高风险相关;最近Choi等[14]在一个约513 000例韩国人的前瞻性研究中,发现BMI > 27.5 kg/m2时,AP的发病风险增加,这些研究结果均支持超重/肥胖是AP发生的危险因素。但瑞典约68 158人的前瞻性研究未发现BMI与AP的发病风险有关[7],该项研究人群体重和身高均为自我报告,且只有46~84岁的人群参与,而在本研究中,身高和体重均为专业人员测量所得,而且年龄范围广,因而本研究结果更为可靠。
本研究对年龄进行分层,< 60岁中青年肥胖人群AP的发病风险增加了58%,而≥60岁肥胖人群对AP发生风险的影响未观察到显著性意义。本研究结果提示BMI与AP的发病风险不仅呈剂量依赖效应,而且可能有年龄依赖效应。有日本研究发现中青年肥胖人群高血糖的发病风险高于老年人群[15]。研究还发现肥胖与其他代谢紊乱如高TG、高LDL-C的相关性也随着年龄的增加呈下降趋势。这些结果提示高BMI对糖、脂代谢的不良影响也呈年龄依赖效应,随年龄增加发生不良代谢结果的风险下降,这也间接支持本研究结果。
研究还发现,男性肥胖组人群发生AP的风险增加了40%,而女性肥胖组对AP发生风险的影响无统计学意义,可能与本研究的男性人群占比较大且更倾向与AP相关的不良生活方式相关,也可能与男性患者较女性患者缺乏促进脂质代谢的雌激素有关[16]。而Xiao等[17]的流行病学调查研究认为不同性别对AP发病影响无明显差异。关于性别对肥胖人群AP发病风险的影响,有待进一步研究验证。
在排除随访2年内发生AP的人群数据后,肥胖组AP的发病风险增加了60%,BMI与AP发病风险的相关性仍然有统计学意义,进一步证实本研究结果可靠。
肥胖被认为是一种慢性低度炎症,不仅可使AP的发病风险增加,也是AP预后不良的危险因素[18]。肥胖在AP发病机制中的作用尚未完全明确,可能与下列因素有关:首先,BMI的增加会导致胰腺内脂肪含量的增加,对胰腺组织本身有直接的生物毒性[19-20];其次脂肪分解释放出大量游离脂肪酸,可直接损伤胰腺腺泡细胞及血管内皮细胞,使胰腺局部缺血、缺氧、酸性环境形成,加速胰蛋白酶原活化,加重对胰腺的自身消化和损害[21];此外肥胖可导致脂肪因子失衡,引起炎症、代谢失调及多靶器官损害[22]。
多数研究认为胆石症是AP最常见的危险因素[23],本研究发现,与非胆石症组人群相比,胆石症人群发生AP的HR=2.15(95%CI:1.11~4.18),研究结果支持胆石症是AP的危险因素。研究还发现TG也是AP的危险因素,而文化程度是AP的保护因素,这一研究结果与本课题组前期研究发现一致[24]。
本研究优势在于队列人群样本量大,失访率和漏报率低。但由于随访时间相对较短,可能导致终点事件发生不完全,使新发病例较少。
综上所述,本研究认为肥胖人群发生AP的危险增加,尤其是中青年男性肥胖人群,应积极进行生活方式干预,以预防AP的发生。肥胖是WHO公认的全球流行性疾病,其发生率逐年升高,肥胖所导致的相关并发症如心脑血管疾病、2型糖尿病、肿瘤、胆石症和胰腺炎等疾病的发病风险也在增加[5, 25],所以对肥胖人群给予科学合理的营养治疗联合运动干预,合理控制体重,不仅可预防心脑血管疾病及糖尿病、肿瘤、胆石症等疾病的发生,还可预防AP的发生。
利益冲突 所有作者均声明不存在利益冲突
| [1] |
Popkin BM, Adair LS, Ng SW. Now and Then:The global nutrition transition:the pandemic of obesity in developing countries[J]. Nutr Rev, 2012, 70(1): 3-21. DOI:10.1111/j.1753-4887.2011.00456.x |
| [2] |
Morgen CS, Sørensen TIA. Global trends in the prevalence of overweight and obesity[J]. Nat Rev Endocrinol, 2014, 10(9): 513-514. DOI:10.1038/nrendo.2014.124 |
| [3] |
Ng M, Fleming T, Robinson M, et al. Global, regional, and national prevalence of overweight and obesity in children and adults during 1980-2013:a systematic analysis for the Global Burden of Disease Study 2013[J]. Lancet, 2014, 384(9945): 766-781. DOI:10.1016/S0140-6736(14)60460-8 |
| [4] |
Peery AF, Dellon ES, Lund J, et al. Burden of gastrointestinal disease in the United States:2012 Update[J]. Gastroenterology, 2012, 143(5): 1179-1187.e3. DOI:10.1053/j.gastro.2012.08.002 |
| [5] |
Yadav D, Lowenfels AB. The epidemiology of pancreatitis and pancreatic cancer[J]. Gastroenterology, 2013, 144(6): 1252-1261. DOI:10.1053/j.gastro.2013.01.068 |
| [6] |
Yang AL, Vadhavkar S, Singh G, et al. Epidemiology of alcohol-related liver and pancreatic disease in the United States[J]. Arch Intern Med, 2008, 168(6): 649-656. DOI:10.1001/archinte.168.6.649 |
| [7] |
Sadr-Azodi O, Orsini N, Andrén-Sandberg Å, et al. Abdominal and total adiposity and the risk of acute pancreatitis:a population-based prospective cohort study[J]. Am J Gastroenterol, 2013, 108(1): 133-139. DOI:10.1038/ajg.2012.381 |
| [8] |
Hansen SEJ, Madsen CM, Varbo A, et al. Body mass index, triglycerides, and risk of acute pancreatitis:a population-based study of 118000 individuals[J]. J Clin Endocrinol Metab, 2020, 105(1): 163-174. DOI:10.1210/clinem/dgz059 |
| [9] |
Prizment AE, Jensen EH, Hopper AM, et al. Risk factors for pancreatitis in older women:the Iowa Women's Health Study[J]. Ann Epidemiol, 2015, 25(7): 544-548. DOI:10.1016/j.annepidem.2014.12.010 |
| [10] |
中国超重/肥胖医学营养治疗专家共识编写委员会. 中国超重/肥胖医学营养治疗专家共识(2016年版)[J]. 中华糖尿病杂志, 2016, 8(9): 525-540. Drafting Committee of Chinese Consensus on Overweight/Obesity Medical Nutrition Therapy. Chinese consensus on overweight/obesity medical nutrition therapy (2016)[J]. Chin J Diabetes Mellit, 2016, 8(9): 525-540. DOI:10.3760/cma.j.issn.1674-5809.2016.09.004 |
| [11] |
NCD Risk Factor Collaboration (NCD-RisC). Trends in adult body-mass index in 200 countries from 1975 to 2014:a pooled analysis of 1 698 population-based measurement studies with 19·2 million participants[J]. Lancet, 2016, 387(10026): 1377-1396. DOI:10.1016/S0140-6736(16)30054-X |
| [12] |
Wu SL, Huang ZR, Yang XC, et al. Prevalence of ideal cardiovascular health and its relationship with the 4-year cardiovascular events in a northern Chinese industrial city[J]. Circ Cardiovasc Qual Outcomes, 2012, 5(4): 487-493. DOI:10.1161/CIRCOUTCOMES.111.963694 |
| [13] |
中华医学会消化病学分会胰腺疾病学组, 《中华胰腺病杂志》编辑委员会, 《中华消化杂志》编辑委员会. 中国急性胰腺炎诊治指南(2019, 沈阳)[J]. 中华胰腺病杂志, 2019, 19(5): 321-331. Pancreatic Disease Group, Digestive Disease Branch, Chinese Medical Association, Editorial Board for Chinese Journal of Pancreatology, Editorial Board for Chinese Journal of Gastroenterology. Guideline for the diagnosis and treatment of acute pancreatitis in China[J]. Chin J Pancreatol, 2019, 19(5): 321-331. DOI:10.3760/cma.j.issn.1674-1935.2019.05.001 |
| [14] |
Choi JS, Yi SW, Park JW, et al. Body mass index and the risk of acute pancreatitis by etiology:a prospective analysis of Korean National Screening Cohort[J]. J Gastroenterol Hepatol, 2019, 34(3): 603-611. DOI:10.1111/jgh.14570 |
| [15] |
Wakabayashi I, Daimon T. Age-dependent decline of association between obesity and hyperglycemia in men and wemen[J]. Diabetes Care, 2012, 35(1): 175-177. DOI:10.2337/dc11-1775 |
| [16] |
Chen JQ, Brown TR, Russo J. Regulation of energy metabolism pathways by estrogens and estrogenic chemicals and potential implications in obesity associated with increased exposure to endocrine disruptors[J]. Biochim Biophys Acta Mol Cell Res, 2009, 1793(7): 1128-1143. DOI:10.1016/j.bbamcr.2009.03.009 |
| [17] |
Xiao AY, Tan MLY, Wu LM, et al. Global incidence and mortality of pancreatic diseases:a systematic review, Meta-analysis, and Meta-regression of population-based cohort studies[J]. Lancet Gastroenterol Hepatol, 2016, 1(1): 45-55. DOI:10.1016/S2468-1253(16)30004-8 |
| [18] |
Hong S, Qiwen B, Ying J, et al. Body mass index and the risk and prognosis of acute pancreatitis:a Meta-analysis[J]. Eur J Gastroenterol Hepatol, 2011, 23(12): 1136-1143. DOI:10.1097/MEG.0b013e32834b0e0e |
| [19] |
Acharya C, Cline RA, Jaligama D, et al. Fibrosis reduces severity of acute-on-chronic pancreatitis in humans[J]. Gastroenterology, 2013, 145(2): 466-475. DOI:10.1053/j.gastro.2013.05.012 |
| [20] |
Navina S, Acharya C, DeLany JP, et al. Lipotoxicity causes multisystem organ failure and exacerbates acute pancreatitis in obesity[J]. Sci Transl Med, 2011, 3(107): 107ra110. DOI:10.1126/scitranslmed.3002573 |
| [21] |
杨立新, 陈婧, 杜丽川, 等. 体重指数及腰臀比与高脂血症急性胰腺炎严重程度和并发症的相关性研究[J]. 中国现代医学杂志, 2016, 26(24): 129-132. Yang LX, Chen J, Du LC, et al. Correlation between severity and complications of hyperlipidemic acute pancreatitis and Body Mass Index and Waist Hip Ratio[J]. China J Mod Med, 2016, 26(24): 129-132. DOI:10.3969/j.issn.1005-8982.2016.24.028 |
| [22] |
Junior GBDS, Bentes ACSN, Daher EDF, et al. Obesity and kidney disease[J]. J Bras Nefrol, 2017, 39(1): 65-69. DOI:10.5935/0101-2800.20170011 |
| [23] |
Yadav D, Lowenfels AB. Trends in the epidemiology of the first attack of acute pancreatitis:a systematic review[J]. Pancreas, 2006, 33(4): 323-330. DOI:10.1097/01.mpa.0000236733.31617.52 |
| [24] |
朱国玲, 张冰, 吉瑞更, 等. 基线三酰甘油水平与急性胰腺炎发病风险的前瞻性队列研究[J]. 中华消化杂志, 2018, 38(12): 829-834. Zhu GL, Zhang B, Ji RG, et al. A prospective cohort study on triglycerides levels and risk of acute pancreatitis[J]. Chin J Digest, 2018, 38(12): 829-834. DOI:10.3760/cma.j.issn.0254-1432.2018.12.008 |
| [25] |
US Preventive Services Task Force. Behavioral weight loss interventions to prevent obesity-related morbidity and mortality in adults:US preventive services task force recommendation statement[J]. JAMA, 2018, 320(11): 1163-1171. DOI:10.1001/jama.2018.13022 |
 2021, Vol. 42
2021, Vol. 42