文章信息
- 陈靖, 李晓清, 卢晓晓, 邢荣琴, 李虹, 张晓红, 魏志云, 穆生财, 冯立忠, 王素萍.
- Chen Jing, Li Xiaoqing, Lu Xiaoxiao, Xing Rongqin, Li Hong, Zhang Xiaohong, Wei Zhiyun, Mu Shengcai, Feng Lizhong, Wang Suping
- 新型冠状病毒灭活疫苗不同接种间隔的免疫原性和安全性研究
- A randomized controlled trial study of immunogenicity and safety of an inactivated SARS-CoV-2 vaccine in different immunization schedules
- 中华流行病学杂志, 2021, 42(12): 2077-2081
- Chinese Journal of Epidemiology, 2021, 42(12): 2077-2081
- http://dx.doi.org/10.3760/cma.j.cn112338-20210807-00617
-
文章历史
收稿日期: 2021-08-07
2. 山西医科大学公共卫生学院流行病学教研室, 太原 030001;
3. 山西航空产业集团有限公司, 太原 030031
2. School of Public Health, Shanxi Medical University, Taiyuan 030001, China;
3. Shanxi Aviation Industry Group Co., LTD, Taiyuan 030031, China
由新型冠状病毒(新冠病毒)感染引起的新型冠状病毒肺炎(新冠肺炎)大流行正在全球蔓延,是威胁公众健康的重大公共卫生问题[1]。截至2021年7月底,新冠病毒已蔓延至全球223个国家和地区,造成超过1.97亿人感染和420万人死亡[2]。
接种新冠病毒疫苗是控制新冠肺炎疫情的重要措施[3]。新冠病毒灭活疫苗安全性高、免疫原性较好[4-11],同时储存要求低,WHO已将中国2种灭活疫苗(国药集团中国生物技术股份有限公司和中国北京科兴中维生物技术有限公司)列入紧急使用清单。现有研究显示,一般人群按不同程序接种新冠病毒灭活疫苗后可产生较好的免疫效果[6-11],中国接种指南建议2剂之间的接种间隔≥3周,并在8周内尽早完成[12],新冠病毒灭活疫苗说明书上注明接种间隔2~4周,但均无明确最佳接种的时间间隔。在我国疫情防控中,公安人员在秩序维持、隔离封控、卡点值守、车辆查控方面发挥着重要作用,是新冠疫情主要防控力量之一,其暴露风险高,是新冠病毒感染的高危人群,但目前尚无该人群的相关研究。为进一步了解该人群接种新冠病毒灭活疫苗后的免疫效果,本研究在山西省公安人员中进行了不同方案接种新冠病毒灭活疫苗免疫效果比较的随机对照试验,旨在评价公安人员按不同方案(0~14 d、0~21 d、0~28 d)接种新冠病毒灭活疫苗的免疫原性和安全性,为优化新冠病毒灭活疫苗接种方案提供科学依据。
对象与方法1.研究对象:在山西省太原市公安系统内公开招募警务工作人员参加不同方案新冠病毒灭活疫苗免疫效果的随机对照试验。纳入标准:①年龄18~59岁;②近14 d无疫苗接种史;③无新冠病毒感染史;④新冠病毒核酸检测阴性;⑤签署知情同意书。排除标准:①孕期或哺乳期妇女;②发热;③对疫苗任何成分不耐受或过敏;④有过敏、惊厥、癫痫、脑病和精神病等病史或家族史;⑤患免疫缺陷病、恶性肿瘤治疗期间、接受免疫抑制剂治疗(口服类固醇激素)或HIV导致的免疫力低下;⑥患严重的肝肾疾病、呼吸系统疾病、心血管疾病,恶性肿瘤;⑦各种急性疾病或慢性疾病急性发作期;⑧未签署知情同意书。研究由山西省CDC伦理委员会审查(批准文号:SXCDCIRBPJ2020056001),并在中国临床试验中心注册(ChiCTR2100041706)。
2.研究内容与方法:
(1)基线调查和标本采集:通过问卷星自填电子问卷方式,收集一般人口学特征、疫苗接种情况等信息,采集研究对象咽拭子和非抗凝肘静脉血。
(2)随机对照试验:①随机分组:由专业人员通过SAS 9.4软件生成随机数字表,将符合接种纳入标准的405名研究对象通过区组随机(区组为6)按1∶1∶1比例分为0~14 d、0~21 d和0~28 d方案组,每组均接种2剂新冠病毒灭活疫苗;②盲法:本研究未设盲法,为开放性试验;③疫苗接种:由具有疫苗接种资质的护士按照不同接种方案对3组研究对象肌肉注射接种新冠病毒灭活疫苗。所接种疫苗为国药集团中国生物技术股份有限公司北京生物制品研究所(国药中生)生产(批号:202007037,202007036),每瓶0.5 ml,含新冠病毒(灭活)4 µg,上臂三角肌注射用0.5 ml/人次;④随访:在第2剂接种完成后28 d进行随访,采集研究对象咽拭子和非抗凝肘静脉血。
3.实验室检测:由具有检测资质的机构采用RT-PCR检测新冠病毒核酸,采用活病毒微量病变法检测新冠病毒中和抗体。待测血清预先经1∶2倍稀释,再经2倍系列稀释至所需稀释度,加入等体积不同毒株的攻击病毒液,37 ℃培养箱内中和2 h后,加入1.0×105/ml~2.5×105/ml的细胞悬液0.1 ml/孔,置37 ℃ CO2培养箱中培养,第4天判定结果。检测用毒株为19nCoV-CDC-Tan-strain 05(QD01)。计算中和终点(将血清稀释度转化为对数),即能够保护50%细胞不受病毒攻击感染的血清最高稀释度为该血清的抗体效价。血清阳转定义:如果基线中和抗体效价低于1∶4,接种后28 d中和抗体效价至少达到1∶16;若基线中和抗体效价至少为1∶4,则接种后28 d效价相较于基线至少增加4倍[10]。
4.安全性评估:每针次接种后留观30 min,并向接种者提供疫苗接种日记卡,记录其30 min内和0~7 d的征集性不良反应,并在8~28 d通过自发报告和常规随访进行非征集性不良反应的收集。常见的不良反应包括局部反应(红斑、水肿、疼痛、硬结、红晕、肿胀、皮疹、瘙痒)和全身反应(发热、头痛、乏力、恶心、呕吐、咳嗽、疲劳、腹泻、急性过敏反应)。不良反应的分级标准主要依据《预防用疫苗临床试验不良事件分级标准指导原则》进行评估[13]。为了尽可能及时、准确地收集不良反应情况,在签署知情同意书和接种后留观时均对研究对象进行不良反应及其填写注意事项的说明,以确保研究对象能正确理解,并在随访时提醒研究对象及时、如实填写日记卡和非征集性不良反应的报告。
5.样本量的计算:本研究通过PASS 15.0软件计算样本量(方差分析),检验水准α为0.05,检验效能1-β为80%,根据临床研究的数据或文献获得的一般疫苗程序接种后新冠病毒中和抗体GMT为160~180,标准差为100~120。考虑到20%的脱落率,最终确定每组观察人数为120名,3组总样本量总计360名。
6.统计学分析:采用EpiData 3.1软件进行数据双录入,经校验核对后,使用SAS 9.4软件进行数据整理分析。主要研究指标是新冠病毒中和抗体,用GMT表示,计量资料采用x±s描述,采用方差分析进行统计学分析;计数资料采用构成比或率描述,采用χ2检验或Fisher确切概率法进行统计学分析。本次研究的免疫效果主要以依从者分析(遵循接种方案完成接种并完成随访者为分析对象)结果为主,为避免由于排除受试者而导致的潜在偏倚,对受试者的免疫效果同时进行意向治疗分析(以接受随机分组者为分析对象,未接种或未随访者其新冠病毒中和抗体GMT按1∶4赋值)。P < 0.05为差异有统计学意义。
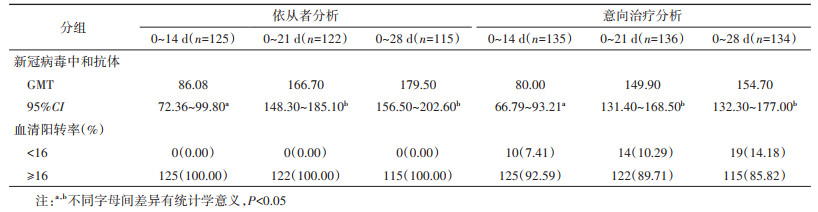
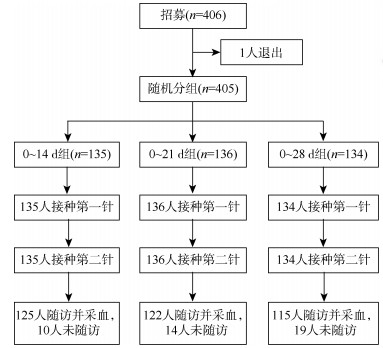
结果1.一般情况:研究共纳入405名研究对象,0~14 d、0~21 d和0~28 d组各135、136和134名。其中男性339名(83.70%)、女性66名(16.30%);54.07%(219/405)年龄在18~39岁;98.77%(400/405)为大专及以上文化程度;39.50%(160/405)BMI正常;所有研究对象核酸检测结果均为阴性。研究对象基本情况在3组间均衡可比(P > 0.05)。见表 1。3组分别有125名(92.59%)、122名(89.71%)和115名(85.82%)完成全程接种及全程接种后28 d的随访。见图 1。
|
| 图 1 公安人员新冠病毒灭活疫苗接种效果研究流程 |
2.免疫原性:全程接种后28 d时,0~14 d、0~21 d和0~28 d组新冠病毒中和抗体GMT分别为86.08(95%CI:72.36~99.80)、166.70(95%CI:148.30~ 185.10)和179.50(95%CI:156.50~202.60),方差分析结果表明,0~21 d和0~28 d组新冠病毒中和抗体水平接近(P > 0.05),且均明显高于0~14 d组(P < 0.001)。3组新冠病毒中和抗体血清阳转率均为100%。意向治疗分析与依从者分析结果类似,0~21 d和0~28 d组新冠病毒中和抗体水平接近(P > 0.05),且均明显高于0~14 d组(P < 0.001);血清阳转率(0~14 d vs. 0~21 d vs. 0~28 d:92.59% vs. 89.71% vs. 85.82%)差异无统计学意义(P > 0.05)。见表 2。
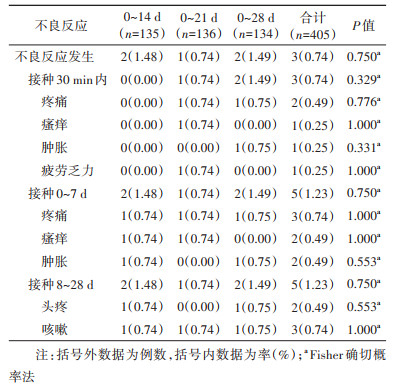
3.安全性:405名研究对象纳入安全性分析。接种者总不良反应发生率为0.74%(3/405),0~14 d、0~21 d和0~28 d组不良反应总发生率分别为1.48%(2/135)、0.74%(1/136)和1.49%(2/134)(P=0.750),均为轻度不良反应。接种30 min内、0~7 d、8~28 d 3个接种方案不良反应的发生差异均无统计学意义(P > 0.05)。见表 3。
本研究采用随机对照试验的方法,比较了公安人员按0~14 d、0~21 d和0~28 d方案组接种国药中生4 μg新冠病毒灭活疫苗的免疫原性和安全性。依从者分析结果发现,全程接种后28 d时新冠病毒中和抗体血清阳转率均为100%,而0~21 d和0~28 d组新冠病毒中和抗体GMT(166.70和179.50)均明显高于0~14 d组(86.08)(P < 0.001),这与健康人群中新冠病毒灭活疫苗Ⅱ期免疫方案比较的结果一致[6, 8, 11, 14]。Xia等[8]在河南省商丘市18~59岁健康人群中进行的一项Ⅱ期随机对照试验研究中发现,0~14 d、0~21 d和0~28 d组全程接种4 μg新冠病毒灭活疫苗后28 d新冠病毒中和抗体GMT分别为169.5(95%CI:132.2~217.1)、282.7(95%CI:221.2~361.4)和218.0(95%CI:181.8~261.3),0~21 d和0~28 d组中和抗体GMT明显高于0~14 d组(P < 0.05);在河南省武陟县18~59岁健康人群进行的5 μg新冠病毒灭活疫苗Ⅱ期随机对照试验也显示[11],0~21 d组GMT [247(95%CI:176~345)]明显高于0~14 d组[121(95%CI:95~154)]。Zhang等[6]和Pan等[14]进行了0~14 d、0~28 d多种不同剂量新冠病毒灭活疫苗的Ⅱ期临床试验,结果显示0~28 d新冠病毒中和抗体GMT均高于0~14 d [3 μg:44.1(37.2,52.2)vs. 23.8(20.5,27.7),6 μg:65.4(56.4,75.9)vs. 30.1(26.1,34.7);5 μg:131.7(109.3,158.6)vs. 110.5(92.4,132.2),10 μg:110.7(94.7,129.4)vs. 100.2(84.6,118.7)]。提示与0~14 d较短的间隔时间相比,第1剂和第2剂新冠病毒灭活疫苗接种间隔0~21 d或0~28 d能产生更高的抗体反应。此外,本研究中新冠病毒中和抗体是由具有检测资质的机构采用活病毒微量病变法进行检测,该方法准确可靠,结果可信。
本研究安全性结果显示,0~14 d、0~21 d、0~28 d 3个方案组不良反应主要表现为疼痛、瘙痒、肿胀(0.74%、0.49%、0.49%)等轻度不良反应,且报告发生率低于现有研究[6-11, 14],这可能与公安人员本身身体素质好,不良反应发生较少有关,也可能是由于公安人员忙于工作而出现漏报。结合现有其他研究可以认为新冠病毒灭活疫苗安全性较好。
本研究存在局限性。首先,本研究只比较了第2剂接种后的免疫原性,疫苗持久性和消减情况的研究尚在进行中。其次,本研究对象为公安人员,与一般人群的身体素质和体能有所不同,其可比性受到限制。另外,部分研究对象未完成接种后的随访,存在一定的失访(失访率7.41%~14.18%),对免疫原性结果可能会产生一定影响,且在不良反应的收集时,可能存在漏报等报告偏倚。
利益冲突 所有作者均声明不存在利益冲突
| [1] |
Walker PGT, Whittaker C, Watson OJ, et al. The impact of COVID-19 and strategies for mitigation and suppression in low-and middle-income countries[J]. Science, 2020, 369(6502): 413-422. DOI:10.1126/science.abc0035 |
| [2] |
World Health Organization. WHO Coronavirus (COVID-19) Dashboard[EB/OL]. (2021-08-02)[2021-08-02]. https://covid19.who.int.
|
| [3] |
Amanat F, Krammer F. SARS-CoV-2 vaccines: status report[J]. Immunity, 2020, 52(4): 583-589. DOI:10.1016/j.immuni.2020.03.007 |
| [4] |
Gao Q, Bao LL, Mao HY, et al. Development of an inactivated vaccine candidate for SARS-CoV-2[J]. Science, 2020, 369(6499): 77-81. DOI:10.1126/science.abc1932 |
| [5] |
Wang H, Zhang YT, Huang BY, et al. Development of an inactivated vaccine candidate, BBIBP-CorV, with potent protection against SARS-CoV-2[J]. Cell, 2020, 182(3): 713-721. DOI:10.1016/j.cell.2020.06.008 |
| [6] |
Zhang YJ, Zeng G, Pan HX, et al. Safety, tolerability, and immunogenicity of an inactivated SARS-CoV-2 vaccine in healthy adults aged 18-59 years: a randomised, double-blind, placebo-controlled, phase 1/2 clinical trial[J]. Lancet Infect Dis, 2021, 21(2): 181-192. DOI:10.1016/S1473-3099(20)30843-4 |
| [7] |
Wu ZW, Hu YL, Xu M, et al. Safety, tolerability, and immunogenicity of an inactivated SARS-CoV-2 vaccine (CoronaVac) in healthy adults aged 60 years and older: a randomised, double-blind, placebo-controlled, phase 1/2 clinical trial[J]. Lancet Infect Dis, 2021, 21(6): 803-812. DOI:10.1016/S1473-3099(20)30987-7 |
| [8] |
Xia SL, Zhang YT, Wang YX, et al. Safety and immunogenicity of an inactivated SARS-CoV-2 vaccine, BBIBP-CorV: a randomised, double-blind, placebo-controlled, phase 1/2 trial[J]. Lancet Infect Dis, 2021, 21(1): 39-51. DOI:10.1016/S1473-3099(20)30831-8 |
| [9] |
Che YC, Liu XQ, Pu Y, et al. Randomized, double-blinded, placebo-controlled phase 2 trial of an inactivated severe acute respiratory syndrome coronavirus 2 vaccine in healthy adults[J]. Clin Infect Dis, 2020, ciaa1703. DOI:10.1093/cid/ciaa1703 |
| [10] |
Al Kaabi N, Zhang YT, Xia SL, et al. Effect of 2 inactivated SARS-CoV-2 vaccines on symptomatic COVID-19 infection in adults: a randomized clinical trial[J]. JAMA, 2021, 326(1): 35-45. DOI:10.1001/jama.2021.8565 |
| [11] |
Xia SL, Duan K, Zhang YT, et al. Effect of an inactivated vaccine against SARS-CoV-2 on safety and immunogenicity outcomes: interim analysis of 2 randomized clinical trials[J]. JAMA, 2020, 324(10): 951-960. DOI:10.1001/jama.2020.15543 |
| [12] |
国家卫生健康委员会疾病预防控制局. 新冠病毒疫苗接种技术指南(第一版)[J]. 中国病毒病杂志, 2021, 11(3): 161-162. Bureau of Disease Prevention and Control National Health Commission. Guidelines of vaccination for COVID-19 vaccines in China (First edition)[J]. Chin J Viral Dis, 2021, 11(3): 161-162. DOI:10.16505/j.2095-0136.2021.0018 |
| [13] |
国家药品监督管理局. 国家药监局关于发布预防用疫苗临床试验不良事件分级标准指导原则的通告[EB/OL]. (2019-12-31)[2021-08-02]. https://www.nmpa.gov.cn/xxgk/ggtg/qtggtg/20191231111901460.html. National Medical Products Administration. NMPA Issued the Guidelines for Adverse Event Classification Standards for Clinical Trials of Preventive Vaccines[EB/OL]. (2019-12-31)[2021-08-02]. https://www.nmpa.gov.cn/xxgk/ggtg/qtggtg/20191231111901460.html. |
| [14] |
Pan HX, Liu JK, Huang BY, et al. Immunogenicity and safety of a severe acute respiratory syndrome coronavirus 2 inactivated vaccine in healthy adults: randomized, double-blind, and placebo-controlled phase 1 and phase 2 clinical trials[J]. Chin Med J (Engl), 2021, 134(11): 1289-1298. DOI:10.1097/CM9.0000000000001573 |
 2021, Vol. 42
2021, Vol. 42