文章信息
- 裴蕊欣, 武彩红, 闫佳欣, 丁玲, 宋丽, 吕元婧, 王捷, 刘虹, 孟丹, 祁卓, 郝敏, 王金桃.
- Pei Ruixin, Wu Caihong, Yan Jiaxin, Ding Ling, Song Li, Lyu Yuanjing, Wang Jie, Liu Hong, Meng Dan, Qi Zhuo, Hao Min, Wang Jintao
- 多环芳烃暴露对高危型人乳头瘤病毒感染转归影响的前瞻性队列研究
- Effects of polycyclic aromatic hydrocarbons exposure on prognosis of high risk human papillomavirus infection: a prospective cohort study
- 中华流行病学杂志, 2021, 42(11): 2060-2065
- Chinese Journal of Epidemiology, 2021, 42(11): 2060-2065
- http://dx.doi.org/10.3760/cma.j.cn112338-20210406-00278
-
文章历史
收稿日期: 2021-04-06
2. 山西医科大学第二医院妇产科, 太原 030001
2. Department of Obstetrics and Gynecology, Second Hospital of Shanxi Medical University, Taiyuan 030001, China
宫颈癌是全球女性第四大常见癌症[1],严重威胁女性健康。低度宫颈上皮内瘤变(CINⅠ)为宫颈癌前病变的早期阶段,约有30%的CINⅠ患者持续或进展为高级别的宫颈病变乃至宫颈浸润癌[2]。高危型人乳头瘤病毒(HR-HPV)持续感染是宫颈癌及其癌前病变的主要病因因素[3-5],但是究竟何种原因导致HR-HPV持续感染目前尚不清楚。多环芳烃(PAHs)是一类广泛存在于环境中的有机污染物,不仅可诱发机体产生急性毒性、免疫毒性、神经毒性和胎盘毒性[6],而且与人类肺癌、乳腺癌等多种癌症的发生有关[7-8]。PAHs在机体代谢后主要产生1-羟基芘(1-OHP)、2-羟基芴(2-FLU)、1-羟基菲(1-PHE)等,其中尿液中的1-OHP作为反映人体PAHs内暴露剂量、敏感性较高、特异性较强的生物标志物,被广泛用于评价人体PAHs暴露情况[9]。本课题组前期研究发现,PAHs高暴露可增加宫颈上皮内瘤变的患病风险,特别是与HR-HPV感染相结合时风险更大[10]。本研究采用前瞻性队列研究的方法,旨在了解PAHs暴露对CINⅠ患者HR-HPV感染转归的影响,以期为预防和控制HR-HPV持续感染及宫颈病变的恶性转化提供新思路。
对象与方法1. 研究对象:2014年6-12月在山西省介休市和阳曲县社区建立的自然人群队列[10-11]。在对研究初期招募到的39 988名女性经宫颈液基薄层细胞学筛查,诊断为不典型鳞状细胞的2 769名女性中,排除资料信息不完整(387名)和拒绝参加后续检查者(68名)后,2 314名女性接受了HPV检测、阴道镜检查以及组织病理学检查。进一步排除10名不合格样本后对2 304名女性进行了病理学检查,诊断为正常宫颈者1 503名,CIN Ⅰ 564名、中重度宫颈上皮内瘤变者(CIN Ⅱ/Ⅲ)218名,以及宫颈鳞状细胞癌患者19名。本研究将其中的564名CIN Ⅰ患者纳入研究,包括基线HPV感染和未感染者,24个月后实施了随访,共有483名完成了全程随访,并接受HPV二次检测,在随访过程中未纳入新的研究对象。研究对象的纳入排除标准参照文献[11],研究对象均签署了知情同意书,本研究获得了山西医科大学伦理委员会审批(批准文号:2013-003)。
2. 基线资料与标本收集:由经过严格培训的调查员采用统一的结构式问卷收集研究对象的人口学特征、生殖情况、既往病史、临床资料以及生活卫生习惯等资料的基础上,采集研究对象的晨尿30 ml,取1 ml尿液置于1.5 ml EP管中进行尿肌酐检测,剩余尿液分装后立即置于-80 ℃冰箱保存,用于1-OHP的检测。同时,由具有专业执业资质的妇科临床医生采用扩阴器将宫颈暴露,使用棉拭子擦去宫颈口的分泌物后,将HPV专用宫颈刷置于阴道侧壁1/3处,轻轻搓动宫颈刷使其顺时针旋转3~5周,将其放入加有专用细胞保存液的取样管,收集宫颈脱落细胞并置于-4 ℃冰箱保存,于24 h内完成HPV的分型检测。
3. PAHs暴露的确定:根据研究对象基线检测的尿液中的1-OHP浓度,确定研究对象的PAHs暴露水平。
4. 随访结局的确定:与研究对象基线HR-HPV检测结果比较,基线HR-HPV阳性24个月随访时仍为阳性者判为持续感染(其中单一型别或与其他型别重叠感染者判为同型持续感染),转阴者判为阳转阴;基线HR-HPV阴性24个月随访时仍为阴性者判为持续阴性,转为阳性者判为阴转阳。
5. 实验方法:所有实验均由经过专项培训的专业人员完成,并统一检测标准和方法。
(1)尿液中的1-OHP浓度检测:采用高效液相色谱法对尿液中的1-OHP进行浓度检测。参照课题组前期建立的方法[10-11],主要操作步骤:取2 ml尿液用碱水解法预处理后,设定流动相为75%甲醇(色谱级)和25%超纯水,以等度方式进行洗脱,流速为1.0 ml/min,进样时间10 min,进样体积10 μl,柱温箱温度为30 ℃。采用反相C18高效液相色谱柱(150 mm×4.6 mm×5 μm;美国Waters公司),利用配置有2475多波长荧光检测器(美国Waters公司)的Alliance E2695高效液相色谱仪(美国Waters公司)进行检测,激发波长λex=346 nm,发射波长λem=386 nm,检出限为0.02 µg/L。根据绘制好的标准曲线(Y=0.067 5X-0.031 5,R2=0.999 1)及相应公式计算尿液中的1-OHP浓度,尿肌酐校正后获得最终浓度(μmol/molCr)。每次检测均设置平行样本,保证结果的可重复性。
(2)HR-HPV感染状态及分型检测:采用导流杂交法检测HR-HPV感染状态及型别。应用HPV-DNA提取试剂盒和HPV分型检测试剂盒(潮州凯普生物化学有限公司),参照课题组前期建立的方法[10],使用DNA提取试剂盒从沉淀物中提取HPV-DNA。严格按照说明书进行规范检测和结果判定。本研究涵盖了其中的绝大多数型别(HPV16、18、31、33、35、39、45、51、52、53、56、58、59、66和68,共15种)。检测结果中包含任意一种高危型别(无论是否与其他型别共同感染)即定义为HR-HPV感染。
6. 统计学分析:采用EpiData 3.1软件录入问卷,进行双录入和双核查。采用SPSS 23.0软件进行数据分析,定量资料采用F检验、纽曼-科伊尔斯检验(Student-Newman-Keuls)分析,分类资料应用χ2检验或趋势性χ2检验。使用Cox比例风险回归模型计算PAHs暴露对HR-HPV感染转归的效应指标RR值(95%CI)、aRR值(95%CI)和归因危险度百分比(AR%)。采用限制性立方条样模型分析尿液中的1-OHP浓度与HR-HPV转归结局的剂量-反应关系,应用R Studio软件的rms包绘制限制性立方样条图。检验水准α=0.05。
结果1. 基本特征:本研究选择了564名CIN Ⅰ患者,经过24个月的随访后,共有483名完成随访,研究对象的年龄为51(44~56)岁,初中及以下文化程度者占62.5%,在婚者占81.9%,随访率为85.6%(483/564)。483名在访者与失访者在年龄、家庭人均年收入、文化程度、职业等方面差异无统计学意义(P > 0.05)。
2. HR-HPV感染转归及型别分布:在基线HR-HPV阳性者中,持续感染率为52.4%(75/143),同型持续感染率为35.7%(51/143)、阳转阴率为47.6%(68/143);在基线HR-HPV阳性者中,阴转阳率为19.7%(67/340)、持续阴性率为80.3%(273/340)。各种转归型别分布分析显示,同型HR-HPV持续感染的主要型别依次为HPV16(17/51,33.3%)、HPV58(7/51,13.7%)、HPV53(7/51,13.7%)、HPV52(7/51,13.7%);阳转阴的主要型别分别为HPV16(23/68,33.8%)、HPV58(14/68,20.6%)、HPV18(7/68,10.3%)、HPV52(6/68,8.8%);阴转阳的主要型别依次为HPV16(16/67,23.9%)、HPV58(15/67,22.4%)、HPV52(11/67,16.4%)、HPV51(10/67,14.9%)。见图 1。

|
| 图 1 HR-HPV感染转归结局的型别分布 |
3. HR-HPV感染转归的相关因素分析:研究对象在文化程度、职业、婚姻状况、家庭人均年收入、洗澡频率、换内裤频率、性生活后清洗、非经期使用护垫、月经史、产次和流产史等方面未见与HR-HPV感染转归有统计学关联(P > 0.05),但年龄(χ2=23.08,P < 0.01)、绝经状况(χ2=5.12,P=0.02)与HR-HPV感染转归有统计学关联。
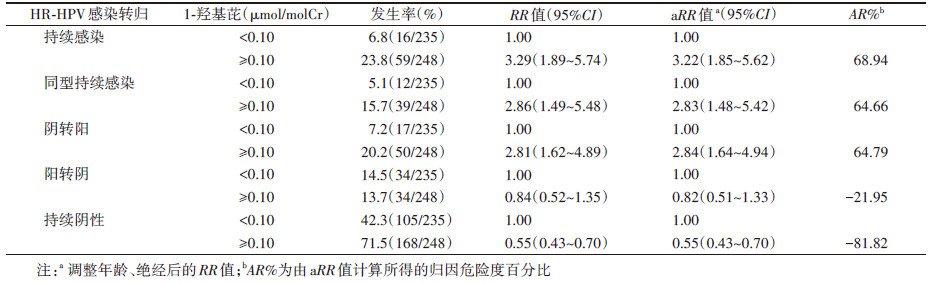
4. PAHs在不同HR-HPV感染转归女性中的分布:1-OHP水平(μmol/molCr)在不同HR-HPV感染转归组中差异有统计学意义(F=43.56,P < 0.05),其中持续感染组的1-OHP水平高于阳转阴组和持续阴性组,阴转阳组的1-OHP水平高于阳转阴和持续阴性组,且差异均有统计学意义(P < 0.05)。见图 2。
|
| 注:aP < 0.05 图 2 不同HR-HPV感染转归结局1-羟基芘(1-OHP)分布 |
5. PAHs暴露对HR-HPV感染转归的影响:根据研究对象尿液中的1-OHP中位数(0.10 μmol/molCr)分为高低暴露组,分析PAHs暴露对HR-HPV感染转归的影响。结果显示,PAHs高暴露组HR-HPV持续感染、同型持续感染、阳转阴的发生率高于较低暴露组(P < 0.01),持续阴性率则相反(P < 0.01)。见表 1。
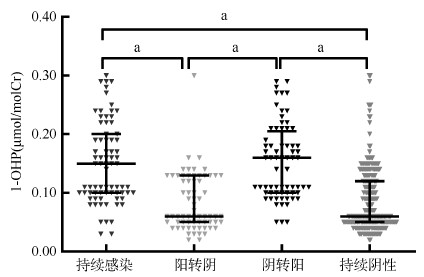
为了排除前述分析中与HR-HPV感染转归密切相关的年龄和绝经因素对结果的可能干扰,进一步按照年龄和绝经状况分层,进行PAHs暴露对HR-HPV感染转归影响的分析。结果显示,PAHs高暴露(≥0.10 μmol/molCr)可增加 < 50岁女性(aRR=3.97,95%CI:1.90~8.29)和未绝经女性(aRR=4.05,95%CI:1.94~8.44)阴转阳的风险。无论年龄如何、是否绝经,PAHs高暴露发生HR-HPV持续感染、同型持续感染的风险均增加,发生持续阴性的风险均降低。见图 3。
|
| 注:年龄中aRR值为调整绝经后的RR值,绝经状况中aRR值为调整年龄后的RR值 图 3 不同年龄和绝经状况下多环芳烃暴露对HR-HPV感染转归的影响 |
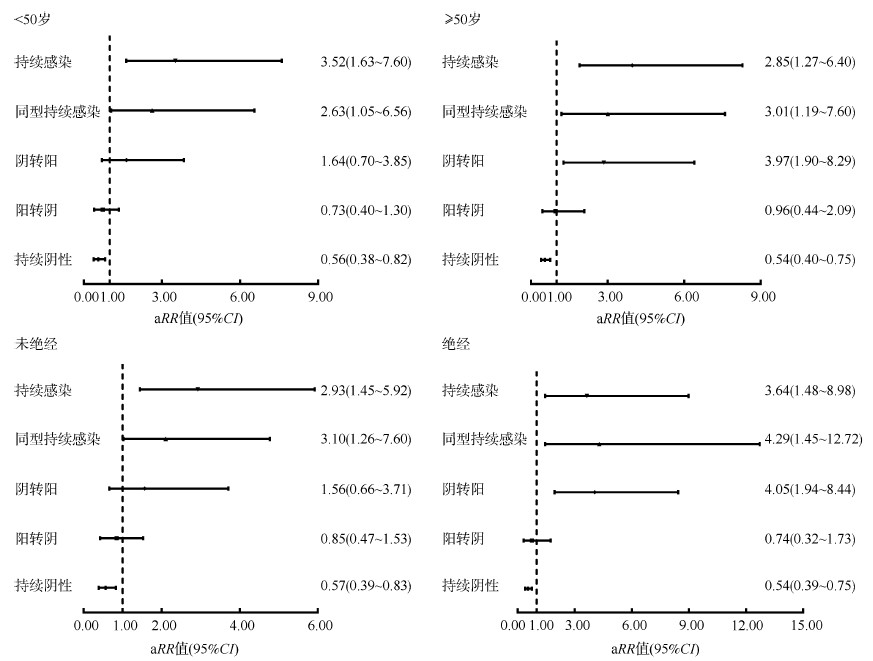
6. PAHs暴露对HR-HPV感染转归影响的剂量-反应关系:采用限制性立方样条拟合PAHs对HR-HPV转归影响的Cox回归模型,调整年龄和绝经后,结果显示,尿液中的1-OHP水平对HR-HPV持续感染(χ2=27.02,P < 0.01)和同型持续感染(χ2=18.56,P < 0.01)影响的效应呈线性剂量-反应关系(非线性检验:P > 0.01),对阴转阳(χ2=13.47,P < 0.01)和持续阴性(χ2=36.78,P < 0.01)影响的效应呈非线性剂量-反应关系(非线性检验:P < 0.01)。随着1-OHP浓度的增高,HR-HPV持续感染、同型持续感染和阴转阳的aRR值(95%CI)呈升高趋势,持续阴性的aRR值(95%CI)呈下降趋势,而在HR-HPV阳转阴中未见相似趋势。见图 4。
|
| 注:aRR值为调整年龄、绝经后的RR值;1-OHP∶1-羟基芘 图 4 多环芳烃暴露对HR-HPV感染转归影响的剂量-反应关系 |
宫颈癌是危害女性健康的第四大恶性肿瘤[1],HR-HPV持续感染是导致宫颈癌发生的主要病因[3-5]。研究表明,80%以上的女性一生中至少发生一次HPV感染,其中10%为持续性感染[12]。目前发现的HPV有120多种类型,其中14种以上型别可引起癌症,被称为HR-HPV[13]。不同的HR-HPV亚型具有不同的公共卫生学意义。本研究显示,基线HR-HPV感染率为30.2%,24个月后随访时持续感染率为52.4%。不同国家和地区,发生HR-HPV感染转归的主要型别有所差异,一项丹麦的研究发现,相对于其他型别,HPV16、58和31更易发生持续感染[14],Bulkmans等[15]在荷兰的研究显示,清除率最低的前几位型别依次为HPV16、31、33和18,而本研究持续感染率最高的型别包括HPV16、58、53和52。提示,HPV16是HR-HPV持续感染的主要型别,特别值得关注的是,在本地区感染HPV58、53、52后也容易发生持续感染。
PAHs是一种环境中普遍存在的公认致癌物质,国内外研究表明,PAHs暴露与宫颈癌及宫颈癌前病变密切相关,本课题组前期研究发现,PAHs高暴露与HR-HPV感染均可增加宫颈癌前病变的患病风险,两者在CIN Ⅱ/Ⅲ的发生发展过程中存在协同作用[10]。基于细胞实验的结果提示,苯并芘可能导致HPV31、16、18病毒滴度的升高[16]。本研究基于人群为基础的前瞻性队列研究发现,HR-HPV持续感染和阴转阳的女性中归因于PAHs高暴露者高达68.9%和64.8%,随着PAHs暴露水平的不断增加,HR-HPV发生持续感染、同型持续感染和阴转阳的概率呈不断升高趋势,而HR-HPV持续阴性率则呈不断降低趋势。提示积极预防和减少PAHs暴露对阻碍HR-HPV持续感染、阴转阳及持续阴性的保持具有非常重要的作用。
本研究基于自然社区人群队列,前瞻性地分析了PAHs暴露对女性HR-HPV感染转归的影响,结果显示,PAHs高暴露可促进HR-HPV持续感染、阴转阳及阻碍HR-HPV持续阴性的发生,从PAHs的角度为控制HR-HPV感染转归提供了重要依据。然而,由于本研究中随访发生HR-HPV感染转归的人数较少,未能分析PAHs暴露对不同型别HR-HPV感染转归的影响。鉴于HR-HPV感染转归的复杂性,未来我们将对HR-HPV感染转归及其致癌机制进行深入研究,为防控HR-HPV持续感染及宫颈病变的发生提供更有力的证据。
利益冲突 所有作者均声明不存在利益冲突
| [1] |
Sung H, Ferlay J, Siegel RL, et al. Global cancer statistics 2020:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA: Cancer J Clin, 2021, 71(3): 209-249. DOI:10.3322/caac.21660 |
| [2] |
Solé-Sedeno J, Mancebo G, Miralpeix E, et al. Utility of human papillomavirus genotyping in the management of low-grade squamous intraepithelial lesions[J]. J Low Genit Tract Dis, 2018, 22(1): 13-16. DOI:10.1097/LGT.0000000000000354 |
| [3] |
Silva C, Almeida ECS, de Castro Côbo E, et al. A retrospective study on cervical intraepithelial lesions of low-grade and undetermined significance: evolution, associated factors and cytohistological correlation[J]. Sao Paulo Med J, 2014, 132(2): 92-96. DOI:10.1590/1516-3180.2014.1322579 |
| [4] |
Bodily J, Laimins LA. Persistence of human papillomavirus infection: keys to malignant progression[J]. Trends Microbiol, 2011, 19(1): 33-39. DOI:10.1016/j.tim.2010.10.002 |
| [5] |
张韶凯, 赵方辉, 乔友林. 中国宫颈癌防治研究20年历程与成就[J]. 中华流行病学杂志, 2020, 41(6): 809-812. Zhang SK, Zhao FH, Qiao YL. Development and achievements regarding the prevention and control of cervical cancer in the last 20 years in China[J]. Chin J Epidemiol, 2020, 41(6): 809-812. DOI:10.3760/cma.j.cn112338-20191203-00849 |
| [6] |
Verma N, Pink M, Rettenmeier AW, et al. Review on proteomic analyses of benzo[a]pyrene toxicity[J]. Proteomics, 2012, 12(11): 1731-1755. DOI:10.1002/pmic.201100466 |
| [7] |
Armstrong BG, Gibbs G. Exposure-response relationship between lung cancer and polycyclic aromatic hydrocarbons (PAHs)[J]. Occup Environ Med, 2009, 66(11): 740-746. DOI:10.1136/oem.2008.043711 |
| [8] |
Shen J, Liao YY, Hopper JL, et al. Dependence of cancer risk from environmental exposures on underlying genetic susceptibility: an illustration with polycyclic aromatic hydrocarbons and breast cancer[J]. Br J Cancer, 2017, 116(9): 1229-1233. DOI:10.1038/bjc.2017.81 |
| [9] |
Yamano Y, Hara K, Ichiba M, et al. Urinary 1-hydroxypyrene as a comprehensive carcinogenic biomarker of exposure to polycyclic aromatic hydrocarbons: a cross-sectional study of coke oven workers in China[J]. Int Arch Occup Environ Health, 2014, 87(7): 705-713. DOI:10.1007/s00420-013-0913-6 |
| [10] |
Li XX, Ding L, Song L, et al. Effects of exposure to polycyclic aromatic hydrocarbons combined with high-risk human papillomavirus infection on cervical intraepithelial neoplasia: a population study in Shanxi Province, China[J]. Int J Cancer, 2020, 146(9): 2406-2412. DOI:10.1002/ijc.32562 |
| [11] |
王铭, 丁玲, 刘学智, 等. 多环芳烃与高危型人乳头瘤病毒感染在宫颈上皮内瘤变中的作用及其交互效应[J]. 中华流行病学杂志, 2018, 39(5): 673-677. Wang M, Ding L, Liu XZ, et al. Interaction between polycyclic aromatic hydrocarbons and high risk human papillomavirus infection on cervical intraepithelial neoplasia[J]. Chin J Epidemiol, 2018, 39(5): 673-677. DOI:10.3760/cma.j.issn.0254-6450.2018.05.026 |
| [12] |
Fajardo-Ramírez O, Barboza-Cerda MC, Ortiz-López R, et al. Prevalence and 3-year persistence of human papillomavirus serotypes in asymptomatic patients in Northern Mexico[J]. Int J Gynaecol Obstet: Official Organ Int Federation Gynaecol Obstet, 2017, 136(1): 40-46. DOI:10.1002/ijgo.12009 |
| [13] |
World Health Organization. Human papillomavirus (HPV) and cervical cancer[EB/OL]. (2020-11-11)[2021-04-01]. https://www.who.int/news-room/fact-sheets/detail/human-papillomavirus-(hpv)-and-cervical-cancer.
|
| [14] |
Nielsen A, Kjaer SK, Munk C, et al. Persistence of high-risk human papillomavirus infection in a population-based cohort of Danish women[J]. J Med Virol, 2010, 82(4): 616-623. DOI:10.1002/jmv.21750 |
| [15] |
Bulkmans NWJ, Berkhof J, Bulk S, et al. High-risk HPV type-specific clearance rates in cervical screening[J]. Br J Cancer, 2007, 96(9): 1419-1424. DOI:10.1038/sj.bjc.6603653 |
| [16] |
Alam S, Conway MJ, Chen HS, et al. The cigarette smoke carcinogen benzo[a]pyrene enhances human papillomavirus synthesis[J]. J Virol, 2008, 82(2): 1053-1058. DOI:10.1128/JVI.01813-07 |
 2021, Vol. 42
2021, Vol. 42