文章信息
- 朱小琪, 司妮平, 付晓宇, 程静雯, 秦娜, 刘逸辰, 田甜, 马红霞, 褚敏捷.
- Zhu Xiaoqi, Si Niping, Fu Xiaoyu, Cheng Jingwen, Qin Na, Liu Yichen, Tian Tian, Ma Hongxia, Chu Minjie
- 一种新的调控型遗传变异与中国人群肺癌发病风险的关系:两阶段病例-对照研究
- Association between a novel regulatory genetic variants and lung cancer risk in Chinese: a two-stage case-control study
- 中华流行病学杂志, 2021, 42(11): 2053-2059
- Chinese Journal of Epidemiology, 2021, 42(11): 2053-2059
- http://dx.doi.org/10.3760/cma.j.cn112338-20210331-00262
-
文章历史
收稿日期: 2021-03-31
2. 南京医科大学公共卫生学院流行病学系 211166
2. Department of Epidemiology, School of Public Health, Nanjing Medical University, Nanjing 211166, China
肺癌是严重危害人类健康的恶性肿瘤之一,也是我国发病率和死亡率最高的恶性肿瘤[1]。据统计,2020年,我国肺癌新增病例约82万例,死亡病例近71万例。目前,肺癌仍然是危害我国人民群众健康的重要公共卫生问题之一[2]。肺癌的发生发展是环境和遗传因素共同作用的结果[3]。尽管吸烟是肺癌最重要的环境危险因素,但是遗传因素在肺癌的发生发展过程中也起着非常关键的作用,有研究表明肺癌的遗传度接近20%[4]。此外,近期研究表明,与低遗传风险的重度吸烟者相比,存在高遗传风险的轻度吸烟者的肺癌易感性更高[5],这更加提示遗传因素可能在较大程度上影响了个体对肺癌的易感程度。在肺癌的遗传因素中,研究最多的主要是单核苷酸多态性(single nucleotide polymorphisms,SNPs)[6]。
研究者通过表达数量性状位点(expression quantitative trait loci,eQTL)分析可以判定一个SNP位点的不同基因型是否能够影响一个或多个基因(mRNA)的表达水平,因此,通过eQTL分析评估SNP的生物学功能是目前公认的一种研究策略[7]。然而,eQTL分析方法仍然存在着一定的不足,例如,它只能从二维的角度探讨SNP与相关mRNA表达之间的关联。近些年,有研究将SNP基因型和mRNA表达数据与微小RNA(miRNA)表达数据相结合,从三维的角度评估某SNP对miRNA以及mRNA表达水平的调控情况,并将存在统计学意义的SNP定义为调控型QTL(regulatory quantitative trait loci,regQTL)-SNP[8]。这种regQTL-SNPs的不同基因型对相关miRNA与mRNA表达关联的影响存在明显的差异,例如,在某一SNP野生纯合基因型下,相应的mRNA和miRNA表达水平呈现出较强的正相关性,在其突变杂合基因型下,相应的mRNA和miRNA表达水平无相关性,而在其突变纯合基因型下,相应的mRNA和miRNA表达水平呈现出强烈的负相关性。这种regQTL分析方法的出现为进一步评估相关SNPs的调控功能提供了新的视角。然而,目前与肺癌易感性相关的可以发挥regQTL功能的SNPs却鲜有报道。
本研究依据regQTL调控理论,利用肺癌相关regQTL-SNPs数据库,并结合全基因组关联研究(GWAS)Catalog数据库中的肺癌易感区域,筛选这些区域内可能具有regQTL功能的SNPs,随后,通过两阶段病例-对照研究,进一步明确相关regQTL-SNPs与肺癌易感性的关联。
资料与方法1. 肺癌相关regQTL-SNPs的筛选:利用已发表的肺癌regQTL-SNPs数据库[8],得到555 366个regQTL-SNPs(P < 0.05)。在此基础上,基于两个筛选标准(P < 10-4和错误发现率P < 0.2),进一步获得1 723个满足条件的regQTL-SNPs(主要分布于352个染色体区域)。同时,基于肺癌GWAS Catalog数据库(包含45篇已发表的肺癌GWAS文章,其中研究人群来源于亚洲地区的共有21篇),根据P < 10-5的标准筛选出726个肺癌易感SNPs(对应于325个肺癌易感区域)。将325个肺癌易感区域与上文提及的352个染色体区域进行匹配,共得到169个交集区域(包含581个符合条件的regQTL-SNPs)。这581个候选regQTL-SNPs主要位于264个基因上,利用GEPIA数据库(http://gepia.cancer-pku.cn/index.html)分析了这些基因在肺癌和癌旁组织间的表达情况,共筛选得到51个存在差异表达的基因(P < 0.05),进一步按照癌和癌旁组织间的差异表达倍数 > 2.0的标准,最终得到6个基因(包含12个符合条件的regQTL-SNPs)。接着,利用千人基因组数据库(https://www.ncbi.nlm.nih.gov/variation/tools/1000genomes/),将最小等位基因频率(minor allele frequency)≤0.05的SNPs去除,得到10个符合条件的regQTL-SNPs。最后,通过连锁不平衡分析(linkage disequilibrium,LD)(r2 < 0.8),最终筛选得到8个候选regQTL-SNPs。
2. 研究对象:初筛阶段的样本来源于南京医科大学的肺癌GWAS数据库[9]。验证阶段的病例来自2015-2018年南通大学附属医院、常熟市第一人民医院和南通市第六人民医院收集的明确诊断的肺癌新发病例(纳入标准:汉族,年龄、性别不限;排除标准:采血前接受过化疗、放疗或有既往肿瘤病史)。验证阶段的对照组选自同时期参加常规体检的健康人群(> 2 000人),与病例组的年龄、性别因素进行频数匹配,随机选择合适的对照人群[10]。
3. 流行病学调查和临床信息采集:病例和对照采用统一设计的肺癌流行病学调查问卷进行面访调查。内容包括研究对象的一般情况(年龄、性别等)、个人疾病史、肿瘤家族史和生活习惯等。根据统一制定的流行病学调查工作手册培训调查员,采用统一方法和标准进行调查,确保流行病学调查资料的质量。临床资料包括确诊日期、肿瘤病理、TNM分期、治疗方式和日期等。
4. 生物标本收集:每位研究对象均采用EDTA真空抗凝采血管采集静脉血5 ml,按标准方法在4 h内离心,将分离到的血浆、白细胞和红细胞转至1.5 ml离心管中(均各保存2份),-80 ℃冷冻保存备用。
5. Taqman基因分型:采用酚氯仿法从外周血中提取基因组DNA,验证阶段利用南京骥骜生物公司合成的探针、引物和Master Mix配成基因分型体系。然后,利用7500 FAST Real-Time PCR系统(美国Applied Biosystems公司)进行PCR扩增并读取荧光信号。根据荧光强度,在SDS软件上进行基因分型结果鉴定。
6. 统计学分析:采用χ2检验或t检验比较病例组和对照组人口学特征及肺癌发病相关因素的分布情况。采用logistic回归分析(共显性模型:突变杂合型vs.野生纯合型,突变纯合型vs. 野生纯合型;显性模型:突变纯合型+突变杂合型vs.野生纯合型;隐性模型:突变纯合型vs.野生纯合型+突变杂合型;相加模型:疾病发病风险随突变等位基因的增加而改变的概率)计算OR值及其95%CI,估计regQTL-SNPs与肺癌发病风险的关联强度。基因与环境间相乘交互作用分析采用logistic回归模型。所有检验均为双侧检验,检验水准α=0.05。所有的统计分析均通过R 3.6.2软件进行计算。
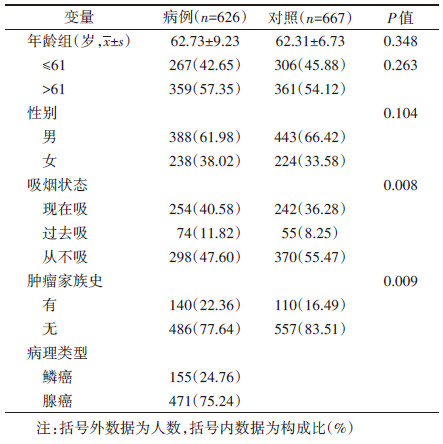
结果1. 基本情况:初筛阶段包含2 331例肺癌病例和3 077例健康对照。验证阶段包含626例肺癌病例和667例健康对照,其中,病例组和对照组的年龄和性别分布差异无统计学意义(均P > 0.05)。病例组和对照组的吸烟情况差异有统计学意义(P=0.008)。病例组中具有肿瘤家族史的占22.36%,高于对照组的16.49%,差异有统计学意义(P=0.009)。病例组中肺鳞癌患者有155人(24.76%),肺腺癌患者有471人(75.24%)。见表 1。
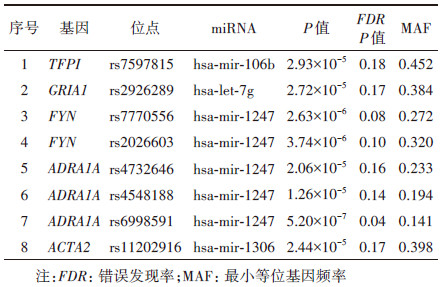
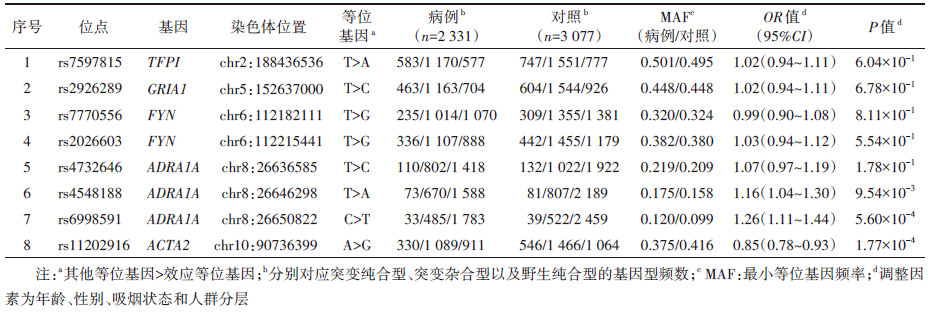
2. 候选regQTL-SNPs与肺癌发病风险之间的关联(初筛阶段):候选的8个regQTL-SNPs位点的基本信息见表 2。经年龄、性别、吸烟状态及人群分层因素调整后,结果显示,位于ADRA1A基因上的rs4548188(T > A)和rs6998591(C > T),以及ACTA2基因上的rs11202916(A > G)多态性位点与肺癌的发病风险存在明显的统计学关联。相加模型结果显示,rs4548188和rs6998591的基因型改变增加肺癌发病风险(rs4548188:OR=1.16,95%CI:1.04~1.30,P=9.54×10-3;rs6998591:OR=1.26,95%CI:1.11~1.44,P=5.60×10-4),rs11202916基因型改变则与肺癌发病风险降低有关(OR=0.85,95%CI:0.78~0.93,P=1.77×10-4)。其余5个regQTL-SNPs与肺癌发病风险无统计学关联(P > 0.05)。见表 3。
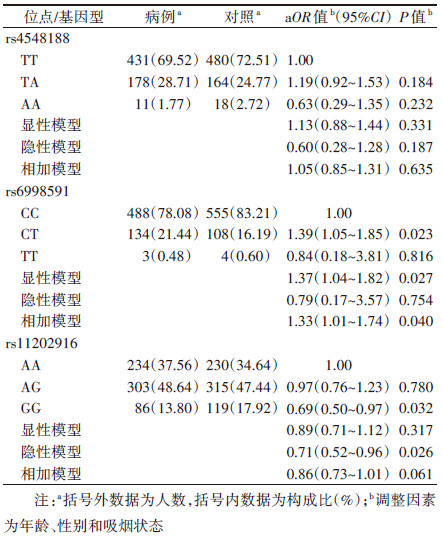
3. 阳性regQTL-SNPs与肺癌发病风险之间的关联(验证阶段):对初筛阶段获取的3个阳性regQTL-SNPs(rs4548188、rs6998591、rs11202916)进行验证,logistic回归分析结果显示,在调整年龄、性别和吸烟状态之后,位于ADRA1A基因上的rs6998591(C > T)可以显著增加肺癌的发病风险(相加模型:OR=1.33,95%CI:1.01~1.74,P=0.040)。而位于ACTA2基因上的rs11202916(A > G)可以显著降低肺癌的发病风险(隐性模型:OR=0.71,95%CI:0.52~0.96,P=0.026)。见表 4。
4. 按肺癌病理类型分层分析:考虑到病例组中肺鳞癌与肺腺癌的比例差别较大,且两者具有不完全相同的发病机制。进一步对2个阳性regQTL- SNPs按肺癌病理类型进行分层分析,结果显示,rs6998591的突变等位基因T增加肺鳞癌的发病风险(相加模型:OR=1.53,95%CI:1.01~2.32,P=0.043),而与肺腺癌的发病风险无显著相关性。相反,rs11202916的突变等位基因G降低肺腺癌的发病风险(相加模型:OR=0.83,95%CI:0.69~0.98,P=0.031),而与肺鳞癌发病风险无显著相关性。见表 5。
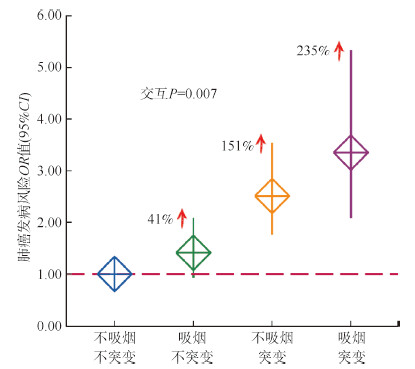
5. 基因与环境交互作用分析:基线数据显示,肺癌组的吸烟率显著高于对照组,进一步开展了基因(SNP位点)与环境(吸烟)的交互作用分析,结果显示,位于ADRA1A基因上的rs6998591(C > T)与吸烟间存在显著的交互作用(OR=1.71,95%CI:1.16~2.52,P=0.007),其中携带rs6998591突变等位基因T且吸烟的个体与不携带rs6998591突变等位基因T且不吸烟的个体相比,肺癌的发病风险增加了235%(OR=3.35,95%CI:2.10~5.34,P < 0.001)(图 1)。
|
| 图 1 rs6998591(C>T)与吸烟的交互作用分析 |
本研究综合利用肺癌GWAS Catalog数据库和肺癌regQTL-SNPs数据库,筛选得到GWAS已报道的肺癌易感区域中8个潜在的发挥regQTL功能的SNPs。进一步的两阶段病例-对照研究结果提示,位于ACTA2基因上的rs11202916位点(A > G)和ADRA1A基因上的rs6998591位点(C > T)与肺癌的发病风险显著相关。基因环境交互作用分析显示,rs6998591与吸烟在肺癌发病危险中存在显著的交互作用。
ACTA2又称为α平滑肌肌动蛋白,属于肌动蛋白家族。肌动蛋白在细胞中发挥重要的作用[11]。ACTA2基因的异常表达与多种肿瘤的发生发展过程有关[12]。GEPIA数据库显示ACTA2在肺鳞癌(LUSC)和肺腺癌(LUAD)癌组织中的表达水平均明显低于癌旁组织,提示ACTA2可能发挥抑癌基因的作用。研究表明,在肺腺癌细胞中,ACTA2的高表达可抑制癌细胞的增殖、侵袭和迁移,加速细胞凋亡,这些信息提示ACTA2可以发挥抑癌基因的作用,这与GEPIA数据库的结果一致。此外,高表达的ACTA2还可通过调节c-MET和FAK的表达影响肺癌细胞转移,提示ACTA2可能作为转移性肺癌的预后生物标志物和治疗靶点[13]。本研究发现,rs11202916的不同基因型可能会影响ACTA2和miRNA-1306之间的表达相关性,从而在肺癌的发生发展中起到一定的调控作用。目前,已有部分研究关注了miRNA-1306在不同癌症中发挥的作用,并进行了相应的生物学功能探索。He等[14]的研究发现miRNA-1306-3p可通过靶向结合FBXL5基因,促进上皮间质转化(EMT)过程从而调控肝癌的发生发展。Li等[15]的研究显示,miRNA-1306可以调控SIX1基因的表达,即miRNA-1306表达水平的下调可以促进SIX1基因的表达,而SIX1基因与多种肿瘤发病的关联已经被证实。还有研究发现,miRNA-1306可影响TGF-β/SMAD信号通路活性[16],而TGF-β的过度表达与肺癌的不良预后有关[17]。然而,miRNA-1306在肺癌发生中的生物学功能尚未明确,本研究的结果可能为后续更加深入的生物学机制探讨提供基础数据。
ADRA1A是肾上腺素受体1A蛋白,属于α1-肾上腺受体家族[18]。它在生物体内发挥的功能主要有调控血压、收缩血管以及收缩平滑肌等[19]。有研究发现,ADRA1A基因在多种癌症的发生发展过程中发挥了重要的作用。例如,Chen等[20]的研究指出,当ADRA1A基因的启动子区域出现高甲基化时,ADRA1A基因的表达随之下降,从而促进了肝癌的发生发展。有研究指出,ADRA1A基因高表达能够明显降低肝癌患者的死亡率[21],提示ADRA1A基因可能在肝癌的发生发展中发挥抑癌基因的作用。同时,GEPIA数据库提示ADRA1A基因在LUSC和LUAD癌组织中表达水平均显著低于癌旁组织,提示ADRA1A基因在肺癌的发生发展中也发挥着相似的抑癌基因作用。本研究已预测出,rs6998591的不同基因型可能会影响ADRA1A基因和miRNA-1247之间的表达相关性。目前,已有多篇研究指出miRNA-1247在多种癌症发生发展中起到抑制癌症发生的作用[22-24]。有研究显示,与健康对照组相比,miRNA-1247-5p在非小细胞肺癌患者血浆中显著高表达,提示其可以作为早期诊断非小细胞肺癌的生物标志物[25]。此外,Chu等[22]的研究表明,高表达的miRNA-1247可以靶向结合Wnt3并抑制细胞增殖,进而影响肝癌的发生发展过程。此外,还有学者发现Wnt3可以通过调控EMT过程来促进肺腺癌的侵袭与转移,进而影响肺腺癌患者的预后[26]。后续需要进一步明确ADRA1A基因与miRNA-1247在肺癌发生发展中的调控作用。
本项研究主要有两个优点:基于regQTL调控理论,在目前已报道的肺癌易感区域中筛选发挥regQTL功能的SNPs,为发现更多的肺癌易感区域内致病位点提供基础数据;本研究利用两阶段的病例-对照研究设计开展人群易感性研究(以中国大样本肺癌GWAS数据为初筛辅以其他人群数据进行验证),增加了研究结果的准确性和可靠性。
本研究存在局限性。首先,本研究是以医院为基础的病例-对照研究,可能导致入院率偏倚,后续还需在以社区人群为基础的更大样本中评价研究结果的稳定性;其次,人群中获得的关联研究结果还需后续生物功能学实验来进一步评价其潜在的机制。再次,尽管rs6998591在相加模型下与肺癌发病风险具有统计学意义,但是由于验证阶段样本量的限制,病例组仅有3个rs6998591突变纯合型TT携带者(占0.48%),对照组也仅有4个rs6998591突变纯合型TT携带者(占0.60%),所以,该位点相加模型具有统计学意义的效应可能主要是由突变杂合型CT所体现(病例组CT型占21.44%,对照组CT型占16.19%),后续还需要更大的样本量来明确在共显性模型下rs6998591突变纯合型TT与肺癌发病风险之间的关联。最后,regQTL-SNPs数据库是基于TCGA数据分析得到,不同种族人群的遗传变异差异可能会对候选SNPs的选择产生影响。尽管千人基因组数据库提示在全世界范围内不同种族人群中,上述2个阳性regQTL-SNPs突变方向与中国汉族人群一致率均较高,但后续还是需要在其他种族人群中深入评价上述2个阳性regQTL-SNPs与肺癌易感性的关联。
综上所述,本研究基于最新的regQTL调控理论,通过两阶段病例-对照研究设计,发现肺癌GWAS已报道区域中2个发挥regQTL功能的潜在致病位点(ACTA2基因上的rs11202916和ADRA1A基因上的rs6998591)与肺癌易感性显著相关。研究结果对识别和评价肺癌的遗传易感因素,阐明肺癌的发生机制具有重要指导价值。
利益冲突 所有作者均声明不存在利益冲突
| [1] |
陈万青, 李贺, 孙可欣, 等. 2014年中国恶性肿瘤发病和死亡分析[J]. 中华肿瘤杂志, 2018, 40(1): 5-13. Chen WQ, Li H, Sun KX, et al. Report of cancer incidence and mortality in China, 2014[J]. Chin J Oncol, 2018, 40(1): 5-13. DOI:10.3760/cma.j.issn.0253-3766.2018.01.002 |
| [2] |
Sung H, Ferlay J, Siegel RL, et al. Global cancer statistics 2020:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA A Cancer J Clin, 2021, 71(3): 209-249. DOI:10.3322/CAAC.21660 |
| [3] |
Yang DW, Liu Y, Bai CX, et al. Epidemiology of lung cancer and lung cancer screening programs in China and the United States[J]. Cancer Lett, 2020, 468: 82-87. DOI:10.1016/j.canlet.2019.10.009 |
| [4] |
Mucci LA, Hjelmborg JB, Harris JR, et al. Familial risk and heritability of cancer among twins in Nordic countries[J]. JAMA, 2016, 315(1): 68-76. DOI:10.1001/jama.2015.17703 |
| [5] |
Dai JC, Lv J, Zhu M, et al. Identification of risk loci and a polygenic risk score for lung cancer: a large-scale prospective cohort study in Chinese populations[J]. Lancet Respir Med, 2019, 7(10): 881-891. DOI:10.1016/S2213-2600(19)30144-4 |
| [6] |
沈洪兵, 靳光付. 全基因组关联研究与复杂疾病风险预测的现状与展望[J]. 中华流行病学杂志, 2011, 32(7): 643-649. Shen HB, Jin GF. Genome-wide association study (GWAS) and risk prediction of complex disease: advances and prospects[J]. Chin J Epidemiol, 2011, 32(7): 643-649. DOI:10.3760/cma.j.issn.0254-6450.2011.07.002 |
| [7] |
宋庆峰, 张红星, 马亦龙, 等. 复杂疾病的遗传易感基因区域的精细定位[J]. 遗传(北京), 2014, 36(1): 2-10. Song QF, Zhang HX, Ma YL, et al. Fine mapping of complex disease susceptibility loci[J]. Hereditas (Beijing), 2014, 36(1): 2-10. DOI:10.3724/SP.J.1005.2014.0011 |
| [8] |
Wilk G, Braun R. RegQTLs: Single nucleotide polymorphisms that modulate microRNA regulation of gene expression in tumors[J]. PLoS Genet, 2018, 14(12): e1007837. DOI:10.1371/journal.pgen.1007837 |
| [9] |
Hu ZB, Wu C, Shi YY, et al. A genome-wide association study identifies two new lung cancer susceptibility loci at 13q12.12 and 22q12.2 in Han Chinese[J]. Nat Genet, 2011, 43(8): 792-796. DOI:10.1038/ng.875 |
| [10] |
Yu YH, Mao LP, Lu X, et al. Functional variant in 3'UTR of FAM13A is potentially associated with susceptibility and survival of lung squamous carcinoma[J]. DNA Cell Biol, 2019, 38(11): 1269-1277. DOI:10.1089/dna.2019.4892 |
| [11] |
Yuan SM. α-Smooth muscle actin and acta2 gene expressions in vasculopathies[J]. Braz J Cardiovasc Surg, 2015, 30(6): 644-649. DOI:10.5935/1678-9741.20150081 |
| [12] |
Luo LL, Wang M, Li XP, et al. A novel mechanism by which ACTA2-AS1 promotes cervical cancer progression: acting as a ceRNA of miR-143-3p to regulate SMAD3 expression[J]. Cancer Cell Int, 2020, 20: 372. DOI:10.1186/s12935-020-01471-w |
| [13] |
Lee HW, Park YM, Lee SJ, et al. Alpha-smooth muscle actin(ACTA2) is required for metastatic potential of human lung adenocarcinoma[J]. Clin Cancer Res, 2013, 19(21): 5879-5889. DOI:10.1158/1078-0432.CCR-13-1181 |
| [14] |
He ZJ, Li W, Chen H, et al. miR-1306-3p targets FBXL5 to promote metastasis of hepatocellular carcinoma through suppressing snail degradation[J]. Biochem Biophys Res Commun, 2018, 504(4): 820-826. DOI:10.1016/j.bbrc.2018.09.059 |
| [15] |
Li L, Liang YC, Kang L, et al. Transcriptional regulation of the warburg effect in cancer by SIX1[J]. Cancer Cell, 2018, 33(3): 368-385. DOI:10.1016/j.ccell.2018.01.010 |
| [16] |
Yang L, Du X, Liu L, et al. miR-1306 mediates the feedback regulation of the TGF-β/SMAD signaling pathway in granulosa cells[J]. Cells, 2019, 8(4): 298. DOI:10.1186/s12885-019-5917-5 |
| [17] |
Li J, Shen C, Wang X, et al. Prognostic value of TGF-β in lung cancer: systematic review and Meta-analysis[J]. BMC Cancer, 2019, 19(1): 691. DOI:10.1186/s12885-019-5917-5 |
| [18] |
Perez DM. Structure-function of alpha1-adrenergic receptors[J]. Biochem Pharmacol, 2007, 73(8): 1051-1062. DOI:10.1016/j.bcp.2006.09.010 |
| [19] |
Docherty JR. Subtypes of functional α1-adrenoceptor[J]. Cell Mol Life Sci, 2010, 67(3): 405-417. DOI:10.1007/s00018-009-0174-4 |
| [20] |
Chen GQ, Fan XX, Li YR, et al. Promoter aberrant methylation status of ADRA1A is associated with hepatocellular carcinoma[J]. Epigenetics, 2020, 15(6/7): 684-701. DOI:10.1080/15592294.2019.1709267 |
| [21] |
He JF, Zhao HC, Deng DF, et al. Screening of significant biomarkers related with prognosis of liver cancer by lncRNA-associated ceRNAs analysis[J]. J Cell Physiol, 2020, 235(3): 2464-2477. DOI:10.1002/jcp.29151 |
| [22] |
Chu YK, Fan WN, Guo WW, et al. miR-1247-5p functions as a tumor suppressor in human hepatocellular carcinoma by targeting Wnt3[J]. Oncol Rep, 2017, 38(1): 343-351. DOI:10.3892/or.2017.5702 |
| [23] |
Taddei ML, Cavallini L, Ramazzotti M, et al. Stromal-induced downregulation of miR-1247 promotes prostate cancer malignancy[J]. J Cell Physiol, 2019, 234(6): 8274-8285. DOI:10.1002/jcp.27679 |
| [24] |
Shi S, Lu Y, Qin Y, et al. miR-1247 is correlated with prognosis of pancreatic cancer and inhibits cell proliferation by targeting neuropilins[J]. Curr Mol Med, 2014, 14(3): 316-327. DOI:10.2174/1566524014666140228120014 |
| [25] |
Dong XH, Chang MH, Song XG, et al. Plasma miR-1247-5p, miR-301b-3p and miR-105-5p as potential biomarkers for early diagnosis of non-small cell lung cancer[J]. Thorac Cancer, 2021, 12(4): 539-548. DOI:10.1111/1759-7714.13800 |
| [26] |
Xu JM, Lv W, Hu YJ, et al. Wnt3a expression is associated with epithelial-mesenchymal transition and impacts prognosis of lung adenocarcinoma patients[J]. J Cancer, 2017, 8(13): 2523-2531. DOI:10.7150/jca.18560 |
 2021, Vol. 42
2021, Vol. 42