文章信息
- 温俏睿, 吴曼, 刘琪, 吕筠, 郭彧, 卞铮, 裴培, 杜怀东, 陈君石, 余灿清, 陈铮鸣, 李立明, 代表中国慢性病前瞻性研究项目协作组.
- Wen Qiaorui, Wu Man, Liu Qi, Lyu Jun, Guo Yu, Bian Zheng, Pei Pei, Du Huaidong, Chen Junshi, Yu Canqing, Chen Zhengming, Li Liming, on Behalf of China Kadoorie Biobank (CKB) Collaborative Group
- 中国成年人慢性病与肌肉重量、力量及质量的相关性分析
- Correlation between chronic diseases and low muscle mass, strength and quality in adults in China
- 中华流行病学杂志, 2021, 42(11): 1948-1954
- Chinese Journal of Epidemiology, 2021, 42(11): 1948-1954
- http://dx.doi.org/10.3760/cma.j.cn112338-20200910-01146
-
文章历史
收稿日期: 2020-09-10
2. 中国医学科学院, 北京 100730;
3. 英国牛津大学纳菲尔德人群健康系临床实验与流行病学研究中心, 牛津OX3 7LF;
4. 国家食品安全风险评估中心, 北京 100022
2. Chinese Academy of Medical Sciences, Beijing 100730, China;
3. Nuffield Department of Population Health, Center for Clinical and Epidemiological Studies, University of Oxford, Oxford OX3 7LF, UK;
4. China National Center for Food Safety Risk Assessment, Beijing 100022, China
随着人口老龄化的进程,我国慢性病的患病率逐年上升[1]。据全球疾病负担统计,脑卒中、冠心病及慢性阻塞性肺疾病(慢阻肺)已经成为我国排名前五的死亡原因;随着医疗水平的进步,慢性病患者存活期延长,其造成的疾病负担也不断增加[2]。当个体处于慢性疾病状态时,其机体炎症因子分泌增加、氧化应激损伤加剧、线粒体功能异常,这些因素共同作用可能导致肌肉结构和功能减退[3]。骨骼肌作为人体的重要组成成分,可一定程度反映机体的营养健康状况[4]。肌肉重量(skeletal muscle mass,SMM)和肌肉力量(skeletal muscle strength,SMS)常用于反映骨骼肌的结构功能。SMM和SMS低下可以导致多种疾病预后不良,如糖尿病、心血管疾病、癌症等[5-6],甚至增加死亡风险[7]。二者形成恶性循环,进一步加重健康负担。本研究旨在利用中国慢性病前瞻性研究(China Kadoorie Biobank,CKB)项目的第二次重复调查数据,探索主要慢性病种类、个数及患病年限与肌肉重量、力量及质量的相关性。
对象与方法1. 研究对象:CKB项目于2004-2008年在中国10个项目地区(5个城市地区和5个农村地区)开展基线调查,共纳入50万余名研究对象,每4~5年随机抽取5%仍在队列中的研究对象进行重复调查。由于CKB在第二次重复调查时才新增对SMM和SMS的测量,本研究以第二次重复调查的人群为研究对象。CKB的详细介绍参见文献[8-10]。第二次重复调查在2013年8月至2014年9月展开,共纳入25 239名研究对象,剔除问卷信息缺失者(n=205),SMM或SMS信息任一项缺失者(n=508),确诊癌症者(n=281)及自报慢性病患病年龄大于调查时年龄者(n=3),本研究最终纳入24 242人。CKB项目获得英国牛津大学和中国CDC伦理委员会审查批准,所有研究对象签署了知情同意书。
2. 研究方法:通过面对面电子问卷调查获得研究对象的一般人口学特征(性别、年龄、文化程度、婚姻状况、家庭收入、职业)和生活行为(吸烟、饮酒、饮食、体力活动)等信息。对问卷收集的20个食物组进行因子分析(主成分法),根据因子负荷系数解读出平衡和米肉膳食模式,并计算得分。体力活动包括工作、交通、休闲和家务,通过问卷中不同体力活动的代谢当量(MET)和从事该类体力活动的累计时间(h/d),其乘积之和即个体每天体力活动的水平(MET-h/d),具体赋值方法见文献[11]。
所有的体格检查项目均由经过统一培训的调查员进行测量。利用身高仪和TANITA TBF-300GS体质构成分析仪直接测量身高(cm)和体重(kg);采用艾科·益优血糖测试系统现场检测随机血糖(mmol/L),对于空腹 < 8 h且随机血糖在7.8~11.0 mmol/L之间的调查对象,次日复查FPG;利用手握微型电子肺功能仪(spirometer)测量肺功能[第一秒用力呼气量(forced expiratory volume in one second,FEV1)、用力肺活量(forced vital capacity,FVC)],单位为L,所有对象均测2次,取最大值进行分析,具体测量过程见文献[12];利用TANITA BC418 MA人体脂肪测量仪测量各个部位的脂肪量,得出体脂百分比(%)。
在面对面调查中,研究对象自报是否被乡/区级或以上医院医生诊断患有过糖尿病、冠心病、脑卒中和慢阻肺等疾病以及首次诊断时年龄。糖尿病定义为研究对象自报患糖尿病或随机血糖 > 11.1 mmol/L、或FPG > 7.0 mmol/L;慢阻肺定义为研究对象自报患慢性支气管炎或肺气肿、或FEV1/FVC < 0.7。根据研究对象自报的患病年龄与基线/重复调查时年龄之差为该病的患病时长。
由经过统一培训的调查员利用TANITA BC418 MA人体脂肪测量仪采用生物电阻抗分析法(bioelectrical impedance analysis,BIA)按照标准流程测量各个部位的肌肉量等体成分信息。本研究采用的SMM绝对指标为四肢肌肉重量(appendicular skeletal muscle mass,ASM)和全身肌肉重量(total skeletal muscle mass,TSM),单位为kg。为了控制体型对肌肉重量的影响,将ASM和TSM分别除以身高的平方,得到四肢肌肉重量指数(appendicular skeletal muscle mass index,ASMI)和全身肌肉重量指数(total skeletal muscle mass index,TSMI),单位为kg/m2[13]。采用Jamar J00105液压手握力测量仪测量手握力,分别测量左右手的握力,每只手各测量一次,要求调查对象用力紧握测量仪手柄并保持3秒钟,计算双手手握力的算术平均值作为四肢SMS指标,单位为kg。此外,将手握力与上肢肌肉重量的比值[(左手手握力+右手手握力)/(左上肢肌肉重量+右上肢肌肉重量)]定义为上肢肌肉质量(arm muscle quality,AMQ),反映单位SMM的SMS大小[14],单位为kg/kg。
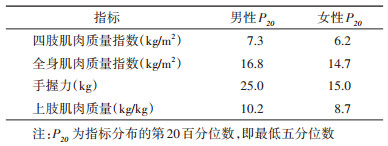
根据亚洲肌肉减少症工作组(Asian Working Group for Sarcopenia,AWGS)推荐的标准[13],本研究以分性别的最低五分位数为截断值,将肌肉重量、力量和质量分别分为二分类变量,即低组(低于分性别的五分位数)和参照组,具体数值见表 1。
3. 统计学分析:本研究以x±s、构成比(%)描述研究对象的基本情况。根据任一主要慢性病(糖尿病、冠心病、脑卒中和慢阻肺)情况分组,采用线性回归(连续变量)及logistic回归(分类变量)描述调整了年龄、性别和地区后的一般人口学特征和生活行为方式特征。以肌肉重量、力量和质量的二分类变量为因变量,采用logistic回归分析主要慢性病(糖尿病、冠心病、脑卒中和慢阻肺)与低肌肉重量、力量及质量的相关性,模型1中调整了社会人口学因素(年龄、性别、地区、文化程度、家庭年收入、婚姻状态、职业),模型2在模型1的基础上调整了体脂百分比和生活方式因素(体力活动水平、吸烟、饮酒、平衡和米肉膳食模式得分),模型3在模型2的基础上对各主要慢性病互相调整,得到OR值和95%CI;以未患该病人群为参照组,在各主要慢性病(糖尿病、冠心病、脑卒中和慢阻肺)患病人群中按照患病年限分组,并以各组中位数为连续变量,采用logistic回归分析与各慢性病病程与低肌肉重量、力量及质量的相关性,得到OR值、95%CI和线性趋势P值。使用Stata 15.0软件进行统计学分析,采用双侧检验(P < 0.05)。
结果1. 一般情况:本研究共纳入24 242人,年龄(59.4±10.1)岁,男性占38.3%,城市地区人群占42.8%。糖尿病、冠心病、脑卒中和慢阻肺的患病率分别为9.6%、5.8%、3.2%和26.8%,患以上任一慢性病者占38.8%,他们与非慢性病患者相比,年龄较大,男性占比较高,文化程度较低,当前吸烟率较高,但当前饮酒率较低,戒烟、戒酒者比例较高,平均体力活动水平较低,且超重或肥胖者所占比例和体脂百分比均较高(表 2)。
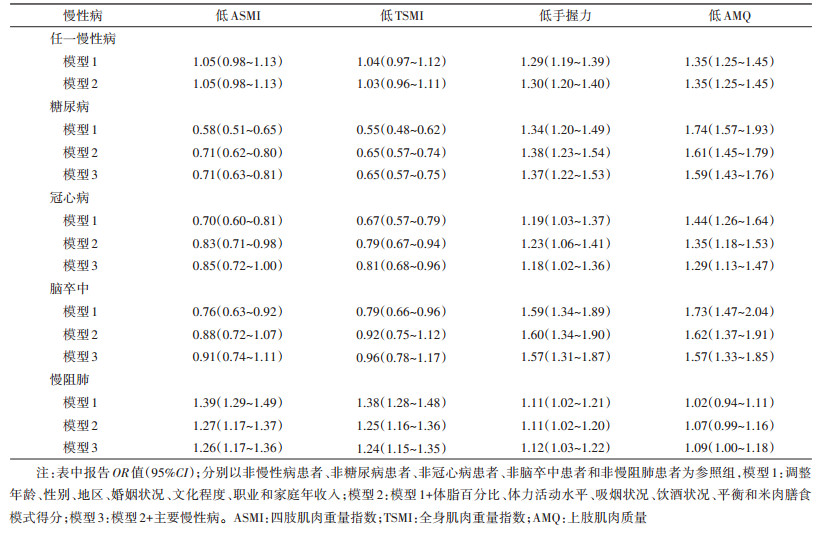
2. 慢性病种类、个数及病程与肌肉重量、力量及质量的分析:调整社会人口学因素、生活方式和体脂百分比等因素后,患以上任一慢性病与低手握力和低AMQ呈正相关,OR值(95%CI)分别为1.30(1.20~1.40)、1.35(1.25~1.45),上述各单一慢性病结果类似,见表 3。不同疾病与低ASMI和低TSMI的相关性不一致,糖尿病和冠心病患病率均与之呈负相关(P < 0.05),未发现脑卒中与两者的相关性,而慢阻肺患者与低ASMI和低TSMI的OR值(95%CI)分别为1.26(1.17~1.36)和1.24(1.15~1.35)。
同样,患主要慢性病的个数越多,低手握力和低AMQ的危险性越高。与未患以上任一慢性病的调查对象相比,患1、2、≥3种慢性病者低手握力的OR值(95%CI)分别为1.26(1.17~1.37)、1.42(1.23~1.64)和2.27(1.55~3.32),低AMQ的OR值(95%CI)分别为1.28(1.18~1.38)、1.67(1.46~1.92)和2.41(1.69~3.45),且关联均存在线性趋势(线性趋势P值均 < 0.001,见图 1)。未发现患主要慢性病个数与低ASMI或低TSMI之间存在有统计学意义的关联。
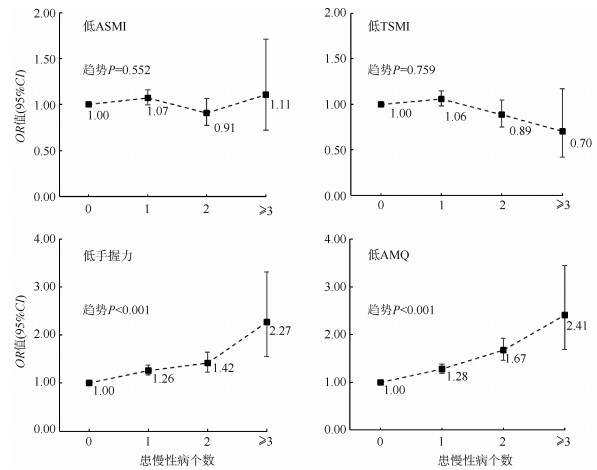
|
| 注:主要慢性病包括糖尿病、冠心病、脑卒中和慢阻肺;ASMI:四肢肌肉重量指数;TSMI:全身肌肉重量指数;AMQ:上肢肌肉质量;模型调整年龄、性别、地区、文化程度、婚姻状况、职业、家庭年收入、吸烟状况、饮酒状况、体力活动水平、平衡和米肉膳食模式得分 图 1 中国成年人主要慢性病现患个数与低肌肉重量、力量和质量的相关性 |
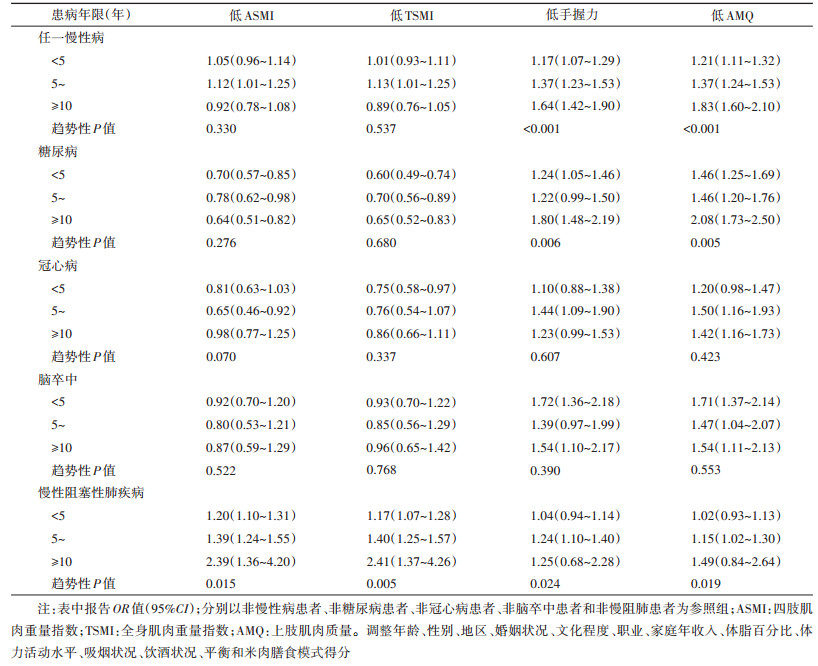
按照上述4种慢性病患病年限分析发现:患任一慢性病者,其患病年限越长,低手握力和低AMQ的风险越高,且存在线性趋势(线性趋势P值均 < 0.001),其中以糖尿病和慢阻肺结果表现更为明显。未发现任一慢性病患病年限与低ASMI、低TSMI间存在有统计学意义的关联,但相比于未患慢阻肺者,患慢阻肺≥10年者低ASMI和低TSMI的比例明显增加,OR值(95%CI)分别为2.39(1.36~4.20)和2.41(1.37~4.26),且关联存在线性趋势(线性趋势P < 0.05)。见表 4。
本研究利用我国大规模人群调查获得主要慢性病患病情况与客观测量的肌肉重量、力量和质量之间的关系,分析发现糖尿病、冠心病、脑卒中和慢阻肺患者的肌肉力量和质量更低;患慢性病个数与低手握力、低AMQ的风险呈正相关;且慢阻肺患病年限越长,肌肉重量、力量和质量越差。
目前关于慢性病与肌肉重量、力量及质量关系的研究多基于欧美和日韩人群,本研究首次在中国人群得到一致的结果。美国全国健康和营养检查调查发现糖尿病患者握力低于非糖尿病患者(61.7 kg vs. 69.8 kg,P=0.008)[15];基于韩国人群的研究发现糖尿病患者低肌肉质量的风险增加3.5倍[16];一项在芬兰开展的前瞻性随访研究发现冠心病会导致手握力下降,且下降速度更快[17];在中风幸存者中开展的研究发现瘫痪大腿的肌肉面积和体积均低于非瘫痪大腿,而肌肉内脂肪含量比非瘫痪腿高[18],二者都与肌肉力量降低有关[19]。
本研究结果显示糖尿病和冠心病患者与低肌肉重量呈负相关关系,可能与横断面设计有关:研究对象在患糖尿病和冠心病后可能采取更为积极的生活方式,例如改变膳食习惯、加强锻炼等,从而出现这2种疾病患者肌肉重量更高,即反向因果作用。其次,肥胖是上述2种疾病的危险因素,患糖尿病和冠心病的研究对象比非患病者肥胖比例更高,从而脂肪和肌肉重量均较高[20],所以TSMI和ASMI指标更高,即更不易出现低肌肉重量;此外,还可能与选择偏倚有关:本研究的调查对象为自愿参与,可能身体尚好的现患慢性病者比身体条件差的慢性病患者更愿意参与重复调查。一项前瞻性随访研究发现,基线时糖尿病患者的肌肉重量虽高于正常者,但随访期间糖尿病患者肌肉重量的下降速度更快[21]。这一研究结果需要在前瞻性研究中进一步进行验证。
值得注意的是,本研究发现慢阻肺患者的各项肌肉指标均比未患病者更低,且随着患病年限延长,低ASMI和低TSMI的风险逐渐增加。既往研究发现慢阻肺评分等级越高的患者,其SMI越低[22]。慢阻肺患者可能由于长期缺氧、高碳酸血症和营养不良,激活泛素蛋白酶体和溶酶体途径,最终导致肌肉细胞内的蛋白质加速降解[23-24]。四肢肌肉功能障碍已经被欧洲呼吸学会认为是慢阻肺的常见并发症[25],且研究发现慢阻肺患者膝伸/屈肌的脂肪浸润程度是正常人的2倍[26],这可能共同导致了慢阻肺患者肌肉质量低下。
本研究覆盖地区广,样本量较大,一定程度上能反映我国一般人群中慢性病与肌肉重量、力量和质量的关系,但也存在一定的局限性。首先,目前测量SMM的方法中以计算机断层扫面(CT)和核磁共振(MRI)最为精确,但受限于其高成本、高技术难度和仪器空间需求,难以应用于大规模流行病学研究。BIA法通过测量人体电阻值而估计肌肉含量,安全无害、价格低廉且操作简便,但精确度不如CT和MRI,且未对头颈部的肌肉重量进行测量,可能低估了TSMI。其次,本研究未对下肢肌肉力量进行测量,不能反映四肢肌肉力量的情况,但有研究表明手握力与腿部肌肉力量有很强的相关性,是代表四肢SMS的有效指标[27]。同时,手持握力计测量手握力简便易行、价格低廉、准确且重复性好,适用于大规模的流行病学现场调查[28]。第三,本研究通过调查对象自报经乡/区级或以上医院诊断的冠心病、脑卒中的患病情况及患病年龄信息,可能存在调查对象已患病未能及时前往医疗机构就医而出现的漏诊,以及在面对面调查时上述疾病的患者可能漏报自己的患病情况,导致患病者被错分到非患病组,从而使慢性病与低肌肉重量、力量和质量的关联趋近于无效假设,低估两者的关联强度。此外,本研究为横断面设计,不能区分时间先后顺序,仅能提示慢性病可能是导致肌肉结构和功能减退的因素之一。随着未来CKB项目后续重复调查及随访数据的补充,可以探索中国人群慢性病与肌肉重量、力量和质量的前瞻性关联。
利益冲突 所有作者均声明不存在利益冲突
志谢 感谢所有参加CKB项目的队列成员和各项目地区的现场调查队调查员;感谢项目管理委员会、国家项目办公室、牛津协作中心和10个项目地区办公室的工作人员
| [1] |
王丽敏, 陈志华, 张梅, 等. 中国老年人群慢性病患病状况和疾病负担研究[J]. 中华流行病学杂志, 2019, 40(3): 277-283. Wang LM, Chen ZH, Zhang M, et al. Study of the prevalence and disease burden of chronic disease in the elderly in China[J]. Chin J Epidemiol, 2019, 40(3): 277-283. DOI:10.3760/cma.j.issn.0254-6450.2019.03.005 |
| [2] |
Zhou MG, Wang HD, Zeng XY, et al. Mortality, morbidity, and risk factors in China and its provinces, 1990-2017:a systematic analysis for the Global Burden of Disease Study 2017[J]. Lancet, 2019, 394(10204): 1145-1158. DOI:10.1016/S0140-6736(19)30427-1 |
| [3] |
Moylan JS, Reid MB. Oxidative stress, chronic disease, and muscle wasting[J]. Muscle Nerve, 2007, 35(4): 411-429. DOI:10.1002/mus.20743 |
| [4] |
Frontera WR, Ochala J. Skeletal muscle: a brief review of structure and function[J]. Calcif Tissue Int, 2015, 96(3): 183-195. DOI:10.1007/s00223-014-9915-y |
| [5] |
Rier HN, Jager A, Sleijfer S, et al. The prevalence and prognostic value of low muscle mass in cancer patients: a review of the literature[J]. Oncologist, 2016, 21(11): 1396-1409. DOI:10.1634/theoncologist.2016-0066 |
| [6] |
Hamasaki H, Kawashima Y, Katsuyama H, et al. Association of handgrip strength with hospitalization, cardiovascular events, and mortality in Japanese patients with type 2 diabetes[J]. Sci Rep, 2017, 7(1): 7041. DOI:10.1038/s41598-017-07438-8 |
| [7] |
Wu YL, Wang WJ, Liu TW, et al. Association of grip strength with risk of all-cause mortality, cardiovascular diseases, and cancer in community-dwelling populations: a Meta-analysis of prospective cohort studies[J]. J Am Med Dir Assoc, 2017, 18(6): 551e17-551.e35. DOI:10.1016/j.jamda.2017.03.011 |
| [8] |
Chen ZM, Lee LM, Chen JS, et al. Cohort profile: the Kadoorie study of chronic disease in China (KSCDC)[J]. Int J Epidemiol, 2005, 34(6): 1243-1249. DOI:10.1093/ije/dyi174 |
| [9] |
Chen ZM, Chen JS, Collins R, et al. China Kadoorie Biobank of 0.5 million people: survey methods, baseline characteristics and long-term follow-up[J]. Int J Epidemiol, 2011, 40(6): 1652-1666. DOI:10.1093/ije/dyr120 |
| [10] |
李立明, 吕筠, 郭彧, 等. 中国慢性病前瞻性研究: 研究方法和调查对象的基线特征[J]. 中华流行病学杂志, 2012, 33(3): 249-255. Li LM, Lv J, Guo Y, et al. The China Kadoorie Biobank: related methodology and baseline characteristics of the participants[J]. Chin J Epidemiol, 2012, 33(3): 249-255. DOI:10.3760/cma.j.issn.0254-6450.2012.03.001 |
| [11] |
On Behalf of the China Kadoorie Biobank Collaborative Group. Physical activity and sedentary leisure time and their associations with BMI, waist circumference, and percentage body fat in 0.5 million adults: the China Kadoorie Biobank study[J]. Am J Clin Nutr, 2013, 97(3): 487-496. DOI:10.3945/ajcn.112.046854 |
| [12] |
Smith M, Li LM, Augustyn M, et al. Prevalence and correlates of airflow obstruction in ~317000 never-smokers in China[J]. Eur Respir J, 2014, 44(1): 66-77. DOI:10.1183/09031936.00152413 |
| [13] |
Chen LK, Liu LK, Woo J, et al. Sarcopenia in Asia: consensus report of the Asian Working Group for Sarcopenia[J]. J Am Med Dir Assoc, 2014, 15(2): 95-101. DOI:10.1016/j.jamda.2013.11.025 |
| [14] |
Goodpaster BH, Park SW, Harris TB, et al. The loss of skeletal muscle strength, mass, and quality in older adults: the health, aging and body composition study[J]. J Gerontol A Biol Sci Med Sci, 2006, 61(10): 1059-1064. DOI:10.1093/gerona/61.10.1059 |
| [15] |
Mainous Ⅲ AG, Tanner RJ, Anton SD, et al. Grip strength as a marker of hypertension and diabetes in healthy weight adults[J]. Am J Prev Med, 2015, 49(6): 850-858. DOI:10.1016/j.amepre.2015.05.025 |
| [16] |
Yoon JW, Ha YC, Kim KM, et al. Hyperglycemia is associated with impaired muscle quality in older men with diabetes: the Korean longitudinal study on health and aging[J]. Diabetes Metab J, 2016, 40(2): 140-146. DOI:10.4093/dmj.2016.40.2.140 |
| [17] |
Stenholm S, Tiainen K, Rantanen T, et al. Long-term determinants of muscle strength decline: prospective evidence from the 22-year mini-Finland follow-up survey[J]. J Am Geriatr Soc, 2012, 60(1): 77-85. DOI:10.1111/j.1532-5415.2011.03779.x |
| [18] |
Ryan AS, Dobrovolny CL, Smith GV, et al. Hemiparetic muscle atrophy and increased intramuscular fat in stroke patients[J]. Arch Phys Med Rehabil, 2002, 83(12): 1703-1707. DOI:10.1053/apmr.2002.36399 |
| [19] |
Akazawa N, Harada K, Okawa N, et al. Muscle mass and intramuscular fat of the quadriceps are related to muscle strength in non-ambulatory chronic stroke survivors: A cross-sectional study[J]. PLoS One, 2018, 13(8): e0201789. DOI:10.1371/journal.pone.0201789 |
| [20] |
Park SW, Goodpaster BH, Strotmeyer ES, et al. Accelerated loss of skeletal muscle strength in older adults with type 2 diabetes: the health, aging, and body composition study[J]. Diabetes Care, 2007, 30(6): 1507-1512. DOI:10.2337/dc06-2537 |
| [21] |
Park SW, Goodpaster BH, Lee JS, et al. Excessive loss of skeletal muscle mass in older adults with type 2 diabetes[J]. Diabetes Care, 2009, 32(11): 1993-1997. DOI:10.2337/dc09-0264 |
| [22] |
da Rocha Lemos Costa TM, Costa FM, Jonasson TH, et al. Body composition and sarcopenia in patients with chronic obstructive pulmonary disease[J]. Endocrine, 2018, 60(1): 95-102. DOI:10.1007/s12020-018-1533-4 |
| [23] |
Jaitovich A, Angulo M, Lecuona E, et al. High CO2 levels cause skeletal muscle atrophy via AMP-activated kinase (AMPK), FoxO3a protein, and muscle-specific Ring finger protein 1(MuRF1)[J]. J Biol Chem, 2015, 290(14): 9183-9194. DOI:10.1074/jbc.M114.625715 |
| [24] |
Barreiro E, Sznajder JI, Nader GA, et al. Muscle dysfunction in patients with lung diseases: a growing epidemic[J]. Am J Respir Crit Care Med, 2015, 191(6): 616-619. DOI:10.1164/rccm.201412-2189OE |
| [25] |
Maltais F, Decramer M, Casaburi R, et al. An official American thoracic society/European Respiratory Society statement: update on limb muscle dysfunction in chronic obstructive pulmonary disease[J]. Am J Respir Crit Care Med, 2014, 189(9): e15-62. DOI:10.1164/rccm.201402-0373ST |
| [26] |
Roig M, Eng JJ, Macintyre DL, et al. Deficits in muscle strength, mass, quality, and mobility in people with chronic obstructive pulmonary disease[J]. J Cardiopulm Rehabil Prev, 2011, 31(2): 120-124. DOI:10.1097/HCR.0b013e3181f68ae4 |
| [27] |
Bohannon RW, Magasi SR, Bubela DJ, et al. Grip and knee extension muscle strength reflect a common construct among adults[J]. Muscle Nerve, 2012, 46(4): 555-558. DOI:10.1002/mus.23350 |
| [28] |
Roberts HC, Denison HJ, Martin HJ, et al. A review of the measurement of grip strength in clinical and epidemiological studies: towards a standardised approach[J]. Age Ageing, 2011, 40(4): 423-429. DOI:10.1093/ageing/afr051 |
 2021, Vol. 42
2021, Vol. 42