文章信息
- 黎祺, 李媛秋, 马超, 郝利新, 王富珍, 苏琪茹, 安志杰, 尹遵栋.
- Li Qi, Li Yuanqiu, Ma Chao, Hao Lixin, Wang Fuzhen, Su Qiru, An Zhijie, Yin Zundong
- 2016-2020年中国麻疹暴发疫情流行特征与处置情况分析
- Surveillance and response to measles outbreaks in China, 2016-2020
- 中华流行病学杂志, 2021, 42(10): 1817-1822
- Chinese Journal of Epidemiology, 2021, 42(10): 1817-1822
- http://dx.doi.org/10.3760/cma.j.cn112338-20210520-00414
-
文章历史
收稿日期: 2021-05-20
2. 湖南省湘西州疾病预防控制中心, 吉首 416000
2. Xiangxi Prefectural Center for Disease Control and Prevention, Jishou 416000, China
麻疹是传染性极强的呼吸道传染病,我国与全球其他国家共同致力于消除麻疹[1]。实现疫苗高接种率使人群免疫力维持在较高水平是实现消除麻疹的基础,敏感地发现、报告和调查处置暴发疫情亦是消除麻疹的重要措施[2]。WHO将消除麻疹定义为:在监测系统运行良好的前提下,某特定地理区域(如地区或国家)≥12个月未出现本土麻疹病毒传播[3]。截至2019年底,全球有83个国家已证实实现了麻疹消除[3]。2000-2016年,全球报告麻疹病例数下降了88%,但2017-2019年有所回升,2019年报告病例数较2016年增加了556%[3]。麻疹消除阶段对暴发的界定敏感,WHO曾建议发现1例实验室确诊麻疹病例即可认为是1起麻疹暴发疫情[4]。我国自2015年以来报告麻疹发病水平持续下降,即便在2018-2019年全球麻疹疫情大幅回升背景下,2019年报告麻疹病例数较2018年依然下降24.5%,2020年进一步大幅下降[2, 5-6]。鉴于近些年有关我国麻疹暴发疫情报告及处置情况分析较少,本研究对2016-2020年报告的麻疹暴发疫情数据进行分析,为进一步提高麻疹监测系统(Measles Surveillance System,MSS)运转质量、优化消除麻疹策略措施提供参考。
资料与方法 (1) 资料来源中国各县(区、市、旗)CDC按照《全国麻疹监测方案》[7],通过MSS报告的麻疹病例个案和麻疹暴发疫情调查处置信息。CDC收到当地麻疹暴发报告后,在MSS中将同属1起暴发的病例个案进行关联,填报暴发疫情调查处置相关信息,包括暴发涉及病例数、死亡数、疫情持续天数、暴发场所类型、病例主动搜索情况、含麻疹成分疫苗(measles-containing vaccine,MCV)接种率评估与应急接种等。
(2) 相关定义(1)麻疹暴发:根据《全国麻疹监测方案》[7],麻疹暴发疫情定义:①以村、居委会、学校或其他集体机构为单位10 d内发生≥2例麻疹病例;②以乡、镇、社区、街道为单位10 d内发生≥5例麻疹病例;③以县为单位,1周内麻疹发病水平较前5年同期发病水平升高1倍以上。
(2)疑似麻疹暴发:查询MSS报告的实验室确诊和临床诊断麻疹病例个案,剔除已报告的麻疹暴发所涉及病例后,根据上述麻疹暴发疫情定义中的①和②判断是否构成应报告为麻疹暴发疫情,对于符合相应标准构成应报告为麻疹暴发的,定义为疑似麻疹暴发。
(3) 统计学分析(1)资料整理:对2016年1月1日至2020年12月31日通过MSS报告的实验室确诊病例和临床诊断麻疹病例进行整理,剔除被判为已报告的麻疹暴发涉及病例的个案后,根据上述“疑似麻疹暴发”的定义条件,逐一判断这些散发病例是否构成应报告为麻疹暴发疫情的疑似麻疹暴发。
(2)分析指标:对2016-2020年已报告麻疹暴发、疑似麻疹暴发相关信息进行统计描述。分析指标包括频数(构成比)、M(P25,P75)。描述性统计使用SPSS 26.0软件,小提琴图绘制采用RGui 4.03软件。
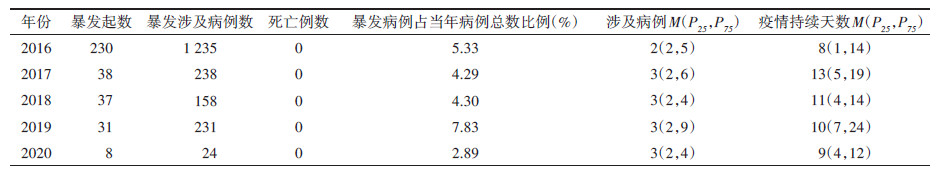
结果 (1) 已报告麻疹暴发疫情2016-2020年我国通过MSS报告麻疹暴发疫情344起,涉及麻疹病例1 886例。2016年报告麻疹暴发230起,2017年降至38起,2018年(37起)至2020年(8起)持续下降。所有暴发均无死亡病例报告,各年暴发涉及病例M均为2~3人;疫情持续天数M为8~13 d(表 1)。
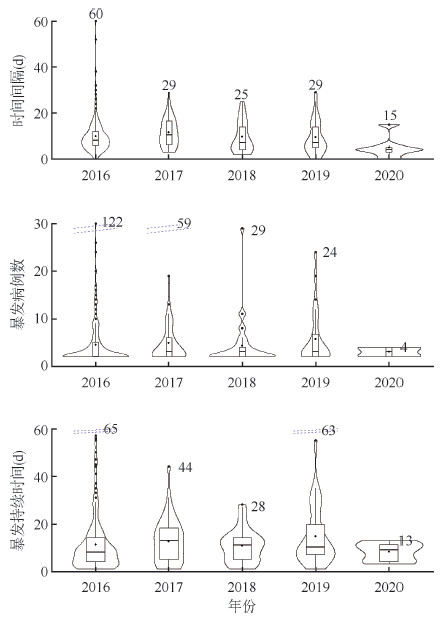
(1)报告时间:2016-2020年,各年麻疹暴发疫情首例病例的发病日期至暴发疫情报告日期间隔M为4~10 d,日期间隔集中于20 d以内,最长为60 d(图 1)。
|
| 注:部分超出纵坐标的值用紫色斜线表示;箱式图里横线表示M、点代表均值,箱两头分别表示P75与P25;两头延线分别截止为异常值截断点;小提琴宽度表示相应结果的频率/概率,越宽表示频率/概率越大;高于异常值截断点的数值以点标记在相应坐标轴上,2020年由于基数小(仅8起),频率波动大出现断层 图 1 2016-2020年中国麻疹暴发疫情报告时间、规模和持续时间 |
(2)疫情规模:各年麻疹暴发疫情规模(涉及病例数)M均为2~3例,2016年规模最大的1起涉及122例,2020年规模最大暴发涉及4例。2016年和2017年部分麻疹暴发涉及病例数超过10例,其他各年多在5例以下(图 1)。
(3)暴发持续时间:各年麻疹暴发疫情持续时间M多在10 d左右,2017年最长(13 d),2016年最短(8 d)。暴发疫情持续天数多在20 d以内。2016-2020年持续时间最长的暴发疫情分别为65、44、28、63、13 d(图 1)。
(4)省份分布:2016年以来报告麻疹暴发起数较多的为甘肃(66起)、北京(59起)、山东(47起),辽宁、海南、陕西、西藏无暴发报告。
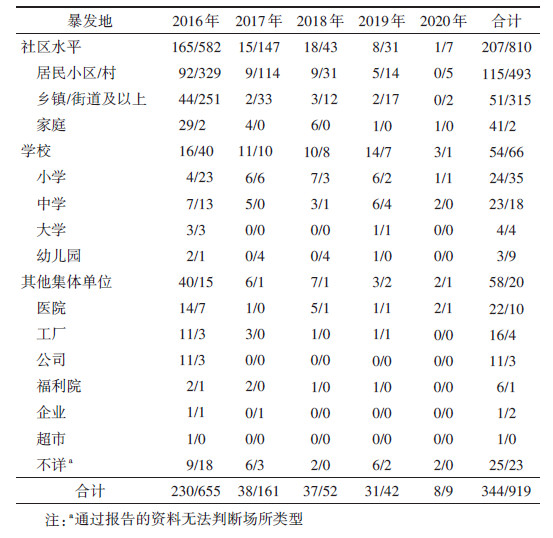
(5)场所类型:2016-2020年报告的344起麻疹暴发中,207起为社区水平传播的暴发,112起发生在集体机构,另外25起场所类型不详。社区水平暴发中,波及范围为乡镇/街道及以上51起,占24.63%(51/207),居民小区/村范围115起,占55.56%(115/207),只涉及单个家庭41起占19.81%(41/207)。在各类集体机构的112起暴发中,学校54起(小学24起、中学23起、大学4起、幼儿园3起),其他类型集体单位58起,医院是最易出现麻疹暴发的场所(22起),2020年仍报告了2起。见表 2。
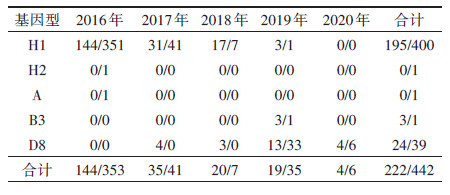
(6)实验室确诊情况:2016-2020年报告的344起麻疹暴发中,有337起97.97%(337/344)的病例采集了血标本进行实验室确诊,共采集1 730例,其余7起根据基层医务工作者进行流行病学诊断后,结合麻疹暴发定义,通过MSS进行上报,未进行实验室检测。2016年和2017年各有1起暴发未采集血标本;99起报告了基因型鉴定结果,占28.78%(99/344)。2016年麻疹暴发疫情中,共144例病例报告了基因型鉴定结果,均为H1型;2017年共报告35例基因型鉴定结果,H1基因型共31例,占88.5%(31/35),其余均为D8基因型;2018年共报告20例基因型鉴定结果,H1基因型共17例占85.0%(17/20),其余均为D8基因型;2019年报告的19例基因型鉴定结果中,以D8基因型为主,共13例,H1基因型仅有3例;2020年仅报告4例基因型鉴定结果,均为D8基因型(表 3)。
(7)调查处置情况:报告的344起麻疹暴发疫情中,313起开展了医疗机构病例主动搜索,占90.99%(313/344),其中5起(1.45%)共发现未报告的病例8例,最多1起搜索到3例。296起进行入户搜索占86.05%(296/344),其中7起暴发共搜索到未就诊病例18例,最多1起搜索到8例。有266起暴发开展了MCV接种率评估占77.33%(266/344),其中143起评估目标人群年龄为8月龄至14岁,占53.76%(143/266);其中有137起报告了接种率评估结果,评估接种率≥90%的126起,占91.97%(126/137)、80%~90%的有7起,占5.11%(7/137)、< 80%有4起,占2.92%(4/137)。有17起评估MCV接种率达100.00%及1起接种率为87.50%的未开展应急接种,其他暴发地均采取了应急接种措施,应急接种率为86.86%(119/137)。应急接种开始至结束历时时间M为4 d,时间跨度从1~58 d不等,7 d内完成应急接种的比例为73.95%(88/119),5.88%(7/119)的应急接种时间跨度 > 21 d。其他123起MCV接种率评估未局限为8月龄至14岁,除27起(27/123,占21.95%)无法计算接种率外,MCV接种率 < 80%的有16起,占13.01%(16/123),80%~90%的有6起,占4.88%(6/123),接种率 > 90%的有74起,占60.16%(74/123)。
(2) 疑似麻疹暴发疫情分析共侦测到2016-2020年符合判定标准的疑似麻疹暴发919起,涉及麻疹病例4 212例。疑似暴发位于前三的省(自治区)为新疆(164起)、甘肃(126起)及四川(114起),广西、贵州、宁夏未发现潜在麻疹暴发。场所类型以社区水平为主,占88.14%(810/919),学校66起,占7.18%(66/919),其他集体单位20起,占2.18%(20/919)。社区水平的疑似麻疹暴发(810起)是已报告暴发起数(207起)的3.9倍。发生在学校的暴发中,各类学校幼儿园的疑似麻疹暴发(66起)为已报告起数(52起)的1.3倍,而其他集体单位疑似麻疹暴发起数(20起)低于已报告暴发数(58起)(表 2)。919起疑似麻疹暴发中,有18.93%起(174/919)涉及的442例病例报告了基因型鉴定结果:2016年疑似麻疹暴发所含的353例病例中,351例为H1基因型,占99.43%(351/353)。2017及2018年疑似麻疹暴发涉及病例的基因型均为H1型,2019年疑似麻疹暴发涉及病例35例中有33例为D8基因型,占94.29%(33/35)。2020年6例报告的基因结果均为D8基因型(表 3)。
讨论虽然我国消除麻疹已经取得实质性的进展[8],但由于麻疹是传播力极强的传染病,若未采取有效控制,将造成疫情蔓延[9-10]。本研究从我国2016-2020年麻疹暴发疫情报告的及时程度、疫情规模、持续时间、暴发场所类型、处置措施等指标进行分析,结合麻疹暴发定义对疑似麻疹暴发分析结果显示,2016年以来麻疹暴发疫情数量、规模和持续时间逐渐下降,2019年以来的麻疹暴发疫情中,社区水平的麻疹暴发不容忽视,本土H1基因型有逐渐被其他基因型替代的趋势。结合麻疹暴发定义进一步分析发现,符合报告标准的疑似麻疹暴发起数为已报告暴发起数的2.67倍,提示麻疹暴发疫情监测敏感性有待进一步提高。
2016-2020年年均报告麻疹暴发起数(69起)较2009-2015年(204起)大幅下降,2009-2015年暴发疫情报告时间M为8~9 d,与本研究中疫情报告时间相差不大,疫情规模各年也均以2~3人的小规模为主[1]。监测数据表明,2016-2020年我国各年麻疹暴发疫情持续时间M均在10 d左右,2016年最长疫情持续时间为65 d,2020年仅为13 d,整体呈下降趋势,而麻疹的平均潜伏期为10~14 d[11],表明我国对麻疹暴发疫情控制有力。值得注意的是,2020年报告的麻疹暴发事件数、持续时间和疫情规模等均为历史新低。这可能与新冠疫情暴发[12],各地积极采取防护措施及响应,致使呼吸道传染病难以达到暴发规模有关。
2016-2020年报告的麻疹暴发疫情主要来自东部省份,而未报告的疑似麻疹暴发则以中西部省份为主,可能的原因之一是东部省份麻疹暴发疫情监测更为灵敏[13]。部分西部省份局部地区免疫规划工作相对薄弱,易感人群逐渐积累,再加上疫情的响应及处置不及时,容易导致麻疹暴发[14]。接种MCV是预防麻疹最有效的措施,数据表明,MCV的全球覆盖率从2000年的72%上升至2010年的84%,并于2016年稳定在85%水平[3]。而2016-2020年暴发监测结果显示,个别地区儿童MCV接种率在80%以下,提示仍存在疫苗接种薄弱地区,应加强MCV的宣传与接种。
麻疹病毒通常通过呼吸道在短距离内传播,其悬浮的气溶胶颗粒在空中可存活长达2 h[15-16]。即使患者离开,若长时间通风不良,易感者进入后依然存在经呼吸道吸入感染的可能[1]。已有研究表明,如果不能持久地形成人群高水平免疫力,麻疹病毒很容易在社区中传播[17],2016-2020年报告的麻疹暴发以及同期疑似麻疹暴发进行场所分类提示,居民小区/村和更大范围社区依然是麻疹暴发最重要的场所。不仅如此,本研究结果也表明,社区水平的麻疹病例不容易被判定为暴发疫情,且随着社区范围的扩大,被准确关联的概率更低。基于此,在消除麻疹阶段,宜根据WHO建议[4],发现1例实验室确诊麻疹病例即可按暴发疫情调查处置。在冬末初春的学校等人员密集的场所容易发生麻疹暴发[18],不同类型的机构,尤其是学校和医院仍时有麻疹暴发疫情发生,这些场所仍为麻疹防控重点。
近年来我国不同省份相继分离到输入型麻疹病毒,但既往一直以本土H1基因型为主[19-20],2016-2020年暴发疫情分析显示本土H1基因型麻疹病毒有逐步被其他基因型麻疹病毒替代的趋势,提示若无及时响应与处置,国外输入的其他基因型麻疹病毒亦可造成麻疹暴发。因此,在我国范围内对麻疹病例进行及时、敏感的病毒学检测和监测非常必要。
主动搜索疑似病例对于防止麻疹疫情扩散至关重要。流调人员应联系当地卫生机构工作者、村负责人和麻疹病例家庭其他成员对潜在的麻疹病例进行排查[4]。2016-2020年我国麻疹暴发疫情调查处置中经主动搜索发现漏报病例8例和未就诊病例18例,并及时采取控制措施对疫情防控起到了积极的作用,然而仍有部分暴发疫情处置过程中未开展主动搜索,考虑到麻疹病例可能在集市或乘坐交通工具过程中接触他人[4],使得疫情防控存在一定的隐患。因此需要严格按照《全国麻疹监测方案》[7]和麻疹疫情调查处置技术指南[4]要求,切实做好病例主动搜索等调查工作。
本研究存在局限性。首先,研究分析的数据为被动监测数据,虽然中国麻疹监测系统运转质量不断提高[13],但其监测结果可能无法反映全部实际情况。本研究对疑似麻疹暴发进行分析,但只是用现阶段麻疹暴发的定义并结合住址和病例发病日期进行筛选,并未对每起的实际情况进行核实,同1起暴发疫情的部分病例,因各种原因未被及时发现,而依据应报暴发定义被判定为另1起暴发的情况也可能存在,导致应报暴发起数被高估,由此可能导致未报告的疑似麻疹暴发起数被高估。
在全球致力于消除麻疹的现阶段,进一步做好麻疹监测和暴发疫情调查处置更为重要。WHO于2021年发布麻疹暴发疫情处置应对策略指南,在加强基础免疫及提升麻疹疫苗第二剂次接种率、减少不同地区免疫水平差异防止疫情暴发、加强监测和及时有效地处置疫情等方面提出了建议[21]。结合我国现状,进一步做好麻疹暴发疫情深入调查、及时报告并落实处置措施,仍是下一步消除麻疹工作的重点。
利益冲突 所有作者均声明不存在利益冲突
| [1] |
马超, 贾海梅, 苏琪茹, 等. 中国2009-2015年麻疹暴发疫情报告与调查处置情况分析[J]. 中国疫苗和免疫, 2016, 22(5): 481-486, 492. Ma C, Jia HM, Su QR, et al. Surveillance and response to measles outbreaks in China[J]. Chin J Vacc Immun, 2016, 22(5): 481-486, 492. |
| [2] |
马超, 苏琪茹, 郝利新, 等. 中国2017-2018年麻疹流行病学特征[J]. 中国疫苗和免疫, 2020, 26(1): 5-8, 41. Ma C, Su QR, Hao LX, et al. Epidemiology of measles in China, 2017-2018[J]. Chin J Vacc Immun, 2020, 26(1): 5-8, 41. |
| [3] |
Patel MK, Goodson JL, Alexander JP, et al. Progress toward regional measles elimination-worldwide, 2000-2019[J]. MMWR Morb Mortal Wkly Rep, 2020, 69(45): 1700-1705. DOI:10.15585/mmwr.mm6945a6 |
| [4] |
WHO. Measles elimination field guide[M]. Manila: WHO Regional Office for the Western Pacific, 1993.
|
| [5] |
马超, 郝利新, 温宁, 等. 中国2019年麻疹流行病学特征[J]. 中国疫苗和免疫, 2020, 26(5): 493-497. Ma C, Hao LX, Wen N, et al. Epidemiology of measles in China, 2019[J]. Chin J Vacc Immun, 2020, 26(5): 493-497. |
| [6] |
疾病预防控制局. 2020年全国法定传染病疫情概况[EB/OL]. (2021-03-12)[2021-05-01]. http://www.nhc.gov.cn/jkj/s3578/202103/f1a448b7df7d4760976fea6d55834966.shtml. Bureau of Disease Control and Prevention. Overview of national epidemic situation of legal infectious diseases in 2020[EB/OL]. (2021-03-12)[2021-05-01]. http://www.nhc.gov.cn/jkj/s3578/202103/f1a448b7df7d4760976fea6d55834966.shtml. |
| [7] |
卫生部. 卫生部办公厅关于印发《全国麻疹监测方案》的通知[EB/OL]. (2009-02-02) [2021-05-01]. http://www.nhc.gov.cn/zwgk/wtwj/201304/f9956cbc95594311902cf554e0aee4b7.shtml. Ministry of Health. Notice of the General Office of the Ministry of Health on printing and distributing the National Measles Monitoring Program[EB/OL]. (2009-02-02) [2021-05-01]. http://www.nhc.gov.cn/zwgk/wtwj/201304/f9956cbc95594311902cf554e0aee4b7.shtml. |
| [8] |
Ma C, Rodewald L, Hao LX, et al. Progress toward measles elimination-China, January 2013-June 2019[J]. MMWR Morb Mortal Wkly Rep, 2019, 68(48): 1112-1116. DOI:10.15585/mmwr.mm6848a2 |
| [9] |
Guerra FM, Bolotin S, Lim G, et al. The basic reproduction number (R0) of measles: a systematic review[J]. Lancet Infect Dis, 2017, 17(12): e420-428. DOI:10.1016/S1473-3099(17)30307-9 |
| [10] |
Hao LX, Glasser JW, Su QR, et al. Evaluating vaccination policies to accelerate measles elimination in China: a Meta-population modelling study[J]. Int J Epidemiol, 2019, 48(4): 1240-1251. DOI:10.1093/ije/dyz058 |
| [11] |
Misin A, Antonello RM, Di Bella S, et al. Measles: an overview of a re-emerging disease in children and immunocompromised patients[J]. Microorganisms, 2020, 8(2): 276. DOI:10.3390/microorganisms8020276 |
| [12] |
Harapan H, Itoh N, Yufika A, et al. Coronavirus disease 2019(COVID-19): A literature review[J]. J Infect Public Health, 2020, 13(5): 667-673. DOI:10.1016/j.jiph.2020.03.019 |
| [13] |
马超, 苏琪茹, 温宁, 等. 中国2015-2016年麻疹监测系统运转情况分析[J]. 中国疫苗和免疫, 2018, 24(2): 141-145. Ma C, Su QR, Wen N, et al. Evaluation of the measles surveillance system performance in China, 2015-2016[J]. Chin J Vacc Immun, 2018, 24(2): 141-145. |
| [14] |
沙吾拉西·热加甫, 玛合木提江·库尔班, 谢娜, 等. 2012-2018年新疆维吾尔自治区麻疹流行病学特征分析[J]. 疾病监测, 2019, 34(12): 1109-1112. Rejiafu S, Kuerban M, Xie N, et al. Epidemiological characteristics of measles in Xinjiang[J]. Dis Surveill, 2019, 34(12): 1109-1112. DOI:10.3784/j.issn.1003-9961.2019.12.016 |
| [15] |
Remington PL, Hall WN, Davis IH, et al. Airborne transmission of measles in a physician's office[J]. JAMA, 1985, 253(11): 1574-1577. DOI:10.1001/jama.1985.03350350068022 |
| [16] |
Hope K, Boyd R, Conaty S, et al. Measles transmission in health care waiting rooms: implications for public health response[J]. Western Pac Surveill Response J, 2012, 3(4): 33-38. DOI:10.5365/WPSAR.2012.3.3.009 |
| [17] |
Moss WJ, Griffin DE. Measles[J]. Lancet, 2012, 379(9811): 153-164. DOI:10.1016/S0140-6736(10)62352-5 |
| [18] |
Fine PEM, Clarkson JA. Measles in England and Wales-Ⅰ: An analysis of factors underlying seasonal patterns[J]. Int J Epidemiol, 1982, 11(1): 5-14. DOI:10.1093/ije/11.1.5 |
| [19] |
Chen M, Zhang Y, Huang F, et al. Endemic and imported measles virus-associated outbreaks among adults, Beijing, China, 2013[J]. Emerg Infect Dis, 2015, 21(3): 477-479. DOI:10.3201/eid2103.140646 |
| [20] |
王淑蕾, 李崇山, 王慧玲, 等. 中国大陆首次发现输入性B3基因型麻疹病毒病例[J]. 病毒学报, 2014, 30(5): 535-540. Wang SL, Li CS, Wang HL, et al. Imported B3 genotype measles viruses were isolated from measles cases in the Chinese mainland[J]. Chin J Virol, 2014, 30(5): 535-540. DOI:10.13242/j.cnki.bingduxuebao.002544 |
| [21] |
World Health Organization. Measles outbreaks strategic response plan: 2021-2023: measles outbreak prevention, preparedness, response and recovery[EB/OL]. (2020-10-07)[2021-06-25]. https://apps.who.int/iris/handle/10665/340657.
|
 2021, Vol. 42
2021, Vol. 42