文章信息
- 贺冰洁, 张明轩, 詹思延.
- He Bingjie, Zhang Mingxuan, Zhan Siyan
- 药物流行病学中处方序列对称分析研究的系统综述
- Prescription sequence symmetry analysis in pharmacoepidemiology: a systematic review
- 中华流行病学杂志, 2021, 42(9): 1641-1649
- Chinese Journal of Epidemiology, 2021, 42(9): 1641-1649
- http://dx.doi.org/10.3760/cma.j.cn112338-20201208-01386
-
文章历史
收稿日期: 2020-12-08
2. 北京大学生育健康研究所 100191
2. Institute of Reproductive and Child Health, Peking University, Beijing 100191, China
药品安全是影响人类生命健康的重要公共卫生问题之一,药品上市后的监测对于及时发现和有效控制药物安全问题是必要的[1]。目前国内外药品不良反应监测主要基于自发报告,存在漏报、选择性报告、无法计算不良反应发生率等局限[2-3]。随着信息技术的发展和健康医疗大数据概念的兴起,利用有效的分析框架和大规模真实世界数据开展主动监测是发现和检验不良反应的一种积极尝试[4],也促进了多种信号挖掘方法的发展,其中处方序列对称分析(Prescription sequence symmetry analysis,PSSA)被认为是最适合的方法之一[5-6]。PSSA是一种依据现有、完备的处方记录数据库来发掘药品不良反应信号的研究方法,由Hallas[7]于1996年进行介绍,国内在2012年由本课题组介绍了该方法的实施[8]。PSSA是一种单纯病例的设计,使用某种药品的处方(标签药)来代替某特定药品(指示药)引起的不良反应,再基于指示药与标签药的处方时序分布的对称性来发掘不良反应信号。如A药(指示药)可能产生某种不良反应,需要用B药(标签药)进行治疗,在处方数据库中先确定一定时间窗内处方了A和B两种药品的患者。若不存在因果关联,则处方序列应是对称分布的,即先处方A药的人数与先处方B药的人数相等;若存在因果关联,则A药处方后会引起B药处方的增多,处方序列的分布不对称,即先处方A药的人数更多。
近年来,PSSA在国际上已展开应用,且发展迅速[9];本课题组2016年对PSSA也进行了文献计量分析,但国内实际应用较少[10]。随着近几年研究的深入,PSSA研究情况需进一步更新,对PSSA的方法学过程也需要系统梳理,因此本研究系统检索并分析国内外公开发表的PSSA的原始研究,总结研究进展和方法学细节,为我国今后同类研究的设计提供参考。
资料与方法1. 文献检索策略:参考既往研究,英文数据库以“prescription event analysis”OR“symmetry principle”OR“symmetry analysis”OR“prescription symmetry”OR“sequence symmetry”OR“prescription sequence”OR“symmetry analyses”OR“sequence- symmetry”为基本检索式,检索PubMed、Embase和Cochrane文献数据库;中文数据库以“处方序列对称分析”为检索词,检索中国知网、万方数据知识服务平台和维普数据库。检索截止时间为2020年6月30日。
2. 纳入排除标准:纳入标准:使用PSSA研究药物不良反应或其他药物相关结局的原始研究。排除标准:①综述或系统综述;②方法学研究;③模拟数据研究;④会议摘要、信件等非正式发表研究,或无法获取全文;⑤非中、英文文献。
3. 文献筛选与资料提取:文献筛选由双人独立进行,先阅读标题和摘要进行初筛,符合标准的文献进一步阅读全文判断是否纳入。参考既往研究设计信息提取表,提取内容主要包括文献基本信息、研究地区、使用的数据库、指示药、不良反应、标签药、间隔期、洗脱期、同一天处方者的处理、敏感性分析、亚组分析等方法学处理,以及效应估计结果的报告情况。由两名受过专业培训的研究者独立完成信息提取后,再进行交叉核对,提取中的不一致经讨论后统一。
4. 关键术语定义:指示药(index drug):旨在研究其不良反应的药品。标签药(marker drug):用来治疗指示药产生的不良反应的药品。洗脱期(run-in period):为了确定首次用药者,设置的没有指示药或标签药处方的时长,符合该时长内无相应药物处方者被视为首次用药者。间隔期:指示药处方日期与标签药处方日期之间的间隔时长,是预期不良反应发生的合理时间区间。Waiting time分布法:确定洗脱期长度的一种方法,将标签药、指示药等涉及的药品的使用者按数据库中首次处方的时间进行分类,横坐标为时间(月、周、天等)、纵坐标为人数作图,曲线陡峭下滑阶段为洗脱期,曲线平台期为首次用药者的研究期。
前因后果组(causal组):先处方了指示药,后处方了标签药;非前因后果组(non-causal组):先处方了标签药,后处方了指示药。粗序列比(crude sequence ratio,CSR):causal组人数与non-causal组人数的比值,反映两种药物不对称程度的指标,但没有考虑处方随时间变化的自然趋势。空效应序列比(null-effect sequence ratio,NESR):假定没有任何因果关联的情况下期望的序列比,反映研究周期内处方频率的变化。调整序列比(adjusted sequence ratio,ASR):等于CSR/NESR,调整时间趋势后的序列比,显著 > 1.0时,说明可能存在因果关联。
5. 统计学分析:主要进行描述性统计分析,连续变量报告均数(标准差)或中位数(四分位数),分类变量报告频数(百分比)。采用Excel 2019软件提取信息、Stata 15.0软件进行分析。
结果1. 文献检索:根据检索式检索中、英文数据库,获得文献952篇。经双人独立筛选后,最终确定纳入研究的文献共计45篇,其中2篇中文文献,43篇英文文献(图 1)。
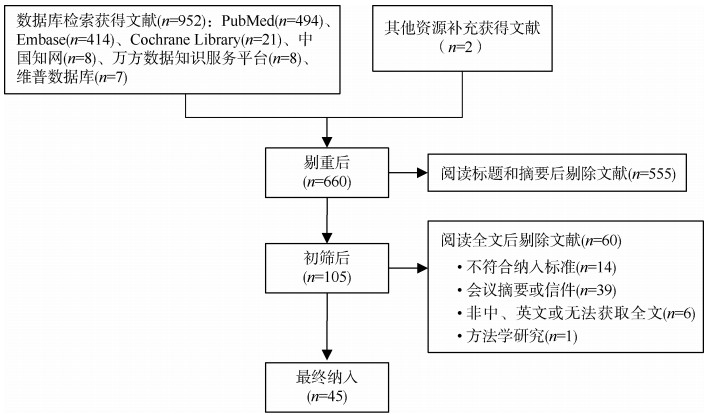
|
| 图 1 文献筛选流程 |
2. 研究基本信息:
(1)研究地区和数据来源:纳入的45项研究中,涉及的国家/地区共14个,且包含3项多中心研究。其中,日本发表研究数量最多,为11篇(24.44%),中国10篇(22.22%),丹麦9篇(20.00%),澳大利亚8篇(17.78%),韩国、荷兰、美国各5篇(11.11%)(表 1)。
研究使用的数据库主要包括澳大利亚的Australian Government Department of Veterans' Affairs(DVA)claims databases(8篇,17.78%)、日本的Japan Medical Data Centre(JMDC)insurance claims database(6篇,13.33%)、丹麦的Odense University Pharmaco Epidemiologic Database(OPED)(5篇,11.11%)和荷兰的Dutch Inter Action Database(IADB.nl)pharmacy prescription database(5篇,11.11%)。中国使用的数据库为全国城镇职工和居民医疗保险数据库和江苏省健康保险数据库等(表 1)。
(2)研究发表时间:本文纳入分析的文献中,最早的研究发表于1996年,1996-2012年仅8个年份有PSSA研究发表,共计11篇(24.44%);从2013年开始,文献发表数量显著上升,2013-2020年共计发表文献34篇(75.56%)(图 2)。

|
| 图 2 处方序列对称分析文献发表时间分布 |
3. 研究方法:
(1)研究设计与样本量:纳入文献的研究设计也包含多种,单纯使用PSSA方法开展研究的文献共计29篇(64.44%),PSSA结合其他方法[队列、病例对照、事件序列对称分析(ESSA)等]共有16篇(35.56%)。各个研究中样本量最小的为161人,样本量最大的有637.7万人。
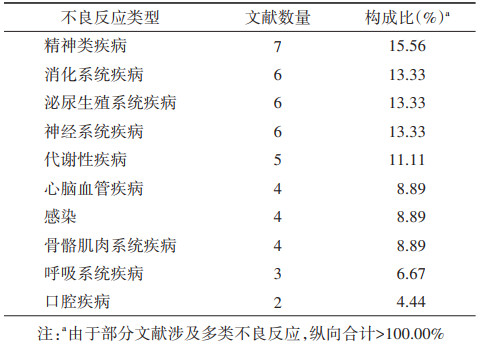
(2)涉及药物与不良反应:本文纳入的PSSA研究共涉及16类药物,其中涉及精神类药物和他汀类药物的研究数量最多,分别有8篇(17.78%),其次为心血管药物(7篇,15.56%),还有7篇(15.56%)文献关注了多种药物(表 2)。文献涉及的不良反应有10类,数量最多的4类分别为精神类疾病、消化系统疾病、泌尿生殖系统疾病和神经系统疾病(表 3)。
(3)研究方法学总结:参数设置方面,45篇文献中共计35篇(77.78%)明确给出了洗脱期,洗脱期时长1个月到17年不等,多为6个月(13篇,37.14%)或12个月(11篇,31.43%);共14篇(31.11%)文献给出了确定洗脱期的具体方法或理由,包括等待时间(waiting time)分布法(11篇,78.57%)和根据既往研究确定(3篇,21.43%)。43篇(95.56%)文献给出了间隔期的长短,但只有9篇(20.00%)文献说明了间隔期时长的确定方法或理由,包括依据不良反应的特征、既往研究和减少时间依赖性混杂的影响。
研究对象处理上,明确说明了同一天或同一个月内处方的患者处理方法的文献有20篇(44.44%),其中19篇直接将此类患者排除分析,1篇进一步判断指示药与标签药的先后顺序再决定纳入排除。
统计学分析方面,由于PSSA的计算分析非常简便,纳入的所有研究都选择了合适的效应指标,使用了正确的计算方法。29篇(64.44%)文献描述了ASR及其95%CI的计算方法,23篇使用二项分布法、4篇使用bootstrap法。另外,16篇(35.56%)文献进行了敏感性分析,主要分析了不同洗脱期、间隔期以及是否换药对研究结果的影响。18篇(40.00%)文献根据指示药的种类、是否患有基础疾病或所患疾病不同亚型等进行了亚组分析。部分纳入文献的方法学细节见表 4。
4. 文献结果报告:在纳入分析的文献的结果部分,有43篇(95.56%)文献给出了具体的causal组和non-causal组的人数。27篇(60.00%)给出了CSR,14篇(31.11%)给出了NESR,39篇(86.67%)给出了ASR及其95%CI。共38篇(84.44%)文献报告了药物不良反应的阳性信号。
讨论本系统综述对45篇PSSA原始研究的基本情况和方法学细节进行了梳理和分析。近年来,PSSA相关研究的数量快速增长,这些研究涉及的目标药物和关注的不良反应都非常广泛,在探索、发现安全性信号方面均有一定优势,但在洗脱期、间隔期的确定等方法学细节和结果报告上仍有待提升,PSSA本身的局限也依赖于更多方法学和应用研究来进一步克服。
本文分析结果显示,使用PSSA设计的研究在2013年之前数量稀少,2013年开始发表数量快速增长,这一时间趋势可能与大数据的发展、医疗数据库的建立及相关研究组织的成立有关[10]。另外,PSSA自1996年问世以来,其方法学也在不断完善,逐渐成为药物上市后监测的有力分析手段,也使得近年来研究数量激增。最主要的研究国家为日本、中国、丹麦和澳大利亚;韩国、荷兰、美国也有多篇文章发表。这些国家研究增多的原因之一是AsPEN(Asian Pharmacoepidemiology Network)的建立,AsPEN旨在支持进行药物流行病学研究并促进参与国家或地区之间迅速识别和验证新出现的安全问题[11, 55]。
本文纳入分析的研究大多利用权威的区域性医疗保险数据库,数据质量良好,使用最多的数据库为DVA、JMDC、OPED和IADB.nl。DVA数据库是澳大利亚退伍军人及其家属的医疗保险数据,有详细的住院信息和处方信息[54];JMDC数据库是日本的大型索赔数据库,主要包含职工及其家属的处方信息,使用标准化疾病分类和匿名记录链接[35];OPED是最早用于PSSA研究的数据库,包含了丹麦菲英郡和南丹麦地区自1990年以来的所有电子处方保险理赔记录,该数据库还可以与丹麦其他健康相关登记数据库进行链接分析[56];IADB.nl数据库隶属荷兰交互数据库项目,由一线药房提供处方记录,具有高覆盖率和完整性[22]。这些医疗保险数据库利用统一编码记录了处方药物和用药时间,可以全面了解患者的用药情况,为PSSA的实施提供了可能。我国城镇医疗保险和新型农村医疗合作保险虽覆盖广泛,适于大数据分析,但由于数据库体量庞大目前只能使用年度抽样库进行分析。我们前期的研究已初步验证了PSSA作为一种快速有效的安全性信号检测方法可以用于我国的医疗保险数据库[21],今后可进一步借鉴国际经验提高数据库管理和数据处理技术水平,完善数据库建设,发挥PSSA在安全性信号挖掘上的作用。
研究方法学方面,洗脱期与间隔期是开展PSSA研究的重要参数,制定不合理可能会影响结果的准确性,导致偏倚。合适的洗脱期可以排除非首次用药者,避免其可能带来的偏倚与混杂,使最终得到的ASR稳定,一般使用通行的waiting-time法确定[8];本文纳入的研究中仅有31.11%给出了确定洗脱期的具体方法,包括waiting-time法和参考既往研究,研究者应重视洗脱期的确定,否则可能错误判断指示药和标签药的使用顺序,得出不可靠的结果。间隔期是指示药首次处方时间与标签药首次处方时间之间的间隔时长,需控制在指示药产生不良反应的合理时间区间内,选择合适的间隔期才能得到更为准确的效应估计结果[57];间隔期的确定尚无金标准,一般根据不良反应的特征和既往研究决定,纳入研究中仅20.00%给出了确定间隔期的理由,研究者在设计、实施和报告时都应关注该问题;另外,为了避免研究时间过长而引入时间依赖性混杂的影响,间隔期也不宜设置得太长,本文纳入的文献中部分研究者在方法部分也考虑到了此问题[27, 31, 36]。总的来说,PSSA研究中洗脱期和间隔期的选择仍较为主观,部分研究者也通过修改洗脱期和间隔期的长短进行敏感性分析来验证结果的稳健性和可靠性[15, 24, 40]。此外,标签药的合理选择在PSSA研究中也非常重要,需要有较高的“灵敏度和特异度”以准确有效地替代所研究的不良反应,标签药的合理选择是PSSA研究有效的重要前提[9]。这些参数的设定目前仍主要依靠专家共同商讨,为了使PSSA的使用更加简洁有力,未来需要研究确定各类不良反应的标准化用药以及药物与不良反应的间隔期等参数。
在结果部分的报告上,绝大部分的研究在报告最终的效应估计指标及其置信区间之外,还汇报了causal组与non-causal组具体的人数,从而为读者理解PSSA是如何进行的奠定了基础。因为充分的结果报告能够对分析做出全面的解释,并对研究的内部有效性进行评估[58]。
据此,参考观察性流行病学研究报告规范(STROBE),针对PSSA研究可提出以下报告清单的核对条目:方法部分应报告研究设计、研究现场、研究时间范围、数据来源、研究对象的纳入排除标准、指示药、研究的不良反应、标签药、标签药的合理性、间隔期(时长及确定方法)、洗脱期(时长及确定方法)、同一天处方者的处理、效应指标、敏感性分析和亚组分析;结果部分应报告样本量、研究对象基本特征、causal/non-causal组人数、CSR、NESR、ASR及其95%CI。
PSSA研究应用范围正逐渐扩大,本文纳入的45项PSSA研究便涉及了16类药物与10类不良反应,涵盖了临床中常见的药物种类,反映了该方法较高的实际应用价值。PSSA的有效性也已经在多个模拟数据和验证性研究中得到证实[59-61],与其他信号挖掘方法相比也有许多独特的优势,这也是研究者选择该方法的重要原因。PSSA可以视作简化的自身病例系列研究[62],是一种单纯病例研究,对不随时间变化的混杂因素稳健,患者可以作为自己的对照,从而很好地控制年龄、性别、就医等非时间依赖的混杂。除此以外,PSSA应用方便,只需要简单的算法和(与其他药物不良反应监测方法相比)较小的数据集[60],非常经济便捷;较小的数据集需求也适合分布式网络分析,可以避免交换原始数据,有助于保护患者的隐私[63]。
同时,PSSA方法仍存在一些局限。首先,研究开展过程中,曾经用药者难以完全排除,这类患者的引入会引起结果偏倚,因此在计算分析前应尽量只纳入新用药者。其次,PSSA设计可能会受到药物处方本身的时间趋势变化影响,该问题可通过计算NESR来调整,但该计算需要新药处方的个体水平数据,并且计算量较大,最近也有研究者开发了新的可视化方法(curve-fit)来调整处方时间趋势[64]。PSSA结果还易受到数据质量的影响,如数据库中处方记录不全面或者仅有处方记录但是患者依从性较差时,难以得出正确的效应估计或风险评估结果。时依性混杂、指示性混杂、特发性偏倚和反向因果关联等因素都会影响PSSA的结果,部分纳入的原始研究在讨论部分对这些问题有不同程度的探讨,也有研究对PSSA所面临的这些挑战进行了总结[63]。此外,如前所述,标签药的合理选择至关重要,选择PSSA进行研究前需满足药物可能导致的不良反应有特定的药物治疗方案等前提假设,另外还发展出了结合处方和某种疾病诊断进行类似分析的ESSA,避免了标签药的选择问题,本文纳入的研究中也有10篇以上综合了PSSA和ESSA进行不良反应研究,但处方数据通常比其他类型的健康数据更具及时性,并且ESSA还需与其他数据库整合,因此研究者应根据研究问题和数据情况合理选择分析方法[9]。
本文系统总结了PSSA的研究进展,首次梳理了原始研究的方法学细节,提出了PSSA研究的初步报告清单。但本研究仍存在一些局限性:只纳入了英文和中文文献,也未搜索灰色文献,但遗漏的研究在数量上通常有限;由于目标药物和不良反应等的异质性,未对不同研究的结果进行整合和定量分析。
综上所述,PSSA作为有效的安全性信号挖掘方法之一发展迅速,但方法学处理和结果报告还需完善。我国PSSA研究仍处于起步阶段,仍需注重研究质量,推进方法学探索,并提高全国和区域性医疗数据库覆盖程度和数据质量,在大数据发展背景下促进药品不良反应信号挖掘的发展。
利益冲突 所有作者均声明不存在利益冲突
| [1] |
崔燕宁. 药物安全与药物警戒[M]. 北京: 人民卫生出版社, 2014. Cui YN. Drug safety and pharmacovigilance[M]. Beijing: People's Medical Publishing House, 2014. |
| [2] |
Zhan C, Roughead E, Liu L, et al. A data-driven method to detect adverse drug events from prescription data[J]. J Biomed Inform, 2018, 85: 10-20. DOI:10.1016/j.jbi.2018.07.013 |
| [3] |
陈锋, 杨世民. 我国药物不良反应监测体系建设现状与存在的问题[J]. 医药导报, 2006, 25(5): 486-488. Chen F, Yang SM. Current situation and existing problems in the construction of adverse reaction monitoring system in China[J]. Her Med, 2006, 25(5): 486-488. DOI:10.3870/j.issn.1004-0781.2006.05.060 |
| [4] |
杨羽, 詹思延. 上市后大数据药品安全主动监测模式研究的必要性和可行性[J]. 药物流行病学杂志, 2016, 25(7): 401-404, 413. Yang Y, Zhan SY. Analysis of necessity and feasibility in studies of post-marketing drug safety active surveillance based on big data[J]. Chin J Pharmacoepidemiol, 2016, 25(7): 401-404, 413. |
| [5] |
Arnaud M, Bégaud B, Thurin N, et al. Methods for safety signal detection in healthcare databases: a literature review[J]. Expert Opin Drug Saf, 2017, 16(6): 721-732. DOI:10.1080/14740338.2017.1325463 |
| [6] |
李海龙, 赵厚宇, 周一帆, 等. 基于电子医疗数据库的药品不良反应信号挖掘方法概述[J]. 药物流行病学杂志, 2018, 27(8): 541-549. Li HL, Zhao HY, Zhou YF, et al. Data mining methods for adverse drug reaction signals detection in healthcare databases: a literature review[J]. Chin J Pharmacoepidemiol, 2018, 27(8): 541-549. |
| [7] |
Hallas J. Evidence of depression provoked by cardiovascular medication: a prescription sequence symmetry analysis[J]. Epidemiology, 1996, 7(5): 478-484. DOI:10.1097/00001648-199609000-00005 |
| [8] |
陶庆梅, 詹思延. 处方序列分析与处方序列对称分析在药物流行病学中的应用[J]. 药物流行病学杂志, 2012, 21(10): 517-519. Tao QM, Zhan SY. Application of prescription sequence analysis and prescription sequence symmetry analysis in pharmacoepidemiology[J]. Chin J Pharmacoepidemiol, 2012, 21(10): 517-519. |
| [9] |
Pratt N, Roughead E. Assessment of medication safety using only dispensing data[J]. Curr Epidemiol Rep, 2018, 5(4): 357-369. DOI:10.1007/s40471-018-0176-6 |
| [10] |
方任飞, 潘昱廷, 詹思延. 处方序列对称分析研究现状的文献计量分析[J]. 药物流行病学杂志, 2016, 25(2): 108-112, 118. Fang RF, Pan YT, Zhan SY. Analysis of the bibliometric of prescription sequence symmetry analysis[J]. Chin J Pharmacoepidemiol, 2016, 25(2): 108-112, 118. |
| [11] |
Pratt N, Andersen M, Bergman U, et al. Multi-country rapid adverse drug event assessment: The Asian Pharmacoepidemiology Network (AsPEN) antipsychotic and acute hyperglycaemia study[J]. Pharmacoepidemiol Drug Saf, 2013, 22(9): 915-924. DOI:10.1002/pds.3440 |
| [12] |
Lai ECC, Hsieh CY, Yang YHK, et al. Detecting potential adverse reactions of sulpiride in schizophrenic patients by prescription sequence symmetry analysis[J]. PLoS One, 2014, 9(2): e89795. DOI:10.1371/journal.pone.0089795 |
| [13] |
Takeuchi Y, Kajiyama K, Ishiguro C, et al. Atypical antipsychotics and the risk of hyperlipidemia: a sequence symmetry analysis[J]. Drug Saf, 2015, 38(7): 641-650. DOI:10.1007/s40264-015-0298-4 |
| [14] |
Takada M, Fujimoto M, Hosomi K. Association between benzodiazepine use and dementia: data mining of different medical databases[J]. Int J Med Sci, 2016, 13(11): 825-834. DOI:10.7150/ijms.16185 |
| [15] |
Park KR, Kim KB, Baek YH, et al. Signal detection of benzodiazepine use and risk of dementia: sequence symmetry analysis using South Korean national healthcare database[J]. Int J Clin Pharm, 2018, 40(6): 1568-1576. DOI:10.1007/s11096-018-0739-0 |
| [16] |
Dunvald ACD, Henriksen DP, Hallas J, et al. Selective serotonin reuptake inhibitors and the risk of restless legs syndrome: a symmetry analysis[J]. Eur J Clin Pharmacol, 2020, 76(5): 719-722. DOI:10.1007/s00228-020-02847-7 |
| [17] |
Hirano Y. Risk of extrapyramidal syndromes associated with psychotropic polypharmacy: a study based on large-scale Japanese claims data[J]. Ther Innov Regul Sci, 2020, 54(2): 259-268. DOI:10.1007/s43441-019-00026-0 |
| [18] |
Yokoyama S, Wakamoto S, Tanaka Y, et al. Association between antipsychotics and osteoporosis based on real-world data[J]. Ann Pharmacother, 2020, 54(10): 988-995. DOI:10.1177/1060028020913974 |
| [19] |
Fujimoto M, Higuchi T, Hosomi K, et al. Association of statin use with storage lower urinary tract symptoms (LUTS): data mining of prescription database[J]. Int J Clin Pharmacol Ther, 2014, 52(9): 762-769. DOI:10.5414/CP202113 |
| [20] |
Takada M, Fujimoto M, Yamazaki K, et al. Association of statin use with sleep disturbances: data mining of a spontaneous reporting database and a prescription database[J]. Drug Saf, 2014, 37(6): 421-431. DOI:10.1007/s40264-014-0163-x |
| [21] |
方任飞, 李静湖, 张杰, 等. 基于处方序列对称分析的他汀类药物肝脏安全性研究[J]. 中华流行病学杂志, 2016, 37(7): 935-939. Fang RF, Li JH, Zhang J, et al. Association between statins use and liver injury based on prescription sequence symmetry analysis[J]. Chin J Epidemiol, 2016, 37(7): 935-939. DOI:10.3760/cma.j.issn.0254-6450.2016.07.006 |
| [22] |
Pouwels KB, Widyakusuma NN, Bos JHJ, et al. Association between statins and infections among patients with diabetes: a cohort and prescription sequence symmetry analysis[J]. Pharmacoepidemiol Drug Saf, 2016, 25(10): 1124-1130. DOI:10.1002/pds.4052 |
| [23] |
Ko HHT, Lareu RR, Dix BR, et al. A sequence symmetry analysis of the interrelationships between statins, diabetes and skin infections[J]. Br J Clin Pharmacol, 2019, 85(11): 2559-2567. DOI:10.1111/bcp.14077 |
| [24] |
Zhang HP, Wu JN, Zhang ZL, et al. Association of atorvastatin with the risk of hepatotoxicity: a pilot prescription sequence symmetry analysis[J]. Ther Clin Risk Manag, 2019, 15: 803-810. DOI:10.2147/TCRM.S204860 |
| [25] |
Nishtala PS, Chyou TY. Exploring New Zealand prescription data using sequence symmetry analyses for predicting adverse drug reactions[J]. J Clin Pharm Ther, 2017, 42(2): 189-194. DOI:10.1111/jcpt.12491 |
| [26] |
Vegter S, de Jong-van den Berg LTW. Misdiagnosis and mistreatment of a common side-effect-angiotensin-converting enzyme inhibitor-induced cough[J]. Br J Clin Pharmacol, 2010, 69(2): 200-203. DOI:10.1111/j.1365-2125.2009.03571.x |
| [27] |
Pouwels KB, Visser ST, Bos HJ, et al. Angiotensin-converting enzyme inhibitor treatment and the development of urinary tract infections: a prescription sequence symmetry analysis[J]. Drug Saf, 2013, 36(11): 1079-1086. DOI:10.1007/s40264-013-0085-z |
| [28] |
Vegter S, de Boer P, van Dijk KW, et al. The effects of antitussive treatment of ACE inhibitor-induced cough on therapy compliance: a prescription sequence symmetry analysis[J]. Drug Saf, 2013, 36(6): 435-439. DOI:10.1007/s40264-013-0024-z |
| [29] |
Rasmussen L, Hallas J, Madsen KG, et al. Cardiovascular drugs and erectile dysfunction-a symmetry analysis[J]. Br J Clin Pharmacol, 2015, 80(5): 1219-1223. DOI:10.1111/bcp.12696 |
| [30] |
Vouri SM, Jiang XY, Manini TM, et al. Magnitude of and characteristics associated with the treatment of calcium channel blocker-induced lower-extremity edema with loop diuretics[J]. JAMA Netw Open, 2019, 2(12): e1918425. DOI:10.1001/jamanetworkopen.2019.18425 |
| [31] |
Roughead EE, Chan EW, Choi NK, et al. Variation in association between thiazolidinediones and heart failure across ethnic groups: retrospective analysis of large healthcare claims databases in six countries[J]. Drug Saf, 2015, 38(9): 823-831. DOI:10.1007/s40264-015-0318-4 |
| [32] |
Adimadhyam S, Schumock GT, Calip GS, et al. Increased risk of mycotic infections associated with sodium-glucose co-transporter 2 inhibitors: a prescription sequence symmetry analysis[J]. Br J Clin Pharmacol, 2019, 85(1): 160-168. DOI:10.1111/bcp.13782 |
| [33] |
Hellfritzsch M, Rasmussen L, Hallas J, et al. Using the symmetry analysis design to screen for adverse effects of non-vitamin k antagonist oral anticoagulants[J]. Drug Saf, 2018, 41(7): 685-695. DOI:10.1007/s40264-018-0650-6 |
| [34] |
Maura G, Billionnet C, Coste J, et al. Non-bleeding adverse events with the use of direct oral anticoagulants: a sequence symmetry analysis[J]. Drug Saf, 2018, 41(9): 881-897. DOI:10.1007/s40264-018-0668-9 |
| [35] |
Yokoyama S, Ieda S, Nagano M, et al. Association between oral anticoagulants and osteoporosis: Real-world data mining using a multi-methodological approach[J]. Int J Med Sci, 2020, 17(4): 471-479. DOI:10.7150/ijms.39523 |
| [36] |
Roughead EE, Chan EW, Choi NK, et al. Proton pump inhibitors and risk of Clostridium difficile infection: a multi-country study using sequence symmetry analysis[J]. Expert Opin Drug Saf, 2016, 15(12): 1589-1595. DOI:10.1080/14740338.2016.1238071 |
| [37] |
Park SK, Baek YH, Pratt N, et al. The uncertainty of the association between proton pump inhibitor use and the risk of dementia: prescription sequence symmetry analysis using a Korean healthcare database between 2002 and 2013[J]. Drug Saf, 2018, 41(6): 615-624. DOI:10.1007/s40264-018-0638-2 |
| [38] |
Tsiropoulos I, Andersen M, Hallas J. Adverse events with use of antiepileptic drugs: a prescription and event symmetry analysis[J]. Pharmacoepidemiol Drug Saf, 2009, 18(6): 483-491. DOI:10.1002/pds.1736 |
| [39] |
Lai ECC, Yang YHK, Lin SJ, et al. Use of antiepileptic drugs and risk of hypothyroidism[J]. Pharmacoepidemiol Drug Saf, 2013, 22(10): 1071-1079. DOI:10.1002/pds.3498 |
| [40] |
van Boven JFM, de Jong-van den Berg LTW, Vegter S. Inhaled corticosteroids and the occurrence of oral candidiasis: a prescription sequence symmetry analysis[J]. Drug Saf, 2013, 36(4): 231-236. DOI:10.1007/s40264-013-0029-7 |
| [41] |
Hersom K, Neary MP, Levaux HP, et al. Isotretinoin and antidepressant pharmacotherapy: a prescription sequence symmetry analysis[J]. J Am Acad Dermatol, 2003, 49(3): 424-432. DOI:10.1067/s0190-9622(3)02087-5 |
| [42] |
Corrao G, Botteri E, Bagnardi V, et al. Generating signals of drug-adverse effects from prescription databases and application to the risk of arrhythmia associated with antibacterials[J]. Pharmacoepidemiol Drug Saf, 2005, 14(1): 31-40. DOI:10.1002/pds.1019 |
| [43] |
Roughead EE, Kalisch LM, Pratt NL, et al. Managing glaucoma in those with co-morbidity: not as easy as it seems[J]. Ophthalmic Epidemiol, 2012, 19(2): 74-82. DOI:10.3109/09286586.2011.638743 |
| [44] |
Lindberg G, Hallas J. Cholesterol-lowering drugs and antidepressants-a study of prescription symmetry[J]. Pharmacoepidemiol Drug Saf, 1998, 7(6): 399-402. DOI:10.1002/(SICI)1099-1557(199811/12)7:6<399:AID-PDS385>3.0.CO;2-C |
| [45] |
Winkel JS, Damkier P, Hallas J, et al. Treatment with montelukast and antidepressive medication-a symmetry analysis[J]. Pharmacoepidemiol Drug Saf, 2018, 27(12): 1409-1415. DOI:10.1002/pds.4638 |
| [46] |
周一帆, 程吟楚, 高双庆, 等. 处方序列对称分析探测喜炎平注射液与过敏反应关系的研究[J]. 药物流行病学杂志, 2019, 28(6): 376-379, 388. Zhou YF, Cheng YC, Gao SQ, et al. Study of Xiyanping injection and allergic reaction based on prescription sequence symmetry analysis[J]. Chin J Pharmacoepidemiol, 2019, 28(6): 376-379, 388. |
| [47] |
Dyson TE, Cantrell MA, Lund BC. Lack of association between 5α-reductase inhibitors and depression[J]. J Urol, 2020, 204(4): 793-798. DOI:10.1097/JU.0000000000001079 |
| [48] |
Hallas J, Bytzer P. Screening for drug related dyspepsia: an analysis of prescription symmetry[J]. Eur J Gastroenterol Hepatol, 1998, 10(1): 27-32. DOI:10.1097/00042737-199801000-00006 |
| [49] |
Bytzer P, Hallas J. Drug-induced symptoms of functional dyspepsia and nausea. A symmetry analysis of one million prescriptions[J]. Aliment Pharmacol Ther, 2000, 14(11): 1479-1484. DOI:10.1046/j.1365-2036.2000.00862.x |
| [50] |
Caughey GE, Roughead EE, Pratt N, et al. Increased risk of hip fracture in the elderly associated with prochlorperazine: is a prescribing cascade contributing?[J]. Pharmacoepidemiol Drug Saf, 2010, 19(9): 977-982. DOI:10.1002/pds.2009 |
| [51] |
Garrison SR, Dormuth CR, Morrow RL, et al. Nocturnal leg cramps and prescription use that precedes them: a sequence symmetry analysis[J]. Arch Intern Med, 2012, 172(2): 120-126. DOI:10.1001/archinternmed.2011.1029 |
| [52] |
Ellett LMK, Pratt NL, Barratt JD, et al. Risk of medication-associated initiation of oxybutynin in elderly men and women[J]. J Am Geriatr Soc, 2014, 62(4): 690-695. DOI:10.1111/jgs.12741 |
| [53] |
Hashimoto M, Hashimoto K, Ando F, et al. Prescription rate of medications potentially contributing to lower urinary tract symptoms and detection of adverse reactions by prescription sequence symmetry analysis[J]. J Pharm Health Care Sci, 2015, 1: 7. DOI:10.1186/s40780-014-0004-1 |
| [54] |
Wahab IA, Pratt NL, Ellett LK, et al. Sequence symmetry analysis as a signal detection tool for potential heart failure adverse events in an administrative claims database[J]. Drug Saf, 2016, 39(4): 347-354. DOI:10.1007/s40264-015-0391-8 |
| [55] |
Andersen M, Bergman U, Choi NK, et al. The Asian Pharmacoepidemiology Network (AsPEN): promoting multi-national collaboration for pharmacoepidemiologic research in Asia[J]. Pharmacoepidemiol Drug Saf, 2013, 22(7): 700-704. DOI:10.1002/pds.3439 |
| [56] |
Hallas J, Hellfritzsch M, Rix M, et al. Odense pharmacoepidemiological database: a review of use and content[J]. Basic Clin Pharmacol Toxicol, 2017, 120(5): 419-425. DOI:10.1111/bcpt.12764 |
| [57] |
Idema DL, Wang YY, Biehl M, et al. Effect estimate comparison between the prescription sequence symmetry analysis (PSSA) and parallel group study designs: a systematic review[J]. PLoS One, 2018, 13(12): e0208389. DOI:10.1371/journal.pone.0208389 |
| [58] |
Nordmann S, Biard L, Ravaud P, et al. Case-only designs in pharmacoepidemiology: a systematic review[J]. PLoS One, 2012, 7(11): e49444. DOI:10.1371/journal.pone.0049444 |
| [59] |
Wahab IA, Pratt NL, Wiese MD, et al. The validity of sequence symmetry analysis (SSA) for adverse drug reaction signal detection[J]. Pharmacoepidemiol Drug Saf, 2013, 22(5): 496-502. DOI:10.1002/pds.3417 |
| [60] |
Pratt NL, Ilomäki J, Raymond C, et al. The performance of sequence symmetry analysis as a tool for post-market surveillance of newly marketed medicines: a simulation study[J]. BMC Med Res Methodol, 2014, 14: 66. DOI:10.1186/1471-2288-14-66 |
| [61] |
Pratt N, Chan EW, Choi NK, et al. Prescription sequence symmetry analysis: Assessing risk, temporality, and consistency for adverse drug reactions across datasets in five countries[J]. Pharmacoepidemiol Drug Saf, 2015, 24(8): 858-864. DOI:10.1002/pds.3780 |
| [62] |
Maclure M, Fireman B, Nelson JC, et al. When should case-only designs be used for safety monitoring of medical products?[J]. Pharmacoepidemiol Drug Saf, 2012, 21(Suppl 1): 50-61. DOI:10.1002/pds.2330 |
| [63] |
Lai ECC, Pratt N, Hsieh CY, et al. Seqauence symmetry analysis in pharmacovigilance and pharmacoepidemiologic studies[J]. Eur J Epidemiol, 2017, 32(7): 567-582. DOI:10.1007/s10654-017-0281-8 |
| [64] |
Preiss AK, Roughead EE, Pratt NL. Sequence symmetry analysis graphic adjustment for prescribing trends[J]. BMC Med Res Methodol, 2019, 19(1): 143. DOI:10.1186/s12874-019-0781-1 |
 2021, Vol. 42
2021, Vol. 42